Химия высоких энергий, 2020, T. 54, № 1, стр. 60-67
Авторадиолиз радиофармпрепарата “2-[18F]фтордезоксиглюкоза” с объемными активностями 4–5.5 ГБк/мл
С. Д. Бринкевич a, *, О. В. Тугай a
a Белорусский государственный университет
220030 Минск, просп. Независимости, 4, Беларусь
* E-mail: BrinkevichSD@bsu.by
Поступила в редакцию 15.08.2019
После доработки 15.08.2019
Принята к публикации 19.08.2019
Аннотация
В работе изучена кинетика авторадиолитического разложения радиофармацевтического препарата “2-[18F]фтордезоксиглюкоза” ([18F]ФДГ) с начальными объемными активностями 4.02–5.45 ГБк/мл в насыщенном воздухом физиологическом растворе. Показано, что увеличение начальной объемной активности или снижение концентрации этанола (химическая примесь) приводят к более интенсивному накоплению радиолитического [18F]фторида и деградации радиохимической чистоты препарата. При хранении радиофармацевтического препарата зафиксировано снижение концентрации этанола и образование продукта его радиационно-индуцированных превращений – ацетальдегида, причем концентрация последнего коррелирует с относительной активностью [18F]фторида. Установлено, что при хранении препарата [18F]ФДГ с одинаковой начальной объемной активностью в герметичных флаконах объемом 15 мл по истечении 8 ч относительная активность [18F]фторида значительно выше в растворах объемом 8 мл по сравнению с 1.5 мл. Это может быть связано как с увеличением поглощенной препаратом дозы, так и с ингибирующим действием кислорода на процесс авторадиолитического дегалогенирования. Описан способ очистки [18F]ФДГ от примеси [18F]фторидав условиях действующего ПЭТ-центра, обеспечивающий сохранение асептики и апирогенности инъекционного лекарственного средства.
ВВЕДЕНИЕ
Разложение радиоактивных фармацевтических лекарственных средств под действием излучения собственного радионуклида – авторадиолиз – приводит к потере активного фармакологического компонента, образованию нежелательных радиохимических примесей, увеличивающих дозовую нагрузку на пациентов и ухудшающих специфичность и селективность диагностических исследований c использованием меченых соединений [1, 2]. Вследствие авторадиолитического разложения снижается доступность методов ядерной медицины для населения из-за уменьшения сроков годности радиофармпрепаратов (РФП) и сокращения времени на доставку радионуклидной продукции [3].
Одним из наиболее востребованных РФП в настоящее время является 2-[18F]фтор-2-дезокси-D-глюкоза ([18F]ФДГ) – аналог важнейшего для человека углевода, содержащий вместо гидроксильной группы при С2-атоме радиоактивный изотоп фтор-18. В силу благоприятных ядерно-физических свойств радионуклида и особенностей метаболизма РФП in vivo [18F]ФДГ широко применяется для диагностики онкологических, кардиологических и неврологических заболеваний методом позитронно-эмиссионной томографии (ПЭТ) [4]. Для бесперебойного обеспечения диагностических потребностей в США, Западной Европе и в последнее время в России одновременно работают как локальные производители [18F]ФДГ, так и крупные центры, ежедневно доставляющие продукцию в течение 1–6 ч с использованием авиационного и автомобильного транспорта. Вызванные экономическими факторами увеличение длительности перевозки и выпуск препаратов с высокими объемными активностями [5] значительно обостряют проблему авторадиолитического разложения [18F]ФДГ. Так, например, нестабилизированный препарат с начальными объемными активностями порядка 19–22 ГБк/мл имеет срок годности менее 1 ч [6], исключающий возможность его диагностического применения. Это указывает на необходимость детального изучения закономерностей авторадиолитического разложения [18F]ФДГ и проведения научно-обоснованного поиска ингибиторов данного процесса.
В нашей предыдущей работе [7] мы детально рассмотрели радиационно-индуцированные превращения [18F]ФДГ с начальными объемными активностями порядка 1–2 ГБк/мл. В настоящей статье будут представлены закономерности изменения химической и радиохимической чистоты, а также относительной активности [18F]фторида в насыщенном воздухом физиологическом растворе [18F]ФДГ с начальными объемными активностями 4.02–5.45 ГБк/мл. Такие объемные активности наиболее часто используются в мультидозовых флаконах для зарядки автоматических инжекторов, обеспечивающих приготовление индивидуальных доз [18F]ФДГ для пациентов в современных ПЭТ-центрах.
МЕТОДИКА ЭКСПЕРИМЕНТА
В работе без предварительной очистки использовали следующие коммерчески доступные реагенты: этанол, ацетонитрил, натрия [19F]фторид, 50% раствор NaOH в воде (“Sigma-Aldrich”, США); аналитические стандарты 2-[19F]фтор-2-дезокси-D-глюкозы ([19F]ФДГ), 2-[19F]фтор-2-дезокси-D-маннозы ([19F]ФДМ) и 1,2,3,4-тетра-О-ацетил-D-глюкозы фирмы ABX (Германия). Ультрачистую воду (Тип 1) с удельным сопротивлением не менее 15 МОм получали с использованием лабораторной установки Milli-Q (“Merck Millipore”, США).
Для исследования авторадиолитического разложения использовали инъекционное лекарственное средство “2-[18F]фтордезоксиглюкоза” для ПЭТ-диагностики, полученное по стандартной технологии [8, 9] на кассетных модулях Synthera (“IBA”, Бельгия) с использованием наборов реагентов для производства [18F]ФДГ от ABX (Германия).
Для изучения динамики накопления свободного [18F]фторида и изменения радиохимической чистоты препарата при хранении в стандартные флаконы объемом 15 мл фасовали 1.5 мл РФП, для подтверждения назначенного срока хранения использовали 8 мл. После розлива фармацевтической субстанции флаконы укупоривали бутилкаучуковой пробкой, обжимали алюминиевой крышкой, маркировали и выгружали из радиационно-защитной камеры в свинцовых контейнерах СF-18 Pb (“Comecer”, Италия).
Полный контроль качества готового лекарственного средства [18F]ФДГ проводили через 8 ч (назначенный срок хранения) для проверки соответствия выпускаемого РФП требованиям статьи государственной фармакопеи Республики Беларусь на лекарственное средство “2-[18F]фтор-дезоксиглюкоза”, гармонизированной с европейской фармакопеей [10]. Динамику накопления [18F]фторида и других радиохимических примесей контролировали методами радио-ТСХ и радио-ВЭЖХ сразу после выпуска партии и далее через 2, 4, 6 и 8 ч.
Содержание этанола, ацетальдегида и других остаточных растворителей определяли методом газовой хроматографии на Agilent 6850 с пламенно-ионизационным детектором аналогично [11, 12]. Методики радио-ТСХ и радио-ВЭЖХ анализа подробно описаны в работе [7]. При проведении исследований в лаборатории поддерживали постоянный температурный режим – 23 ± 2°С.
Для очистки [18F]ФДГ от [18F]фторида применяли последовательно соединенные картридж твердофазной экстракции Alumina B (“Waters”, США) и систему стерилизующей фильтрации с размером пор 0.22 µм (“Merck Millipore”, США). Раствор РФП пропускали со скоростью 5 мл/мин через сборку, после чего ее промывали трехкратным объемом воды для инъекций. [18F]Фторид в элюате не детектируется, при его относительных активностях до 15% в исходном растворе [18F]ФДГ.
Все работы с высокоактивными препаратами проводились при строгом соблюдении мер радиационной безопасности квалифицированным персоналом в специализированной радиофармацевтической лаборатории.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При хранении растворов [18F]ФДГ наблюдается снижение ее радиохимической чистоты – доли активности, которая приходится на основное меченое соединение от общей активности препарата. При этом единственным регистрируемым радиоактивным продуктом авторадиолитических превращений является [18F]фторид, другие радиохимические примеси присутствуют в РФП с момента производства и их доля изменяется в пределах погрешности измерения [7].
Динамика изменения относительной активности [18F]фторида при хранении [18F]ФДГ представлена на рис. 1. Можно заметить, что увеличение начальной объемной активности с 1–2 ГБк/мл до 4–5.5 ГБк/мл приводит к ускорению радиационно-индуцированного дегалогенирования [18F]ФДГ как по данным фармакопейного метода радио-ТСХ [10], так и по результатам радио-ВЭЖХ, которая обладает более высокой точностью и воспроизводимостью результатов. Однако в пределах рассматриваемого диапазона начальных объемных активностей можно заметить, что графики накопления [18F]фторида практически совпадают для растворов содержавших 4.196 ГБк/мл и 5.452 ГБк/мл на момент выпуска партии. Поглощенная доза для последнего раствора РФП на 30.0% превышает соответствующее значение для образца с начальной объемной активностью 4.196 ГБк/мл и, поэтому, следовало бы ожидать накопления более высоких активностей [18F]фторида при хранении.
Рис. 1.
Изменение относительной активности [18F]фторида при хранении растворов радиофармпрепарата [18F]ФДГ в зависимости от начальной объемной активности по данным радио-ТСХ (а) и радио-ВЭЖХ (б).
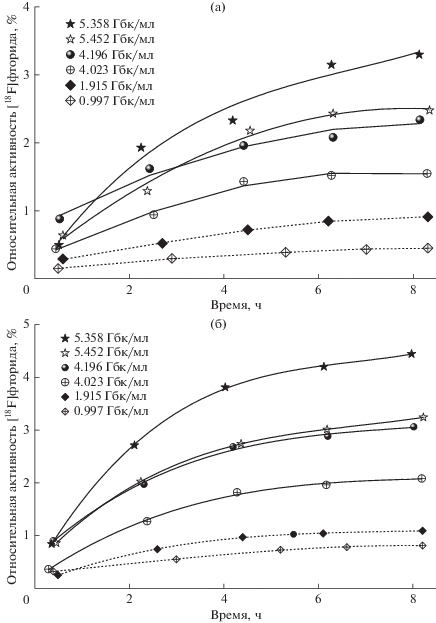
Полученные экспериментальные данные могут быть объяснены различиями в концентрациях химических примесей, в первую очередь этанола, в исследуемых растворах РФП. Так, содержание этанола в растворе [18F]ФДГ с начальной объемной активностью 5.452 ГБк/мл было на 28.6% выше, чем в РФП с активностью 4.196 ГБк/мл на момент выпуска партии (табл. 1). Таким образом, увеличение поглощенной препаратом дозы было компенсировано более высокой концентрацией акцептора радикальных продуктов радиолиза воды.
Таблица 1.
Динамика изменения концентрации ацетальдегида и этанола при хранении радиофармпрепарата [18F]ФДГ
| Начальная объемная активность [18F]ФДГ, ГБк/мл | Вещество | Содержание веществ в зависимости от времени хранения, моль/л × 104 | ||||
|---|---|---|---|---|---|---|
| 0 часов | 2 часа | 4 часа | 6 часов | 8 часов | ||
| 4.196 | Этанол | 150.7 | 121.7 | 105.0 | 109.8 | 98.5 |
| Ацетальдегид | – | – | – | – | – | |
| 4.023 | Этанол | 205.2 | 151.5 | 151.1 | 134.6 | 132.8 |
| Ацетальдегид | 0 | 2.05 | 3.64 | 3.86 | 5.23 | |
| 5.452 | Этанол | 193.7 | 148.3 | 120.2 | 117.4 | 114.3 |
| Ацетальдегид | 0 | 3.64 | 4.77 | 6.14 | 6.82 | |
| 5.358 | Этанол | 75.4 | 63.0 | 57.4 | 52.0 | 46.5 |
| Ацетальдегид | 0 | 6.59 | 7.05 | 8.64 | 9.32 | |
Об активном вовлечении этанола в радиационно-индуцированные реакции, происходящие при хранении [18F]ФДГ, свидетельствует и снижение концентрации спирта, которое мы наблюдали во всех исследованных партиях РФП, причем наиболее активно этот процесс происходит в первые 2 ч после выпуска партии. Более того, среди химических примесей в [18F]ФДГ, образующихся вследствие авторадиолиза, на рис. 2 отчетливо заметно присутствие ацетальдегида – продукта радиационно-индуцированных превращений этанола в насыщенных воздухом растворах [13]. При сопоставлении профилей накопления [18F]фторида (рис. 1) и приведенных в табл. 1 данных можно заметить, что значения концентраций альдегида коррелируют с процентом дегалогенирования [18F]ФДГ. При одинаковом времени хранения в образцах с более высокими величинами относительных активностей [18F]фторида содержание ацетальдегида было выше. Необходимо отдельно отметить, что это вещество относится к высокотоксичным соединениям и в инъекционных лекарственных средствах его содержание строго лимитируется фармакопеей величиной в 50 ppm или 1.14 × 10–3 моль/л. Поскольку мы обнаружили в одном из образцов через 8 ч хранения близкую к предельной концентрацию ацетальдегида – 9.32 × 10-4 моль/л, при дальнейшем увеличении начальной объемной активности [18F]ФДГ препарат может не выдержать фармакопейные испытания не только из-за радиохимической чистоты, но и по содержанию химических примесей.
Рис. 2.
Хроматограмма остаточных растворителей и легколетучих соединений в радиофармпрепарате [18F]ФДГ с начальной объемной активностью 5.358 ГБк/мл через 6 ч хранения.

Этиловый спирт входит в состав щелочного гидролизующего агента при синтезе [18F]ФДГ на модуле Synthera (“IBA”, Бельгия) в соответствии с патентом [3], что позволяет вводить его в препарат уже на этапе синтеза активной фармацевтической субстанции. Кроме того, этанол может попадать в РФП вследствие его активного использования для обеспечения асептики радиофармацевтического производства, в частности, при ежедневной обработке линий трансферта активной фармацевтической субстанции, поверхностей модулей синтеза радиофармпрепартов, экранированных свинцом радиохимических шкафов-изоляторов и другого оборудования в горячих лабораториях. Из-за наличия нескольких путей поступления концентрация этанола в готовой лекарственной форме [18F]ФДГ может отличаться от партии к партии вплоть до 2–3 раз, что непосредственно сказывается на интенсивности авторадиолитических процессов в РФП и, соответственно, флуктуациях его радиохимической чистоты.
Помимо начальной объемной активности и концентрации этанола в [18F]ФДГ на скорость радиационно-индуцированного дегалогенирования влияет и объем фасовки лекарственного средства. В табл. 2 представлены значения относительной активности [18F]фторида и радиохимической чистоты [18F]ФДГ после 8 ч хранения растворов РФП объемом 1.5 мл и 8 мл во флаконах. Можно заметить, что в образцах из одной партии РФП, имевших на момент выпуска одинаковую концентрацию этанола и объемную активность меченого соединения, увеличение объема с 1.5 до 8 мл приводит к приросту относительной активности [18F]фторида на 1–2.3% (в 1.32–1.52 раза) по данным радио-ВЭЖХ и 0.3–1.8% (в 1.12–1.54 раза) – в случае радио-ТСХ. Причем для флакона с 8 мл раствора [18F]ФДГ с начальной объемной активностью 5.358 ГБк/мл, имевшего невысокую концентрацию этанола на момент окончания синтеза – 7.54 × 10–3 моль/л, доля активности [18F]фторида по данным радио-ТСХ превышает установленный фармакопеей 5% предел [10]. Таким образом, данный образец [18F]ФДГ имеет фактический срок годности меньше 8 ч – периода, указанного в регистрационном досье на РФП. При этом флакон из идентичной партии РФП объемом 1.5 мл не имеет отклонений по содержанию [18F]фторида на момент окончания срока хранения.
Таблица 2.
Зависимость доли активности [18F]фторида и радиохимической чистоты [18F]ФДГ через 8 ч хранения от объема раствора радиофармпрепарата во флаконе
| Начальная объемная активность [18F]ФДГ, ГБк/мл | Объем раствора, мл | Показатели качества радиофармпрепарата | |||
|---|---|---|---|---|---|
| по данным радио-ВЭЖХ | по данным радио-ТСХ | ||||
| Доля активности [18F]F–, % | радиохимическая чистота, % | доля активности [18F]F-, % | радиохимическая чистота, % | ||
| 4.196 | 1.5 | 3.07 | 96.71 | 2.34 | 97.66 |
| 8 | 4.06 | 95.75 | 2.62 | 97.38 | |
| 4.023 | 1.5 | 2.09 | 97.77 | 1.55 | 98.45 |
| 8 | 3.56 | 96.44 | 2.50 | 97.50 | |
| 5.452 | 1.5 | 3.25 | 96.56 | 2.48 | 97.52 |
| 8 | 4.58 | 95.21 | 3.35 | 96.65 | |
| 5.358 | 1.5 | 4.45 | 95.29 | 3.30 | 96.70 |
| 8 | 6.75 | 92.90 | 5.08 | 94.92 | |
Одна из причин наблюдаемой интенсификации авторадиолитического разложения [18F]ФДГ при увеличении объема фасовки раствора во флаконы может быть связана с ростом поглощенной препаратом дозы. В растворах РФП объемом 1.5 мл, что примерно соответствует 10% заполнения флакона, часть позитронов и вторичных электронов теряет свою кинетическую энергию уже в стекле. По мере увеличения степени заполнения флакона такой “эффект стенки” будет уменьшаться. Однако средний пробег позитрона, испускаемого 18F, в воде составляет всего 0.6 мм [14], поэтому только лишь увеличением поглощенной дозы сложно объяснить наблюдаемую интенсификацию авторадиолиза [18F]ФДГ.
Можно заметить, что прирост относительной активности [18F]фторида при увеличении объема фасовки раствора наиболее сильный для партий с высокими начальными объемными активностями [18F]ФДГ (табл. 2), когда в водно-органических системах, насыщенных воздухом, происходит интенсивное расходование кислорода. Поэтому наблюдаемый эффект интенсификации авторадиолиза [18F]ФДГ может быть связан с изменением концентрации кислорода в РФП.
Технологически достижимые концентрации [18F]ФДГ в растворах не превышают 10–6 моль/л, поэтому данное фторорганическое соединение не способно выиграть конкуренцию у кислорода за гидратированный электрон. Следовательно, в аэрированном физиологическом 0.9% водном растворе NaCl гидратированный электрон и атом водорода будут количественно взаимодействовать с кислородом по реакциям 4 и 5. Процессы типа диссоциативного присоединения ${\text{e}}_{{{\text{aq}}}}^{ - },$ характерные для хлор-, бром- и иодорганических соединений [15] будут маловероятны для препаратов [18F]ФДГ, насыщенных воздухом.
(2)
${{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}^{{\centerdot \oplus }}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to {\text{O}}{{{\text{H}}}^{\centerdot }} + {{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{ \oplus }}$(3)
${\text{e}}_{{{\text{aq}}}}^{ \ominus } + {{{\text{H}}}_{{\text{3}}}}{{{\text{O}}}^{ \oplus }} \to {{{\text{H}}}^{\centerdot }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}$(4)
${\text{e}}_{{{\text{aq}}}}^{ \ominus } + {{{\text{O}}}_{2}} \to {\text{O}}_{{\text{2}}}^{{\centerdot \ominus }}$(6)
${\text{HO}}_{{\text{2}}}^{\centerdot } + {{{\text{H}}}_{2}}{\text{O}} \rightleftarrows {\text{O}}_{2}^{{\centerdot \ominus }} + {{{\text{H}}}_{3}}{{{\text{O}}}^{ \oplus }}\,\,\,\,{\text{pKa = 4}}{\text{.8}}{\text{.}}$Радикалы •ОН при взаимодействии с хлорид-ионами будут превращаться в ${\text{Cl}}_{2}^{{\centerdot - }}$ по реакциям 7 и 8:
(7)
${\text{H}}{{{\text{O}}}^{\centerdot }} + {\text{C}}{{{\text{l}}}^{ \ominus }} \to {\text{H}}{{{\text{O}}}^{ \ominus }} + {\text{C}}{{{\text{l}}}^{\centerdot }}$(8)
${\text{C}}{{{\text{l}}}^{\centerdot }} + {\text{C}}{{{\text{l}}}^{ \ominus }} \to {\text{Cl}}{{_{2}^{\centerdot }}^{ \ominus }}.$Как и •ОН анион-радикал ${\text{Cl}}_{2}^{{\centerdot - }}$ проявляет сильные окислительные свойства и в РФП будет в первую очередь взаимодействовать с органическими веществами, содержащимися в более высоких концентрациях, в частности, с этанолом по реакции 9. Лишь малая доля ${\text{Cl}}_{2}^{{\centerdot - }}$ будет окислять [18F]ФДГ, например, по реакции 10.
С учетом строения молекулы [18F]ФДГ наиболее вероятным механизмом элиминирования [18F]фторида является двойная β-фрагментация α-гидроксилсодержащих углеродцентрированных радикалов (α-ГУР), например по реакции 11. Аналогичного рода процессы являются доминирующими при дегалогенировании хлор- и бромгидринов [16], дегидратации моносахаридов [17], расщеплении О-гликозидной связи в гликозидах и дисахаридах [18–20].
В публикациях [18, 21] было показано, что кислород за счет окисления α-ГУР эффективно ингибируeт свободнорадикальные реакции элиминирования функциональных фрагментов от гликозидов различного строения. Можно предположить, что и в нашем случае кислород так же будет ингибировать процессы авторадиолитического дегалогенирования [18F]ФДГ в аэрированных водных растворах посредством окисления α-ГУР, например по реакции 12.
С использованием несложных расчетов можно показать, что концентрация растворенного кислорода будет быстро снижаться в препарате [18F]ФДГ вследствие радиационно-индуцированных процессов. При средней энергии испускаемых при распаде фтора-18 позитронов 0.25 МэВ [14] в растворе РФП с объемной активностью 5.4 ГБк/мл будет выделяться 1.35 × 1015 эВ мл–1 c–1. Кислород будет расходоваться в реакциях 4 и 5 с восстанавливающими радикальными продуктами радиолиза воды, а также при взаимодействии с углеродцентрированными радикалами органических соединений по реакциям 12 и 13. В дальнейшем ${\text{HO}}_{2}^{\centerdot }$ и ${\text{O}}_{2}^{{\centerdot - }}$ будут диспропорционировать до пероксида водорода по реакциям 14, 15.
(13)
${{{\text{O}}}_{2}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\dot {C}HOH} \to {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{COH}} + {\text{HO}}_{2}^{\centerdot }$(14)
${\text{HO}}_{2}^{\centerdot } + {\text{HO}}_{2}^{\centerdot } \to {{{\text{O}}}_{2}} + {{{\text{H}}}_{2}}{{{\text{O}}}_{2}}$(15)
${\text{HO}}_{2}^{\centerdot } + {\text{O}}_{2}^{{\centerdot \ominus }} \to {{{\text{O}}}_{2}} + {\text{HO}}_{2}^{ \ominus }.$Уравнение материального баланса для радиационно-химического выхода разложения кислорода примет следующий вид G(–O2) = 0.5 (${{{\text{G}}}_{{{\text{H}}{{{\text{O}}}^{\centerdot }}}}}$ + + ${{{\text{G}}}_{{{{{\text{H}}}^{\centerdot }}}}}$ + ${\text{G}}_{{{\text{eaq}}}}^{--}$) = 2.975 молекул/100 эВ, а скорость его расходования будет составлять 4.02 × 1013 молекул мл–1 c–1 . При концентрации растворенного в воде кислорода 2.58 × 10–4 моль/л (25°С) для его полного расходования будет достаточно 3856 с или 1.07 ч. Приведенные расчеты используют упрощенную схему авторадиолитических превращений и не учитывают ряд других факторов, однако позволяют количественно оценить интенсивность расходования растворенного кислорода. По мере снижения его концентрации в препарате [18F]ФДГ кислород начнет диффундировать в раствор из воздуха, который содержится во флаконе. Поэтому соотношение объемов раствора РФП и воздуха во флаконе непосредственно влияет на концентрацию растворенного кислорода в препарате [18F]ФДГ при хранении.
Таким образом, наблюдаемая интенсификация авторадиолитического разложения [18F]ФДГ при увеличении объема фасовки раствора во флаконы может быть связана со снижением концентрации кислорода в растворе РФП, вследствие чего соотношение вероятности реализации реакций 11 и 12 смещается в сторону первого процесса – монорадикального дегалогенирования.
Следует отметить, что, несмотря на все усилия по ингибированию авторадиолиза, периодически выпускаются партии [18F]ФДГ, для которых на момент окончания срока годности радиохимическая чистота и относительная активность [18F]фторида может превысить установленные фармакопеей пределы. Как правило, такое случается вследствие нештатных условий производства или проблем с доставкой РФП. При этом отмена запланированных ПЭТ/КТ-исследований с [18F]ФДГ создает значительные неудобства для пациентов и репутационные потери для клиник.
Для исключения артефактов радионуклидной диагностики, связанных с наличием [18F]фторида в [18F]ФДГ, а также для снижения дозовой нагрузки на красный костный мозг пациентов мы рекомендуем использовать сорбционный способ очистки РФП от этого радиоактивного продукта авторадиолиза, приведенный в методической части статьи. Описанная процедура может быть легко реализована в любом ПЭТ-центре и позволяет полностью удалять [18F]фторид из [18F]ФДГ. Потери меченого соединения и степень разбавления – приемлемые для радионуклидной диагностики. Например, при очистке 1.27 мл раствора [18F]ФДГ активностью 380 МБк (эквивалент одной диагностической дозы РФП), содержащего 57 МБк примеси [18F]фторида, 67.2% активности [18F]ФДГ регистрируется в элюате, 20% – остаются на картридже, остальное – в шприце и на фильтре. Объемная активность [18F]ФДГ при этом снижается в 3.7 раза. Препарат сохраняет стерильность и апирогенность в силу использования фильтра с размером пор 0.22 µм.
ЗАКЛЮЧЕНИЕ
В работе изучена кинетика авторадиолитического разложения радиофармацевтического препарата “2-[18F]фтордезоксиглюкоза” ([18F]ФДГ) в насыщенном воздухом физиологическом растворе с начальными объемными активностями 4.02–5.45 ГБк/мл. Показано, что увеличение начальной объемной активности или снижение концентрации этанола приводят к более интенсивному накоплению радиолитического [18F]фторида и деградации радиохимической чистоты препарата. При хранении радиофармацевтического препарата зафиксировано снижение концентрации этанола и образование продукта его радиационно-индуцированных превращений в присутствии кислорода – ацетальдегида, причем концентрация последнего коррелирует с относительной активностью [18F]фторида. Установлено, что при хранении препаратов [18F]ФДГ с одинаковой начальной объемной активностью в герметичных флаконах объемом 15 мл по истечении 8 ч относительная активность [18F]фторида и, соответственно, степень авторадиолитического разложения исходного меченого соединения значительно выше в растворах объемом 8 мл по сравнению с 1.5 мл. Это может быть связано как с увеличением поглощенной препаратом дозы, так и с ингибирующим действием кислорода на процесс радиационно-индуцированного дегалогенирования. Для обеспечения качества радиофармацевтического препарата предложен сорбционный способ очистки [18F]ФДГ от [18F]фторида в условиях действующего ПЭТ-центра, обеспечивающий сохранение асептики и апирогенности инъекционного лекарственного средства.
Список литературы
Vallabhajosula S. // Molecular Imaging: Radiopharmaceuticals for PET and SPECT / Book, Berlin Heidelberg: Springer-Verlag. 2009. 372 p.
Búriová E., Macášek F., Melichar F., Kropá M., Procházka L. // J. Radioanal. Nucl. Chem. 2005. V. 264. № 3. P. 595.
US Patent 7,018,614
Бринкевич С.Д., Суконко О.Г., Чиж Г.В., Полойко Ю.Ф. // Медико-биологические проблемы жизнедеятельности. 2014. № 11. С. 151.
Brinkevich S., Pires L.P., Portilho F.L., Santos-Oliveira R. // Current Radiopharmaceuticals. 2018. V. 11. P. 69.
Walters L.R., Martin K.J., Jacobson M.S., Hung J.C., Mosman E.A. // Journal of Nuclear Medicine Technology. 2012. V. 40. № 1. P. 52.
Бринкевич С.Д., Тугай О.В., Невзоров Д.И. // Химия высоких энергий. 2019. Т. 53. № 4. С. 294.
Иванюкович А.А., Сорока С.А., Крот В.О., Бринкевич Д.И., Бринкевич С.Д., Чиж Г.В., Свердлов Р.Л. // Медицинская физика. 2018. № 4. С. 59.
Бринкевич С.Д., Крот В.О., Бринкевич Д.И., Тугай О.В., Едимечева И.П., Иванюкович А.А. // Радиохимия 2019. Т. 61. № 4. С. 344.
Council of Europe // European Pharmacopoeia 8.0. Article 01/2014:1325: Fludeoxyglucose (18F) injection. / Strasbourg, France. 2013. P. 1052.
Бринкевич С.Д., Шадыро О.И. // Химия высоких энергий. 2018. Т. 52. № 4. С. 347.
Бринкевич С.Д., Кузьмук Д.А. Свердлов Р.Л., Шадыро О.И. // Химия высоких энергий. 2019. Т. 53. № 6. C. 478.
Бринкевич С.Д. // Химия высоких энергий. 2015. Т. 49. № 2. С. 83.
Бринкевич С.Д., Суконко О.Г., Чиж Г.В., Наумович А.С. // Медико-биологические проблемы жизнедеятельности. 2013. № 10. С. 129.
Джагацпанян Р.В., Филиппов М.Т. // Радиационная химия галогенсодержащих органических соединений. М.: Атомиздат, 1973. 271 с.
Петряев Е.П., Шадыро О.И. // Радиационная химия бифункциональных органических соединений. Минск: Университетское, 1986. С. 165.
Von Sonntag C., Schuchmann H.P. // Carbohydrates / Radiation chemistry: present status and future trends. Amsterdam: Elsevier, 2001. P. 481
Шадыро О.И., Кисель Р.М. // Химия высоких энергий. 2007. Т. 41. № 5. С. 369.
Yurkova I., Kisel M., Arnhold J. Shadyro O. // Chem. Phys. Lipids. 2005. V. 134. № 1. P. 41.
Shadyro O., Yurkova I., Kisel M., Brede O., Arnhold J. // Free Rad. Biol. Med. 2004. V. 36. № 12. P. 1612.
Edimecheva I.P., Kisel R.M., Shadyro O.I., Kazem K., Murase H., Kagiya T. // J. Radiat. Res. 2005. V. 46. № 3. P. 319
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий




