Химия высоких энергий, 2020, T. 54, № 5, стр. 333-338
Молекулярная фотоника 2,4-дибензилиденциклобутанона и его производных
В. Н. Гутров a, Г. В. Захарова a, *, М. В. Фомина a, **, Р. О. Старостин a, b, В. Н. Нуриев a, b, С. П. Громов a, b, А. К. Чибисов a
a Центр фотохимии РАН, ФНИЦ “Кристаллография и фотоника” РАН
119421 Москва, ул. Новаторов, 7а, корп. 1, Россия
b Химический факультет, Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, стр. 3, ГСП-1, Россия
* E-mail: gvzakharova@gmail.com
** E-mail: mv_fomina@mail.ru
Поступила в редакцию 20.04.2020
После доработки 20.04.2020
Принята к публикации 20.04.2020
Аннотация
Исследованы спектральные, люминесцентные и спектрально-кинетические свойства 2,4-дибензилиденциклобутанона и его диэтиламино-, метилтио-, метокси-, диметоксипроизводных. Наличие электронодонорных заместителей приводит к длинноволновому смещению максимума полосы поглощения на 45–140 нм по сравнению с незамещенным диеноном и к длинноволновому смещению максимума флуоресценции на 50–125 нм по сравнению с метоксипроизводным. Под действием лазерного импульса происходит переход диенонов в триплетное состояние с временем жизни 0.15–3.5 мкс и образование стабильного фотопродукта.
Исследование спектрально-люминесцентных и фотохимических свойств кросс-сопряженных диенонов, известных как кетоцианиновые красители, является предметом ряда работ [1–7]. Было показано, что кетоцианины обнаруживают сольватохромные свойства, проявляющиеся в сдвигах максимумов спектров поглощения и спектров флуоресценции в зависимости от полярности среды и структуры молекулы красителя, а также проявляют способность к интеркомбинационному переходу в триплетное состояние с квантовым выходом 0.25–0.36 и временем жизни 0.4 мкс [8, 9] и выступают в качестве сенсибилизаторов синглетного кислорода [10]. Свойством данного класса соединений является также их способность участвовать в реакциях [2 + + 2]-фотоциклоприсоединения [11]. Реакцией фотоциклоприсоединения и ее стереоселективностью можно управлять с помощью супрамолекулярной предорганизации двойных связей.
Ранее нами были исследованы спектрально-люминесцентные и спектрально-кинетические свойства симметричных 2,5-дибензилиденциклопентанонов с различными электронодонорными заместителями, находящимися в пара-положениях бензольных циклов [12].
В настоящей работе приведены результаты спектрально-люминесцентного исследования производных 2,4-дибензилиденциклобутанона с электронодонорными заместителями, а также результаты спектрально-кинетического изучения промежуточных продуктов импульсного лазерного возбуждения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Диенон (2,4-дибензилиденциклобутанон) и его производные были синтезированы в ЦФ РАН ФНИЦ “Кристаллография и фотоника” РАН.
Для приготовления растворов диенонов использовали ацетонитрил марки “Криохром” осч и толуол марки “Aldrich”. Измерения разностных спектров триплет-триплетного (Т-Т) поглощения кетоцианина и продукта его фотореакции, а также кинетики дезактивации триплетного состояния проводили на установке лазерного импульсного фотолиза [13, 14]. Импульсное фотовозбуждение осуществляли с помощью 3-й (λ = 354 нм) и 2-й (λ = 532 нм) гармоник лазера Nd:YAG, “Solar”. Растворенный кислород воздуха удаляли путем барботирования раствора газообразным аргоном. Для стационарного облучения растворов кетоцианинов использовали лампу КГМ-100. Облучение проводили как полным, так и фильтрованным светом через светофильтры ЖС-18 + + СЗС-21 и ОС-11 + СЗС-21. Время облучения варьировали в интервале 1–2 мин. Обработку результатов эксперимента выполняли с помощью программы OriginLab версия 8.0. Соединение экспериментальных точек на спектральных кривых в экспериментах по лазерному фотолизу проводили с помощью операции сплайн. Регистрацию спектров поглощения проводили на спектрофотометре Agilent 8453, спектров флуоресценции и фосфоресценции – на спектрофлуориметре Cary Eclipse. Спектры фосфоресценции регистрировали через 100 мкс после прекращения излучения импульсной лампы как источника возбуждения (опция спектрофлуориметра). Измерения выполняли как при комнатной температуре, так и при 77 К.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Поглощение и люминесценция
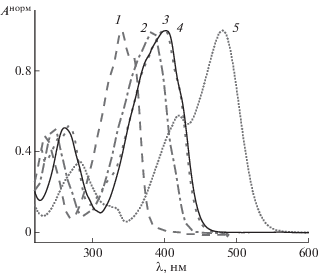
На рис. 1 приведены нормированные спектры поглощения кетоцианинов 1a–e в ацетонитриле. Из рис. 1 следует, что спектры поглощения состоят из двух групп полос. Первая группа полос расположена в области 200–300 нм, вторая – в области 300–550 нм. Интенсивность полос второй группы превышает интенсивность первой. Полосы первой группы относятся к π → π*-переходу, характерному для ароматических кетонов. Полосы второй группы относятся к состоянию с переносом заряда на карбонильную группу [15, 16]. Введение электронодонорных заместителей в па-ра-положения бензольных циклов 2,4-дибензилиденциклобутанона приводит к длинноволновому смещению спектров поглощения. При этом максимальная величина сдвига составляет 140 нм для 1e.
На рис. 2 приведены нормированные спектры флуоресценции 1b–e. Спектры испускания состоят из одной полосы, которая претерпевает батохромный сдвиг при увеличении электронодонорности заместителя. Отметим, что незамещенный диенон 1а не обладает флуоресценцией ввиду того, что нижним является nπ*-уровень. Разгорание флуоресценции при введении электронодонорных заместителей обусловлено инверсией положений nπ*- и ππ*-уровней в молекуле диенона, в результате которой nπ*-уровень располагается над ππ*-уровнем.
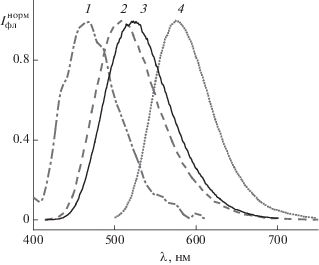
Для 1а–c, 1е обнаружена фосфоресценция в ацетонитриле при 77 К (рис. 3). В спектрах фосфоресценции наблюдали две полосы, причем для 1а–с малоинтенсивная полоса лежит в длинноволновой части спектра, в отличие от 1е, малоинтенсивная полоса которого относится к замедленной флуоресценции красителя, максимум которой совпадает с максимумом быстрой флуоресценции. Наличие замедленной флуоресценции для 1е обусловлено наименьшим энергетическим зазором между T1 и S1 уровнями (2740 см–1) по сравнению с 1b (4090 см–1) и 1с (3440 см–1).
Рис. 3.
Нормированные спектры фосфоресценции 1a (1), 1b (2), 1c (3) и 1e (4) в ацетонитриле при 77 К.
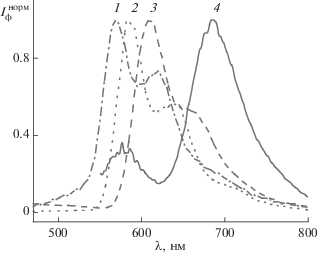
В табл. 1 приведены результаты спектрально-люминесцентных измерений. Интенсивность флуоресценции измеряли в условиях одинакового поглощения на длине волны возбуждения.
Таблица 1.
Спектрально-люминесцентные свойства диенонов 1a–e в ацетонитриле
| Диенон | $\lambda _{{{\text{макс}}}}^{{{\text{погл}}}}$, нм | $\lambda _{{{\text{макс}}}}^{{{\text{фл}}}},$ нм | $I_{{{\text{фл}}}}^{{{\text{отн}}}}$ | Стоксов сдвиг, нм | ЕТ, см–1* |
|---|---|---|---|---|---|
| 1a | 340 | – | – | – | 17 605 |
| 1b | 384 | 470 | 0.0001 | 86 | 17 182 |
| 1c | 398 | 507 | 0.3 | 109 | 16 286 |
| 1d | 402 | 522 | 0.7 | 120 | – |
| 1e | 481 | 576 | 1 | 95 | 14 619 |
Из приведенных данных следует, что с ростом электронодонорности заместителя имеет место увеличение Стоксова сдвига, достигающего 120 нм для тиометоксипроизводного диенона. Наблюдаемые изменения флуоресцентных свойств производных 2,4-дибензилиденциклобутанона указывают на стабилизацию его возбужденного состояния при введении электронодонорных заместителей.
Импульсный лазерный фотолиз
При лазерном импульсном облучении обескислороженных растворов диенонов в ацетонитриле наблюдали кратковременные обратимые изменения в спектрах поглощения кетоцианинов. На рис. 4 приведены разностные спектры поглощения 1e, измеренные к различным моментам времени после лазерного импульса. Короткоживущее поглощение при 720 нм относится к Т-Т поглощению, тогда как поглощение при 520 нм – к поглощению стабильного фотопродукта. На вставке приведена кинетическая кривая дезактивации триплетного состояния 1e в ацетонитриле.
Рис. 4.
Разностные спектры фотоиндуцированного поглощения обескислороженного раствора 1е в ацетонитриле, измеренные через 2 (1), 5 (2), 10 (3) и 50 (4) мкс после лазерного импульса (354 нм). На вставке – кинетика дезактивации триплетного состояния при 720 нм.
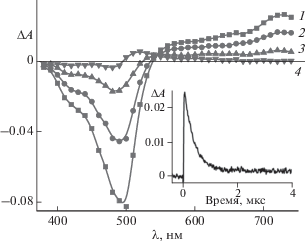
В пользу триплетной природы диенонов свидетельствуют данные по сокращению их времени жизни в воздушнонасыщенном растворе, что особенно проявляется для диенона 1e, имеющего наибольшее время жизни Т-состояния (3.5 мкс). Кроме того, сокращение времени жизни триплетных молекул имеет место в присутствии нафтацена как акцептора триплетной энергии (ET= 10 250 см–1 [17]). Подтверждением переноса энергии является возникновение Т-Т поглощения нафтацена при 460 нм. Для метокси-, диметокси- и метил-тиозамещенных диенонов (1b, 1c и 1d) время жизни триплетных молекул значительно короче и составляет 0.2, 0.15, 0.25 мкс соответственно. Для незамещенного диенона 1a не наблюдали ни Т-Т поглощения, ни образования стабильного фотопродукта.
Ранее нами было показано [18], что для 2,5‑бис-(диэтиламинобензилиден)циклопентанона в ацетонитриле при лазерном импульсном и стационарном облучении образуется стабильный фотопродукт (В), способный к интеркомбинационному переходу в триплетное состояние, а также к фотоиндуцированному переходу в исходный 2,5-бис-(диэтиламинобензилиден)циклопентанон.
Исследования, проведенные в толуоле показали сокращение времени жизни триплетного состояния диенона 1e и увеличение выхода стабильного фотопродукта.
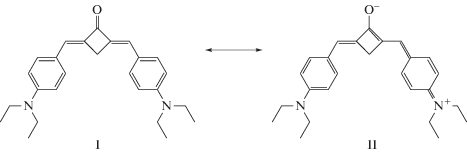
Согласно [19], кетоцианиновые красители присутствуют в растворе в виде резонансных форм (схема), соотношение между которыми зависит от природы растворителя. В неполярных растворителях преобладает кето-форма и, следовательно, в толуоле изменения в поглощении 1e относятся к фотопревращениям кето-формы (I).
Схема
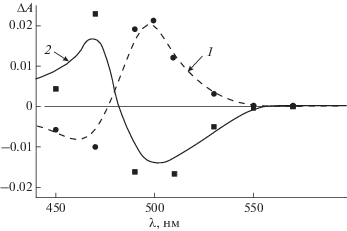
При лазерном возбуждении (λвозб = 354 нм) обескислороженного раствора диенона 1e в толуоле наблюдали образование короткоживущего триплетного состояния с временем жизни 0.5 мкс и долгоживущего стабильного фотопродукта В. На рис. 5 приведен разностный спектр поглощения обескислороженного раствора 1e в толуоле, измеренный через 3 мкс после лазерного импульса (кривая 1). Измеренный спектр отвечает поглощению долгоживущего фотопродукта В. Последующее облучение В лазерным импульсом при 532 нм приводит к образованию исходного диенона 1e (рис. 5, кривая 2).
Рис. 5.
Разностные спектры поглощения в толуоле, измеренные через 3 мкс после лазерного импульса: (1) 1e, λвозб = 354 нм; (2) В, λвозб = 532 нм.
Полученные результаты подтверждаются данными по стационарному облучению. На рис. 6 приведены спектры поглощения 1e, измеренные до (спектр 1) и после (спектр 2) облучения через светофильтры, выделяющие область поглощения красителя, а также после последующего облучения в области λ > 515 нм (спектр 3), через светофильтры, выделяющие область поглощения продукта В фотохимической реакции.
Рис. 6.
Спектры поглощения 1e в толуоле до облучения (1), после облучения через комбинацию светофильтров ЖС-18 + СЗС-21 в течение 2 мин (2) и после последующего облучения через светофильтры ОС-11 + СЗС-20 (3). На вставке приведен разностный спектр между кривыми 2 и 1.
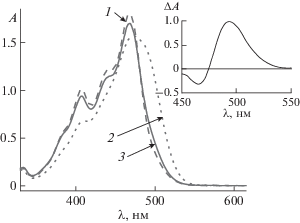
При стационарном облучении в области поглощении фотопродукта В происходит его переход в исходный 1e. На вставке рис. 6 представлен разностный спектр поглощения, полученный вычитанием спектра 1 из спектра 2 и отвечающий поглощению продукта В. Спектр B совпадает со спектром, полученным при импульсном фотовозбуждении 1e (рис. 5, кривая 2). Согласно [20], кетоцианиновые красители проявляют склонность к реакции фотоизомеризации, поэтому, наблюдаемый нами продукт B может быть фотоизомером красителя.
ВЫВОДЫ
Установлено наличие батохромного сдвига максимумов поглощения и флуоресценции при введении электронодонорных заместителей в молекулу 2,4-дибензилиденциклобутанона. Наибольшие сдвиги наблюдаются для диэтиламинозамещенного диенона.
Молекулы дибензилиденциклобутанона и его производных обнаруживают способность к интеркомбинационному переходу в триплетное состояние с временем жизни 0.15–3.5 мкс.
При импульсном лазерном и стационарном возбуждении имеет место образование стабильного фотопродукта, способного к обратному фотоиндуцированному переходу в исходный диенон.
Список литературы
Khalaf A.A., Etaiw S.H., Issa R.M. et al. // Rev. Roum. Chim. 1977. V. 22. № 8. P. 1251.
Kessler M.A., Wolfbeis O.S. // Spectrochim. Acta. A.: Molecular and Biomolecular Spectroscopy. 1991. V. 47. № 2. P. 187.
Татиколов А.С., Красная Ж.А., Шведова Л.А. и др.// Журн. науч. прикл. фотогр. 2001. Т. 46. № 1. С. 34.
Doroshenko A.O., Pivovarenko V.G. // J. Photochem. Photobiol. A. 2003. V. 156. № 1–3. P. 55.
Вацадзе С.З., Голиков А.Г., Кривенько А.П. и др. // Усп. хим. 2008. Т. 77. № 8. С. 707.
Kedia N., Sarkar A., Shannigrahi M. et al. // Spectrochim Acta, A.: Molecular and Biomolecular Spectroscopy. 2011. V. 81. № 1. P. 79.
Zoto C.A., Ucak-Astarlioglu M.G., Connors R.E. // J. Mol. Struct. 2016. V. 1105. P. 396.
Barnabas M.V., Liu A., Trifunac A.D. et al. // J. Phys. Chem. 1992. V. 96. № 1. P. 212.
Захарова Г.В., Зюзькевич Ф.С., Нуриев В.Н. и др. // Химия высоких энергий. 2016. Т. 50. № 1. С. 29.
Zou Q., Zhao H., Zhao Y. et al. // J. Med. Chem. 2015. T. 58. № 20. P. 7949.
Овчинникова И.Г., Никулов Д.К., Барташевич Е.В. и др. // Изв. АН. Сер. хим. 2011. Т. 60. № 5. С. 805.
Захарова Г.В., Зюзькевич Ф.С., Гутров В.Н. и др. // Химия высоких энергий. 2017. Т. 51. № 2. С. 121.
Атабекян Л.С., Чибисов А.К., Алфимов М.В. // Химия высоких энергий. 1997. Т. 31. № 5. 381.
Захарова Г.В., Авакян В.Г., Маркелов В.П. и др. // Химия высоких энергий. 2015. Т. 49. № 6. С. 451.
MondalJ.A.l., VermaS., GhoshH.N. et al. // J. Chem. Sci. 2008. V. 120. № 1. P. 45.
Marcotte N., Fery-Forgues S. // J. Photochem. Photobiol. A. 2000. V. 130. P. 133.
Handbook of Photochemistry, 3rd ed. Boca Raton–London–New York: Taylor & Francis Group. 2006. 635 p.
Гутров В.Н., Захарова Г.В., Зюзькевич Ф.С. и др. // Химия высоких энергий. 2018. Т. 52. № 6. С. 463.
Thipperudrappa J., Deepa H.R., Raghavendra U.P. et al. // J. Biol. Chem. Lum. 2017. № 32. P. 51.
Pronkin P., Tatikolov A. // Sci. – Open Access Journal. 2019. V. 1. № 1. P. 19. https://doi.org/10.3390/sci1010019
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий