Химия высоких энергий, 2020, T. 54, № 6, стр. 489-496
Моделирование газодинамических и тепловых процессов восстановления фторида молибдена и синтеза его карбида в ВЧ индуктивно-связанной плазме
Л. В. Шабарова a, *, П. Г. Сенников a, Р. А. Корнев a, А. Д. Плехович a, А. М. Кутьин a
a Институт химии высокочистых веществ им. Г.Г. Девятых РАН
603950 Нижний Новгород, ул. Тропинина, 49, Россия
* E-mail: shabarova@ihps.nnov.ru
Поступила в редакцию 29.05.2020
После доработки 29.05.2020
Принята к публикации 06.07.2020
Аннотация
Предложена методика моделирования газодинамических условий синтеза молибдена и его карбидов в ВЧИ-плазмохимическом реакторе с вихревой подачей газа. Рассматривается гомогенное течение смеси в турбулентном режиме с учетом индуктивного нагрева и влияния силы электромагнитного поля на движение плазмы. Состав продуктов превращения определяется в соответствии с результатами термодинамических расчетов. Учитывается влияние основных продуктов синтеза на температурное поле и течение потока в реакторе. Проведен анализ возможности применения термической квазиравновесной аргоно-водородной плазмы для получения молибдена и его карбидов Мо2С и Мо3С2 из летучего фторида и для сравнения – вольфрама и его карбида WC. Эти результаты сравниваются с полученными ранее для бора, кремния и их карбидов.
Среди тугоплавких металлов молибден и его соединения (наряду с вольфрамом) относятся к числу наиболее востребованных. Его химии и металлургии посвящено большое число оригинальных публикаций и книг, вышедших еще в 60–80-е годы прошлого века [1–4]. Одним из наиболее эффективных способов получения молибдена в виде плотных слоев и порошков различной дисперсности высокой чистоты, а также карбида Мо2С является метод CVD, в котором в газовой фазе реализуется процесс восстановления летучих соединений молибдена водородом [5]. В случае получения металлического молибдена исходными веществами служат галогениды молибдена или его карбонил, а в случае карбида – галогениды молибдена (или карбонил), и углеводороды [3, 5]. Гексафторид молибдена не относится к числу наиболее часто используемых прекурсоров для получения элементарного молибдена или его соединений, главным образом, по причине образования химически активных побочных продуктов. Однако в последние годы MoF6 стал востребован, будучи обогащенным стабильными изотопами 98Мо и 100Мо центробежным методом. Эти изотопы в результате ядерных превращений можно перевести в радиоактивный изотоп 99Мо, переходящий в cвою очередь в 99mТс – один из важнейших современных радиофармпрепаратов [6]. Поэтому разработка метода эффективной конверсии небольших количеств дорогостоящего изотопнообогащенного MoF6 представляется весьма актуальной [7]. MoF6 является термодинамически устойчивым соединением [8]. Его разложение при температуре значительно выше 1000 К сопровождается образованием фторидов с низкими степенями окисления металла и в конечном счете твердого осадка молибдена и фтора. На практике проводят восстановление водородом. Например, в [9] описана эта реакция в температурном интервале 600–1100°С при соотношении компонентов Н2: MoF6 = 1–60 и парциальных давлениях 5–760 Торр. Оптимальная скорость осаждения имела место при соотношении, равном 3 или больше, парциальном давлении 300 Торр и температуре 700°С. Но в [10] отмечается, что гомогенное протекание реакции водородного восстановления с образованием порошка возможно только при 1200–1400°С при низком выходе. В качестве альтернативы в ряде работ было предложено использовать тот же метод химического осаждения из газовой фазы, но поддерживаемый не резистивным нагревом, а плазмой (PECVD). Как известно, в газовом разряде, поддерживаемом плазму, энергия электрического поля передается электронам слабоионизированной плазмы, которые в свою очередь обеспечивают надтепловое заселение возбужденных атомов и молекул [11]. Возбуждаемые электронами нейтральные частицы стимулируют селективные атомно-молекулярные превращения с высокой скоростью. При этом варьирование параметров плазмы дает возможность управлять химическими процессами, направлять их по нужному каналу и оптимизировать их энергетическую эффективность [12]. Например, в [13] в ВЧ емкостном разряде изучалось водородное восстановление MoF6. Был получен осадок молибдена (не уточняется, в каком виде), на поверхности которого по данным атомной эмиссионной спектроскопии отсутствовал фтор. Термодинамические расчеты не показывали образования осадков молибдена и его фторидов MoFх. Согласно тем же расчетам, в смеси с метаном должен образовываться карбид Мо2С. В [7] сообщалось о получении молибдена в виде порошка и объемных образцов восстановлением MoF6 водородом в ВЧ емкостном и ВЧ дуговом разрядах. В первом случае порошок состоял из смеси Mo и MoF3, во втором практически из чистого молибдена. В [14] из смеси MoF6 + Н2 + СН4 в ВЧ дуговом разряде был получен карбид состава Мо3С2. Пленки карбида молибдена различного состава из подобных смесей методом PECVD получали также в [15, 16].
Ограниченность данных по плазмохимическому осаждению молибдена и его карбидов из смесей на основе MoF6 наряду с упомянутой важностью проблемы конверсии его изотопно-обогащенной разновидности, а также жесткими требованиями по примесному составу к продуктам конверсии с учетом их дальнейшего облучения тепловыми нейтронами, делает актуальным поиск других более эффективных разрядов, поддерживаемых плазму, и конструирование плазмотронов на их основе. Одним из таких разрядов является ВЧ индуктивно-связанный при атмосферном давлении [17]. При разработке конструкции плазмотрона на его основе с оптимальными термогазодинамическими параметрами полезны виртуальные эксперименты, основанные на методах (CFD) [18, 19].
В работах [20–22] нами было выполнено моделирование газодинамических, тепловых и термодинамических условий восстановления фторидов бора, кремния и синтеза их карбидов в ВЧИ аргоно-водородной плазме. Целью настоящего исследования является модификация разработанного ранее подхода с учетом особенностей, возникающих при моделировании восстановления фторидов тяжелых металлов и синтезе их карбидов в исследуемом ВЧИ плазмотроне. На основании доработанной модели проведено теоретическое исследование процесса водородного восстановления в ВЧИ плазме гексафторида молибдена и синтеза его карбида. Аналогичные расчеты проведены для процесса водородного восстановления гексафторида вольфрама и синтеза его карбида. Выполнено сравнение полученных результатов с полученными ранее для синтеза бора и кремния и их карбидов в аналогичных условиях.
МЕТОДИКА ЧИСЛЕННОГО ЭКСПЕРИМЕНТА
В работе рассматривались случаи ввода в исследуемый реактор химически-активных смесей (MoF6 + H2) и (MoF6 + CH4 + H2). Термодинамическое моделирование многокомпонентной плазмохимической системы выполнено по методу минимизации энергии Гиббса. При этом формулы (4), получаемые в процедуре условной минимизации энергии Гиббса (1), выражают концентрации компонентов через неопределенные множители Лагранжа ${{{\lambda }}_{j}}$
(1)
$\begin{gathered} {{G(T,P,\{ {{n}_{i}}\} )} \mathord{\left/ {\vphantom {{G(T,P,\{ {{n}_{i}}\} )} {RT}}} \right. \kern-0em} {RT}} = \\ = \,\,\sum\limits_i {{{n}_{i}}\left( {{{g}_{i}} + \ln {{n}_{i}}} \right)} - \sum\limits_f {{{{\bar {n}}}_{f}}\ln {{{\bar {n}}}_{f}}} , \\ \end{gathered} $(4)
${{n}_{i}} = {{\bar {n}}_{f}}\exp \left( {\sum\limits_j {{{a}_{{ij}}}{{{\lambda }}_{j}}} - {{g}_{i}}} \right),$(5)
$\begin{gathered} {{g}_{i}} = {{{{\Delta }_{f}}H^\circ (298)} \mathord{\left/ {\vphantom {{{{\Delta }_{f}}H^\circ (298)} {RT}}} \right. \kern-0em} {RT}} - {{\Phi _{{298}}^{^\circ }(T)} \mathord{\left/ {\vphantom {{\Phi _{{298}}^{^\circ }(T)} R}} \right. \kern-0em} R} + \\ + \,\,\left\{ {\begin{array}{*{20}{l}} {\ln \tilde {P},}&{{\text{пар}}} \\ {0,}&{{\text{конденсат}}} \end{array}} \right.. \\ \end{gathered} $Решение балансных уравнений (2) и (3) по ${{f}_{0}}$ фазам и ${{j}_{0}}$ элементам относительно {${{{\lambda }}_{j}}$} после подстановки выражений (4) в (2) и (3) определяет равновесный состав гетерофазной системы. Величины ${{g}_{i}},$ включающие стандартную энтальпию образования ${{\Delta }_{f}}H^\circ (298)$ и функцию Планка $\Phi _{{298}}^{^\circ }(T),$ содержат необходимую исходную информацию по каждому i-му компоненту. Общее давление $\tilde {P}$ смеси компонентов плазмы в уравнении (5) дается в атмосферах. Матрица ${{A}_{{ij}}} = \{ {{a}_{{ij}}},\;{{a}_{{if}}}\} $ кроме стехиометрических коэффициентов участия j-го элемента в химической формуле i-го вещества ${{a}_{{ij}}},$ включает коэффициенты принадлежности i-го компонента фазе f${{a}_{{if}}} = \{ 1,0\} .$ По исходному химическому составу реагентов рассчитывается элементный состав ${{b}_{j}}$ системы в балансных уравнениях (3). Входящие в выражение (5) стандартные термодинамические функции конденсированных и газообразных компонентов, включая ионы и электронный газ, заимствованы из банка данных ИВТАН ТЕРМO [23].
Отметим, что использование для синтеза молибдена и его карбидов, достаточно мощной, близкой к термической, плазмы индуктивного типа обусловливает применимость к данной задаче предлагаемого метода анализа равновесной плазмы.
Результаты термодинамических расчетов для двух газовых смесей, соответствующих случаям синтеза в исследуемом реакторе молибдена (Mo) и карбидов молибдена (Mo2C, Mo3C2) представлены на рис. 1а, 1б. Молибден образуется из газовой смеси MoF6 + H2 (рис. 1а) в конденсированном состоянии до температуры около 3000 К. В присутствии метана (рис. 1б) образуется смесь карбидов молибдена (Mo2C(с) и Mo3C2(с)). При температурах более 3000 К молибден переходит из формы Mo(g) в ионную Mo(+g).
Рис. 1.
Температурная зависимость состава основных продуктов превращения при давлении 1 атм для смесей (а) 3.333 MoF6 +23.556H2 +150Ar; (б) 3.333 MoF6 + 2.222CH4 + 23.556H2 + 150Ar.

Моделирование газодинамических процессов проведено для плазмохимического реактора мощностью до 50 кВт с вихревой подачей плазмообразующего газа, представленной на рис. 2. Модель включает плазмотрон I, в котором реализуется формирование и индуктивный нагрев аргоно-водородной плазмы; реакционную камеру II, в которую осуществляется подача газа-носителя, газов-реагентов и происходят реакции водородного восстановления и синтез карбидов; а так же охлаждаемый канал III, в котором целевые продукты конверсии конденсируются.
Рис. 2.
Схема ВЧИ-плазмохимического реактора: 1 – входные трубки для подачи смеси Ar : Н2 (8 трубок); 2 – выход; 3 – четырехвитковой индуктор; 4 – входные трубки для подачи газа-носителя и газов-реагентов (3 трубки); I – зона индуктивного нагрева плазмы; II – реакционная зона; III – охлаждаемый канал; D = 0.1 м, lI = 0.3 м, lII = 0.4 м, lIII = 4 м.

Моделирование газодинамики плазмохимического реактора разбито на два этапа. На первом этапе решается задача о течении аргоно-водородной индуктивно-связанной плазмы в зоне плазмотрона I [24]. На втором этапе решается задача о течении аргоно-водородной плазмообразующей смеси и поступающих из входных трубок 4 (рис. 2) газа-носителя и газов-реагентов в зонах II и III. Определенные в результате решения задачи в зоне I поля скоростей и температур аргоно-водородной смеси используются при задании граничного условия на границе плазмотрона и реакционной камеры при решении задачи в зонах II и III. Ниже изложена математическая постановка газодинамической и тепловой задачи в зонах II и III.
Особенностями математического описания движения молибдена и его карбидов в потоке газовой смеси являются прогнозируемая на основании термодинамических расчетов (рис. 1а, 1б) высокая степень конверсии при синтезе исследуемых материалов при температурах, соответствующих температурному режиму в охлаждаемом канале реактора. Так же молибден и его карбиды обладают высокой плотностью, что в сочетании с их ожидаемой значительной концентрацией приводит к необходимости учета влияния мелкодисперсной конденсированной фазы исследуемых целевых продуктов реакции на физические свойства смеси сред и характер течения потока. В этой связи используемое в [20–22] при моделировании синтеза бора, кремния и их карбидов допущение об отсутствии влияния целевых продуктов реакции на течение основного потока для случая синтеза частиц тяжелых металлов и их карбидов некорректно. Описание движения смеси сред в реакторе проводится в следующих допущениях:
– рассматривается массовый трансфер фторида молибдена, водорода и метана (в случае синтеза карбидов) во фтороводород и целевые продукты реакции – молибден и, опционально, его карбиды. Отметим, что согласно термодинамическим расчетам, образования других твердых фторидов в исследуемом температурном диапазоне не происходит. Образование атомарного водорода, фтора, а как же углерода в случае синтеза карбидов, происходит при температурах выше 3000 К (рис. 1), и в газодинамической модели не учитывается, ввиду малости объема части расчетной области, температура в которой превышает 3000 К (<7% от всего объема);
– образование мелкодисперсной конденсированной фазы целевых продуктов в газодинамической модели течения определяется термодинамически обусловленной концентрацией в данной ячейке расчетной области газов-реагентов, при этом процесс конденсации в задаче не моделируется;
– течение смеси сред (аргоно-водородная плазмообразующая смесь, газ-носитель, газы-реагенты, фтороводород и мелкодисперсная фаза целевых продуктов) носит гомогенный характер.
Отметим, что тестовые расчеты свидетельствуют о нарушении гомогенности исследуемого потока при радиусе частиц молибдена и его карбидов более 10 мкм, что на два порядк м а больше предполагаемых размеров получаемых в текущем ВЧИ-плазмотроне мелкодисперсных частиц (около 200 нм).
Ввиду отсутствия физической симметрии течения задача решалась в трехмерной постановке. Расчетная область включает реакционную зону плазмохимического реактора (рис. 2, II) и охлаждаемый канал (рис. 2, III). Рассматривается турбулентное движение вязких сжимаемых идеальных газов и мелкодисперсных частиц в неоднородном температурном поле с учетом теплообмена посредством теплопроводности и конвекции.
Течение газов описывается системой уравнений количества движения (6), энергии (7) и неразрывности (8):
(6)
$\begin{gathered} {\text{div}}(\rho \bar {V} \times \bar {V}) = - {\text{grad}}p + {\text{div}}({{\mu }_{e}}({\text{grad}}\bar {V} + \\ \left. {\left. { + \,\,{{{({\text{grad}}\bar {V})}}^{T}} - \frac{2}{3}\delta {\text{div}}\bar {V}} \right)} \right), \\ \end{gathered} $(7)
${\text{div}}(\rho {{c}_{p}}T \times \bar {V}) = {\text{div}}({{\lambda }_{e}}\nabla T) + \frac{{\partial p}}{{\partial t}},$В (6)–(8) индекс i = 1 соответствует аргоно-водородной плазмообразующей смеси, i = 2 – газу-носителю водороду H2; i = 3 – газу-реагенту (MoF6); i = 4 – метану CH4 (в случае подачи его для водородного восстановления карбидов), i = = 5 – фтороводороду HF(g), i = 6 – молибдену Mo, i = 7 – карбиду димолибдена Mo2C; i = 8 – дикарбиду тримолибдена Mo3C2; fi, ρi, μi, λi – объемная доля и плотность соответствующей среды, при этом: $\sum\nolimits_{i = 1}^8 {{{f}_{i}}} = 1;$ $\rho = \sum\nolimits_{i = 1}^8 {{{f}_{i}}{{\rho }_{i}}} ;$ V – скорость; p – давление, ${{c}_{p}}$– удельная теплоемкость при постоянном давлении (${{c}_{p}} = \sum\nolimits_{i = 1}^8 {{{f}_{i}}{{c}_{p}}_{i}} $), Т – температура, ${{\mu }_{e}},{{\lambda }_{e}}$ – эффективные динамическая вязкость и коэффициент теплопроводности, ${{\mu }_{e}} = \mu + {{\mu }_{t}},$ ${{\lambda }_{e}} = \lambda + {{\lambda }_{t}},$ $\mu ,\lambda $ – ламинарные вязкость и теплопроводность ($\mu = \sum\nolimits_{i = 1}^8 {{{f}_{i}}{{\mu }_{i}}} ,$ $\lambda = \sum\nolimits_{i = 1}^8 {{{f}_{i}}{{\lambda }_{i}}} $), ${{\mu }_{t}},{{\lambda }_{t}}$ – турбулентные (вихревые) вязкость и теплопроводность.
Система уравнений (6)–(8) замыкается моделью турбулентности k–ω, которая описывает завихренность потока в пристеночной области и, по результатам тестовых расчетов, обеспечивает высокую скорость сходимости задачи.
Si – массовые источниковые члены соответствующего вещества в единице объема, при этом в случае подачи в реактор химически-активной смеси (MoF6 + H2) ${{S}_{4}} = {{S}_{7}} = {{S}_{8}} = 0.$
В качестве примера в выражениях (9), (10) и (11) приведен вид источниковых членов для целевых продуктов реакции – соответственно Mo и Mo2C, Mo3C2 (при подаче в реактор CH4):
(9)
${{S}_{{6({\text{Mo}})}}} = {{f}_{3}}{{\rho }_{3}}{{{{n}_{6}}(T)} \mathord{\left/ {\vphantom {{{{n}_{6}}(T)} {n_{3}^{0}}}} \right. \kern-0em} {n_{3}^{0}}}{{{{M}_{6}}} \mathord{\left/ {\vphantom {{{{M}_{6}}} {{{M}_{3}}}}} \right. \kern-0em} {{{M}_{3}}}}.$Здесь и далее ${{n}_{i}}(T)$ – изменение количества вещества в единицу времени (рис. 1); $n_{i}^{0}$(T) – начальное количество вещества, задаваемые в термодинамическом расчете; Mi – молярная масса. Индекс i соответствует обозначениям в уравнениях (6)–(8). Для удобства в индекс массового источника в скобках добавлено вещество, к которому данный источник относится
(10)
$\left[ \begin{gathered} {\text{если}}\,\,\,\,{{f}_{3}} < 2{{f}_{4}}:\,\,\,\,{{S}_{{7({\text{M}}{{{\text{o}}}_{2}}{\text{C}})}}} = {{f}_{3}}{{\rho }_{3}}\frac{{{{n}_{7}}(T)}}{{n_{{_{3}}}^{0}}}\frac{{{{M}_{7}}}}{{({{M}_{3}} + {{M}_{4}})}} + \tfrac{1}{2}{{f}_{3}}{{\rho }_{4}}\frac{{{{n}_{7}}(T)}}{{n_{{_{4}}}^{0}}}\frac{{{{M}_{7}}}}{{({{M}_{3}} + {{M}_{4}})}}, \hfill \\ {\text{если}}\,\,\,\,{{f}_{3}} > 2{{f}_{4}}:\,\,\,\,{{S}_{{7({\text{M}}{{{\text{o}}}_{2}}{\text{C}})}}} = 2{{f}_{4}}{{\rho }_{3}}\frac{{{{n}_{7}}(T)}}{{n_{{_{3}}}^{0}}}\frac{{{{M}_{7}}}}{{({{M}_{3}} + {{M}_{4}})}} + {{f}_{4}}{{\rho }_{4}}\frac{{{{n}_{7}}(T)}}{{n_{{_{4}}}^{0}}}\frac{{{{M}_{7}}}}{{({{M}_{3}} + {{M}_{4}})}}. \hfill \\ \end{gathered} \right.$(11)
$\left[ \begin{gathered} {\text{если}}\,\,\,\,{{f}_{3}} < 1.5{{f}_{4}}:\,\,\,\,{{S}_{{8({\text{M}}{{{\text{o}}}_{3}}{{{\text{C}}}_{2}})}}} = {{f}_{3}}{{\rho }_{3}}\frac{{{{n}_{8}}(T)}}{{n_{{_{3}}}^{0}}}\frac{{{{M}_{8}}}}{{({{M}_{3}} + {{M}_{4}})}} + \tfrac{2}{3}{{f}_{3}}{{\rho }_{4}}\frac{{{{n}_{8}}(T)}}{{n_{{_{4}}}^{0}}}\frac{{{{M}_{8}}}}{{({{M}_{3}} + {{M}_{4}})}}, \hfill \\ {\text{если}}\,\,\,\,{{f}_{3}} > 1.5{{f}_{4}}:\,\,\,\,{{S}_{{8({\text{M}}{{{\text{o}}}_{3}}{{{\text{C}}}_{2}})}}} = 1.5{{f}_{4}}{{\rho }_{3}}\frac{{{{n}_{8}}(T)}}{{n_{{_{3}}}^{0}}}\frac{{{{M}_{8}}}}{{({{M}_{3}} + {{M}_{4}})}} + {{f}_{4}}{{\rho }_{4}}\frac{{{{n}_{8}}(T)}}{{n_{{_{4}}}^{0}}}\frac{{{{M}_{8}}}}{{({{M}_{3}} + {{M}_{4}})}}. \hfill \\ \end{gathered} \right.$Система уравнений (6)–(8) дополняется граничными условиями, которые задаются в соответствии с экспериментальными условиями процесса конверсии в плазмохимическом реакторе с вихревой стабилизацией потока. На входы трубок 4 подается смесь H2, газа-реагента и CH4 комнатной температуры с заданным объемным расходом и соотношением компонентов. На входную границу, отделяющую зоны плазмотрона I и реакционной камеры II, подается плазмообразующий газ с заданными на границе полями скоростей и температур, определенными из решения задачи в зоне плазмотрона I [24]. На выходной границе 2 задается нулевое избыточное давление. На всех твердых стенках ставится условие прилипания, при этом в зоне реакционной камеры II температура боковой стенки составляет 1450 К, в зоне охлаждаемого канала III – 573 К; стенки входных трубок 4 полагаются адиабатическими.
Значения плотности, вязкости, удельной теплоемкости и теплопроводности плазмообразующего газа, H2 и CH4 в модели задаются функциями температуры [25–27]. Для MoF6, HF(g), а так же для Mo удельная теплоемкость определялась с использованием базы данных NIST, вязкость и теплопроводность рассчитывались по формулам, приведенным в [27]. Целевые продукты реакции полагаются несжимаемыми средами, их плотности задаются равными плотностям соответствующих материалов при комнатной температуре. Температурная зависимость теплопроводности Mo взята из [28]. Температурные зависимости удельной теплоемкости и коэффициента теплопроводности для Mo2C в литературе отсутствуют, поэтому в модели теплофизические свойства данного материала задаются постоянными, соответствующими комнатным условиям [29]. Данные о теплофизических свойствах Mo3C2 не приведены в открытых источниках, поэтому они полагаются равными соответствующим характеристикам для Mo2C. При отработке модели проведено параметрическое исследование по влиянию физических свойств продуктов реакции на газодинамическую картину в реакторе. Установлена допустимость применения указанных допущений о теплофизических свойствах мелкодисперсной конденсированной фазы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Моделирование проведено для следующих вариантов объемных расходов при подаче в реактор химически-активных газовых смесей: (MoF6 : H2) = = (3.3 л/мин : 5.5 л/мин); (MoF6 : CH4 : H2) = = (3.3 л/мин : 2.2 л/мин : 5.5 л/мин). Расход CH4 соответствовал минимально необходимому количеству для синтеза карбидов. Расход плазмообразующей смеси Ar : H2 составлял 150 л/мин : 18 л/мин. Энерговыделение в плазме задавалось равным 38 кВт [23].
Результаты моделирования в части тепловых и газодинамических условий в реакторе приведены на рис. 3а, 3б.
Средняя температура газовой смеси в реакционной камере II изменяется в зависимости от вида вводимой смеси не более чем на 7% и составляет около 4400 К. При подаче в реактор смеси для синтеза карбидов скорость потока и температура в охлаждаемом канале III падает соответственно с 1.8 до 1.5 м/c и с 1225 до 1185 К по сравнению со случаем ввода смеси (MoF6 : H2). Данный результат объясняется более существенным вкладом продуктов реакции в распределение температур и скоростей в реакторе при синтезе карбидов молибдена за счет большей плотности целевых продуктов (Mo2C и Mo3C2) по сравнению со случаем синтеза Mo.
Основными численными параметрами при исследовании эффективности синтеза продуктов в ВЧИ-плазмотроне являлись производительность Q (массовый выход целевого продукта) и степень конверсии θ, характеризующая долю газа-реагента, превратившуюся в ходе химической реакции в целевой продукт (Mo, и его карбиды Mo2C, Mo3C2): $\theta = {{Q_{{M - 2}}^{*}{{M}_{3}}} \mathord{\left/ {\vphantom {{Q_{{M - 2}}^{*}{{M}_{3}}} {{{Q}_{{M\,{\text{ГР}} - 4}}}M{\text{*}}}}} \right. \kern-0em} {{{Q}_{{M\,{\text{ГР}} - 4}}}M{\text{*}}}}$ × 100%, где Q–2 и ${{Q}_{{M\,{\text{ГР}} - 4}}}$ – массовые расходы соответственно целевого продукта через выходную границу 2 и газа-реагента через входную границу 4.
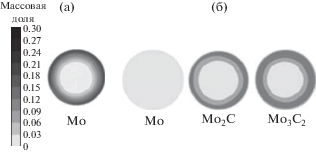
Результаты расчетов по распределению объемной доли Mo на выходе из реактора при конверсии MoF6 в Mo приведены на рис. 4а. Аналогичные результаты в случае синтеза карбидов показаны на рис. 4б.
Рис. 3.
(а) Поле температур в осевом сечении реактора; (б) изоповерхность Т = 3000 К и линии тока в верхней части реактора.

Рис. 4.
Распределение массовой доли конденсированной фазы продуктов реакции на выходе из реактора при подаче в реактор химически-активных смесей (а) MoF6 + H2; (б) MoF6 + CH4 + H2.
В табл. 1 представлены значения массового выхода и степени конверсии молибдена и его карбидов, полученные по результатам cfd-расчетов, в сравнении с соответствующими величинами для синтеза вольфрама, бора, кремния и их карбидов. Характеристики для вольфрама и его карбида рассчитывались аналогично представленной в данной работе модели. Результаты расчетов по синтезу бора, кремния и их карбидов были получены нами ранее [20–22]. Для сравнения температурных режимов образования исследуемых веществ в табл. 1 приведены пороговые значения температур Tmin, выше которых согласно термодинамическим расчетам происходит образование целевого продукта (бора, кремния, молибдена, вольфрама и их карбидов). Входные параметры расчетов, результаты которых приведены в таблицах, в части геометрии реактора, объемных расходов компонентов газового потока и энерговыделения в плазме задавались одинаковыми.
Таблица 1.
Характерные параметры процесса конверсии для различных химически-активных смесей
| (MoF6 + H2)* | (BF3 + + H2) [20] | (SiF4+ H2) [21] | (MoF6 + + CH4 + H2)* | (BF3 + + CH4 + H2) [22] | (SiF4 + + CH4+ + H2) [22] | (WF6 + + H2)* | (WF6 + + CH4+ H2)* | |
|---|---|---|---|---|---|---|---|---|
| Tmin, К | 1000 | 4000 | 3000 | 1000 | – | 2000 | 1000 | 1000 |
| QMo, г/час | 681 | – | – | 4 | – | – | – | – |
| θMo, % | 100% | – | – | 0.1% | – | – | – | – |
| QB, г/час | – | <1 | – | – | <1 | – | – | – |
| θB, % | – | <1% | – | – | <1% | – | – | – |
| QSi, г/час | – | – | 6 | – | – | 8.5 | – | – |
| θSi, % | – | – | 3% | – | – | 4.5% | – | – |
| ${{Q}_{{{\text{M}}{{{\text{o}}}_{{\text{2}}}}{\text{C}}}}}$, г/час | – | – | – | 403 | – | – | – | – |
| ${{\theta }_{{{\text{M}}{{{\text{o}}}_{{\text{2}}}}{\text{C}}}}}$, % | – | – | – | 22% | – | – | – | – |
| ${{Q}_{{{\text{M}}{{{\text{o}}}_{{\text{3}}}}{{{\text{C}}}_{2}}}}}$, г/час | – | – | – | 504 | – | – | – | – |
| ${{\theta }_{{{\text{M}}{{{\text{o}}}_{{\text{3}}}}{{{\text{C}}}_{2}}}}}$, % | – | – | – | 18% | – | – | – | – |
| ${{Q}_{{{{{\text{B}}}_{{\text{4}}}}{\text{C}}}}}$, г/час | – | – | – | – | – | – | – | – |
| ${{\theta }_{{{{{\text{B}}}_{{\text{4}}}}{\text{C}}}}}$, % | – | – | – | – | – | – | – | – |
| QSiC, г/час | – | – | – | – | – | 15.5 | – | – |
| θSiC, % | – | – | – | – | – | 6% | – | – |
| QW, г/час | – | – | – | – | – | – | 1458 | 655 |
| θW, % | – | – | – | – | – | – | 100% | 12% |
| QWC, г/час | – | – | – | – | – | – | – | 1209 |
| θWC, % | – | – | – | – | – | – | – | 88% |
Результаты расчетов свидетельствуют, что при использовании в качестве газов реагентов летучих фторидов газодинамические условия в исследуемом плазмохимическом реакторе наиболее эффективны для синтеза молибдена, вольфрама и их карбидов. Данный результат обосновывается тем, что температурный режим в охлаждаемом канале реактора 1000–3000 К (рис. 3) является на основании термодинамических расчетов (рис. 1) оптимальным для образования конденсированной фазы Mo, W и их карбидов. Напротив, для синтеза из летучего фторида бора и его карбида исследуемая конструкция реактора непригодна. Процесс восстановления бора из его летучего фторида в данном реакторе не может быть реализован, так как подача фторида бора и движение его в реакторе осуществляется в температурную зону Т < 3500 К. Для повышения массового выхода бора необходима модернизация реактора с целью доставки газов-реагентов в высокотемпературную зону (Т > 4000 К), в которой согласно термодинамическому расчету происходит образование газообразного бора [20]. Далее, при поступлении в охлаждаемый канал реактора образовавшийся газообразный бор будет конденсироваться естественным образом, или понадобится дополнительная закалка. В случае подачи в реактор смеси (BF3 + + CH4 + H2) согласно термодинамическому расчету образование B4C в исследуемом температурном диапазоне (1000–10 000 К) термодинамически невыгодно [22]. Промежуточное положение между максимально возможной производительностью исследуемой конструкции для молибдена, вольфрама и их карбидов и нулевым массовым выходом для бора и его карбида занимает вариант синтеза кремния и его карбида. В данном случае, по сравнению с бором несколько понижается пороговая температура образования целевых продуктов. Это позволяет получить небольшое количество кремния и его карбида в исследуемых условиях, однако при весьма низкой степени конверсии, в отличие от синтеза молибдена и его карбидов.
ЗАКЛЮЧЕНИЕ
Предложена методика моделирования газодинамических и тепловых условий получения тяжелых металлов и их карбидов в ВЧИ-плазмохимическом реакторе с вихревой подачей газа, основанная на сочетании термодинамических расчетов квазиравновесной плазмы и моделировании конструкции реактора методами вычислительной гидродинамики.
Выполнены термодинамические расчеты и вычислительные эксперименты для процесса водородного восстановления MoF6 и синтеза Mo2C, Mo3C2 для исследуемой конструкции реактора. На основании расчетов определены поля температур и скоростей потоков при вводе в реактор в струю аргоно-водородной плазмы химически-активных смесей газов (MoF6 + H2) и (MoF6 + CH4 + H2), получены значения прогнозируемой производительности и степени конверсии.
Проведенные термодинамические расчеты указывают на образование молибдена, и его карбидов из летучего фторида в низкотемпературной зоне (1000–3000 К). По результатам cfd-расчетов в исследованной конструкции реактора температура в охлаждаемом канале реактора изменяется от 570 до 4500 К при среднем значении 1200 К. Результаты расчетов свидетельствуют о максимально возможной производительности реактора при получении молибдена и его карбидов из летучего фторида. Аналогичные расчеты, проведенные для процесса водородного восстановления гексафторида вольфрама и синтеза его карбида, так же указывают на максимальную степень конверсии в исследуемом ректоре.
Результаты расчетов для исследованных в настоящей работе веществ значительно отличаются от результатов выполненных ранее расчетов по синтезу кремния, бора их карбидов в аналогичный условиях. Так, конструкция исследуемого реактора является оптимальной для получения в нем молибдена, вольфрама и их карбидов. Вместе с тем, синтез бора и его карбида из летучего фторида в тех же условиях не может быть реализован, а синтез кремния и его карбида происходит с низкой степенью конверсии. Это объясняется тем, что температурный режим в зоне движения газов реагентов не соответствует термодинамически рассчитанным температурам образования бора, кремния и их карбидов из летучих фторидов.
Список литературы
Зеликман А.Н., Меерсон Г.А. Металлургия редких металлов. М.: Металлургия, 1981. 607 с.
Зеликман А.Н. Молибден. М.: Металлургия, 1970. 440 с.
Сонгина О.А. Редкие металлы. М.: Металлургия, 1964. 568 с.
Химия и технология редких и рассеянных элементов. Ч. 3 / Под ред. Большакова К.А. М.: Высшая школа, 1976. 319 с.
McDonald H.O., Stefenson J.B. Chemical vapor deposition of group IVB, VB, and VIB elements with Nnonmetals: a literature review. US Department of the Interior. Bureau of Mines Information Circular. 1983. 29 p.
Risovany V.D., Rotmanov K.V., Maslakov G.I., Goncharenko Yu.D., Shimansky G.A., Zvir A.I., Smirnova I.M., Kuchkina I.N. // World J. Nucl. Sci. and Technol. 2012. V. 2. P. 58.
Kornev R.A., Sennikov P.G., Konychev D.A., Potapov A.M., Chuvilin D.Yu., Yunin P.A., Gusev S.A., Naumann M. // J. Radioanal. Nucl. Chem. 2016. V. 309. P. 833.
Galkin N.P., Tumanov Yu.N. // Russian Chem. Rev. 1971. 40. P. 154.
Shroff A.M., Delval G. // High Temp.-High Pressure. 1971. V. 3. P. 695.
Карелин В.А., Ковалев С.В. // Изв. Томского политехнического университета. 2005. Т. 308. С. 97.
Fridman A. Plasma Chemistry. N.Y.: Cambridge University Press, 2008. 978 p.
Русанов В.Д., Фридман А.А., Шолин Г.В. // УФН. 1981. Т. 134. С. 185.
Di Giuseppe G., Selman J.R. // J. Electroanal. Chem. 2003. V. 559. P. 31.
Kornev R.A., Sennikov P.G., Nazarov V.V. // Plasma Phys. Technol. 2017. V. 4. P. 169.
Yoon S.F., Huang Q.F., Rusli, Yang H., Ahn J., Zhang Q., Blomfield C., Tielsch B., Tan L.Y.C. // J. Appl. Phys. 1999. V. 86. P. 4871.
Wolden C.A., Pickerell A., Gawai T., Parks S., Hensley J., Way J.D. // ACS Appl. Mater. Inyerfaces. 2011. V. 3. P. 517.
Корнев Р.А., Сенников П.Г., Шабарова Л.В., Шишкин А.И., Дроздова Т.А., Синцов С.В. // Химия высоких энергий. 2019. Т. 53. № 3. С. 235.
Rehmet C., Cao T., Cheng Y. // Plasma Sources Science and Technology. 2016. V. 25. № 2. 025011.
Ivanov D.V., Zverev S.G. // IEEE Transactions on Plasma Science. 2017. V. 45. № 12. P. 3125.
Шабарова Л.В., Плехович А.Д., Кутьин А.М., Сенников П.Г., Корнев Р.А. // Химия Высоких Энергий. 2019. Т 53. № 2. С. 148.
Шабарова Л.В., Плехович А.Д., Кутьин А.М., Сенников П.Г., Корнев Р.А. // Теоретические основы химической технологии. 2020. Т 54. № 4. С. 504.
Шабарова Л.В., Сенников П.Г., Корнев Р.А., Плехович А.Д., Кутьин А.М. // Химия высоких энергий. 2019. Т. 53. № 6. С. 489.
Белов Г.В., Иориш В.С., Юнгман В.С. // Теплофизика высоких температур. 2000. Т. 38. № 2. С. 214.
Шабарова Л.В., Корнев Р.А., Сенников П.Г. // Химия высоких энергий. 2018. Т 52. № 5. С. 409.
Murphy A.B. // Plasma Chemistry and Plasma Processing. 2000. V. 20. № 3. P.279.
Гамбург Д.Ю. Водород. Свойства, получение, хранение, транспортирование, применение. М.: Химия, 1989, 672 с.
Бретшнайдер С. Свойства газов и жидкостей. М.-Л.: Химия, 1966. 536 с.
Зиновьев В.Е. Теплофизические свойства металлов при высоких температурах. М.: Металлургия, 1989. 384 с.
Физические величины / Под ред. Григорьев И.С., Мейлихов Е.З. М.: Энергоатомиздат, 1991. 358 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


