Химия высоких энергий, 2022, T. 56, № 3, стр. 235-239
Очистка воды от нафталина под действием диэлектрического барьерного разряда в кислороде
А. А. Гущин a, *, В. И. Гриневич a, Т. В. Извекова a, Е. Ю. Квиткова a, О. Ю. Сулаева a, Е. М. Бабурина a, В. В. Рыбкин a
a Ивановский государственный химико-технологический университет
153000 Иваново, Шереметевский пр., 7, Россия
* E-mail: guschin79@gmail.com
Поступила в редакцию 12.10.2021
После доработки 29.10.2021
Принята к публикации 02.11.2021
- EDN: HPPVZC
- DOI: 10.31857/S0023119322020048
Аннотация
Исследован процесс разложения одного из полициклических ароматических углеводородов (нафталина, НАФ) в его водном растворе под действием диэлектрического барьерного разряда атмосферного давления в кислороде. Диапазон концентраций НАФ составлял 3.4–192.5 мкмоль/л, среднеквадратичных значений напряжений и токов (6–13) кВ и (0.1–0.8) мА. Расход кислорода составлял 3 см3/с. Объемный расход раствора варьировался в пределах 0.15–0.5 мл/с. Показано, что кинетика разложения формально подчинялась 1-му кинетическому порядку с константой скорости (2–3) с–1 при энергетической эффективности 0.005–0.15 разложившихся молекул на 100 эВ вложенной энергии. Достигнутая степень разложения составляла 99%. Установлено, что основными продуктами разложения являются молекулы диоксида углерода (85% от общего содержания углерода) и альдегиды.
Одними из приоритетных загрязнителей окружающей среды являются полициклические ароматические углеводороды (ПАУ) [1, 2]. Каналом попадания ПАУ в объекты окружающей среды могут быть как естественные, так и антропогенные источники [1, 3, 4]. Нафталин, как и другие ПАУ, содержится в воде в относительно небольших количествах, и традиционные методы очистки воды (адсорбция, флотация, коагуляция) практически неэффективны в отношении этой группы загрязняющих веществ, что приводит к их накоплению в различных компонентах окружающей среды, включая водные экосистемы. ПАУ очень опасны из-за их высокой токсичности для организмов всех уровней организации, и их способности накапливаться в водных организмах и передаваться по трофическим цепям. Поэтому актуальной задачей является поиск эффективного метода очистки воды от таких органических соединений.
Одним из перспективных деструктивных методов является метод, основанный на воздействии газовых разрядов на водные растворы. Исследования возможностей этого метода опубликованы во множестве работ, включая обзорные [5–10].
Однако публикаций, связанных с изучением процессов деструкции ПАУ, даже таких простых, как нафталин, практически нет. Например, в работе [11] изучалось разложение нафталина под действием ДБР на воздухе, а также в сухом и увлажненном азоте. Было обнаружено, что эффективность разложения нафталина в сухом азоте выше, чем в увлажненном. В работе [8] представлены результаты сравнения нескольких методов (фотокатализ, озонирование совместно с реактивом Фентона) для очистки воды, содержащей примеси толуола, ксилола, нафталина, фенола, уксусной и малоновой кислот, а также морскую воду. Однако в этих работах отсутствуют оценки кинетических параметров процессов, энергозатрат и полноты процессов деструкции. Поэтому целью данной работы было изучение кинетики разложения нафталина и кинетики образования основных продуктов разложения под действием ДБР в кислороде при различных параметрах разряда и начальных концентрациях. Эти данные позволили получить эффективные константы скорости и определить энергетические параметры процесса разложения.
ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Объектом исследования служили водные растворы НАФ чистотой 99.0% с концентрацией от 3.4 до 192.5 мкмоль/л. Обработку водных растворов НАФ проводили на установке ДБР с реактором коаксиального типа, схема которого приведена в [9]. Цилиндрический реактор из пирексового стекла имел внутренний диаметр 22 мм. Стенка реактора служила диэлектрическим барьером разряда. Внешний электрод длиной 12 см помещался на поверхность реактора. Внутренний электрод из алюминиевого сплава диаметром 8 мм был покрыт тканью из гидрофильного стекловолокна толщиной около 1 мм. Раствор НАФ протекал через ткань в пленочном режиме. Объемный расход раствора варьировался в пределах 0.15–0.5 мл/с. Навстречу потоку раствора подавали поток кислорода (чистота 99.8%) с объемным расходом 3 см3/с. Расход раствора регулировали перистальтическим насосом и определяли время пребывания раствора (τR), которое рассчитывалось как
где D – диаметр стекловолоконного покрытия, см; h – толщина пленки раствора, см; L – длина зоны разряда, см; Q – объемный расход раствора, мл/с.Толщина пленки жидкости рассчитывалась по уравнению для гладкого ламинарного течения из соотношения [12]:
(2)
$h = {{\left( {\frac{{3\nu Q}}{{g\pi D}}} \right)}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}},$Разряд зажигался от источника питания с частотой 50 Гц. Осциллограммы тока и напряжения измерялись цифровым двухканальным осциллографом GW Instek GDS-2072 (Тайвань). Диапазон среднеквадратичных напряжений составлял от 6 до 13 кВ. При этих напряжениях среднеквадратичный ток разряда изменялся от 0.1 до 0.8 мА. Вводимая в разряд мощность рассчитывалась путем интегрирования произведения волновых форм тока и напряжения за период.
Содержание НАФ измеряли на газовом хроматографе Хроматек-5000 (Хроматек, Россия) с пламенно-ионизационным детектором. НАФ также анализировали методом высокоэффективной жидкостной хроматографии на жидкостном анализаторе Флуорат-02 М (Россия) в качестве флуориметрического детектора с колонкой “Supelcosil® LC PAH” с обращенно-фазовым сорбентом “Khromasil C18”.
Общую концентрацию карбоновых кислот определяли абсорбционным методом. Для этого к обработанному раствору добавляли метаванадат аммония и измеряли поглощение полученного соединения при длине волны 400 нм [13]. Для измерений использовался спектрофотометр Hitachi U-2001.
Суммарную концентрацию альдегидов определяли флуоресцентным методом (спектрофлуориметр Флуорат-02, Россия). Для получения флуоресцентного вещества использовали реакцию альдегидов с 1,3-циклогексадионом в присутствии ионов аммония [14]. При анализе длина волны возбуждающего света составляла 395 нм, а длина волны для регистрации составляла 465 нм. Максимальная погрешность определения кислот составляла ~10%, альдегидов ~20%.
Концентрацию озона измеряли по поглощению на длине волны 253.7 нм на выходе из реактора, где находилась кварцевая ячейка. Использовали монохроматор AvaSpec-2048FT-2 (Avantes BV, Netherlands). Источником излучения служила ртутная лампа низкого давления. Концентрация рассчитывалась с использованием сечения фотопоглощения, равного 1.418 × 10–18 см2 [15].
Содержание СО2 в газовой фазе на выходе из реактора измеряли методом газовой хроматографии (хроматограф Хроматек-5000, Хроматек, Россия) с метанатором и пламенно-ионизационным детектором. Калибровку хроматографической системы проводили с использованием CO2 хроматографической чистоты.
Эффективность разложения НAФ (α) и селективность по CO2 (η) определялись как
(4)
${{\eta }_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}(\% ) = \frac{{{{C}_{{{\text{C}}{{{\text{O}}}_{{\text{2}}}}}}}}}{{10\left( {{{C}_{{in}}} - {{C}_{{out}}}} \right)}} \times 100\% ,$Индекс химического потребления кислорода (ХПК) определяли фотометрическим методом, основанным на обработке пробы воды серной кислотой и бихроматом калия при температуре 150°С в присутствии катализатора окисления – сульфата серебра и добавлении сульфата ртути (II). Погрешность метода составляет ±15%.
Энергоэффективность разложения (количество разложившихся молекул на 100 эВ затраченной энергии) оценивалась как
где Q – расход раствора (л/с), необходимый для требуемой степени удаления загрязняющих веществ, NAv – число Авогадро, 1.6 × 10–19 – заряд электрона (Кл), P – мощность, подводимая к разряду, (Вт), Cin – концентрация вещества на входе в реактор (моль/л).РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
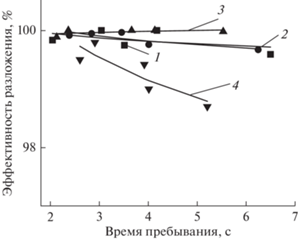
Во всем рассмотренном диапазоне начальных концентраций НАФ в воде степень его разложения в ДБР была высокой (до 99.99%). Степень разложения слабо зависела от исходной концентрации загрязняющего вещества (рис. 1). В связи с тем, что НАФ летуч, были проведены эксперименты по определению его выхода в газовую фазу. Оказалось, что выход НАФ составлял не более 1% от его исходного содержания в растворе.
Рис. 1.
Эффективность разложения как функция времени пребывания раствора в реакторе. 1–4 – исходные концентрации 3, 4, 9.2, 14.2, 192.5 мкмоль/л соответственно. Вложенная мощность W = 0.4 Вт/см3, расход кислорода 3 см3/с.
Кинетика разложения НАФ хорошо описывалась уравнением 1-го кинетического порядка по концентрации НАФ (коэффициент детерминации больше 0.99, рис. 2):
где Keff – эффективная константа скорости разложения.Рис. 2.
Зависимость концентрации от времени пребывания раствора в реакторе. Вложенная мощность W = 0.4 Вт/см3, расход кислорода 3 см3/с. Линия – расчет по уравнению (6) (R2 > 0.99).
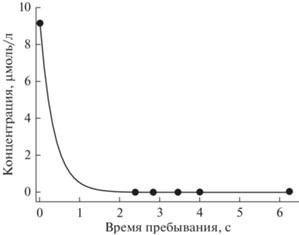
Экспериментально найденные величины Keff, скорости разложения и энергоэффективность приведены в табл. 1. Скорость разложения Wd рассчитывалась при времени пребывания τR → 0, т.е.
Таблица 1.
Скорости, эффективные константы скорости и энергоэффективность процесса разложения нафталина. Условия такие же, как на рис. 1
| Начальная концентрация, мкмоль/л | Эффективная константа скорости, с–1 | Скорость разложения, мкмоль × л–1 × с–1 | Энергоэффективность, молекул/100 эВ |
|---|---|---|---|
| 3.4 | 3.12 ± 0.60 | 0.21 | 0.0053 |
| 9.2 | 2.89 ± 0.81 | 0.45 | 0.014 |
| 14.2 | 3.28 ± 0.11 | 0.56 | 0.025 |
| 192.5 | 1.94 ± 0.44 | 15.48 | 0.15 |
Представляет интерес сравнить результаты, полученные для НАФ, с данными для других органических соединений (загрязнителей). Но при сравнении возникают следующие проблемы. Для разрядов низкого давления разработана теория подобия, определяющая параметры разряда, фиксация которых обеспечивает одинаковость свойств разряда [16]. Для разрядов атмосферного давления такой теории не существует. Наиболее распространены энергетические параметры. Так, в [17] для сравнения предлагается использовать параметр G50 = m50/(Pt), P – мощность, подводимая к разряду, t – длительность разряда, в течение которой масса исходного вещества уменьшается на 50% (m50). Но этот параметр не слишком адекватен по следующим причинам, которые известны из эксперимента. При одной и той же концентрации скорости разложения нелинейно зависят от мощности. При той же мощности скорости разложения нелинейно возрастают с увеличением концентрации. При фиксированной начальной концентрации и мощности скорости зависят от объема обрабатываемого раствора. Уменьшение объема приводит к увеличению скорости [18]. По этой причине значения G50, приведенные в [17], даже для одного вещества и одного типа разряда различаются на порядки. Следовательно, по энергетическим критериям можно сравнивать стойкость различных веществ к действию разряда, если соответствующие результаты были получены в одном и том же реакторе при одинаковой начальной концентрации и мощности разряда. Вышеперечисленные обстоятельства привели к выбору работ, результаты которых были использованы для сравнения. Так, константы скорости разложения водных растворов 2,4-дихлорфенола, измеренные в кислородном ДБР, составили около 2.0 с–1 [19]. Константы скорости разложения четыреххлористого углерода в водных растворах такого разряда были порядка 4 с–1 [20]. В то же время константы скорости разложения фенола в водных растворах намного ниже и лежат в пределах 10–2–10–3 с–1 для разных типов разряда, включая ДБР [18]. Таким образом, НАФ по стойкости к действию разряда близок к стойкости хлорпроизводных фенола, четыреххлористого углерода и гораздо менее устойчив, чем фенол. Из-за близости констант скорости процесса разложения энергетическая эффективность также близка, за исключением фенола. Так, для 2,4-дихлорфенола энергоэффективность составляет 0.05–0.17 молекул/100 эВ, а для четыреххлористого углерода 0.14–1.34 молекулы/100 эВ в ДБР в рассматриваемом диапазоне концентраций [19, 20].
Слабая зависимость констант скорости разложения от начальной концентрации и практически линейное увеличение скорости разложения с увеличением концентрации нафталина свидетельствует о том, что НАФ не влияет на концентрацию активных частиц в растворе и свойства разряда. То есть реакции активных частиц с НАФ не являются лимитирующей стадией для образования активных частиц. По этой причине энергоэффективность увеличивается с увеличением концентрации.
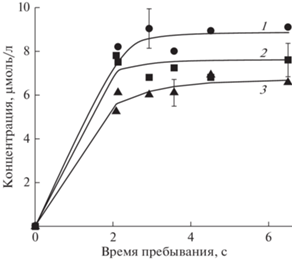
В результате воздействия разряда на его выходе регистрировались альдегиды в жидкой фазе (рис. 3), а также СО2 в газовой фазе. Карбоновые кислоты в обработанных растворах не обнаруживались. Основная часть углерода (около 85%), присутствующего в системе, представлена молекулами СО2. Доля углерода в жидкой фазе составляет всего ~1.0% от исходного содержания углерода в системе. Степень минерализации НАФ в растворе составляет не менее 60%, в зависимости от условий опыта.
Рис. 3.
Общая концентрация альдегидов как функция времени пребывания. 1, 2, 3 – начальная концентрация НАФ составляет 9.2, 29.9, 42.6 мкмоль/л соответственно. Подводимая мощность W = 0.4 Вт/см3, расход кислорода 3 см3/с.
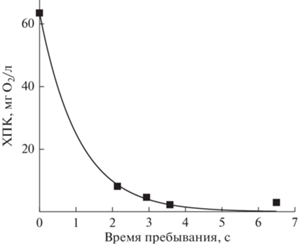
Уровень общего содержания органических соединений до и после обработки оценивался значением показателя “химическое потребление кислорода” (ХПК), который выражается в количестве кислорода, необходимом для окислительных процессов органических веществ, присутствующих в воде. Этот показатель характеризует полноту минерализации органических соединений. На рис. 4 показана зависимость ХПК от времени пребывания. Увеличение времени пребывания раствора приводит к резкому снижению содержания органических соединений в растворе, что согласуется с высоким содержанием молекул СО2 в газовой фазе. При максимальных изученных временах контакта значение ХПК в образцах обработанного раствора снижается в 27 раз, а значение минерализации составляет максимум 96%, что свидетельствует о полноте разложения растворенного НАФ.
Рис. 4.
ХПК как функция времени пребывания. Начальная концентрация 26 мкмоль/л. Подводимая мощность 0.4 Вт/см3, расход кислорода 3 см3/с.
К настоящему времени существует общее мнение (см., например, обзоры [10, 21]), что основными активными частицами, приводящими к окислительной деструкции органических соединений, являются радикалы ОН, атомы кислорода и, в меньшей степени, озон.
Эксперименты показали, при всех концентрациях НАФ и расходах раствора концентрация озона в пределах погрешности эксперимента не меняется и составляет (1.0 ± 0.2) × 1016 см–3. Константа скорости взаимодействия озона с нафталином составляет 3 × 10–19 см3/с [22], а константы скорости взаимодействия атомов О и радикалов ОН с нафталином сравнимы и равны соответственно 2.3 × × 10–11 см3/с и 2.2 × 10–11 см3/с [23]. Концентрации радикалов ОН и атомов кислорода для условий нашего разряда составляют ~(0.1–1) × 1017 см–3 и ~(0.1–1) × 1012 см–3 соответственно [24, 25]. Поэтому можно ожидать, что инициирование разложения НАФ происходит с участием, в основном, радикалов ОН. Судя по экспериментальным константам скоростей, реакция должна быть диффузионно-лимитированной.
ЗАКЛЮЧЕНИЕ
Таким образом, использование ДБР атмосферного давления в кислороде является эффективным средством разрушения полициклических ароматических углеводородов (нафталина) в их водных растворах. Действие разряда позволяет достичь степени разложения 0.99 и выше. Процесс разложения протекает с высокой скоростью и характеризуется характерными временами порядка 0.3–0.5 с и умеренными энергозатратами. Важным преимуществом исследуемого метода является то, что примерно 85% углерода, содержащегося в нафталине, превращается в диоксид углерода.
Список литературы
Ravindr K., Sokhi R., Van Grieken R. // Atmos. Environt. 2008. V. 42. № 13. P. 2895.
Kim K.-H., Jahan S.A., Kabir E., Brown R.J.C. // Environ. Int. 2013. V. 60. P. 71.
Izvekova T.V., Kobeleva N.A., Gushchin A.A., Gerasimova M.S., Grinevich V.I. // CheChemTech. 2018. V. 61. № 12. P. 144.
Izvekova T.V., Kobeleva N.A., Gushchin A.A., Grinevich V.I., Rybkin V.V. // Chemosphere. 2020. V. 242. P. 125150.
Pera-Titus M., García-Molina V., Baños M.A., Giménez J., Esplugas S. // Appl. Catal. B: Environ. 2004. V. 47. № 4. P. 219.
Wang J.L., Xu J.L. // Crit. Rev. Environ. Sci. Technol. 2012.V. 42. № 3. P. 251.
Oturan M.A., Aaron J.J. // Crit. Rev. Environ. Sci. Technol. 2014. V. 44. № 23. P. 2577.
Jiménez S., Andreozzi M., Micó M.M., Álvarez M.G., Contreras S. // Sci. Total Environ. 2019. V. 666. P. 12.
Grinevich V.I., Kvitkova E.Y., Plastinina N.A., Rybkin V.V. // Plasma Chem. Plasma Process. 2011. V. 31. № 4. P. 573.
Rybkin V.V., Shutov D.A. // Plasma Phys. Rep. 2017. V. 43. № 11. P. 1089.
Abdelaziz A.A., Seto T., Abdel-Salam M., Otani Y. // J. Hazard. Mater. 2013. V. 246–247. P. 26.
Bird R.B., Stewart W.E., Lightfoot E.N. Transport phenomena. Second edition. Wiley. 2006.
Lur'e Y.Y. Analytical chemistry of industrial wastewater. Chemistry, Moscow, 1984.
www.lumex.ru/metodics/11AR01.05.05-1.pdf
Parkinson W.H., Yoshino K., Freeman D.E. Smithsonian Institution Astrophysical Observatory. MA 02138. 1988.
Pfau S., Rutscher A., Wojaczek K. // Beitr. Plasmaphys. 1969. V. 9. № 4. P. 333.
Malik M.A. // Plasma Chem. Plasma Process. 2010. V. 30. № 1. P. 21.
Bobkova E.S., Rybkin V.V. // Plasma Chem. Plasma Process. 2015. V. 35. № 1. P. 133.
Gushchin A.A., Grinevich V.I., Shulyk V.Y., Kvitkova E.Y., Rybkin V.V. // Plasma Chem. Plasma Process. 2018. V. 38. № 1. P. 123.
Gushchin A.A., Grinevich V.I., Izvekova T.V., Kvitkova E.Y., Tyukanova K.A., Rybkin V.V. // Plasma Chem. Plasma Process. 2019. V. 39. № 2. P. 461.
Zeghioud H., Nguyen-Tri P., Khezami L., Amrane A., Assadi A.A. // J. Water Process Eng. 2020. V. 38. P. 101664.
Atkinson R., Aschmann S.M. // Int. J. Chem. Kinet. 1986. V. 18. № 5. P. 569.
Shaw J.T., Lidster R.T., Cryer D.R., Ramirez N., Whi-ting F.C., Boustead G.A., Whalley L.K., Ingham T., Rickard A.R., Dunmore R.E., Heard D.E., Lewis A.C., Carpenter L.J., Hamilton J.F., Dillon T.J. // Atmos. Chem. Phys. 2018. V. 18. № 6. P. 4039.
Bobkova E.S., Khodor Y.V., Kornilova O.N., Rybkin V.V. // High Temp. 2014. V. 52. № 4. P. 511.
Kovačević V.V., Dojčinović B.P., Jović M., Roglić G.M., Obradović B.M., M.M. Kuraica M.M. // J. Phys. D: A-ppl. Phys. 2017. V. 50. № 15. P. 155205.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


