Химия высоких энергий, 2022, T. 56, № 5, стр. 416-418
Модификация радиочувствительности холестерической дисперсии ДНК с помощью диметилсульфоксида
М. А. Колыванова a, b, А. В. Белоусов b, В. А. Кузьмин a, В. Н. Морозов a, *
a Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, ул. Косыгина, 4, Россия
b Федеральный медицинский биофизический центр им. А.И. Бурназяна ФМБА России
123098 Москва, ул. Живописная, 46, Россия
* E-mail: morozov.v.n@mail.ru
Поступила в редакцию 30.04.2022
После доработки 05.05.2022
Принята к публикации 10.05.2022
- EDN: VAFZTE
- DOI: 10.31857/S0023119322050072
Химический подход к дозиметрии предлагает богатую палитру методов регистрации радиационного воздействия для самых разных задач использования ионизирующего излучения (ИИ) [1]. Одним из них является хироптический метод: маркером в этом случае выступает оптическая активность чувствительного вещества, регистрируемая с помощью поляриметрии, дисперсии оптического вращения или спектроскопии кругового дихроизма (КД). Учитывая многообразие оптически активных веществ и материалов [2], есть все основания предполагать его перспективность в детектировании ИИ. К простейшим представителям этого класса дозиметрических систем относятся растворы хиральных молекул (например, простых сахаров: сахарозы, глюкозы, арабинозы и др. [3–5]). Однако могут использоваться и более сложные супрамолекулярные системы. Так, например, в недавней работе при проведении облучения на промышленном ускорителе электронов мы показали возможность регистрации высоких доз ИИ (от 20 до 90 кГр) с использованием холестерических жидкокристаллических дисперсий (ХЖКД) ДНК [6]. Эти системы, получаемые в результате конденсации низкомолекулярных (≤ 1 × 106 Да) ДНК в присутствии полиэтиленгликоля (ПЭГ) и высокой концентрации соли [7], обладают выдающимся по интенсивности сигналом КД, просты в приготовлении, дешевы и доступны. Привлекательности их применения в промышленной дозиметрии в значительной мере способствует отечественный опыт разработки компактных дихрометров-анализаторов [8].
Ключевой задачей развития дозиметрических систем на основе ХЖКД ДНК является расширение диапазона регистрируемых с их помощью доз ИИ как в область более низких (~Гр), так и в сторону более высоких значений (~МГр). Ранее на примере производных холестерина было показано, что присутствие перехватчика свободных радикалов позволяет существенно снизить изменение оптических свойств этих молекул, вызванных радиационным воздействием [9]. Поэтому с целью исследования возможности влияния на чувствительность ХЖКД ДНК к радиационному облучению в настоящей работе мы провели эксперимент с добавлением в эту систему диметилсульфоксида (ДМСО). ДМСО представляет собой небольшую амфипатическую молекулу, состоящую из гидрофильной сульфоксидной группы и двух гидрофобных метильных групп, и является одним из важнейших апротонных растворителей. Кроме того, он хорошо известен как радиопротектор: противолучевой эффект ДМСО, основанный на перехвате свободных радикалов, был показан во множестве работ in vitro и in vivo [10–14]. К слову, в этом растворителе хорошо растворяется ПЭГ [15], и в небольших количествах ДМСО не вызывает критических изменений в ХЖКД ДНК.
Процедура приготовления образцов ХЖКД ДНК, а также условия их облучения детально описаны в работе [6]. Концентрации ДНК и ПЭГ в конечной системе составляли 1.2 × 10–4 М и 17 мас. % соответственно. Отметим, что для приготовления образцов в настоящей работе использовался стоковый раствор ПЭГ с концентрацией 34 мас. %. Ранее мы отмечали, что интенсивность сигнала КД системы может заметно снижаться из-за уменьшения осмотического давления раствора полимера в результате ее разбавления [16]. Поэтому для минимизации этого эффекта ДМСО (≥ 99.8%; производства ООО “Компонент-Реактив”, Россия) в концентрации от 0.83 до 5.00 об. % от конечного объема образца (т.е. от 25 до 150 мкл на 3 мл) добавляли в водно-солевой раствор ДНК перед внесением ПЭГ (т.е. перед формированием дисперсии). Этот путь был выбран поскольку внесение ДМСО в исследуемых объемах в готовую дисперсную систему сопровождалось бы значительно более сильным падением сигнала КД (до ≈40% согласно проведенным измерениям). В нашем же случае изменение амплитуды КД-сигнала не превышало 15%.
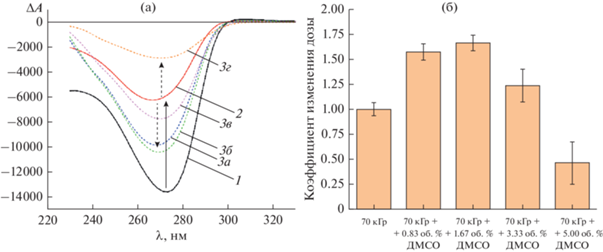
На рис. 1а представлены спектры КД образцов ХЖКД ДНК, облученных пучком высокоэнергетичных тормозных фотонов с максимальной энергией в спектре равной 7.6 МэВ в дозе 70 кГр в отсутствии и в присутствии ДМСО. В результате облучения интенсивность КД-сигнала ХЖКД ДНК уменьшалась на ≈54% по сравнению с необлученным контролем, что с учетом точности пленочной дозиметрии хорошо согласуется с опубликованными ранее результатами [6]. Отметим, что механизм уменьшения оптической активности этой системы под действием ИИ окончательно не определен, однако мы полагаем наличие комплексного влияния радиационно-индуцированного повреждения молекул ДНК и ПЭГ. Поскольку основным компонентом дисперсионной среды является вода, этот эффект, вероятно, обусловлен в первую очередь действием активных форм кислорода (как известно, их вклад в лучевое поражение может составлять до 80–90% [17]). Это подтверждается тем фактом, что добавление в ХЖКД ДНК ДМСО в концентрации от 0.83 до 3.33 об. % приводило к меньшему падению амплитуды сигнала КД: изменения составляли ≈27% (0.83 об. %), ≈23% (1.67 об. %) и ≈43% (3.33 об. %) от исходного значения, что соответствует значениям коэффициента изменения дозы 1.57 ± 0.08, 1.66 ± 0.08 и 1.24 ± 0.17 соответственно (данные для всех исследованных концентраций ДМСО представлены на рис. 1б; по аналогии с работой [18] при фиксированной дозе облучения его значение определяли как отношения пиковой интенсивности КД-сигнала в исследуемом образце к облученному в отсутствии радиопротектора). Отметим, что при внесении в систему аналогичных объемов дистиллированной воды противолучевого действия не наблюдалось. Вместе с тем, при увеличении фракции ДМСО до 5.00 об. % было отмечено падение интенсивности сигнала КД до ≈22% от величины его исходного значения. Коэффициент изменения дозы в этом случае составлял 0.46 ± 0.10. Такое поведение системы указывает на конкуренцию двух процессов: снижения чувствительности ХЖКД ДНК к лучевому воздействию за счет нейтрализации продуктов радиолиза молекулами ДМСО с одной стороны и повышения ее радиочувствительности за счет уменьшения стабилизирующего частицы дисперсии осмотического давления раствора полимера с другой стороны. При небольших концентрациях ДМСО доминирует эффект радиозащиты, однако с ростом его объемной фракции в системе начинает преобладать эффект разбавления.
Рис. 1.
(а) КД-спектры образцов ХЖКД ДНК: 1 – необлученный, 2 – облученный в дозе 70 кГр в отсутствии ДМСО, 3 – облученные в дозе 70 кГр в присутствии ДМСО в различных концентрациях: 0.83 об. % (а), 1.67 об. % (б), 3.33 об. % (в), 5.00 об. % (г). (б) Значения коэффициента изменения дозы для образцов ХЖКД ДНК, облученных в дозе 70 кГр в присутствии различных концентраций ДМСО. Стандартные отклонения рассчитаны по пяти независимым измерениям.
Таким образом, полученные результаты позволяют сделать следующие выводы: 1) добавление в ХЖКД ДНК противолучевых соединений, способных ингибировать протекание радикальных процессов, позволяет уменьшить ее чувствительность к лучевому воздействию и в целом представляет многообещающий способ расширения дозиметрического потенциала этой системы; 2) критическое значение в чувствительности ХЖКД ДНК к облучению имеет осмотическое давление раствора полимера, изменение которого, по-видимому, может позволить в широких пределах варьировать отклик этой системы.
Список литературы
Пикаев А.К. Дозиметрия в радиационной химии. М.: Наука, 1975.
Головина Т.Г., Константинова А.Ф., Тимофеев В.И. // Кристаллография. 2020. Т. 65. С. 677.
Стародубцев С.В., Абляев Ш.А., Генералова В.В. // Атомная энергия. 1960. Т. 8. С. 264.
Генералова В.В., Кишиневская М.Б., Вайншток Б.А. // Атомная энергия. 1969. Т. 26. С. 31.
Venkataramani R. // Radiat. Eff. 1971. V. 11. P. 15.
Kolyvanova M.A., Klimovich M.A., Shibaeva A.V., Koshevaya E.D., Bushmanov Y.A., Belousov A.V., Kuzmin V.A., Morozov V.N. // Liq. Cryst. 2022. In press.
Евдокимов Ю.М., Скуридин С.Г., Салянов В.И., Семенов С.В., Кац Е.И. // Успехи физических наук. 2021. Т. 191. С. 999.
Евдокимов Ю.М., Компанец О.Н. // Научное приборостроение. 2018. Т. 28. С. 44.
Kerllenevich B., Coche A. // Radiat. Eff. 1978. V. 39. P. 103.
Chapman J.D., Doern S.D., Reuvers A.P., Gillespie C.J., Chatterjee A., Blakely E.A., Smith K.C., Tobias C.A. // Radiat. Environ. Biophys. 1979. V. 16. P. 29.
Eberhardt M.K., Colina R. // J. Org. Chem. 1988. V. 53. P. 1071.
Goddu S.M., Narra V.R., Harapanhalli R.S., Howell R.W., Rao D.V. // Acta Oncol. 1996. V. 35. P. 901.
Hirayama R., Matsumoto Y., Kase Y., Noguchi M., Ando K., Ito A., Okayasu R., Furusawa Y. // Radiat. Phys. Chem. 2009. V. 78. P. 1175.
Peng R., Zhang W., Zuo Z., Shan Y., Liu X., Tang Y., Yu Z., Wang L., Cong Y. // Free Radic. Biol. Med. 2020. V. 153. P. 1.
Özdemir C., Güner A. // Eur. Polym. J. 2007. V. 43. P. 3068.
Морозов В.Н., Климович М.А., Колыванова М.А., Дементьева О.В., Рудой В.М., Кузьмин В.А. // Химия высоких энергий. 2021. Т. 55. С. 339.
Korystov Y.N. // Radiat. Res. 1992. V. 129. P. 228.
Detappe A., Kunjachan S., Rottmann J., Robar J., Tsiamas P., Korideck H., Tillement O., Berbeco R. // Cancer Nanotechnol. 2015. V. 6. P. 4.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


