Физикохимия поверхности и защита материалов, 2019, T. 55, № 1, стр. 93-99
Влияние хемосорбированных слоев нитрило-трис-метиленфосфонатных комплексов свинца(II) с мостиковой и хелатной координацией на коррозионно-электрохимическое поведение поверхности стали 20. Термохимическая индукция вторичного ингибирования
Ф. Ф. Чаусов 1, 2, *, **, Н. В. Ломова 1, Н. Ю. Исупов 1, И. Н. Шабанова 1, С. М. Решетников 2
1 Физико-технический институт УрО РАН
426000 Ижевск, ул. Кирова, 132, Россия
2 ФГБОУ ВО “Удмуртский государственный университет”,
426034 Ижевск, ул. Университетская, 1, Россия
* E-mail: chaus@udsu.ru
** E-mail: xps@ftiudm.ru
Поступила в редакцию 29.11.2017
После доработки 25.01.2018
Принята к публикации 27.02.2018
Аннотация
Исследовано влияние хемосорбированных слоев двух комплексов свинца(II) с нитрило-трис-метиленфосфоновой кислотой, отличающихся один от другого координацией атома Pb(II), на коррозионно-электрохимическое поведение поверхности стали 20 в нейтральной водной среде с естественной аэрацией после нанесения адсорбционных слоев комплексов и их термической обработки в воздушной среде. Адсорбционный слой комплекса с мостиковой структурой слабо тормозит анодное растворение стали, термическая обработка практически не влияет на эффективность защиты. Адсорбционный слой комплекса с хелатной структурой при умеренных температурах также незначительно влияет на кинетику анодного процесса; однако после термической обработки при 300°С изменение структуры поверхностного слоя приводит к резкому снижению анодного тока и к облагораживанию стационарного потенциала коррозии. Сделан вывод, что термическая обработка индуцирует распад хелатного комплекса и приводит к вторичному ингибированию поверхности стали продуктами термохимического превращения.
ВВЕДЕНИЕ
Металлокомплексы органофосфоновых кислот, в частности, нитрило-трис-метиленфосфоновой кислоты (NTP), успешно применяются в качестве ингибиторов коррозии стали в нейтральных и умеренно щелочных водных средах [1, 2]. Показано, что эффективность ингибирования коррозии комплексами с одинаковым металлом-комплексообразователем и лигандом зависит от способа координации металла лигандом; так, из двух комплексов цинка с NTP ингибирующая способность комплекса с хелатной структурой оказалась выше, чем с мостиковой [3].
Механизм ингибирующего действия органофосфонатных ингибиторов изучен недостаточно. По-видимому, основным механизмом формирования защитного слоя является образование нерастворимых гетерополинуклеарных комплексов, включающих ионы железа(II) [4, 5]. Именно такие комплексы, образующиеся при взаимодействии Fe2+ с хелатными нитрило-трис-метиленфосфонатными комплексами цинка и кадмия, выделены и детально изучены [6].
По этому критерию органофосфонатные комплексы должны быть отнесены к так называемым вторичным ингибиторам коррозии, которые обеспечивают формирование защитного слоя, включающего продукты химического превращения ингибитора [7, 8]. Эффективность вторичных ингибиторов коррозии определяется их реакционной способностью и природой продуктов химического превращения [9]; эти свойства, в свою очередь, определяются строением.
Ранее в нашей работе [10] было показано, что комплексы свинца(II) с NTP, имеющие мостиковое и хелатное строение, подвергаются термическому разложению при различных температурах, и состав продуктов их термического разложения различен.
В настоящей работе проведено сравнительное исследование влияния хемосорбированных слоев нитрило-трис-метиленфосфонатных комплексов свинца(II) с мостиковым и хелатным строением на поверхности стали 20 после нанесения и высушивания адсорбционных слоев комплексов при комнатной температуре, а также после их термической обработки в воздушной среде при 100, 200 и 300°С.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез, выделение и очистку нитрило-трис-метиленфосфонатных комплексов свинца(II) с различной координацией проводили по ранее описанным методикам [11]. Полученные продукты идентифицировали методами ИК-спектроскопии и РСА с ранее выделенными и исследованными соединениями [10, 11]. Ниже приведены структурные формулы мостикового (I) и хелатного (II) комплексов свинца(II).
Для получения поверхностных слоев использовали образцы из стали 20 (ГОСТ 1050-2013). Образцы шлифовали наждачной бумагой с корундовым зерном № 2000, травили 15%-й соляной кислотой в течение 1 мин для удаления деформированного слоя металла и промывали дистиллированной водой. Далее подготовленные образцы погружали на 15 мин в 1%-е водные растворы комплексов (I) и (II), после чего удаляли остатки растворов с помощью фильтровальной бумаги.
Рентгенофотоэлектронные спектры (РФЭС) образцов с адсорбированными слоями комплексов (I) и (II) получали при помощи отечественного рентгеноэлектронного спектрометра ЭМС-3, разработанного и выпущенного Физико-техническим институтом УрО РАН, г. Ижевск [12]. После установки в рабочую камеру спектрометра с остаточным давлением 10–4–10–3 Па образцы подвергали термическому воздействию от комнатной температуры до 450°С. В процессе термического воздействия регистрировали in situ РФЭС поверхности образцов, покрытой адсорбированными слоями комплексов (I) и (II), с возбуждением Al-Kα-излучением (hν = 1486.6 эВ). Регистрировали спектры внутренних уровней Na2s, P2p, Pb4f, C1s, N1s, O1s и Fe2p3/2, а также спектр валентной полосы. Калибровку энергоанализатора проводили по спектрам C1s (энергия связи EB = = 285.0 эВ) и Na2s (EB = 63.5 эВ). Коррекцию фона и неупругого рассеяния осуществляли по Ширли [13]. Статистическую обработку спектроскопических данных проводили на ЭВМ при помощи программы Fityk 0.9.8 [14]. Для потока фотоэлектронов принимали пуассоновский закон распределения; на спектрограммах засечками показаны 95% доверительные интервалы для экспериментальных значений интенсивности спектров.
Коррозионно-электрохимическое поведение образцов исследовали в среде боратного буферного раствора Холмса [15] с pH 7.6 в условиях естественной аэрации. Измерения проводили в потенциодинамическом режиме при помощи автоматизированного потенциостата Ecolab-2a-500 (ООО “Эковектор”, г. Ижевск). Перед испытаниями каждый из образцов стали 20, покрытых адсорбированными слоями комплексов (I) и (II), высушивали при заданной температуре (25, 100, 200 и 300°С) в воздушной среде. После этого образцы охлаждали до комнатной температуры и помещали в электрохимическую ячейку. Измерения проводили при 25 ± 2°C по трехэлектродной схеме, используя платиновый вспомогательный электрод и электрод сравнения Ag, AgCl|KCl (нас.), относительно которого и приведены электродные потенциалы. Перед началом измерений образцы подвергали катодной тренировке при потенциале ‒900 мВ в течение 15 мин. Для регистрации процесса разрушения защитного слоя в ходе коррозионного процесса проводили последовательно три цикла развертки в диапазоне от –900 до 1500 мВ при скорости развертки потенциала 2 мВ/с. Измеренные в ходе потенциодинамической поляризации анодные токи приведена в мкА на 1 см2 геометрической поверхности.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Наиболее характерные РФЭС основных компонентов поверхностного слоя образцов стали с адсорбированным слоем мостикового комплекса (I) приведены на рис. 1. При температуре, близкой к комнатной, спектр P2p содержит одну составляющую с энергией связи EB = 132.1 эВ и шириной на половине высоты (ШПВ) 1.8 эВ. Выравнивание электронной плотности на атомах фосфора комплекса (I) при его адсорбции на поверхности стали происходит вследствие их взаимодействия с атомами железа поверхностного слоя, что указывает на химический механизм адсорбции, сопровождающейся образованием поверхностных донорно-акцепторных комплексов. Наблюдается дублет Pb4f7/2–Pb4f5/2 с энергиями связи EB = 137.8 и 142.6 эВ, характерными для Pb+2 [16]. Спектр железа Fe2p3/2 при температуре 75°С не наблюдается; это показывает, что толщина хемосорбированного слоя (I) превышает аналитическую глубину метода РЭС (4–6 нм).
Рис. 1.
РФЭС P2p, Pb4f7/2–Pb4f5/2 и Fe2p3/2 образцов стали 20 с адсорбированным слоем мостикового комплекса (I) при термическом воздействии in situ.

Выше 100°С в спектре P2p появляется составляющая с EB = 133.5 эВ и ШПВ 1.8 эВ, что указывает на окисление части фосфонатных групп C–${\text{PO}}_{3}^{{2 - }}$ до фосфатных ${\text{PO}}_{4}^{{3 - }}.$ В спектре Fe2p3/2 присутствуют составляющие с EB = 707 и 710 эВ, относящиеся, соответственно, к металлическому железу и Fe+2 [17]. Показано [18, 19], что при взаимодействии солей железа с фосфонатными лигандами Fe стабилизируется в степени окисления +2; по-видимому, наблюдаемое в спектре окисленное состояние железа обусловлено взаимодействием с фосфонатными группами комплекса (I).
При 200°С спектр P2p содержит только составляющую с EB = 133.5 эВ и ШПВ 2.2 эВ, соответствующую окисленному состоянию атомов фосфора в составе фосфатов и полифосфатов железа. Интенсивность спектра Pb4f падает ниже статистической погрешности. В спектре Fe2p3/2 увеличивается пик, отвечающий металлическому железу, что свидетельствует об уменьшении толщины слоя фосфатов и полифосфатов, содержащих Fe+2.
При 300°С интенсивность как спектра P2p, так и пика Fe+2 резко снижается, а интенсивность спектра металлического железа существенно возрастает из-за разрушения поверхностного слоя фосфатов железа.
На рис. 2 представлены потенциодинамические кривые образцов стали 20 с адсорбированными слоями мостикового комплекса (I), обработанными при различной температуре, в сравнении с потенциодинамической кривой образца стали 20 без защитного слоя (контрольный опыт). Видно, что нанесение защитного слоя при температуре 25–200°C не приводит к заметному снижению анодного тока на участке условно-активного растворения. При 300°C формирование поверхностного слоя с участием фосфатов железа приводит к снижению анодного тока в области условно-активного растворения и снижает потенциал начала пассивации. Анодный ток в области пассивного состояния металла несколько меньше, чем в контрольном опыте. Стационарный потенциал коррозии для образца с адсорбированным слоем (I), обработанным при 300°C, облагораживается лишь на 40 мВ по сравнению с образцом незащищенной стали 20.
Рис. 2.
Потенциодинамические кривые образцов стали 20 без обработки (контрольный опыт) и с адсорбированным слоем мостикового комплекса (I), подвергнутым обработке при различных температурах.

Потенциодинамические кривые образца стали 20 с адсорбированным слоем комплекса (I), обработанным при 300°C, в трех последовательных циклах развертки потенциала в сравнении с контрольным опытом, приведены на рис. 3. Можно отметить значительное возрастание анодных токов при циклической анодной поляризации образца, свидетельствующее о быстрой деградации защитного слоя. В целом можно сделать вывод, что адсорбированный слой комплекса (I), независимо от условий термической обработки, слабо влияет на коррозионно-электрохимическое поведение поверхности стали. Свинец, входящий в состав комплекса (I), не принимает участия в формировании защитного слоя. Можно считать, что комплекс (I) играет роль прекурсора для формирования на поверхности стали железофосфатной пленки, защитные свойства которой в водной среде незначительны.
Рис. 3.
Потенциодинамические кривые образца стали 20 без обработки (контрольный опыт) и с адсорбированным слоем мостикового комплекса (I), обработанным при 300°C, в трех последовательных циклах развертки потенциала в сравнении с контрольным опытом.

РФЭС образца стали с адсорбированным слоем хелатного комплекса (II) (рис. 4) свидетельствуют о том, что механизм адсорбции и термохимическое поведение адсорбированного слоя комплекса (II) резко отличается от соответствующих свойств мостикового комплекса (I). В спектре P2p наблюдается одна составляющая с EB = 131.8 эВ и ШПВ 2.0 эВ. Свинец содержится как в окисленном (EB = 137.8 и 142.6 эВ), так и в восстановленном состоянии (EB = 136.0 и 140.8 эВ). Это свидетельствует о существенных отличиях механизма хемосорбции хелатного комплекса (II) от комплекса (I): по-видимому, при взаимодействии (II) с поверхностью стали происходит не только образование поверхностных донорно-акцепторных комплексов, но и частичный внутрисферный обмен Pb+2 на Fe+2. Спектр Fe2p3/2 не наблюдается из-за покрытия поверхности стали плотным адсорбированным слоем, толщина которого превосходит аналитическую глубину метода РФЭС. При 200°С интенсивность спектра Pb4f перераспределяется, свидетельствуя о повышении содержания металлического свинца.
Рис. 4.
РФЭС P2p, Pb4f7/2–Pb4f5/2 и Fe2p3/2 образцов стали 20 с адсорбированным слоем хелатного комплекса (II) при термическом воздействии in situ.

При 300°С составляющие спектра Pb4f, отвечающие Pb+2 (EB = 137.8 и 142.6 эВ), полностью отсутствуют, свинец находится в восстановленном состоянии (EB = 136.0 и 140.8 эВ). Атомы фосфора при этом переходят в окисленное состояние (EB = 133.2 эВ) вследствие окисления фосфонатных групп до фосфатных. Спектр Fe2p3/2 указывает на присутствие наряду с металлическим железом (EB = 707 эВ), также Fe+2 (EB = 710 эВ), что свидетельствует об образовании на поверхности стали при температуре около 300°С слоя соединений сложного состава, предположительно, (Fe,Pb)POx.
При температуре 450°С интенсивность спектра восстановленного свинца снижается, но остается выше статистической погрешности измерений. Сохраняются достаточно интенсивные линии P2p (EB = 133.2 эВ) и Fe2p3/2 (EB = 709.5 эВ), свидетельствующие о сохранении на поверхности фосфатного слоя сложного состава.
На рис. 5 представлены потенциодинамические кривые образцов стали 20 без обработки (контрольный опыт) и с адсорбированными слоями хелатного комплекса (II), обработанными при различной температуре. Как и в случае с мостиковым комплексом (I), нанесение защитного слоя с его обработкой при температуре 25–200°C не приводит к заметному снижению анодного тока на участке условно-активного растворения, а облагораживание потенциала коррозии в сравнении с необработанным образцом не превышает 40 мВ. Однако термическая обработка адсорбированного слоя хелатного комплекса (II) при 300°C приводит к значительному (более чем на порядок) снижению анодного тока, причем участок условно-активного растворения практически отсутствует. Потенциал коррозии при этом смещается по сравнению с контрольным опытом в анодную сторону более чем на 100 мВ.
Рис. 5.
Потенциодинамические кривые образцов стали 20 без обработки (контрольный опыт) и с адсорбированным слоем хелатного комплекса (II), подвергнутым обработке при различных температурах.
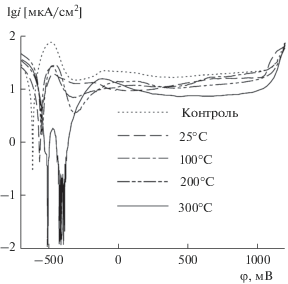
На рис. 6 представлены потенциодинамические кривые образца стали 20 с адсорбированным слоем комплекса (II), обработанным при 300°C, в трех последовательных циклах развертки потенциала. Рост тока коррозии при циклической нагрузке анодным потенциалом образца с защитным слоем хелатного комплекса (II) значительно меньше, чем в аналогичных условиях для комплекса (I). Это свидетельствует о высокой прочности защитного слоя, формируемого при термической обработке при 300°C адсорбированного слоя хелатного комплекса.
Рис. 6.
Потенциодинамические кривые образца стали 20 без обработки (контрольный опыт) и с адсорбированным слоем хелатного комплекса (II), обработанным при 300°C, в трех последовательных циклах развертки потенциала в сравнении с контрольным опытом.

РФЭС валентной полосы образца стали с защитным слоем хелатного комплекса (II) при температуре до 350°C показан на рис. 7; для сравнения приведены парциальные плотности электронных состояний Pb6sp, Fe3d, Fe4p, O2sp, N2sp, P3sp [20]. Сопоставление спектра валентной полосы защитного слоя и формы кривых парциальных плотностей электронных состояний указывает на то, что в электронном спектре валентной зоны защитного слоя комплекса (II) отчетливо проявляются особенности электронных состояний Pb6p, Fe3d4p, перекрывающихся с N2sp, O2sp, P3sp электронными состояниями. Это свидетельствует о возникновении ковалентных химических связей, формирующих и удерживающих на поверхности стали достаточно прочный защитный слой.
Рис. 7.
РФЭС валентной полосы образцов стали 20 с адсорбированным слоем хелатного комплекса (II) и парциальные электронные плотности основных компонентов слоя.

Таким образом, при термической обработке адсорбированного слоя хелатного комплекса (II) продукты его термохимического превращения образуют на поверхности стали защитный слой, обеспечивающий достаточно эффективную защиту от коррозии в нейтральной водной среде с естественной аэрацией.
ЗАКЛЮЧЕНИЕ
1. Защитные свойства нитрило-трис-метиленфосфонатных комплексов зависят не только от металла-комплексообразователя, но и от структуры комплекса – способа координации атома металла молекулой лиганда.
2. Адсорбционный слой нитрило-трис-метиленфосфонатного комплекса свинца(II) с мостиковой структурой, как при комнатной температуре, так и при термической обработке до 300°C практически не влияет на токи анодного растворения стали в нейтральной водной среде с естественной аэрацией.
3. Адсорбционный слой нитрило-трис-метиленфосфонатного комплекса свинца(II) с хелатной структурой при температурах от 25 до 200°C не обладает существенными защитными свойствами. Однако в процессе его термической обработки при 300°C образующиеся продукты термохимического превращения комплекса образуют поверхностный слой комплексов сложного состава, включающий соединения типа (Fe,Pb)POx, обладающий достаточно высокими защитными свойствами. Это позволяет использовать хелатный нитрило-трис-метиленфосфонатный комплекс свинца(II) для получения защитных покрытий на поверхности стальных изделий.
Список литературы
Kuznetsov Yu.I. Organic inhibitors of corrosion of metals. N.-Y.: Plenum Press, 1996. 283 p.
Кузнецов Ю.И., Казанская Г.Ю., Цирульникова Н.В. // Физикохимия поверхности и защита материалов. 2003. Т. 39. № 2. С. 141–144. [Kuznetsov Yu.I., Kazanskaya G.Yu., Tsirulnikova N.V. // Protection of metals and physical chemistry of surfaces. 2003. V. 39. № 2. P. 120–123.] doi 10.1023/A:1022986625711
Чаусов Ф.Ф., Наймушина Е.А., Шабанова И.Н., Решетников С.М. // Известия РАН. Серия Физическая. 2015. Т. 79. № 6. С. 848–851. doi 10.7868/ S036767651506006X
Кузнецов Ю.И. // Физикохимия поверхности и защита материалов. 2002. Т. 38. № 2. С. 122–131. [Kuznetsov Yu.I. // Protection of metals and physical chemistry of surfaces. 2002. V. 38. № 2. P. 103–111.] doi 10.1023/A:1014904830050
Кузнецов Ю.И. // Успехи химии. 2004. Т. 73. № 1. С. 79–93. [Kuznetsov Yu.I. // Russ. Chem. Rev. 2004. V. 73. № 1. P. 75–87.] doi 10.1070/ RC2004v073n01ABEH000864
Чаусов Ф.Ф., Сомов Н.В., Закирова Р.М. и др. // Изв. РАН. Сер. Физическая. 2017. Т. 81. № 3. С. 394–396. [Chausov F.F., Somov N.V., Zakirova R.M. et al. // Bulletin of the Russian Academy of Sciences: Physics. 2017. V. 81. № 3. P. 394–396.] doi 10.7868/ S0367676517030085
Fischer H. // Werkstoffe und Korrosion. 1972. V. 23. № 6. P. 445–452. doi 10.1002/maco.19720230602
Решетников С.М. Ингибиторы кислотной коррозии металлов. Л.: Химия, 1986. 144 с.
Schweitzer P.A. Fundamentals of Corrosion: Mechanisms, Causes, and Preventative Methods. CRC Press, 2009. 416 p.
Сомов Н.В., Чаусов Ф.Ф., Ломова Н.В. и др. // Координационная химия. 2017. Т. 43. № 9. С. 545–552. [Somov N.V., Chausov F.F., Lomova N.V. et al. // Russ. J. Coord. Chem. 2017. V. 43. №. 9. P. 583–590.] doi 10.1134/S1070328417090093
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М. и др. // Кристаллография. 2017. Т. 62. № 6. С. 896–906. [Somov N.V., Chausov F.F., Zakirova R.M. et al. // Cryst. Rep. 2017. V. 62. № 6. P. 857–867.] doi 10.7868/ S0023476117050228
Trapeznikov V.A., Shabanova I.N., Kholzakov A.V., Ponomaryov A.G. // J. Electron Spectrosc. and Related Phenomena. 2004. V. 137–140. P. 383–385. doi 10.1016/j.elspec.2004.02.115
Shirley D.A. // Phys. Rev. 1972. V. 55. P. 4709–4713. doi 10.1103/PhysRevB.5.4709
Wojdyr M. // J. Appl. Cryst. 2010. V. 43. P. 1126–1128. doi 10.1107/S0021889810030499
Holmes W. // Anat. Rec. 1943. V. 86. № 2. P. 157–187. doi 10.1002/ar.1090860205
Thomas J.M., Tricker M.J. // J. Chem. Soc., Faraday Trans. II. 1975. V. 71. P. 329–336. doi 10.1039/F29757100329
McIntyre N.S., Zetaruk D.G. // Anal. Chem. 1977. V. 49. P. 1521–1529. doi 10.1021/ac50019a016
Bujoli B., Pena O., Palvadeau P. et al. // Chem. Mater. 1993. V. 5. P. 583. doi 10.1021/cm00028a029
Сомов Н.В., Чаусов Ф.Ф., Закирова Р.М. и др. // Кристаллография. 2015. Т. 60. № 6. С. 915–921. [Somov N.V., Chausov F.F., Zakirova R.M. et al. // Cryst. Rep. 2015. V. 60. №. 6. P. 853–859.] doi 10.1134/ S1063774515060334
Сафонцева Н.Ю., Никифоров И.Я. // Журнал структурной химии. 2001. Т. 42. № 3. С. 454–462. [Safontseva N.Yu., Nikiforov I.Ya. // J. Struc. Chem. 2001. V. 42. № 3. P. 378–384.] doi 10.1023/ A:1012452719410
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов



