Физикохимия поверхности и защита материалов, 2019, T. 55, № 1, стр. 86-92
Питтингообразование на углеродистой стали в насыщенных растворах Ca(OH)2, содержащих хлорид
В. С. Шалдаев 1, А. Н. Малофеева 1, А. Д. Давыдов 1, *
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, Россия
* E-mail: davydov@elchem.ac.ru
Поступила в редакцию 17.01.2018
После доработки 22.03.2018
Принята к публикации 26.04.2018
Аннотация
Проведено экспериментальное исследование процесса питтингообразования на углеродистой стали в насыщенных растворах Ca(OH)2, содержащих различные количества NaCl. Для этого были использованы методы циклической вольтамперометрии и хроноамперометрии. Определены зависимости потенциалов коррозии, питтингообразования и репассивации от концентрации NaCl. Сделаны заключения о возможности возникновения питтинговой коррозии стали в таких растворах. Отмечены ограничения возможности используемых электрохимических методов для долгосрочного прогноза питтинговой коррозии металла.
ВВЕДЕНИЕ
Исследования электрохимического поведения углеродистых сталей в хлоридсодержащих щелочных растворах связаны с определением коррозионной стойкости таких сталей с целью их применения для изготовления контейнеров для захоронения радиоактивных отходов [1, 2], анализа коррозионной стойкости стали в бетоне [3, 4] и в других целях.
В работе [1] были получены анодные поляризационные кривые на углеродистой стали (C 0.15, Mn 0.98, Si 0.324, Cr 0.082 мас. %) в насыщенных растворах Ca(OH)2, содержащих различные количества NaCl в интервале температур от 25 до 85°С. Величина рН раствора при 25°С 12.45. Было показано, что исследованная сталь подвергается питтинговому растворению и потенциал питтингообразования (ПО) снижается по линейному закону при увеличении активности ионов Cl– в области примерно от 0.01 до 5 моль/л при фиксированных температурах и при увеличении температуры при фиксированных концентрациях. Закономерности процесса нарушения пассивности и образования питтингов на исследованной стали были объяснены с использованием модели точечных дефектов [5].
Полученные в [1] результаты относятся к процессу нарушения пассивности углеродистой стали в щелочных хлоридных растворах при анодной поляризации. Потенциал ПО Epit в этой работе превышал коррозионный потенциал Ecorr на значительную величину. Например, при содержании 0.1 моль/л NaCl в растворе при 25°С потенциал Epit превышал Ecorr более чем на 1 В. Это затрудняет выводы о возможности питтинговой коррозии стали в таких растворах.
В работе [4] исследовали анодное и коррозионное поведение углеродистой стали (C 0.299, Mn 0.635, Si 0.258, Cu 0.227 мас. %) в щелочном растворе (смесь KOH, NaOH и Ca(OH)2, pH 13.9) при содержании NaCl 0.8 моль/л после экспозиции исследуемых образцов в растворе при потенциале коррозии в течение 90 дней. На анодной кривой наблюдали участок, соответствующий процессу ПО. Потенциал Epit превышал потенциал Ecorr более чем на 0.7 В. Питтинговая коррозия образцов не наблюдалась после 90-дневной экспозиции.
В работах [6–8] исследовали состав и структуру пассивных пленок на железе и сталях в насыщенных растворах Ca(OH)2. Были обнаружены слои оксида и гидроксида железа. В присутствии анионов Cl– состав поверхностной пленки изменялся. Например, авторы [7] пришли к выводу об образовании гидроксидов железа в деаэрированных растворах Ca(OH)2 и оксидов железа в аэрированных растворах. В присутствии в растворе анионов Cl– происходил пробой пассивной пленки. По данным [6] для этого требовалась концентрация CaCl2 0.05 М и выше и анодная поляризация.
Обычно считается, что чем ниже Epit, тем больше вероятность возникновения питтинговой коррозии. При сравнении различных металлов (сплавов) более стойким против питтинговой коррозии в данной коррозионной среде считается тот, для которого выше значение Epit.
Более подробное изучение процессов питтингового нарушения пассивности сталей включает определение не только потенциала Epit, но и потенциала репассивации Erp, определяемого по циклической поляризационной кривой (ЦВА) как потенциал, при котором при обратном ходе кривой ток снижается до значения в пассивном состоянии металла, а также некоторых других характеристических потенциалов, например, [9–12].
Очевидно, например [13], что применение потенциодинамического метода для точных измерений характеристических потенциалов питтингообразования имеет значительный недостаток, заключающийся в наличии индукционного периода процесса ПО, который может составлять весьма длительный период времени. Однако метод ЦВА часто применяется как экспрессный метод исследования закономерностей локальной коррозии. Хроноамперометрия тоже не свободна от влияния индукционного периода, который может значительно затруднить применение этого метода в качестве экспрессного.
При экспериментальном определении Epit и Erp по ходу ЦВА из-за наличия индукционного периода оказывается, что значение Epit зависит от скорости развертки потенциала в некоторых пределах, а значение Erp зависит от количества электричества Q, прошедшего через электрод после начала его активации, или от величины максимальной плотности тока, достигнутой перед изменением направления развертки потенциала imax ([3, 14–20] и множество других работ).
Во многих работах в качестве характеристик локальной коррозии металлов рассматривались величины разности между потенциалами (Erp –Ecorr) или (Epit – Ecorr) [21–27]. Очевидно, что сопротивление материала питтинговой коррозии тем выше, чем выше значения Epit и Erp по сравнению с Ecorr [11].
По мнению авторов ряда работ, например [14, 21, 28, 29], питтинговая коррозия ожидается, если потенциал Erp имеет более отрицательное значение, чем Ecorr. При этом необходимо учитывать, что Ecorr может довольно сильно измениться во времени после начала экспозиции образца в коррозионной среде.
В настоящей работе проведено исследование процесса питтингообразования углеродистой стали в насыщенных растворах Ca(OH)2, содержащих различные количества NaCl.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследование процесса ПО проводилось методом циклической вольтамперометрии (один прямой и один обратный ход анодной вольтамперной кривой) при скорости развертки потенциала 0.5 мВ/с и температуре 20°С. Были использованы потенциостат ПИ-50-1 и двухкоординатный самописец ПДА-1. Углеродистая сталь имела следующий состав, мас. %: C 1.2; Mn 0.25; Si 0.25; Cr < 0.2; Cu < 0.25; Ni < 0.25; S < 0.03; P < 0.035. Использованы насыщенные растворы Ca(OH)2 без добавок и с добавками NaCl с концентрацией от 10–3 до 1 моль/л.
Поверхность образцов стали (диск диаметром 5 мм) перед началом каждого опыта была зачищена наждачной бумагой зернистостью Р400, обезжирена этиловым спиртом и выдержана в соответствующем растворе в течение 1 ч для стабилизации состояния поверхности.
ЦВА снимали от установившегося значения потенциала разомкнутой цепи (потенциала коррозии Ecorr) до потенциала, немного превышающего значение Epit, когда плотность тока активированного растворения достигала 850 мкА/см2. Затем направление развертки потенциала изменяли и кривую снимали при снижении тока до значений, соответствующих пассивному состоянию сплава или до потенциала, при котором происходило изменение знака тока. В ходе таких экспериментов были определены значения потенциалов Ecorr, Epit и Erp. Во всех экспериментах потенциалы измерены и приведены относительно насыщенного хлорид-серебряного электрода сравнения.
Размеры питтингов измеряли с помощью интерферометра Линника.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТОВ
На рис. 1 приведена ЦВА, полученная на стали в насыщенном растворе Ca(OH)2 без добавок NaCl. При прямом ходе (отмечено стрелкой слева направо) при потенциале примерно 0.6 В происходит резкое увеличение тока. При обратном ходе токи в пассивной области меньше, чем при прямом ходе в результате того, что при прямом ходе сталь не активировалась (несмотря на резкое увеличение тока при потенциале около 0.6 В), а еще больше пассивировалась.
На рис. 2 приведена ЦВА, полученная на стали в насыщенном растворе Ca(OH)2 с добавкой NaCl 1 моль/л. Здесь и на других рисунках для опытов с добавками NaCl дан разрыв на кривых и две токовые шкалы, так как интервал токов при наличии активации стали хлоридом очень широк. Шкала А соответствует участку кривой А, шкала В – участку В. В рамках разброса значений Ecorr и Epit они находятся в одном интервале значений. Оценки показывают, что в условиях проведенных опытов Epit примерно на 10 мВ положительнее Eoc.
Потенциал репассивации Erp имеет более отрицательное значение, чем Ecorr и Epit.
На рис. 3 показано как коррозионный потенциал стали изменялся во времени в таком же растворе при длительной экспозиции исследуемого образца в растворе.
Рис. 3.
Изменение во времени Ecorr углеродистой стали в насыщенном растворе Ca(OH)2 с добавкой NaCl 1 моль/л.

Видно, что Ecorr практически сразу после начала опыта начал смещаться в сторону более отрицательных значений, что характерно для возникновения и развития процесса нарушения пассивности стали. После окончания эксперимента на поверхности исследуемого образца обнаружено несколько питтингов: один питтинг глубиной 50 мкм и диаметром 100 мкм на краю образца, а также два питтинга глубиной 15 мкм и диаметром 50 мкм и один питтинг глубиной 6 мкм и диаметром 50 мкм вдали от краев образца.
По ходу кривой на рис. 3 видно, что Ecorr в процессе развития питтингов смещается в сторону более отрицательных значений, приближаясь к значению Erp.
На рис. 4 и 5 приведены ЦВА, полученные в насыщенных растворах Ca(OH)2 с добавками NaCl 0.1 моль/л, рис. 4 и 0.01 моль/л, рис. 5. Потенциал Epit в менее концентрированном 0.01 М растворе значительно выше, чем в 0.1 М растворе, а потенциалы Erp близки между собой. Интересно, что в менее концентрированном по NaCl растворе быстро достигаются значительно большие токи после начала активации. Это можно объяснить тем, что развитие процесса активации в 0.01 М растворе происходит при значительно более высоких анодных потенциалах. Полученный результат означает, что концентрация активатора в данном случае влияет на условия нарушения пассивного состояния стали, на величину Epit, а на развитие процесса активации большее влияние оказывает значение потенциала, при котором происходит этот процесс.
При анодной поляризации легко наблюдается наличие индукционного периода процесса ПО. На рис. 6 приведены кривые изменения плотности тока при трех значениях анодного потенциала Ea, полученные в насыщенном растворе Ca(OH)2 с добавкой NaCl 0.01 М. Длительность индукционного периода зависит от потенциала (кривые 1 и 2). Потенциалы, при которых происходит активация поверхности электрода в этих экспериментах (кривые 1 и 2 на рис. 6) имеют значения 0.2 и 0.25 В, в то время как ЦВА дает нам Epit = 0.35 В. Следовательно, даже при использованной здесь малой (5 × 10–4 В/с) скорости развертки потенциала (в литературе чаще всего встречается скорость развертки 10–3 В/с) из-за наличия индукционного периода значения Epit могут быть несколько завышенными по сравнению с Epit, которые определены методом хроноамперометрии. По этой причине в тех работах, где одновременно имеются данные по значениям Epit, определенным методом ЦВА и методом хроноамперометрии, могут возникать стабильные питтинги при потенциалах ниже Epit, определенного методом ЦВА, например [9, 15]. Надо сказать, что и хроноамперометрические опыты тоже могут давать завышенные значения Epit, если длительность индукционного периода очень высока, например, несколько недель или даже месяцев. Метод хроноамперометрии для нахождения Epit в таких случаях нельзя считать экспрессным. Это тем более относится к методу ЦВА.
Рис. 6.
Изменение во времени плотности анодного тока в насыщенном растворе Ca(OH)2, содержащем 0.01 моль/л NaCl при различных потенциалах, В: 1 – 0.25; 2 – 0.20; 3 – 0.15.

На рис. 7 приведена зависимость коррозионного потенциала от времени экспозиции исследуемого образца в насыщенном растворе Ca(OH)2 с добавкой NaCl 0.1 моль/л. В этом растворе, в отличие от более концентрированного по NaCl (рис. 3), Ecorr смещается в сторону менее отрицательных значений. При экспозиции более месяца наблюдаются скачки потенциала, которые обычно отвечают процессу возникновения и репассивации метастабильных питтингов [9, 13–15, 30, 31]. Развитие такого процесса может привести либо к возникновению активных, стабильных питтингов, либо к затуханию процесса. В наших опытах питтинги на образцах стали не наблюдались. Для получения более определенных выводов необходимы более длительные эксперименты, что выходит далеко за рамки экспрессных электрохимических методов. Вероятность развития процесса по первому, опасному пути (возникновению питтинговой коррозии) в процессе еще более длительных опытов нельзя исключить.
Рис. 7.
Изменение во времени Ecorr углеродистой стали в насыщенном растворе Ca(OH)2 с добавкой NaCl 0.1 моль/л.

На рис. 8 приведены ЦВА, полученные на стали в насыщенном растворе Ca(OH)2 с добавкой NaCl 10–3 моль/л. При столь низкой концентрации NaCl Epit и Erp практически совпадают и превышают потенциал Ecorr более чем на 0.8 В. Эти результаты позволяют сделать вывод об отсутствии опасности питтинговой коррозии используемой в работе углеродистой стали.
Отметим, что кривая обратного хода пересекает кривую прямого хода в области глубокой пассивности при потенциале примерно на 0.8 В положительнее Ecorr. Такая ситуация без какого-либо объяснения отмечалась во многих работах, например [21, 23, 32–34], где было показано, что ток при обратном ходе пересекает кривую прямого хода в области пассивности, и даже изменяет знак; продолжение обратного хода переходит в катодную область при потенциале значительно более положительном, чем исходный Ecorr.
Для объяснения этого надо иметь ввиду наличие разницы потенциалов между Ecorr частично пассивной поверхности (имеется ввиду естественная пассивность металла в водных растворах при Ecorr) и потенциалом полностью активированной поверхности. По мере развития процесса питтингообразования потенциал исследуемого образца должен пройти все промежуточные значения между двумя названными потенциалами [9, 35, 36]. При обратном ходе ЦВА потенциал изменяется в обратном направлении от потенциала полностью или частично активированной поверхности до потенциала репассивации. Если при прямом ходе ЦВА электрод был полностью активирован анионами Cl– (для этого необходимо прохождение достаточно большого количества электричества при анодном потенциале Ea > Epit), то потенциал репассивации может достигать более отрицательных значений, чем Ecorr (кривые на рис. 2, 4, 5). Активация анода при этом столь значительна, что поверхность образца при Erp лишается даже той небольшой степени пассивности, которая характерна для образца перед началом прямого хода поляризационной кривой.
В других случаях вольтамперограмма обратного хода пересекает прямой ход в области пассивности (рис. 8, а также результаты работ [21, 22, 32–34] и ряда других), что можно объяснить недостаточно полной активацией электрода при прямом ходе ЦВА.
На рис. 9 приведены зависимости потенциалов Ecorr, Epit и Erp от концентрации добавки NaCl в насыщенном растворе Ca(OH)2.
Рис. 9.
Зависимости потенциалов Ecorr, Epit и Erp от концентрации добавки NaCl в насыщенном растворе Ca(OH)2.
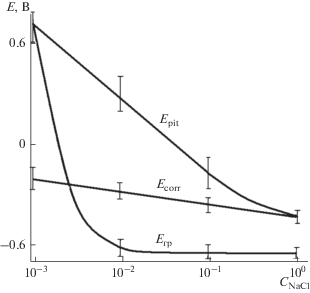
Значения Epit и Erp близки между собой при самой низкой концентрации раствора и несколько сближаются при самой высокой концентрации раствора.
При снижении концентрации NaCl до минимального значения потенциал Erp вплотную приближается к Epit и имеет значительно более положительное значение, чем Ecorr, что означает большую вероятность отсутствия питтинговой коррозии стали. При повышении концентрации NaCl до максимального значения потенциал Epit снижается до значений, близких к Ecorr, а потенциал Erp имеет существенно более отрицательное значение, чем Ecorr, что означает очень высокую вероятность питтинговой коррозии стали.
ЗАКЛЮЧЕНИЕ
Результаты проведенного экспериментального исследования процесса ПО углеродистой стали в насыщенных растворах Ca(OH)2 с добавками NaCl с учетом литературных данных позволяют сделать следующие заключения.
С уверенностью можно заключить, что питтинговая коррозия углеродистой стали указанного состава в насыщенном растворе Ca(OH)2 происходит при содержании в растворе хлорида натрия с концентрацией 1 моль/л. Потенциалы Ecorr и Epit очень близки. После экспозиции исследуемых образцов в течение 25 дней на их поверхности образовались значительные по размерам питтинги.
При содержании добавки NaCl 0.1 моль/л в течение опытов длительностью 50 сут коррозионное поведение стали проявляет характерные признаки образования и репассивации метастабильных питтингов. Для ответа на вопрос, произойдет ли переход к образованию активных питтингов, требуется проведение более длительных экспериментов в условиях свободной коррозии. Потенциал Erp имеет более отрицательное значение, чем начальное значение Ecorr. Полученные результаты свидетельствуют о возможности возникновения питтинговой коррозии стали в таком растворе.
В насыщенных растворах Ca(OH)2 с содержанием NaCl 0.01 моль/л потенциал Erp также имеет более отрицательное значение, чем начальное значение Ecorr. Как и для раствора с содержанием 0.1 М NaCl, это свидетельствует о возможности питтинговой коррозии стали после временного повышения потенциала до значения Epit по какой-либо внешней причине.
В растворах с концентрацией NaCl 0.001 моль/л не обнаружено признаков возникновения питтинговой коррозии стали.
Таким образом, при наиболее высоких и самых низких из использованных концентраций NaCl кратковременные экспрессные электрохимические методы позволяют сделать однозначные выводы относительно прогноза возникновения питтинговой коррозии стали. Что касается “средних” концентраций NaCl, то такие экспрессные методы изучения коррозионного поведения металлов дают неоднозначные выводы. Здесь требуется применение весьма длительных исследований.
Отметим также результат, свидетельствующий о том, что концентрация активирующих ионов влияет на условия нарушения пассивного состояния стали, на величину Epit, а на развитие процесса активации большее влияние оказывает значение потенциала, при котором происходит этот процесс.
Список литературы
Sharifi-Asl S., Mao F., Lu P., Kursten B., Macdonald D.D. // Corros. Sci. 2015. V. 98. P. 708.
Kursten B., Druyts F. // J. Nucl. Mater. 2008. V. 379. P. 91.
Sánchez M., Gregori J., Alonso M.C., García-Jareño J.J., Vicent F. // Electrochim. Acta, 2006, V. 52. P. 47.
Valcarce M.B., Vázquez M. // Electrochim. Acta. 2008. V. 53. P. 5007.
Macdonald D.D. // J. Electrochem. Soc. 1992. V. 139. P. 3434.
Oranowska H., Szklarska-Smialowska Z. // Corros. Sci. 1981. V. 21. P. 735.
Gouda V.K. // Br. Corros. J. 1970.V. 5. P. 198.
Viefhaus H., Janik-Czachor M. // Werkst. Korros. 1977. V. 28. P. 219.
Electrochemical Techniques in Corrosion Science and Engineering / Kelly R.G., Scully J.R., Shoesmith D.W., Buchheit R.G., Eds., NY, Basel: Marcel Dekker, 2003, Ch. 3.
McCafferty E. / Introduction to Corrosion Science, NY: Springer, 2010. Ch. 10.
Pourbaix M., Klimzack-Mathieu L., Mertens C., VanLeugenhaghe C., De Munck L., Laureys J., Neelemans L., Meunier J., Warzee M. // Corros. Sci. 1963. V. 3. P. 239.
Dayal R.K., Parvathavarthini N., Gnanamoorthy J.B. // Corrosion. 1980. V. 36. P. 433.
Schwenk W. // Corrosion. 1964. V. 20. P. 129t.
Давыдов А.Д., Шалдаев В.С., Энгельгардт Г.Р. // Электрохимия. 2006. Т. 42. С. 142.
Давыдов А.Д., Шалдаев В.С., Малофеева А.Н. // Коррозия: материалы, защита. 2004. № 6. С. 2.
Sridhar N., Cragnolino G.A. // Corrosion. 1993. V. 49. P. 885.
Lei K.-S., Macdonald D.D., Pound B.G., Wilde B.E. // J. Electrochem. Soc. 1988. V. 135. P. 1625.
Sussek G., Kesten M. // Corros. Sci. 1975. V. 15. P. 225.
Shibata T., Takeyama T. // Corrosion. 1977. V. 33. P. 243.
Sato N. // Corros. Sci. 1995. V. 37. P. 1947.
Syrett B.C., Viswanathan R., Wing S.S., Wittig J.E. // Corrosion. 1982. V. 38. P. 273.
Thompson N.G., Syrett B.C. // Corrosion. 1992. V. 48. P. 649.
Фрейман Л.И., Флис Я., Пражак М., Гарц И., Наровска Б., Бартоничек Р., Кристаль М.М., Бару Р.Л., Манджагаладзе С.Н., Глазкова С.А., Тламса Я., Реформатская И.И., Старосветский Д.И., Басман А.Р., Маркова Т.П., Данилов И.С., Буканова Г.С., Карасюк Т.Н., Оранская Р.Н., Цикаридзе Т.С., Бандалова М.М. // Защита металлов. 1986. Т. 22. С. 179.
Таранцева К.Р., Пахомов В.С. // Физикохимия поверхности и защита материалов. 2010. Т. 46. С. 301.
Замалетдинов И.И., Барышников И.Н. // Коррозия: материалы, защита. 2016. № 5. С. 7.
Качанов В.А., Гвоздикова Е.К., Балак Т.А., Смирнов А.А., Нестеренко С.В. // Коррозия: материалы, защита. 2012. № 6. С. 9.
Silverman D.C. / Practical Corrosion Prediction Using Electrochemical Techniques, in Uhlig’s Corrosion Handbook, Revie R.W., Ed., NY: Wiley, 2000. P. 1179.
Frankel G.S., Sridhar N. // Materials Today. 2008. V. 11. № 10. P. 38.
Давыдов А.Д. // Электрохимия. 2008. Т. 44. С. 900.
Frankel G.S., Stockert L., Hunkeler F., Boehni H. // Corrosion. 1987. V. 43. P. 429.
Sato N. // J. Electrochem. Soc. 1982. V. 129. P. 255.
Lizlovs E.A., Bond A.P. // Corrosion. 1975. V. 31. P. 219.
Štefec R. // Werkst. Korros. 1982. V. 33. P. 143.
Mor E.D., Scotto V., Mollica A. // Werkst. Korros. 1980. V. 31. P. 282.
Wilde B.E. / Localized Corrosion, Williamsburg, 1971. Int. Corrosion Conf. Ser., Houston: NACE, 1974. P. 342.
Рыбалка К.В., Шалдаев В.С., Бекетаева Л.А., Малофеева А.Н., Давыдов А.Д. // Электрохимия. 2010. Т. 46. С. 204.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов







