Физикохимия поверхности и защита материалов, 2019, T. 55, № 2, стр. 115-119
Расчет изотерм адсорбции компонентов бинарных смесей газов на активных углях методом молекулярной динамики
М. Р. Гумеров 1, П. Е. Фоменков 1, Н. Г. Крюченкова 1, А. М. Толмачев 1, *
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
199992 Москва, Ленинские Горы, дом 1, строение 3, Россия
* E-mail: amtolmach@yandex.ru
Поступила в редакцию 29.04.2018
После доработки 20.06.2018
Принята к публикации 12.07.2018
Аннотация
Показано, что предложенный ранее способ расчета изотерм адсорбции смесей паров в модельной поре активного угля методом молекулярной динамики может быть применен для количественного расчета изотерм адсорбции компонентов бинарных газовых смесей при температурах выше критических. Показано, что рассчитанные изотермы адсорбции компонентов смесей в микропорах и на графеновых поверхностях количественно описываются уравнениями решеточной модели.
ВВЕДЕНИЕ
В развитие предложенного ранее метода [1, 2] в настоящем сообщении будут рассмотрены разработанные авторами варианты применения метода молекулярной динамики для количественных расчетов изотерм адсорбции компонентов смесей газов на микропористых активных углях и графеновых поверхностях в интервале температур, больших критических для адсорбтивов, и показана возможность их количественного описания уравнениями Толмачева–Арановича, полученными в рамках решеточной модели.
Прежде всего отметим, что в физическом эксперименте всегда определяются изотермы избыточной адсорбции, которые необходимо пересчитывать в абсолютные изотермы [3], а определение абсолютных изотерм при адсорбции бинарных смесей усложняется необходимостью аналитического определения состава равновесных фаз. Если состав газовой фазы относительно легко определяется хроматографическими методами, то состав адсорбционной фазы рассчитывается, как правило, по разности исходного и равновесного составов газовой фазы. Это приводит к большим ошибкам в областях малых концентраций компонентов в адсорбционной фазе.
В численном эксперименте затраты времени существенно меньше, а перечисленные выше проблемы физического эксперимента практически отсутствуют. В численном эксперименте возможно проводить расчеты в широком интервале изменений температуры и давления для широкого набора адсорбтивов и их смесей, однако, для количественного совпадения рассчитанных и экспериментальных данных необходимо соблюдение ряда условий.
Помимо ограниченного объема адсорбционной фазы и выбора эффективной ширины микропоры, важное значение имеет выбор универсального силового поля, в котором надежно определены параметры взаимодействия адсорбат-адсорбат и адсорбат-адсорбент [1–3].
МЕТОДИКА ЧИСЛЕННОГО ЭКСПЕРИМЕНТА
В ячейку (12 × 12 × 12 нм) с подвижными стенками и периодическими граничными условиями помещалась щелевидная микропора, ограниченная квадратными пластинами графена размером 5 × 5 нм (рис. 1).
Ширина пор варьировалась от 0.8 до 1.2 нм. В этом случае адсорбция осуществлялась как внутри пор, так и на их внешней и торцевых поверхностях. Затем, в ячейку добавлялось 10 000 молекул адсорбтива и проводился расчет молекулярно-динамических траекторий с использованием универсального силового поля OPLS-AA [4]. Элементарный шаг интегрирования уравнения движения составил 1 фс. Длина траектории составила 1 нс. Координаты системы сохранялись каждую пикосекунду. Анализ траекторий проводился по последним 500 пикосекундам. Постоянная температура поддерживалась за счет коллизионного термостата [5], а давление поддерживалось с помощью баростата [6]. Обрезание кулоновских и ван-дер-ваальсовских взаимодействий происходило, если расстояние между атомами составляло больше 1.2 нм. Учет электростатических взаимодействий дальнего порядка не производился из-за незначительного вклада электростатики в общую энергию системы.
В этом случае в результате усреднения получали равновесные значения в числах молекул m(P) для адсорбции в микропоре и на внешних графеновых поверхностях и соответствующие давления. При расчетах выше критических температур для адсорбтивов распределение плотностей компонентов смеси этан-этилен в ячейке для одной поры представлено в качестве примера на рис. 2.
Рис. 2.
Распределение плотностей молекул метана ( ) и ксенона (
) и ксенона ( ) в ячейке с баростатом. Пояснения в тексте.
) в ячейке с баростатом. Пояснения в тексте.
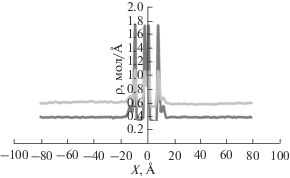
Средние два пика соответствуют адсорбции внутри поры, два крайних пика монослойной адсорбции на внешних поверхностях поры, плоские участки соответствуют задаваемому равновесному давлению.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Как было показано в работах [1–3, 7, 8], уравнения решеточной модели, первоначально полученные для описания равновесной адсорбции паров с использованием равновесно согласованных стандартных состояний компонентов в равновесных фазах (стандартная адсорбция a0 – давление насыщенного пара компонента Ps), могут быть применены для описания равновесной адсорбции газов при замене Ps на стандартные давления при температурах больших критических для адсорбтивов P*(T), находимые линейной экстраполяцией зависимостей логарифмов давлений насыщенных паров от обратной температуры в закритическую область температур.
Применительно к адсорбции бинарных смесей газов при условии полного насыщения адсорбционной фазы суммой адсорбатов уравнения для абсолютной монослойной адсорбции компонентов на графеновых поверхностях и при двухслойной адсорбции в микропорах имеют вид (1), (2):
(1)
$\begin{gathered} \ln {{{{Y}_{1}}(1--{{X}_{1}})} \mathord{\left/ {\vphantom {{{{Y}_{1}}(1--{{X}_{1}})} {{{X}_{1}}(1--{{Y}_{1}})}}} \right. \kern-0em} {{{X}_{1}}(1--{{Y}_{1}})}}-- \\ - \,\,{{B + \Delta } \mathord{\left/ {\vphantom {{B + \Delta } {kT\left( {A{{Y}_{1}}--{\text{ }}12{{X}_{1}}} \right)}}} \right. \kern-0em} {kT\left( {A{{Y}_{1}}--{\text{ }}12{{X}_{1}}} \right)}} = 0, \\ \end{gathered} $(2)
${{Y}_{1}} = {а \mathord{\left/ {\vphantom {а {N{{a}_{{1m}}}}}} \right. \kern-0em} {N{{a}_{{1m}}}}}.$(3)
${m \mathord{\left/ {\vphantom {m {{{m}_{s}}}}} \right. \kern-0em} {{{m}_{s}}}} = {а \mathord{\left/ {\vphantom {а {{{a}_{{\text{o}}}}}}} \right. \kern-0em} {{{a}_{{\text{o}}}}}}$При описании адсорбции смесей газов рассчитывались мольные доли компонентов в объемной (Yi) и адсорбционной (Xi) фазах (см., например, рис. 3) и фазовые диаграммы (зависимости Xi от Yi, см., например, рис. 4).
Рис. 3.
Зависимости мольных долей (Xi, Yi) (а) этана ( ), этилена (
), этилена ( ) и (б) метана (
) и (б) метана ( ), ксенона (
), ксенона ( ) от расстояния от центра поры при адсорбции смесей при 313 К.
) от расстояния от центра поры при адсорбции смесей при 313 К.

Рис. 4.
Фазовые диаграммы: (а) метан ( )-ксенон (
)-ксенон ( ) в микропоре и (б) этан (
) в микропоре и (б) этан ( )-этилен (
)-этилен ( ) на поверхности графена.
) на поверхности графена.
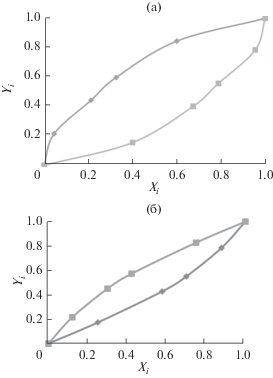
Оказалось, что фазовые диаграммы в микропорах и на графеновых поверхностях практически совпадают. На основании этих данных рассчитывались коэффициенты разделения (K) компонентов смесей:
Причем в качестве первого выбирался более сильно адсорбирующийся компонент. Результаты представлены в табл. 1.
Таблица 1.
Зависимости коэффициентов разделения от состава адсорбционной фазы для адсорбции смесей этан-этилен и метан-ксенон при 313 K в микропоре (Kм) и на графеновой поверхности (Kп)
| Смесь/X | Этан-этилен, 313 K | ||||
|---|---|---|---|---|---|
| 0.2 | 0.4 | 0.5 | 0.6 | 0.8 | |
| Kм | 1.10 | 1.23 | 1.35 | 1.23 | 1.15 |
| Kп | 1.10 | 1.25 | 1.37 | 1.24 | 1.17 |
| Метан-ксенон, 313 K | |||||
| Kм | 1.10 | 1.19 | 1.23 | 1.27 | 1.37 |
| Kп | 1.10 | 1.20 | 1.25 | 1.27 | 1.39 |
На рис. 5, 6 приведены рассчитанные изотермы компонентов смесей в микропорах и на графеновых поверхностях и результаты их описания уравнениями (1), (2).
Рис. 5.
Рассчитанные изотермы адсорбции (а, моль кг–1) метана ( ) и ксенона (
) и ксенона ( ) (сплошные кривые) и результаты их описания уравнениями (1), (2) (
) (сплошные кривые) и результаты их описания уравнениями (1), (2) ( ) при адсорбции в микропоре (а) и на двух графеновых поверхностях (б).
) при адсорбции в микропоре (а) и на двух графеновых поверхностях (б).

Рис. 6.
Рассчитанные изотермы адсорбции (а, моль кг–1) этана ( ) и этилена (
) и этилена ( ) (сплошные кривые) и результаты их описания уравнениями (1), (2) (
) (сплошные кривые) и результаты их описания уравнениями (1), (2) ( ) при адсорбции в микропоре (а) и на двух графеновых поверхностях (б).
) при адсорбции в микропоре (а) и на двух графеновых поверхностях (б).

Видно, что уравнения решеточной модели количественно описывают изотермы адсорбции в микропорах и на графеновых поверхностях, а параметры уравнений, приведенные в табл. 2, удовлетворительно согласуются. Интересно отметить, что отсутствие второй поверхности при адсорбции на графеновых поверхностях приводит к небольшому уменьшению плотности упаковки молекул и, как следствие этого, к тому, что изотермы адсорбции на графеновых поверхностях идут ниже соответствующих изотерм в микропорах. При этом параметры уравнений, характеризующие различие энергий взаимодействия адсорбатов друг с другом и с адсорбентом, практически не различаются.
Таблица 2.
Параметры уравнений решеточной модели для адсорбции при 313 K компонентов смесей: этана и этилена, метана и ксенона в микропорах и на графеновых поверхностях
| Параметры | Этан пора |
Этан пов. |
Этилен пора |
Этилен пов. |
Метан пора |
Метан пов. |
Ксенон пора |
Ксенон пов. |
|---|---|---|---|---|---|---|---|---|
| a0 | 5.60 | 5.29 | 6.12 | 5.70 | 8.38 | 7.87 | 7.76 | 7.18 |
| Δ/kT | 1.49 | 1.48 | 1.96 | 1.98 | 1.67 | 1.66 | 1.20 | 1.15 |
| B | 2.67 | 2.66 | 2.15 | 2.11 | 1.91 | 1.95 | 1.91 | 1.95 |
Список литературы
Толмачев А.М., Анучин К.М., Крюченкова Н.Г., Фомкин А.А. // Физикохимия поверхности и защита материалов. 2011. Т. 47. № 5. С. 451.
Толмачев А.М., Анучин К.М., Бибин А.В., Крюченкова Н.Г., Фомкин А.А. // Коллоидный журнал. 2012. Т. 74. № 6. С. 769.
Толмачев А.М. // Адсорбция газов, паров и растворов. Из-во Граница. 2012.
Jorgensen W.L., Maxwell D.S., Tirado-Rive J. // J. Am. Chem. Soc. 1996. V. 118 (45). P. 11225.
Grest G.S., Kremer K. // Phys. Rev. A. 1986. V. 33 (5). P. 3628.
Feller S.E., Zhang Y., Pastor R.W., Brooks B.R. // J. Chem. Phys. 1995. V. 103. № 11. P. 4613.
Фоменков П.Е., Гумеров М.Р., Толмачев А.М. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 4. С. 374.
Фоменков П.Е., Гумеров М.Р., Толмачев А.М. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 5. С. 411.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов



