Физикохимия поверхности и защита материалов, 2019, T. 55, № 2, стр. 120-126
Адсорбция метана на микропористом углеродном адсорбенте ЛЦН, полученном методом термохимического синтеза на основе лигноцеллюлозы
А. О. Шевченко 1, А. А. Прибылов 1, С. А. Жедулов 1, И. Е. Меньщиков 1, А. В. Школин 1, А. А. Фомкин 1, *
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, стр. 4, Россия
* E-mail: fomkinaa@mail.ru
Поступила в редакцию 28.08.2018
После доработки 05.09.2018
Принята к публикации 13.09.2018
Аннотация
Методом термохимического синтеза на основе лигноцеллюлозы синтезирован микропористый углеродный адсорбент ЛНЦ и исследована адсорбция метана в диапазоне температур 303–333 K и давлений до 40 МПа. Общий объем пор 0.68 см3/г. Максимальные величины адсорбции метана ~14.5 ммоль/г (23.2 мас. %) получены при температуре 303 K и давлении 40 МПа. Рассчитанная дифференциальная мольная изостерическая теплота адсорбции метана в среднем составляет ~12–13 кДж/моль. Проведены расчеты адсорбции метана на адсорбенте ЛНЦ с использованием уравнений Дубинина–Радушкевича, Дубинина–Астахова и свойства линейности изостер адсорбции. Показано, что наилучшее описание экспериментальных данных, при условии использования только стандартных структурно-энергетических характеристик адсорбента, достигается при использовании уравнения Дубинина–Радушкевича и базовых закономерностей ТОЗМ.
ВВЕДЕНИЕ
Природный газ (метан) является одним из наиболее востребованных и распространенных топливных ресурсов современной энергетической отрасли, благодаря таким свойствам как высокие энергетические показатели, относительная дешевизна и пониженная экологическая нагрузка на окружающую среду. В то же время, низкая плотность при нормальных условиях [1], приводит к необходимости разработки специальных методов его хранения и транспортировки, обеспечивающих высокую плотность в единице объема. Такими методами являются современные технологии компримированного (КПГ) [2] и сжиженного природного газа (СПГ) [3]. Несмотря на техническую простоту технологии КПГ, этот способ является в значительной мере энергозатратным, требует металлоемких сосудов высокого давления и зачастую не отвечает требованиям пожаро- и взрывобезопасности. Хранение газа в сжиженном состоянии осуществляется при криогенных температурах и атмосферном давлении, и реализуется только с применением специальных технических средств. Этот способ наиболее эффективен и широко применяется при хранении и транспортировке газа в сверхбольших объемах и не выгоден в сферах малого потребления газа [4].
Технология адсорбированного природного газа (АПГ) является альтернативным решением существующим способам хранения и транспортировки газа [5]. Суть метода заключается в использовании эффекта физической адсорбции газов в пористых материалах, что позволяет существенно повысить удельный объем газа в системе хранения. При этом в зависимости от свойства системы “адсорбент–адсорбат” давление в системе может быть снижено, по сравнению с технологией КПГ и повышена пожаро- и взрывобезопасность.
Молекулы метана, который является основным компонентом природного газа, не обладают дипольным и квадрупольным моментами, поэтому их адсорбция может осуществляться за счет дисперсионных взаимодействий “адсорбент–адсорбат” и “адсорбат–адсорбат”, приводящих при высоких заполнениях микропор к образования адсорбционных ассоциатов. По итогам многочисленных исследований, проведенных в области адсорбционного аккумулирования метана показано [5–9], что одними из наиболее активных к метану пористых материалов являются углеродные микропористые адсорбенты. Помимо выдающихся сорбционных характеристик данный класс адсорбентов обладает рядом технологических плюсов: высокая прочность, циклическая и температурная стабильность, что является важным для практического применения.
Несмотря на кажущуюся простоту решения данной задачи, которая заключается в выборе оптимального адсорбента, на сегодняшний день она не решена в полном объеме. Большинство доступных углеродных сорбентов предназначены для работы в технологических процессах, связанных с очисткой и разделением жидких и газовых сред [10–12], а условия их работы далеки от тех, при которых должен работать адсорбент в технологии АПГ: высокие давления, сверхкритические температуры, необходимость использования полного объема пор.
Физическая адсорбция зависит как от энергии взаимодействия адсорбированных молекул с поверхностью адсорбента, так и от объема микропор [13]. Технология получения углеродных микропористых адсорбентов позволяет менять удельный объем микропор в широких интервалах от 0.01 до 2–3 см3/г [14]. Большинство промышленных адсорбентов имеют удельные объемы микропор в интервале 0.2–0.6 см3/г [15]. Однако для эффективного адсорбционного аккумулирования газов, и в частности, метана, этого недостаточно [16].
Задачей данной работы является экспериментальное исследование адсорбции метана в области сверхкритических температур на микропористом углеродном адсорбенте ЛЦН, синтезированном на основе древесины, с высоким удельным объемом микропор.
ОБЪЕКТЫ ИССЛЕДОВАНИЯ
Адсорбент. В работе использовали микропористый углеродный адсорбент ЛЦН, полученный путем карбонизации лигноцеллюлозных отходов деревопереработки (опилки, древесная пыль) и высокозольной биомассы (шелуха риса, овса, соломы пшеницы) при 673–1073 K, последующей щелочной активации при 873–1273°С в присутствии карбонатов и/или гидроксидов натрия, калия и восстановления отмывкой раствором кислоты и сушки.
Структурно-энергетические характеристики адсорбента ЛЦН исследовали на установке Autosorb iQ (фирма Quantachrome) по изотерме адсорбции азота при 77 K с использованием ТОЗМ, уравнений БЭТ и Кельвина [17]. Структура адсорбента включает микро- и мезопоры. Полученные данные представлены в табл. 1.
Таблица 1.
Структурно-энергетических характеристик адсорбента ЛЦН
| Удельный объем микропор, W0, см3/г | 0.68 |
| Характеристическая энергия адсорбции по азоту, E, кДж/моль | 5.7 |
| Характеристическая энергия адсорбции по стандартному пару бензолу, E0, кДж/моль | 17.45 |
| Характеристическая энергия адсорбции по метану, E, кДж/моль | 6.2 |
| Полуширина микропор х0, нм | 0.69 |
| Удельная поверхность адсорбента, SБЭТ, м2/г | 1814 |
| Предельный адсорбционный объем, Ws, см3/г | 0.91 |
| Удельная поверхность мезопор Sme, м2/г | 6.63 |
| Удельный объем мезопор Wme, см3/г | 0.23 |
Для перехода от данных по азоту к данным по стандартному пару бензолу по ТОЗМ использовали коэффициент подобия ${{\beta }_{{{{{\text{N}}}_{2}}}}}$ = Е/Е0 = 0.33 [13]; эффективную полуширину (радиус) микропор рассчитывали по х0 = 12/Е0.
Коэффициент подобия для метана рассчитали по инкрементам Сагдена:
${{\beta }_{{{\text{С }}{{{\text{Н }}}_{4}}}}}$ = Е/Е0 = 0.35. Удельную поверхность SБЭТ определяли по начальной части изотермы адсорбции азота при относительных давлениях до p/ps = 0.1.
Адсорбат. Использовали метан (CH4) высокой чистоты 99.999%. По данным [1] обладает следующими физико-химическими характеристиками: молекулярная масса: µ = 16.0426 г/моль; нормальная температура кипения T0 = 111.66 K; критическая температура Tс = 190.77 K; критическое давление pс = 4.626 МПа.
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
В основе измерения адсорбции в интервалах давлений от 0.2 до 40 МПа и температур от 303 до 333 K лежит измерение массы заполняемой метаном ампулы с адсорбентом в объемно-весовой установке [18]. Погрешности измерений по давлению и температуре составили ±0.015 МПа и ±0.3 K соответственно, по адсорбции ±4 × 10–4 г. Адсорбцию метана определяли, как полное содержание вещества в микропорах; объем адсорбента – как сумму объемов скелета адсорбента, определенного калибровкой по гелию и объема микропор.
На рис. 1 представлены зависимости адсорбции метана на углеродном микропористом адсорбенте ЛЦН от давления для температур 303, 313, 323 и 333 K.
Рис. 1.
Зависимость адсорбции метана на микропористом углеродном адсорбенте ЛЦН от давления при температурах , К: 1 – 303; 2 – 313; 3 – 323; 4 – 333.
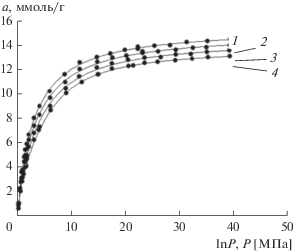
Из экспериментальных данных рис. 1 следует, что адсорбция метана быстро растет при давлениях до ~10 МПа, а затем, при больших давлениях, проявляется тенденция к насыщению. При 40 МПа адсорбция составляет ~14.5 ммоль/г. Адсорбция метана на адсорбенте ЛЦН обратима. С ростом температуры адсорбция падает. По экспериментальным изотермам адсорбции построили изостеры адсорбции метана (рис. 2).
Рис. 2.
Изостеры адсорбции метана в микропористом углеродном адсорбенте ЛЦН при различных величинах адсорбции, a, ммоль/г: 1 – а = 1; 2 – а = 2; 3 – а = = 3; 4 – а = 4; 5 – а = 5; 6 – а = 6; 7 – а = 7; 8 – а = 8; 9 – а = 9; 10 – а = 10; 11 – а =11; 12 – а = 12; 13 – а = 13.

Из рис. 2 следует, что изостеры адсорбции метана в микропористом адсорбенте ЛЦН во всем диапазоне исследованных температур и давлений хорошо аппроксимируются линейными функциями. Полученные изостеры использовали для расчета дифференциальной мольной изостерической теплоты адсорбции метана на адсорбенте ЛЦН, которую определяли как разность мольной энтальпии газовой фазы hg и дифференциальной мольной энтальпии адсорбционной системы ha
ДИФФЕРЕНЦИАЛЬНАЯ МОЛЬНАЯ ИЗОСТЕРИЧЕСКАЯ ТЕПЛОТА АДСОРБЦИИ
Для расчета теплоты адсорбции использовали общее уравнение [19, 20], учитывающее неидеальность газовой фазы при высоких давлениях Z и неинертность адсорбента при адсорбции, т.е. зависимость V = V(a,T)
(2)
$\begin{gathered} {{q}_{{st}}} = - RZ{{\left( {\frac{{\partial (\ln P)}}{{\partial \left( {\frac{1}{T}} \right)}}} \right)}_{a}}\left\{ {1 - {{{{{\left( {\frac{{\partial V\left( a \right)}}{{\partial a}}} \right)}}_{T}}} \mathord{\left/ {\vphantom {{{{{\left( {\frac{{\partial V\left( a \right)}}{{\partial a}}} \right)}}_{T}}} {{{V}_{g}}}}} \right. \kern-0em} {{{V}_{g}}}}} \right\} - \\ - \,\,{{\left( {\frac{{\partial P}}{{\partial a}}} \right)}_{T}}\left[ {V\left( {a,Т } \right) - T{{{\left( {\frac{{\partial V\left( a \right)}}{{\partial T}}} \right)}}_{a}}} \right]. \\ \end{gathered} $В [21] было показано, что относительная адсорбционная деформация адсорбентов при адсорбции метана в области сверхкритических температур не превосходит 1%, а вклад интенсивностей адсорбционной и температурной деформации углеродных адсорбенетов пренебрежимо мал. Поэтому расчет теплоты адсорбции метана на адсорбенте ЛЦН проводили по уравнению
(3)
${{q}_{{st}}} = - RZ{{\left( {\frac{{\partial (\ln P)}}{{\partial \left( {\frac{1}{T}} \right)}}} \right)}_{a}} - {{\left( {\frac{{\partial P}}{{\partial a}}} \right)}_{а }}V,$На рис. 3 представлены результаты расчета зависимости дифференциальной мольной изостерической теплоты адсорбции метана от величины адсорбции метана на адсорбенте ЛЦН.
Рис. 3.
Зависимости дифференциальной мольной изостерической теплоты адсорбции от величины адсорбции метана на адсорбенте ЛЦН при температурах, K: 1 – 303; 2 – 313; 3 – 323; 4 – 333.

Ход зависимостей изостерической теплоты адсорбции на рис. 3, как следует из (3), определяется наклоном изостер адсорбции, неидеальностью газовой фазы (Z) и кривизной изотерм адсорбции (dp/da)T. Резкое падение теплоты адсорбции от 17.8 до 14 кДж/ммоль в начальной области заполнений объема микропор (до ~2 ммоль/г) свидетельствует о наличии существенной гетерогенности поверхности адсорбента. Дальнейший рост адсорбции метана приводит к постепенныму заполнению объема микропор, возникновению адсорбционных ассоциатов в микропорах [22] и замедлению падения теплоты адсорбции. Из сравнения достигнутых величин адсорбции метана ~12 ммоль/г и предельной адсорбции при температуре кипения 19.5 ммоль/г (111.66 K) можно сделать вывод, что значительная часть объема микропор при давлении газовой фазы 40 МПа, остается еще не заполненной. Однако уже при величинах адсорбции метана ~10–12 ммоль/г, при 303 K отмечается уполаживание кривой теплоты адсорбции и имеется тенденция к росту. Данный факт обусловлен увеличением энергии притяжением молекул в адсорбате при высоких заполнениях и образованием адсорбционных ассоциатов метана в микропорах. С ростом температуры эти процессы размываются и падение теплоты адсорбции на кривых 2, 3, 4 при адсорбции между ~8 и ~12 ммоль/г вероятно является следствием уменьшения коэффициента сжимаемости Z по (3) с ростом давления [23].
РАСЧЕТ АДСОРБЦИОННЫХ РАВНОВЕСИЙ В ОБЛАСТИ СВЕРХКРИТИЧЕСКИХ ТЕМПЕРАТУР
Теория объемного заполнения микропор Дубинина (ТОЗМ) позволяет во многих случаях рассчитывать адсорбционные равновесия газов в микропористых адсорбентах в докритической и сверхкритической областях температур. Наиболее общее выражение термического уравнения адсорбции ТОЗМ имеет вид уравнения Дубинина–Астахова (Д–А) [13]:
где а0 – предельная величина адсорбции метана, ммоль/г; Е – характеристическая энергия адсорбции по метану, кДж/моль; А = RTln(ps/p) – дифференциальная мольная работа адсорбции, кДж/моль; ps – давление насыщенного пара, Па; p – равновесное давление, Па; R – универсальная газовая постоянная, кДж/моль K. Параметр n в уравнении (4) для активных углей приближенно равен 2 (уравнение Дубинина–Радушкевича), для цеолитов n = 3 [13]. В литературе описано много результатов применения уравнения Д–А [24–27], в том числе с применением нецелочисленного значения n [28–30]. При высоких давлениях дифференциальную мольную работу адсорбции определяют по уравнению:В (4) f и fs – летучести соответственно равновесной фазы и насыщенного пара адсорбтива, Па. При малых давлениях летучесть f равна давлению пара Р.
Для нахождения fs в области сверхкритических температур в [13] предлагается использовать условие линейной экстраполяции зависимости lnps от 1/T.
Величину предельной адсорбции a0 рассчитывают по уравнению Дубинина–Николаева [13]:
где $a_{0}^{0},$ ммоль/г – предельная адсорбция при температуре кипения T0, K; α, 1/K – термический коэффициент предельной адсорбции. Для метана α = 1.52 × 10–3 K–1 [31].В области сверхкритических температур предельную величину адсорбции рассчитывают по (5) при условии (dlnao/dT)ps = const [13].
Исходя из вышеописанных условий, для наилучшего описания экспериментальных изотерм адсорбции метана на адсорбенте ЛЦН, были подобраны оптимальные значения констант n и Е. Численные значения констант представлены в табл. 2.
Таблица 2.
Значения n и E уравнения Д–А для описания экспериментальных изотерм адсорбции метана на углеродном адсорбенте
| Т, K | 303 | 313 | 323 | 333 |
| n | 1.68 | 1.70 | 1.72 | 1.73 |
| E, кДж/моль | 6.2 | 7.2 | 7.5 | 8.2 |
Из табл. 2 следует, что значения n, при которых описание экспериментальных изотерм с помощью уравнения (4) является наилучшим, варьируется в диапазоне от 1.68 до 1.73, а E от 6.2 до 8.2 кДж/моль. Характеристическая энергия адсорбции Е и степень n, как следует из рис. 4, 5 растут с ростом температуры. Аналогичные зависимости обнаружены и при описании адсорбции метана на других микропористых углеродных адсорбентах [31].
Рис. 4.
Зависимость характеристической энергии адсорбции метана на микропористом углеродном адсорбенте ЛЦН от температуры.

С помощью значений E и n из табл. 2 и уравнения (5) рассчитаны зависимости адсорбции метана на адсорбенте ЛЦН от температуры при 303, 313, 323, 333 K. Результаты расчета представлены на рис. 6.
Рис. 6.
Зависимость адсорбции метана на микропористом углеродном адсорбенте ЛЦН от давления при температурах Т, К: 1 – 303, 2 – 313, 3 – 323, 4 – 333. Сплошные линии – расчет с вариантными величинами n и E по (4). Значки – экспериментальные данные.

Из рис. 6 следует, что при варьировании n и E уравнение Дубинина–Астахова описывает адсорбционные равновесия метана на адсорбенте ЛЦН с удовлетворительной точностью. Наибольшая погрешность характерна в области средних заполнений микропор (6–12 ммоль/г) и доходит до 5% при lnP = 8.7.
Другой путь описания экспериментальных данных опирается на расчет адсорбции в области сверхкритических температур с помощью линейной экстраполяции изостер, построенных при двух температурах: кипения Т0 и критической Тс. Для этого задавались значения адсорбции в диапазоне от 1 до 13 ммоль/г, производили рассечения линиями ai = const изотерм и находили для каждого пересечения с изотермами значения lnP, после чего строили изостеры адсорбции в координатах lnP–1/T. Затем путем линейной экстраполяции изостер в сверхкритическую область, получали изотермы адсорбции метана при заданных температурах. Такой прием использовался ранее в [31–34] для оценки адсорбции газов в области сверхкритических температур. Результаты расчета адсорбции метана на адсорбенте ЛЦН с использованием свойства линейности изостер представлены на рис. 7.
Рис. 7.
Зависимость адсорбции метана на микропористом углеродном адсорбенте ЛЦН от давления при температурах Т, К: 1 – 303, 2 – 313, 3 – 323, 4 – 333. Сплошные линии – расчет по линейности изостер, значки – экспериментальные данные

Из сравнения рассчитанных кривых и экспериментальных данных на рис. 7 следует, что использование свойства линейности изостер, дает лишь оценочные представления о характере адсорбционных равновесий в указанной системе с максимальной погрешностью ~20% в области lnP = 9.5–11.
В третьем варианте расчета изотерм адсорбции метана на адсорбенте ЛЦН использовали Д–Р (n = 2) и экстраполяцию зависимостей lnPs–1/Т, lna0–Т в закритическую область. Результаты расчетов представлены на рис. 8.
Рис. 8.
Зависимость адсорбции метана на микропористом углеродном адсорбенте ЛЦН от давления при температурах Т, К: 1 – 303, 2 – 313, 3 – 323, 4 – 333. Сплошные линии – расчет с использованием уравнения Д–Р (n = 2), значки – экспериментальные данные.

Из рис. 8 следует, что расчет адсорбционных равновесий адсорбции метана на углеродном микропористом адсорбенте ЛЦН по уравнению Д–Р можно считать удовлетворительным, так как отклонение расчетных величин от экспериментальных данных составляет менее ~10% в области lnP = 8.5.
Из данных, представленных на рис. 6, 7, 8 можно сделать вывод, что эти представленные методы предрасчета адсорбционных равновесий метана на микропористом углеродном адсорбенте ЛЦН могут быть использованы для оценочных расчетов адсорбции в области сверхкритических температур. Наилучшее описание экспериментальных данных при условии использования только стандартных структурно-энергетических характеристик адсорбента (табл. 1), достигается при использовании уравнения Дубинина–Радушкевича и базовых закономерностей ТОЗМ.
Такой подход позволяет сделать оценки адсорбции метана при высоких давлениях без проведения трудоемких экспериментальных исследований и использования специального оборудования.
ВЫВОДЫ
Синтезирован микропористый углеродный адсорбент на основе лигноцеллюлозы, имеющий высокую адсорбционную активность (23.2 мас. %) по метану при 303 K и 40 МПа. Рассчитаны его структурно-энергетические характеристики и дифференциальные мольные теплоты адсорбции метана. Построена зависимость дифференциальных мольных теплот адсорбции метана на углеродном микропористом адсорбенте ЛЦН от величины адсорбции, из которой следует, что для увеличения адсорбции необходимо использовать структуры, позволяющие дополнительно увеличить энергию адсорбции за счет энергии ассоциирования адсорбата в микропорах. Приведены оценочные расчеты адсорбции метана в области сверхкритических температур с использованием структурно-энергетических характеристик адсорбента, определенных уравнениям ТОЗМ Дубинина–Астахова, Дубинина–Радушкевича и свойству линейности изостер в области сверхкритических температур. Показано, что наилучшее описание экспериментальных данных при условии использования только стандартных структурно-энергетических характеристик адсорбента, достигается при использовании уравнения Дубинина–Радушкевича и базовых закономерностей ТОЗМ.
Список литературы
Сычев В.В., Вассерман А.А., Загорученко В.А., Козлов А.Д., Спиридонов Г.А., Цымарный В.А. Термодинамические свойства метана. М.: Издательство стандартов, 1979.
Васильев Ю.Н., Гриценко А.И., Чириков К.Ю. Газозаправка транспорта. М.: “Недра”, 1995. 435 с.
Cleaver Ph., Johnson M., Ho B. // J. of Hazardous Materials. 2007. V. 140. P. 429.
Майорец М., Симонов К. Сжиженный газ – будущее мировой энергетики. М.: Альпина Паблишер, 2013. 360 с.
Цивадзе А.Ю., Аксютин О.Е., Ишков А.Г., Меньщиков И.Е., Фомкин А.А., Школин А.В., Хозина Е.В., Грачев В.А. Адсорбционные системы аккумулирования метана на основе углеродных пористых структур // Успехи химии. 2018. Т. 87. № 10. С. 950–983.
Shkolin A.V., Fomkin A.A., Tsivadze A.Yu., Anuchin K.M., Men’shchikov I.E., Pulin A.L. // Prot. Met. Phys. Chem. Surf. 2016. V. 52. P. 955 [Физикохимия поверхности и защита материалов. 2016. Т. 52. С. 563].
Goetz V., Pupier O., Guillot A. // Adsorption. 2006. № 12. P. 55.
Стриженов Е.М., Фомкин А.А., Жердев А.А., Прибылов А.А. // Физикохимия поверхности и защита материалов. 2012. Т. 48. № 6. С. 521.
Rios R.B., Silva F.W.M., Torres A.E.B., Azevedo D.C.S. et al. // Adsorption. 2009. V. 15. I. 3. P. 271.
Кельцев Н.В. Основы адсорбционной техники. М.: Химия. 1976.
Защита атмосферы от промышленных загрязнений. Справочник. Под ред. Калверта А.С., Инглунда Г.М. М.: Металлургия. 1988.
Шумяцкий Ю.И. Промышленные адсорбционные процессы. М.: Колосс. 2009.
Дубинин М.М. Адсорбция и пористость. М.: Изд-во ВАХЗ. 1972.
Фенелонов В.Б. Пористый углерод. Новосибирск. Изд-во ИК РАН. 1995.
Мухин В.М., Тарасов А.В., Клушин В.Н. Активные угли России. М.: Металлургия, 2000.
Меньщиков И.Е., Фомкин А.А., Школин А.В., и др. Оптимизация структурно-энергетических характеристик адсорбентов для хранения метана // Изв. АН Сер. хим. 2018. Т. 67, № 10. С. 1814–1822
Грег С., Синг К. Адсорбция, удельная поверхность, пористость. М.: Мир, 1984.
Прибылов А.А., Калашников С.М., Серпинский В.В. // Изв. АН СССР Сер. хим. 1990. № 6. С. 1233.
Бакаев В.А. Изв. АН СССР, Сер. хим. 1971. № 2. С. 2648.
Fomkin A.A. // Adsorption. 2005. V. 11. P. 425.
Школин А.В., Фомкин А.А.// Коллоидный журнал. 2009. Т. 71. № 1. С. 116.
Толмачев А.М., Анучин К.М., Крюченкова Н.Г., Фомкин А.А.// Физикохимия поверхности и защита материалов. 2011. Т. 47. № 2. С. 124.
Рид Р., Праусниц Д., Шервуд Т. Свойства газов и жидкостей. Л.: Химия. 1982.
Толмачев А.М., Кузнецова Т.А., Годовиков И.А. // Физикохимия поверхности и защита материалов. 2011. Т. 47. № 3. С. 227.
Feng-Chin Wua, Pin-HsuehWub, Ru-Ling Tseng, Ruey-Shin Juang // Journal of the Taiwan Institute of Chemical Engineers. 2014. V. 45. P.1757.
Дубинин М.М., Кадлец О. // Изв. АН СССР. Сер. хим. 1984. С. 496.
Цивадзе А.Ю., Фомкин А.А. В сб. Физическая химия адсорбционных явлений. М.: Изд-во “Граница”, 2011. С. 6.
Толмачев А.М., Кузнецова Т.А., Годовиков И.А. // Физикохимия поверхности и защита материалов. 2011. Т. 47. № 3. С. 227–231.
Кузнецова Т.А., Годовиков И.А., Толмачев А.М. // Физикохимия поверхности и защита материалов. 2012. Т. 48. № 3. С. 360.
Кузнецова Т.А., Толмачев А.М., Крюченкова Н.Г., Фирсов Д.А., Фомкин А.А. // Физикохимия поверхности и защита материалов. 2013. Т. 49. № 4. С. 339.
Меньщиков И.Е., Фомкин А.А., Арабей А.Б., Школин А.В., Стриженов Е.М. // Физикохимия поверхности и защита материалов. 2016. Т. 52. № 4. С. 339.
Чхаидзе Э.В., Фомкин А.А., Серпинский В.В., Цицишвили Г.В., Дубинин М.М. // Изв. АН СССР. Сер. хим. 1988. № 11. С. 2640.
Yakovlev V.Yu., Fomkin A.A. // Colloid J. 2009. V. 71. № 6. P. 877.
Меньщиков И.Е., Фомкин А.А., Цивадзе А.Ю., Школин А.В., Стриженов Е.М., Пулин А.Л. // Физикохимия поверхности и защита материалов. 2015. Т. 51. № 4. С. 345.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов



