Физикохимия поверхности и защита материалов, 2019, T. 55, № 3, стр. 227-233
Адсорбция водорода в микропористых углеродных адсорбентах различного генезиса
А. А. Фомкин 1, *, А. А. Прибылов 1, К. О. Мурдмаа 1, А. Л. Пулин 1, А. В. Школин 1, И. Е. Меньщиков 1, С. А. Жедулов 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, Россия
* E-mail: fomkinaa@mail.ru
Поступила в редакцию 16.10.2018
После доработки 17.12.2018
Принята к публикации 27.12.2018
Аннотация
Изучена адсорбция водорода на четырех образцах активных углей различного происхождения с удельными объемами микропор от 0.46 до 0.96 см3/г при температурах 303, 313, 323 и 333 K и давлениях до 20 МПа. На основе Теории объемного заполнения микропор (ТОЗМ) Дубинина рассчитана предельная адсорбция паров водорода на этих активных углях при температуре кипения 20.38 K и давлении 0.101 МПа и показано, что наибольшей адсорбционной способностью обладает адсорбент ФАС-2008, полученный жидкофазной полимеризацией фурфурола. На основе ТОЗМ с учетом линейности изостер адсорбции, рассчитана адсорбция водорода на углеродном щелевидном микропористом адсорбенте АУ3:5 при температуре 303 K и давлениях 10 и 20 МПа. Полученные экспериментальные и расчетные данные сопоставлены с данными при 101 кПа, 20.38 K. Наибольшая адсорбция водорода 7.9 мас. % при 20 МПа, 303 K получена на углеродном модельном щелевидном микропористом адсорбенте УА3:5 на основе графенов.
ВВЕДЕНИЕ
Водород как универсальный энергетический газ в системах преобразования энергии обладает высокой энергоэффективностью, экологической чистотой и неограниченной ресурсной базой. Технология производства водорода хорошо разработана [1]. При всех его достоинствах, водород в газообразном состоянии обладает низкой температурой сжижения (Тb = 20.38 K), низкой плотностью при атмосферном давлении и, следовательно, низкой объемной энергией. Массовое использование водорода в качестве экологически чистого источника энергии зависит от решения проблем эффективного его хранения и транспортировки, а его высокая взрывоопасность требует разработки эффективных и безопасных систем хранения.
Методы его хранения условно можно разделить на две группы [1, 2]. Первая группа включает в себя методы перевода водорода в состояние с высокой плотностью на основе энегозатратных физических процессов сжатия и сжижения. Водород в таких состояниях слабо взаимодействует со средой хранения и состоит из молекулярного водорода. Системы хранения водорода при высоких давлениях имеют высокую массу и требуют использования специальных сталей.
Хранение сжиженного водорода при 20.38 K, хотя и обеспечивает высокую плотность водорода 700 м3(НТД)/м311 [1], но требует использования специального высокотехнологичного оборудования. Система хранения всегда должна быть открыта для самопроизвольного истечения испаряющегося водорода, что создает дополнительные проблемы обеспечения пожаро- и взрывобезопасности, а также приводит к потерям газа при хранении. При этом создание систем регазификации водорода, представляется энергетически нецелесообразным.
Вторая группа методов включает методы хранения водорода на основе физико-химических (или химических) процессов. К ним относятся: абсорбция в объеме материала; химическое взаимодействие, в результате которого образуются, например, аланаты [2], органические гидриды и аммиак, а также соединения губчатого железа и некоторых сплавов на основе кремния и алюминия [1]. Недостатком этих методов является высокие энергии, которые необходимо подвести к системе при извлечении водорода и высокий удельный вес сорбирующих материалов.
При использовании водорода в качестве моторного топлива, кроме требований высокой безопасности, по оценкам [3], аккумулятор водорода должен обладать гравиметрической плотностью по водороду не менее 6.5 мас. % и объемной плотностью не менее 62 кг(Н2)/м3 или 695 м3(НТД)/м3.
Новое направление использования аккумуляторов водорода в беспилотных летательных аппаратах с электрохимическими топливными элементами, также требует высоких показателей аккумулирования водорода [4, 5].
Физическая адсорбция в микропористых адсорбентах может быть перспективной для создания высокоемких, экономичных и взывобезопасных аккумуляторов водорода. При адсорбции водорода в таких микропористых материалах адсорбат находится в адсорбционном поле, создаваемом перекрывающимися полями противоположных стенок микропор. Их диаметр (ширина) соизмерим с размерами сорбируемых молекул. В таких порах, вследствие суперпозиции потенциальных полей, адсорбция происходит по механизму объемного заполнения микропор [6]. Энергия адсорбции определяется не только взаимодействием молекул водорода с поверхностью, но и взаимодействием адсорбированных молекул водорода между собой с образованием адсорбционных ассоциатов, аналогично адсорбированному метану [7–10].
Взрывоопасность систем “микропористый адсорбент–водород” практически исключается из-за высокой степени диспергирования газа микропористой структурой адсорбента, когда в каждой микропоре адсорбента в среднем находится от нескольких молекул до нескольких десятков молекул водорода и их диффузия затруднена [11]. Физическая адсорбция обратима и не требует значительных энегозатрат при десорбции. Этому направлению в проблеме аккумулирования водорода последнее десятилетие уделяется большое внимание. Адсорбцию водорода исследовали на разных микропористых адсорбентах и наноматериалах – на активных углях [12–17], цеолитах [18], MOF-структурах [19], углеродных наноматериалах – углеродных нанотрубках [20, 21], углеродных нановолокнах [22], фуллеренах [23], графенах [24, 25].
Наилучшие результаты по адсорбции водорода ~6 мас. % при 77 K и давлениях до 10 МПа получены в работах [26–28] были получены при адсорбции водорода в микропористых углеродных адсорбентах.
Из приведенного выше анализа следует, что достижение адсорбционной активности ~6 мас. % и выше возможно, но на существующих микропористых адсорбентах это осуществимо при давлениях более 10 МПа и температурах ниже 77 К. При более высоких температурах адсорбция водорода существенно зависит от характеристик пористой структуры, которая должна быть оптимальной для водорода [25], а поверхность адсорбента должна обеспечивать высокую энергетическую гетерогенность. В связи с этим, исследование зависимости адсорбции водорода на адсорбентах с различными структурно-энергетических характеристиками важно и актуально.
Целью данной работы является исследование адсорбции водорода при высоких давлениях на углеродных адсорбентах разного происхождения, различающихся пористой структурой и химическим состоянием поверхности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объекты исследования
Микропористые активные угли. В работе использовали микропористые углеродные адсорбенты ФАС-3, ФАС-2008, ПАУ-700, АУК, полученные из углеродсодержащих материалов разного происхождения.
Активные угли типа ФАС получают путем жидкофазной полимеризации фурфурола в виде зерен округлой сферической формы диаметром 0.2–3 мм, карбонизацией в среде инертного газа при температуре ~1073–1123 К и парогазовой активацией гранул перегретым водяным паром и СО2 при температуре 1173 К [29].
Углеродный адсорбент ПАУ-700 получен путем термического разложения поливинилиденхлорида в среде инертного газа и последующей парогазовой активации перегретым водяным паром при температуре ~1100 K.
Микропористый углеродный адсорбент АУК синтезирован из карбида кремния (SiC) при температуре ~1173 K путем выщелачивания кремния в потоке хлора с образованием летучего SiCl4 [30].
Структурно-энергетические характеристики (СЭХ) адсорбентов: удельный объем микропор W0, стандартную характеристическую энергию адсорбции Е0, эффективную ширину микропор X0, определяли по адсорбции стандартного пара бензола при 298 K с помощью уравнения Дубинина–Радушкевича [6]. Измерение адсорбции-десорбции бензола производили на адсорбционном стенде конструкции ИФХЭ РАН гравиметрическим методом [31]. Регенерацию адсорбентов осуществляли при температуре 573 K и давлениях меньше 0.01 Па. Погрешность измерения адсорбции составляла ~±1%. В опытах использовали бензол марки ХЧ “хроматографически чистый” с содержанием основного компонента не менее 99.99%. Результаты представлены в табл. 1.
Водород
В работе использовали газообразный водород марки ОСЧ (особой чистоты).
По [1] водород имеет следующие физико-химические характеристики: температура тройной точки ТТ = 13.95 K, температура нормального кипения Тb = 20.38 K, температура критическая Тс = = 33.23 K, давление критическое Рс = 13.16 бар; плотность жидкого водорода при температуре кипения ρ = 0.0708 г/см3.
Представленные в табл. 1 адсорбенты существенно, практически в 2 раза, различаются как по удельному объему микропор W0 = (0.46–0.96) см3/г, так и по стандартной характеристической энергии адсорбции Е0 = (14–29.3) кДж/моль. Более чем в 2 раза также различаются их эффективные ширины микропор X0 = (0.80–1.72) нм. Данные адсорбенты выбраны с целью изучения влияния СЭХ на адсорбцию водорода.
Методика измерения адсорбции
Адсорбцию водорода при давлениях вплоть до 20 МПа и температурах 303, 313, 323, 333 K измеряли объемно-весовым методом [32].
Плотность углеродных адсорбентов ~2.0 г/см3 определяли по гелию. Адсорбцию рассчитывали как абсолютное содержание адсорбата в микропорах. Погрешность измерения адсорбции составляла ~±0.1%.
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
На рис. 1–4 представлены изотермы адсорбции водорода на выбранных адсорбентах.
Рис. 1.
Изотермы адсорбции водорода на адсорбенте ПАУ-700 при температурах, К: 1 – 303, 2 – 313, 3 – 323, 4 – 333.
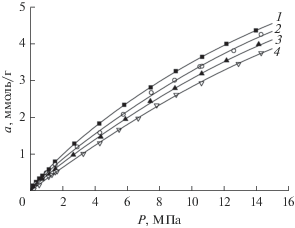
Рис. 2.
Изотермы адсорбции водорода на адсорбенте АУК при температурах, К: 1 – 303, 2 – 336, 3 – 363.

Рис. 3.
Изотермы адсорбции водорода на адсорбенте ФАС-3 при температурах, К: 1 – 303, 2 – 336, 3 – 363.

Рис. 4.
Изотермы адсорбции водорода на адсорбенте ФАС-2008 при температурах, К: 1 – 303, 2 – 313, 3 – 323, 4 – 333.

Из экспериментальных данных, представленных на рис. 1–4 следует, что адсорбция водорода плавно растет с ростом давления водорода, не проявляя тенденции к насыщению даже при 20 МПа (АУК, ФАС-3). Она обратима на всех адсорбентах и падает с ростом температуры.
Характерно, что адсорбция водорода на микропористых углеродных адсорбентах растет с ростом удельного объема микропор. Для сравнения, на рис. 5 представлены изотермы адсорбции водорода на всех адсорбентах при температуре 303 K.
Рис. 5.
Изотермы адсорбции водорода при температуре 303 K на адсорбентах: 1 – ФАС-2008, 2 – ФАС-3, 3 – АУК, 4 – ПАУ-700.

Как следует из рис. 5, наибольшая адсорбция водорода 5.6 ммоль/г при 10 МПа достигается на адсорбенте ФАС-2008, наименьшая – 3.3 ммоль/г на адсорбенте ПАУ-700. Для сравнения, величины адсорбции водорода, рассчитанные по ТОЗМ, при 20.38 K, 101 кПа и измеренные при 10 МПа и 303 К, представлены в табл. 2. Как следует из табл. 2, адсорбция водорода при (10 МПа, 303 К) составляет только 20% от предельной при нормальной температуре кипения (101 кПа, 20.38 К). Из сравнения данных табл. 2 следует, что адсорбция водорода растет с ростом удельного объема микропор W0 и их ширины X0.
Таблица 2.
Экспериментальные величины адсорбции водорода на микропористых углеродных адсорбентах при 10 МПа, 303 К и рассчитанные по ТОЗМ при 20.38 К, 101 кПа
| Адсорбенты | ПАУ-700 | АУК | ФАС-3 | ФАС-2008 | Структура АУ3 : 5 [25] |
|---|---|---|---|---|---|
| Удельный объем микропор, W0, см3/г | 0.46 | 0.51 | 0.71 | 0.96 | 1.62 |
| Эффективная ширина микропор, X0, нм | 0.80 | 0.82 | 1.34 | 1.70 | 1.22 |
| Адсорбция водорода ((101 кПа, 20.38 К), расчет [6]), мас. % | 3.2 | 3.6 | 5.0 | 6.3 | 11.3 |
| Адсорбция водорода ((10 МПа, 303 К), эксперимент), мас. % | 0.7 | 0.8 | 1.0 | 1.4 | 5.3 (10 МПа, 300 К; расчет) |
| Адсорбция водорода ((20 МПа, 303 К), эксперимент), мас. % | 1.0 | 1.3 | 1.6 | 1.9 | 7.9 (20 МПа, 303 К; расчет) |
Из табл. 2 следует, что экспериментальные величины адсорбции при 10 МПа, 303 К на адсорбентах ПАУ-700, АУК, ФАС-3, ФАС-2008 увеличиваются с ростом удельного объема микропор, но не превышают 1.1 мас. %, что значительно меньше требований (6.5 мас. %) [3]. Увеличением давления до 20 МПа при 303 K (рис. 5) удается увеличить адсорбцию водорода в наиболее активном адсорбенте ФАС-2008 до 1.6 мас. %, что явно не достаточно.
Увеличение адсорбции водорода возможно при понижении температуры. В частности, в соответствии с ТОЗМ, при температуре Ткип = 20.38 К и давлении 101 кПа адсорбция водорода на адсорбенте ФАС-2008 достигает 6.3 мас. %. Однако в реальных условиях процесс создания таких температур сопряжен с высокими энергозатратами и мало эффективен.
Увеличение адсорбции водорода, как показывают расчеты адсорбции водорода на модельных углеродных микропористых щелевидных структурах, возможно при использовании адсорбентов с другими структурно-энергетическими характеристиками [25]. В частности, как показывают расчеты [25], если использовать супрамолекулярную структуру АУ 1 : 3, в которой щелевидная пора формируется при параллельном расположении двух графенов на расстоянии 0.538 нм [33], соответствующем расстоянию гексагональных слоев углерода в графите при удалении одного слоя. При этом предельная адсорбция водорода при (20.38 K, 101 кПа) достигает 11.3 мас. %, при (10 МПа, 303 К) – 5.3 мас. % и соответственно при (20 МПа, 303 К) достигает 7.9 мас. %. Такая структура может быть перспективной для адсорбционного аккумулирования водорода.
Изостеры адсорбции
По изотермам адсорбции в координатах ln P–103/T построили изостеры адсорбции водорода (a = const). В хорошем приближении они описываются линейными функциями. На рис. 6, в качестве примера, представлены изостеры адсорбции водорода на микропористом углеродном адсорбенте ПАУ-700.
Рис. 6.
Изостеры адсорбции водорода на адсорбенте ПАУ-700 при адсорбции, а, ммоль/г: 1 – 0.5, 2 – 1.0, 3 – 1.5, 4 – 2.0, 5 – 2.5, 6 – 3.0, 7 – 3.5, 8 – 4.0, 9 – 4.5.
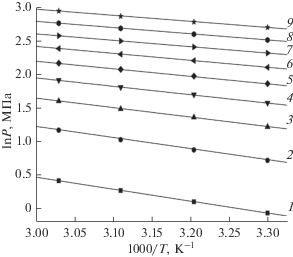
Следует отметить, что свойство линейности изостер адсорбции характерно для многих адсорбционных систем [34, 35].
Дифференциальная мольная теплота адсорбции
Полученные изостеры использовали для расчета дифференциальной мольной теплоты адсорбции водорода, которую определяли как разность мольной энергии газовой фазы εg и дифференциальной мольной энергии адсорбционной системы ${{\varepsilon }_{a}} = {{\left( {\frac{{\partial {{E}_{1}}}}{{\partial a}}} \right)}_{T}}$ [36]
где Е1 – энергия системы “адсорбент-адсорбат”.Теплоту адсорбции рассчитывали по общему уравнению, учитывающему неидеальность газовой фазы при высоких давлениях z и неинертность адсорбента при адсорбции, т.е. зависимость V1= V1(a, T)
(2)
$\begin{gathered} {{q}_{d}} = - zR{{\left( {\frac{{\partial \ln P}}{{\partial (1{\text{/}}T)}}} \right)}_{a}}\left( {1 - \frac{{{{\text{v}}_{a}}}}{{{{\text{v}}_{g}}}}} \right) - zRT + \\ + \,\,T{{\left( {\frac{{\partial P}}{{\partial a}}} \right)}_{T}}{{\left( {\frac{{\partial {{V}_{1}}}}{{\partial T}}} \right)}_{a}} - P{{\left( {\frac{{\partial {{V}_{1}}}}{{\partial a}}} \right)}_{T}}, \\ \end{gathered} $Оценки показываю, что при адсорбции газов в области температур, значительно превышающих критическую, в частности при адсорбции водорода в исследуемой области температур, относительная адсорбционная деформация адсорбентов не превосходит 1% [37–39]. При этом вклад интенсивностей адсорбционной и температурной деформации углеродных адсорбентов пренебрежимо мал. Поэтому расчет теплоты адсорбции водорода на микропористых углеродных адсорбентах проводили по уравнению
(3)
${{q}_{d}} = - zR{{\left( {\frac{{\partial \ln P}}{{\partial (1{\text{/}}T)}}} \right)}_{a}}\left( {1 - \frac{{{{\text{v}}_{a}}}}{{{{\text{v}}_{g}}}}} \right) - zRT.$На рис. 7 представлены результаты расчета по (3) зависимости дифференциальной мольной теплоты адсорбции водорода от величины адсорбции на изученных микропористых углеродных адсорбентах.
Рис. 7.
Зависимость дифференциальной мольной теплоты адсорбции от величины адсорбции водорода при 303 K на адсорбентах: 1 – ФАС-2008, 2 – ФАС-3, 3 – АУК, 4 – ПАУ-700.

Как следует из рис. 7, зависимости дифференциальной теплоты адсорбции водорода от величины адсорбции на исследованных адсорбентах проявляют себя по-разному. Теплоты адсорбции водорода на адсорбентах одинаковой химической природы, полученные из фурфурола, ФАС-2008 и ФАС-3, при малых заполнениях микропор близки и составляют ~3.0–3.5 кДж/моль. Рост адсорбции водорода на адсорбенте ФАС-2008, имеющем самые широкие поры 1.7 нм и малую стандартную характеристическую энергию адсорбции 14 кДж/моль приводит к плавному падению теплоты адсорбции, что свидетельствует о слабой гетерогенности поверхности адсорбента и сближении средней плотности адсорбата в микропорах и плотности газовой фазы при высоких давлениях.
В отличие от ФАС-2008, теплота адсорбции водорода на адсорбенте ФАС-3, слабо растет с ростом адсорбции, достигая ~5.0 кДж/моль. Такое поведение теплоты адсорбции свидетельствует о слабой гетерогенности поверхности адсорбента, относительно узком распределении пор по размерам и проявлении энергетического вклада притяжения между адсорбированными молекулами водорода при заполнении микропор [7]. Аналогичные явления наблюдались, например, при адсорбции метана на микропористом углеродном адсорбенте [40]. По оценке [41] среднее количество молекул в единичной микропоре адсорбента ФАС-3 при 8 ммоль/г для монопористой модели, составляет ~7–8 молекул на полость. По-видимому, уже при таких заполнениях микропор, начинают проявляться эффекты кооперативных взаимодействий в адсорбате.
Дифференциальные теплоты адсорбции водорода на адсорбентах АУК и ПАУ-700 в начальной области заполнений микропор резко падают с ростом адсорбции, что свидетельствует о высокой энергетической гетерогенности поверхности этих активных углей. Самая высокая начальная теплота адсорбции водорода ~14 кДж/моль на адсорбенте ПАУ-700 вероятно является следствием адсорбции в самых узких микропорах пористой структуры, образующихся при термическом разложении поливиниледхлорида. С ростом адсорбции водорода до 4 ммоль/г, теплота адсорбции падает до ~5.5 кДж/моль. При этом в области ~2–4 ммоль/г падение теплоты замедляется.
Зависимость теплоты адсорбции водорода от величины адсорбции на активном угле АУК имеет необычный вид. Теплота адсорбции в начальной области заполнений микропор составляет ~9 кДж/моль. С ростом адсорбции она сначала резко падает до 5 кДж/моль, проходит через минимум при адсорбции 4 ммоль/г и растет до 9.5 кДж/моль при адсорбции ~7 ммоль/г. Начальное падение теплоты до 5 кДж/моль очевидно обусловлено гетерогенностью адсорбента, приводящей к постепенному заполнению высокоэнергетических центров на поверхности и объема ультрамикропор, соизмеримых с диаметром молекул водорода. Однако дальнейший рост изостерической теплоты до 9.5 кДж/моль, вероятно, обусловлен вкладом энергии притяжения между адсорбированными молекулами водорода при заполнении микропор. Проявлению этого вклада способствует, вероятно, узкое распределение пор по размерам, являющееся следствием выщелачивания кремния из кристаллов SiC при синтезе адсорбента. Аналогичные эффекты отмечали, также при адсорбции метана на адсорбенте АУК [42].
Повышение дифференциальных мольных теплот адсорбции водорода на микропористых углеродных адсорбентах ПАУ-700 и АУК вероятно связано узостью самих пор и узким распределением микропор по размерам этих адсорбентов (табл. 1). Кроме того, в теплоту значительный вклад вносит гетерогенность углеродной поверхности адсорбентов. Углерод в этих адсорбентах не входит в соединения гексагональной координации. Часть образующихся при синтезе свободных связей атомов углерода, не связанных с соседними атомами или не занятыми окисными группами [43], создают дополнительные высокоэнергетические адсорбционные центры.
Список литературы
Гамбург Д.Ю., Семенов В.П., Дубовкин Н.Ф., Смирнова Л.Н. Водород. Свойства, получение, хранение, транспортирование, применение. Под ред. Д.Ю. Гамбурга, Н.Ф. Дубовкина. М.: Химия, 1989. С. 672.
Zaluska A., Zaluski L., Strom-Olsen J.O. // J. Alloys and Comp., 2000. V. 298. P. 125.
A Multiyear Plan for the Hydrogen R&D Program. Rationale, Structure, and Technology Roadmaps / Office of Power Technologies: Energy Efficiency and Renewable Energy: U. S. Department of Energy: August. 1999. P. 55.
Bradley T.H., Moffitt B.A., Mavris D.N., Parekh D.E. // J. Power Sources. 2007. V. 171. P. 793.
Stroman R.O., Schuette M.W., Swider-Lyons K., Rodgers J.A., Edwards D.J. // International J. Hydrogen Energy. 2014. V. 39. P. 11 279.
Дубинин М.М. Адсорбция и пористость. М.: ВАХЗ, 1972.
Власов А.И., Бакаев В.А., Дубинин М.М., Серпинский В.В. // Докл. АН СССР. 1981. Т. 260. № 4. С. 904.
Keffer D., Davis H.T., McCormick A.V. // J. Phys. Chem. 1996. V. 100. № 2. P. 638.
Фомкин А.А., Анучин К.М., Коротыч А.П., Толмачев А.М. // Физикохимия поверхности и защита материалов. 2014. Т. 50. № 2. С. 156.
Shkolin A.V., Fomkin A.A., Tsivadze A.Yu, Anuchin K.M., Men’shchikov I.E., Pulin A.L. // Protection of Metals and Physical Chemistry of Surfaces. 2016. V. 52. № 6. P. 955.
Кельцев Н.В. Основы адсорбционной техники. М.: Химия, 1976.
Carpetis C., Peschka W. // Int. J. Hydrogen Energy. 1980. V. 5. P. 539.
Srtobel R., Jorissen L., Schiermann T., Trapp V., Schutz W., Bohmhammel K., Wolf G., Garche J. // J. Power Sources. 1999. V. 84. P. 221.
Tbbetts G.G., Meisher G.P., Olk C.H. // Carbon. 2001. V. 39. P. 2291.
Shindo K., Kondo T., Arakowa M., Sakurai Y. // J. Alloys and Comp. 2003. V. 359. P. 267.
Sethia G., Sayari A. // Carbon. 2016. V. 99. P. 289.
Kostoglou N., Koczwara C., Prehal C., Terziyska V. // Nano Energy. 2017. V. 40. P. 49.
Брек Д. Цеолитовые молекулярные сита. М.: Мир, 1976.
Исаева В.И., Кустов Л.М. // Росс. хим. журн. 2006. № 6. С. 56.
Hirsher H., Becher M., Halushka M., Dettlaff-Weglikowska U., Quintel A., Duesberg G.S., Choi Y-.M., Downes F., Hulman M., Roth C., Stepanek I., Bernier P. // Appl. Phys. A. 2001. V. 72. P. 129.
Parilla P.A., Dillon A.C., Gennat T., Alleman J.L., Jones K.M., Heben M.J. // Mater. Res. Soc. Symp. Proc. 2001. V. 633. P. 1.
Park C., Anderson P.E., Tan C.D., Hidalgo R., Rodrigez N.M. // J. Phys. Chem. B. 1999. V. 103. P. 10 572.
Tarasov B.P., Goldshleger N.F. // International Scientific J. Alternative Energy and Ecology (ISJAEE). 2002. № 3. P. 20.
Яковлев В.Ю., Школин А.В., Фомкин А.А., Меньщиков И.Е. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 5. С. 420.
Fomkin A.A., Sinitsyn V.A. // Russian Chemical Bulletin. 2009. V. 58. № 4. P. 1.
Фомкин А.А., Синицын В.А., Гурьянов В.В. // Коллоидный журн. 2008. Т. 70. № 3. С. 408.
Wang D.-Y., Gong M., Chou H.-L., Pan C.-J. // J. Am. Chem. Soc. 2015. V. 137. № 4. P. 1587.
Dresselhaus M.S., Williams K.A., Eklund P.C. // MRSBulletin. 1999. V. 24. № 11. P. 45.
Ивахнюк Г.К., Севрюгов Л.Б., Плаченов Т.Г. // Получение, структура и свойства адсорбентов. Л.: Изд. ЛТИ им. Ленсовета. 1977. С. 19.
Федоров Н.Ф., Ивахнюк Г.К., Гаврилов Д.Н., Тетенев В.В., Сметанин Г.Н., Самонин В.В., Бабкин О.Э., Зайцев Ю.А Сб. Углеродные адсорбенты и их применение в промышленности. Под ред. Т.Г. Плаченова, М.: Наука, 1983. С. 20.
Shkolin A.V., Fomkin A.A. // Measurement Techniques, 2018. V. 61. № 4. P. 395.
Прибылов А.А., Калашников С.М., Серпинский В.В. // Изв. АН СССР. Сер. хим. 1990. № 6. С. 1233.
Yin Y.F., Mays T., Mc Enan B. // Langmuir. 2000. V. 16. P. 10521.
Barrer R.M., Papadopoulos R. // Proc. R. Soc. London. 1972. A. 326. P. 331.
Shkolin A.V., Fomkin A.A., Yakovlev V.Yu. // Russian Chemical Bulletin. 2007. V. 56. № 3. P. 393.
Шеховцова Л.Г, Фомкин А.А. // Изв. АН СССР. Сер. Хим. 1992. № 1. С. 19.
Shkolin A.V., Fomkin A.A. // Colloid J. 2009. V. 71. № 1. P. 119.
Shkolin A.V., Potapov S.V., Fomkin A.A. // Colloid J. 2015. V. 77. № 6. P. 812.
Potapov S.V., Shkolin A.V., Fomkin A.A. // Colloid J. 2014. V. 76. № 3. P. 351.
Фомкин А.А., Серпинский В.В., Фидлер К. // Изв. АН СССР. Сер. хим. 1982. № 6. С. 1207.
Дубинин М.М. Сб. Углеродные адсорбенты и их применение в промышленности. М.: Изд-во “Наука”, 1983. С. 100.
Shkolin A.V., Fomkin A.A., Sinitsyn V.A. // Colloid J. 2008. V. 70. № 6. P. 796.
Тарковская И.А. Окисленный уголь. Киев.: Изд-во “Наукова думка”, 1981.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов


