Физикохимия поверхности и защита материалов, 2019, T. 55, № 3, стр. 332-336
Особенности двойного электрического слоя на углероде в широком интервале температур. Измерения в воде
Д. Ю. Грызлов 1, Т. Л. Кулова 1, А. Ю. Рычагов 1, А. М. Скундин 1, *
1 Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии
им. А.Н. Фрумкина Российской академии наук
119071 Москва, Ленинский проспект, 31, корп. 4, Россия
* E-mail: askundin@mail.ru
Поступила в редакцию 06.04.2018
После доработки 19.04.2018
Принята к публикации 15.05.2018
Аннотация
Впервые методом циклической вольтамперометрии исследован двойной электрический слой на углеродном материале в воде в диапазоне температур от комнатной до 300°С. Из зависимости вольтамперограмм от температуры и скорости развертки напряжения сделан вывод о решающем вкладе псевдоемкости, определяемой процессами с участием поверхностных групп, и о замедленности этих процессов.
ВВЕДЕНИЕ
В последнее время необычайно вырос масштаб исследований и разработок электрохимических суперконденсаторов [1, 2], из которых особое место занимают псевдоконденсаторы с углеродными электродами [3–7]. В литературе описано большое разнообразие углеродных материалов, использованных в качестве электродов в псевдоконденсаторах с различными водными и неводными электролитами. Однако сведения о строении двойного электрического слоя на углеродных материалах в чистой воде в широком интервале температур в литературе отсутствуют. Настоящая работа посвящена измерениям характеристик двойного слоя в воде при температурах от комнатной до 300°С.
МЕТОДИКА ЭКСПЕРИМЕНТА
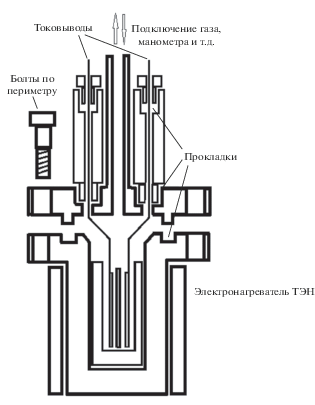
Эксперимент проводили в двухэлектродной электрохимической ячейке высокого давления (до 800 атм), изготовленной из нержавеющей стали (AISI316Ti). Ячейка герметизировалась двойным тефлоновым уплотнением, находящимся вне зоны нагрева (рис. 1). Электрохимическая группа представляла собой симметричный электрохимический конденсатор, состоящий из двух электродов, разделенных волокнистым стеклянным сепаратором (толщиной 1 мм). Электроды изготавливали из активированной углеродной ткани CH-900 (производства компании Kuraray, Япония). СН-900 является микропористой тканью с площадью удельной поверхности, превышающей 1500 м2/г. Электроды размером 20 × 20 мм и массой около 0.04 г, разделенные сепаратором, сжимались токовыми коллекторами из нержавеющей стали давлением около 5 кг/см2, что позволяло обеспечить хороший контакт. В ячейку заливали воду (50% от объема ячейки), после чего ячейку герметизировали и опрессовывали воздухом (300 атм) с целью выяснения наличия возможных утечек. Далее ячейку нагревали с помощью программируемого ленточного нагревателя до нужных значений температур с одновременным контролем и регистрацией давления. Вольтамперограммы снимали с помощью потенциостата-гальваностата Р-20Х8 фирмы “Элинс” (Россия). До и после экспериментов проводили кондуктометрический контроль состояния воды.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Хотя в статье употреблен термин “дистиллированная вода”, его надо трактовать как разбавленный раствор неопределенного состава, поскольку вода была насыщена воздухом, а также контактировала с металлическим корпусом ячейки. Как правило, в процессе проведения высокотемпературных экспериментов, наблюдалось некоторое увеличение проводимости такого электролита. Наиболее сильно эти изменения наблюдались при использовании в качестве электролита дистиллированной воды при температуре 300°С, здесь значение удельной электропроводности после эксперимента приближалось к 30–40 мкСм/см. На рис. 2 приведены циклические вольтамперограммы, полученные в чистой воде при комнатой температуре (30°С) при скоростях развертки напряжения 10, 100, 1000 и 10 000 мВ/с.
Рис. 2.
Циклические вольтамперограммы в чистой воде при температуре 30°С при скоростях развeртки напряжения 10 (1), 100 (2), 1000 (3) и 10 000 (4) мВ/с.

Форма циклических вольтамперограмм характерна для псевдоемкостного поведения (см., напр., [3, 8, 9]). Каждую кривую формально можно характеризовать ее наклоном, точнее тангенсом угла наклона прямой между точками А и В (L ≡ ΔIAB/ΔE), имеющем размерность См или См/г, а также шириной – разницей токов в точках С и D, которая пропорциональна емкости:
Сам по себе факт регистрации вольтамперограмм в воде нетривиален. Электропроводность такой воды обеспечивается не собственными продуктами диссоциации воды (ионное произведение воды даже при температуре 200°С составляет 4 × 10–12), а примесями, в первую очередь, растворенными газами. Так или иначе, сопротивление воды в описанных экспериментах входит в суммарное значение общего сопротивления 1/L. Как видно из рис. 2, даже при комнатной температуре величина 1/L не превышает 100 Ом. Не вдаваясь в детальное рассмотрение строения двойного электрического слоя на исследуемых электродах, можно считать, что плотная часть этого слоя обеспечивается ионами собственно воды и примесей, а также поверхностными функциональными группами [3–5, 10–14]. Что касается диффузной части двойного слоя, то, на первый взгляд, в чистой воде (при бесконечно малой концентрации ионов) емкость диффузной части должна быть очень малой и определять емкость двойного слоя в целом. Однако это заключение справедливо только для измерений вблизи точки нулевого заряда (что, вероятно, не выполнялось в данной работе), а кроме того, реальные значения измеряемой емкости и ее сильная зависимость от скорости развертки потенциала позволяют предположить, что именно псевдоемкость поверхностных групп определяет емкость двойного слоя.
Коль скоро приведенные на рис. 2 циклические вольтамперограммы отражают как емкостное, так и резистивное поведение исследуемой системы, ее можно описать простейшей эквивалентной схемой из последовательного соединения частотно-зависимых активного сопротивления и емкости. Частотная зависимость в этом случае определяется как конечной скоростью токообразующих процессов, так и распределенным характером этих процессов в пористом электроде.
На рис. 3–5 приведены аналогичные вольтамперограммы, полученные при температурах 100, 200 и 300°С.
Рис. 3.
Циклические вольтамперограммы в чистой воде при температуре 100°С при скоростях развeртки напряжения 10 (1), 100 (2), 1000 (3) и 10 000 (4) мВ/с.
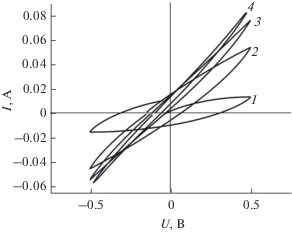
Рис. 4.
Циклические вольтамперограммы в чистой воде при температуре 200°С при скоростях развeртки напряжения 10 (1), 100 (2), 1000 (3) и 10 000 (4) мВ/с.

Рис. 5.
Циклические вольтамперограммы в чистой воде при температуре 300°С при скоростях развeртки напряжения 10 (1), 100 (2), 1000 (3) и 10 000 (4) мВ/с.

Сопоставление вольтамперограмм, приведенных на рис. 2–5 (особенно четко это видно на рис. 5, относящемуся к наиболее высокой температуре), наглядно показывает переход от двойнослойного к псевдоемкостному характеру при увеличении скорости развертки напряжения.
Видно, что обе величины – L и ΔiCD − сложным образом зависят как от скорости развертки напряжения, так и от температуры. С увеличением скорости развертки напряжения величина L возрастает (рис. 6).
Рис. 6.
Зависимость параметра L для чистой воды от скорости развертки потенциала при температурах 30°С (1), 100°С(2), 200°С (3) и 300°С (4).

Температурная зависимость параметра L с определенным приближением описывается уравнением Аррениуса (рис. 7). Прямые на рис. 7 проведены по методу наименьших квадратов. Наклон этих прямых соответствует формальным значениям энергии активации, которая составляет 9.2, 12.9, 14.1 и 14.5 кДж/моль для опытов со скоростью развертки напряжения 10, 100, 1000 и 10 000 мВ/с.
В соответствии с уравнением (1) можно было бы ожидать линейного роста параметра ΔiCD с увеличением скорости развертки напряжения. Фактически зависимость ΔiCD от $\text{v}$ оказалась экстремальной (рис. 8), что свидетельствует о сильной зависимости эффективной емкости электродов от скорости развертки напряжения. Зависимость емкости, вычисленной по уравнению (1), от скорости развертки напряжения показана на рис. 9.
Рис. 8.
Зависимость параметра ΔiCD для воды от скорости развертки напряжения при температурах 30°С (1), 100°С (2), 200°С (3) и 300°С (4).

Рис. 9.
Зависимость емкости, вычисленной по уравнению (1) для чистой воды, от скорости развертки напряжения.

Количественно зависимость емкости, вычисленной по уравнению (1), от скорости развертки напряжения $\text{v}$ с достаточным приближением описывается степенным уравнением
где показатель n несколько уменьшается с ростом температуры и составляет 1.25, 1.21, 1.15 и 1.11 для температур 30, 100, 200 и 300°С (рис. 10). Качественно такое снижение емкости с ростом скорости развертки напряжения имеет ту же природу, как снижение емкости водородного электрода на платине с ростом частоты переменного тока, обнаруженное в классической работе [15], послужившей первым экспериментальным доказательством замедленности разряда иона водорода и обоснованием теории замедленного разряда. Кроме того, как уже отмечалось выше, снижение емкости с ростом скорости развертки напряжения характерно для систем с распределенными параметрами, хотя количественные значения показателя n указывают на основное влияние именно замедленности редокс-процессов в поверхностных функциональных группах на углероде. Близкая зависимость емкости углеродных электродов от частоты при импедансных измерениях и от скорости развертки потенциала при циклических вольтамперометрических измерениях приводится также в [16], но природа такой зависимости в этой работе не обсуждается.Рис. 10.
Зависимость емкости от скорости развертки напряжения в билогарифмических координатах при температурах 30°С (1), 100°С (2), 200°С (3) и 300°С (4).

С ростом температуры емкость углеродных электродов в дистиллированной воде увеличивается, причем эта зависимость подчиняется уравнению Аррениуса, т.е. формально имеет активационную природу, что объясняется опять же замедленностью редокс-процессов функциональных групп на поверхности углерода (рис. 11).
Рис. 11.
Температурная зависимость емкости углеродных электродов в чистой воде, измеренной при скоростях развертки напряжения 10 (1), 100 (2), 1000 (3) и 10 000 мВ/с (4).

Формальные значения энергии активации, соответствующие наклонам прямых на рис. 10, составляют 11.28, 22.57, 19.86 и 18.03 кДж/моль для скоростей развертки потенциала 10, 100, 1000 и 10 000 мВ/с.
ЗАКЛЮЧЕНИЕ
В настоящей работе впервые проведены вольтамперометрические измерения на углеродных электродах в дистиллированной воде при температурах от комнатной до 370°С и скоростях развертки потенциала от 10 мВ/с до 10 В/с. Во всех случаях вольтамперные кривые проявляют емкостные и резистивные свойства, зависящие как от скорости развертки потенциала, так и от температуры. С ростом скорости развертки потенциала емкость снижается, что может быть связано с замедленностью редокс-превращений в поверхностных функциональных группах на углероде. Температурная зависимость емкости в чистой воде подчиняется уравнению Аррениуса, что является следствием ее псевдоемкостного характера.
Работа выполнена при финансовой поддержке Министерства образования и науки РФ.
Список литературы
Bagotsky V.S., Skundin A.M., Volfkovich Yu.M. Electrochemical Power Sources: Batteries, Fuel Cells, and Supercapacitors. Wiley, 2015.
Conway B.E. Electrochemical capacitors. New York: Kluwer Academic/Plenum Publishers, 1999.
Niu J., Pell W.G., Conway B.E. // J. Power Sources. 2006. V. 156. P. 725.
Pandolfo A.G., Hollenkamp A.F. // J. Power Sources. 2006. V. 157. P. 11.
Inagaki M., Konno H., Tanaike O. // J. Power Sources. 2010. V. 195. P. 7880.
Guoping Wang, Lei Zhang, Jiujun Zhang // Chem. Soc. Rev. 2012. V. 41. P. 797.
Zhang Li Li, Zhao X.S. // Chem. Soc. Rev. 2009. V. 38. P. 2520.
Guihua Yu., Liangbing Hu, Nian Liu et al. // Nano Lett. 2011. V. 11. P. 4438.
Рево С.Л., Будзуляк И.М., Рачий Б.И., Кузишин М.М. // Электронная обработка материалов. 2013. Т. 49 № 1. С. 71.
Sullivan M.G., Kötz R., Haas O. // J. Electrochem. Soc. 2000. V. 147. P. 308.
Chien-To Hsieh, Hsisheng Teng // Carbon. 2002. V. 40. P. 667.
Bleda-Martínez M.J., Maciá-Agulló J.A., Lozano-Castelló D. et al. // Carbon. 2005. V. 43. P. 2677.
Li-Zhen Fan, Suyan Qiao, Weili Song et al. // Electrochim. Acta. 2013. V. 105. P. 299.
Toshiyuki Momma, Xingjiang Liu, Tetsuya Osaka et al. // J. Power Sources. 1996. V. 60. P. 249.
Долин П., Эршлер Б. // Журн. физ. химии. 1940. Т. 14. С. 886.
Frackowiak E., Lota G., Machnikowski J. et al. // Electrochim. Acta. 2006. V. 51. P. 2209.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов