Физикохимия поверхности и защита материалов, 2019, T. 55, № 5, стр. 531-537
Роль процессов самоорганизации при формировании наночастиц железа в обратных мицеллах
А. А. Ревина 1, *, О. В. Суворова 1, Ю. С. Павлов 1, Д. Л. Тытик 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, корп. 4, Россия
* E-mail: alex_revina@mail.ru
Поступила в редакцию 03.09.2018
После доработки 07.02.2019
Принята к публикации 08.02.2019
Аннотация
Изучение оптических свойств наночастиц железа, полученных методом молекулярной сборки при использовании реакций химического и радиационно-химического восстановления ионов в обратных мицеллах, рассматриваемых в качестве микрореакторов, позволило выявить особенности формирования наночастиц (НЧ) металлов на различных этапах физико-химических процессов, включая стадию самопроизвольного образования упорядоченных пространственных наноструктур в пострадиационный период. При анализе результатов измерения спектральных характеристик обратномицеллярных растворов (ОМР), не содержащих ионов металлов, была получена важная информация об эволюционных изменениях в коллоидных системах. После введения ионов железа в ОМР по характерным спектрам оптического поглощения в зависимости от времени хранения было зарегистрировано формирование НЧ Fe за счет процессов самоорганизации (“self-assembly”, SA). На основании полученных результатов в нашей работе обсуждаются некоторые особенности процессов самоорганизации в ОМР при различных реакциях инициирования процессов восстановления ионов железа и формирования НЧ Fe.
ВВЕДЕНИЕ
Нанотехнологии предлагают различные способы получения наночастиц металлов, оксидов, биметаллов и других наноструктур с заданными свойствами (каталитическими, магнитными, бактерицидными) для создания функциональных материалов, которые находят широкое практическое применение в технике, электронике, нанофотонике, медицине и сельском хозяйстве [1–12]. К особо перспективным металлам с каталитическими свойствами, близкими к металлам платиновой группы, имеющим большую распространенность и менее высокую стоимость, относится железо. В наших исследованиях для синтеза НЧ железа и других металлов в водноорганических ОМР используются реакции направленного химического (Chem) и радиационно-химического (RadChem) восстановления ионов [5–7]. В Chem синтезе восстановление происходит за счет природных антиоксидантов (например, флавоноида кверцетина) и молекулярного кислорода, а в RadChem – в дезаэрированном ОМР за счет короткоживущих частиц радиолиза воды с высокими восстановительными потенциалами: сольватированных электронов, ${\text{е}}_{{{\text{сольв}}}}^{ - },$ радикалов Н и Ri.
Давно считалось экспериментально установленным, что свойства воды (связанная вода) у границы раздела фаз отличаются от объемной и могут оказывать существенное влияние на поведение всего раствора [4, 14, 15]. По современным представлениям это может определяться кристаллохимическими свойствами молекул воды, формирующих в объеме сетку водородных связей [16], а на границе фаз по данным [17] – слой пограничной воды (“Exclusion Zone Water”, или “EZ-water”). В ходе исследований электропроводности, электромагнитных и спектральных свойств ОМР в [18–20] были получены результаты, подтверждающие что вода в водном пуле обратных мицелл может быть поляризованной11. Схема обратной мицеллы состава Н2О/AOT/изооктан представлена на рис. 1.
Рис. 1.
Схема обратной мицеллы в водно-органическом растворе Н2О/AOT/изооктан: rm и rw – радиусы мицеллы и водного пула, соответственно (a); структурная формула АОТ – 1,4-бис-(2-этилгексил)-сульфосукцинат натрия (б).
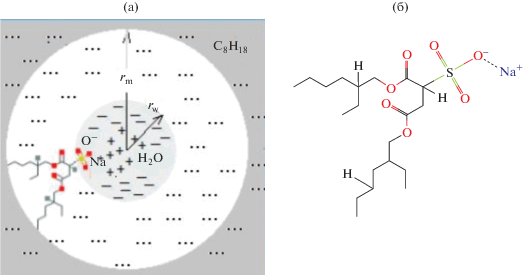
Именно поляризованность воды в пуле обратной мицеллы обеспечивает возможность использования водно-органических ОМР в качестве “микрореакторов” для синтеза стабилизированных НЧ металлов “снизу-вверх”. Ранее при изучении направленных синтезов НЧ металлов [5, 6] нами не учитывались особенности самоорганизации (SA) в ОМС, роль поляризованности воды в водном пуле мицелл и роль процессов SA в формирования НЧ. На данном этапе исследований существует необходимость детектировать наночастицы, которые, как предполагается, могут образовываться в коллоидных системах за счет SA. В связи с этим было проведено тщательное изучение изменений оптических характеристик растворов 0.15 М АОТ в изооктане в аэробных условиях без применения восстановителей и воздействия ионизирующего излучения сразу после введения ионов Fe2+ и далее в зависимости от времени хранения образцов. Также был поставлен вопрос о вкладе процессов SA на всех стадиях формирования НЧ металлов в ОМР при направленном проведении RadChem и Chem синтезов НЧ Fe. Во всех экспериментах спектры оптического поглощения исходных растворов и образцов ОМР НЧ Fe регистрировали с помощью спектрофотометра “Hitachi U-3310” относительно раствора 0.15 М АОТ/изооктан в присутствии кислорода воздуха при комнатной температуре. Длина оптического пути кварцевой кюветы 1.0 мм.
ЭКСПЕРИМЕНТАЛЬНЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Химический (Chem) синтез [3, 5]. Для химического восстановления ионов железа в обратномицеллярной системе в качестве восстановителя использовано природное полифенольное соединение кверцетин (Qr). Способ получения наночастиц основан на способности ионов железа к образованию обратимых комплексов с частичным переносом заряда с молекулами флавоноида Qr и кислорода [11]. Методами переменно-токовой вольтамперометрии и спектрофотометрии было доказано, что формирование наночастиц металлов в организованных мицеллярных системах происходит за счет внутримолекулярного переноса электрона в тройном кислородсодержащем комплексе с частичным переносом заряда (Qrδ+…Fe2+…${\text{O}}_{{\text{2}}}^{{{\delta } - }}$) [5, 11]. Последующее агрегирование восстановленных ионов в организованной системе ОМР приводит к формированию наноразмерных частиц ${\text{Fe}}_{{\text{n}}}^{{{\text{m}} + }}.$ Комплексы Qr c Fe2+ и О2 были идентифицированы спектрофотометрически по батохромному смещению полосы оптического поглощения Qr в присутствии ионов железа и по изменению потенциала восстановления молекулы кислорода в этих растворах [11, 12].
Для формирования НЧ Fe использовали раствор 150 мкМ Qr/ 0.15 М АОТ/изооктан, в который вводился водный раствор 0.3 М соли Мора FeSO4 · (NH4)2SO4 · 6H2O (серножелезистоаммиачная соль) в соответствии с выбранными значениями коэффициентов солюбилизации (ω = = [H2O]/[AOT]): ω1 = 1.5; ω2 = 3.0 и ω3 = 5.0). Спектры оптического поглощения ОМР НЧ Fe Chem были зарегистрированы в разные моменты времени. На рис. 2 представлены спектры ОМР НЧ Fe Chem со значением ω1 = 1.5.
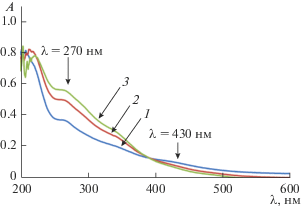
Рис. 2.
Спектры оптического поглощения ОМР растворов НЧ Fe при ω = 1.5 в зависимости от времени синтеза Δt, сут: 1 (1); 8 (2); 15 (3). [Fe2+] в исходном водном растворе соли 0.3 М; в водном пуле [Fe2+]W.P. = = 0.3 М (const), в ОМР [Fe2+]ОМР = 1.2 мM. На вставке: структурная формула Qr (3,5,7,3',4'-пентагидроксифлавона).

На представленных спектрах в зависимости от продолжительности Δt синтеза, наблюдается увеличение оптической плотности полосы поглощения ОМР НЧ Fe (λ ~ 270 нм) и изменение полосы при λ ~ 200–230 нм. С течением времени (до 15 сут) наблюдается снижение интенсивности поглощения в УФ-области спектра (спектр 1) и, отчетливое проявление пика НЧ Fe при λмакс ~ 230 нм (спектр 3). При низкой концентрации ионов [Fe2+]ОМР = 1.2 мM в ОМР (ω = 1.5) регистрируется полоса при λ ~ 430 нм, которая связана с поглощением лабильного комплекса (Qrδ+…Fe2+…${\text{O}}_{{\text{2}}}^{{{\delta } - }}$). Изменение спектров оптического поглощения ОМР НЧ Fe при ω = 5.0 за тот же самый период времени Δt (15 сут) показано на рис. 3.
Рис. 3.
Спектры оптического поглощения ОМР НЧ Fe при ω = 5.0 в зависимости от ∆t, сут: 1 (1); 8 (2); 15 (3). Концентрация ионов в водном пуле, [Fe2+]W.P. = 0.3 М (const), [Fe2+]ОМР = 4.0 мM при значении ω = 5.0.
Видно, что на 15-е сут (спектр 3) полоса поглощения комплекса отсутствует при заметном росте интенсивности полос ОП, характерных для НЧ железа, включая полосу при λ ~ 230 нм. Данные по изменению оптической плотности НЧ Fe при 270, 350 нм и комплекса [Qrδ+…Fe2+…${\text{O}}_{{\text{2}}}^{{{\delta } - }}$] при λ3 = 430 нм в ОМР при трех значениях ω(i) (1.5, 3.0, 5.0) представлены в табл. 1.
Таблица 1.
Изменение оптической плотности ОМР (ωi) при λ1–3 и ∆t(j)
| ω(i) | ∆t(j) ОП при λ1-3 | λ1 = 270 нм | λ2 = 350 нм | λ3 = 430 нм | ||||||
| 1 сут | 8 сут | 15 сут | 1 сут | 8 сут | 15 сут | 1 сут | 8 сут | 15 сут | ||
| 1.5 | 0.32 | 0.44 | 0.52 | 0.14 | 0.19 | 0.20 | 0.11 | 0.18 | 0.20 | |
| 3.0 | 0.35 | 0.46 | 0.58 | 0.17 | 0.22 | 0.28 | 0.09 | 0.09 | 0.09 | |
| 5.0 | 0.36 | 0.49 | 0.59 | 0.19 | 0.26 | 0.27 | 0.10 | 0.07 | 0.07 | |
Размеры НЧ Fe, полученные методом динамического рассеяния света в первые часы после синтеза, приведены и обсуждались в работе [21].
На рис. 3 показано, что интенсивность поглощения НЧ Fe в ОМС при ω = 5.0 (рис. 3) также повышается в зависимости от продолжительности синтеза, Δt, что свидетельствует об увеличении количества наночастиц. При этом ОП ОМР при λ ~ 270 нм и λ ~ 350 нм зависит (нелинейно) от содержания ионов железа в мицеллярном растворе. В ОМР (ω = 5.0) при более высокой концентрации ионов Fe в ОМР = 4.0 мM на основании данных табл. 1 и анализа спектров на рис. 3 можно наблюдать увеличение ОП НЧ Fe Chem даже при низком остаточном поглощении комплекса (Qrδ+…Fe2+…${\text{O}}_{{\text{2}}}^{{{\delta } - }}$). Следовательно, при Chem синтезе увеличение интенсивности поглощения НЧ Fe в ОМР и продолжение образования НЧ со временем почти при полном расходовании восстановителя кверцетина может происходить за счет вклада процессов SA, наблюдаемых в коллоидных ОМС [8].
Радиационно-химический НЧ Fe (RadChem) синтез [2, 6]. Процесс восстановления ионов и формирование НЧ Fe RadChem происходит в анаэробных условиях при внешнем воздействии ионизирующего излучения за счет взаимодействия с короткоживущими продуктами радиолиза воды, обладающих восстановительными свойствами: ${\text{е}}_{{{\text{solv}}}}^{ - },$ Н, R(i). Для удаления окислительной компоненты радикала ОН, вводится изопропиловый спирт, который при взаимодействии с ОН переходит в восстановительный оксиизопропильный радикал и тоже участвует в реакции восстановления ионов и в образовании НЧ Fe. Для синтеза использовали 0.3 М водный раствор соли Мора в 0.15 М растворе АОТ в изооктане, в объемах, соответствующих выбранным значениям ω = [Н2О]/[AOT]. Приготовленные растворы в ампулах герметизировали и облучали потоком ускоренных электронов при использовании установки УЛВ-10-10-C-70 (ИФХЭ РАН) при мощности дозы 3 × 103 Гр/с. Дозы облучения были выбраны в диапазоне от 5.0 до 25 кГр.
При изучении механизма формирования НЧ RadChem в ОМР [6] было установлено, что ключевыми варьируемыми параметрами радиационно-химического синтеза НЧ металлов является доза и мощность дозы излучения, которые во многом определяют скорость процесса генерации, величину радиационного выхода короткоживущих восстановительных частиц в момент радиолиза, а также увеличение выхода наночастиц в пострадиационный период. Поскольку в RadChem синтезе можно использовать высокие мощности дозы излучения, т.е. предельно короткие времена воздействия на систему, то появилась надежда найти различия в оптических свойствах НЧ Fe, зарегистрированных сразу после прекращения воздействия потока ускоренных электронов и НЧ, появляющихся в пострадиационный период. Влияние дозы облучения на оптические характеристики НЧ Fe в ОМР при значении ω = 5.0 представлены на рис. 4. Ампулы с облученными в деаэрированных условиях образцами ОМР при [Fe2+]ОМР = 4 мМ были вскрыты через 2–4 ч после конца облучения и измерены их спектры поглощения. Дальше облученные образцы хранились в присутствии воздуха, в темноте при комнатной температуре.
Рис. 4.
Спектры оптического поглощения НЧ Fe в ОМР (ω = 5.0), облученных при дозах, кГр: 5.0 (1), 10.0 (2), 15 (3), 20 (4), 25 (5). Спектры записаны в спектральном диапазоне от 200 до 500 нм после облучения, ∆t < 4 ч (а); после облучения, ∆t = 4 мес. (б).

По оптическим характеристикам представленных спектров на рис. 4б (разрешимость, более четкие значения λмакс полос поглощения, их интенсивность) указанных образцов можно судить о большой эффективности процесса образования НЧ Fe в пострадиационный период в ОМР за счет процессов SA наноструктур, который ведет к увеличению общего выхода НЧ Fe после облучения при мощности дозы (3 × 103 Гр/с). Однако зависимость RadChem выхода НЧ Fe от дозы имеет сложный характер. Для образцов ОМР НЧ Fe RadChem зависимость ОП = f (Доза) показана на рис. 4а. Можно видеть, что если спектры записаны сразу после облучения, то ОП образцов уже после дозы >20 кГр почти не изменяется. В спектрах этих же образцов, зарегистрированных через 4 мес. в пострадиационный период, увеличение интенсивности ОП за счет SA НЧ наблюдается только в ОМР НЧ Fe после облучения при дозах 5.0, 10 и 15 кГр, как показано на рис. 4б. В образцах ОМР НЧ Fe, облученных при дозе 20 и 25 кГр оптическая плотность всех характерных полос спектра ниже, чем образца (15 кГр), но соотношение интенсивностей полос и их разрешение почти не изменилось. Можно сделать вывод, что дозы >15 кГр для синтеза RadChem НЧ Fe в ОМР данного состава менее эффективны. Действительно, в ОМР некоторых облученных образцов при дозах >20 кГр было обнаружено некоторое количество НЧ Fe в осадке.
Измерение спектров электронного плазмонного резонанса в УФ-области образцов ОМР НЧ Fe без их разбавления (которое нежелательно для коллоидных самоорганизующихся систем) позволило зарегистрировать некоторые дополнительные изменения в спектрах сразу после внешнего воздействия ионизирующего излучения в пострадиационный период. Спектры оптического поглощения образцов ОМР НЧ Fe RadChem, облученных при разных дозах, зарегистрированных через 2–4 после облучения и через 4 мес. хранения представлены на рис. 5а и 5б, соответственно.
Рис. 5.
Спектры оптического поглощения НЧ Fe в ОМР (ω = 5.0), облученных при дозах, кГр: 5.0 (1), 10.0 (2), 15 (3), 20 (4), 25 (5). Спектры записаны после облучения через ~2–4 ч в спектральном диапазоне от 190 до 250 нм (а); через 4 мес. (б).

Сравнение представленных спектров на рис. 6 показывает существенное отличие характера спектра “поглощения” образца ОМР НЧ Fe через 4 мес. после RadChem синтеза в диапазоне от 200 до 250 нм, особенно в высоко энергетической области (интенсивность которого уходит за пределы измерений, принятых в спектрофотометрии). Представляет интерес сравнить изменения в спектрах оптического поглощения образцов НЧ Fe в ОМР при одном значении ω = 5.0, но для разных первичных процессов инициирования реакций восстановления. Для НЧ Fe RadChem взяты образцы, облученные до 15 кГр, поскольку процессы “самообразования” НЧ Fe в образцах, облученных при более высоких дозах проходят с меньшей эффективностью.
Рис. 6.
Спектры оптического поглощения НЧ Fe в ОМР (ω = 5.0): НЧ Fe RadChem (Доза 15 кГр) (1), после облучения через ~2–4 ч; ОМР НЧ Fe Chem (2), ОМР НЧ Fe SA (3) после введения раствора соли.

На рис. 6 представлены спектры ОП образцов ОМР 0.15 М АОТ/изооктан (ω = 5.0) при [Fe2+]ОМР = 4 мМ: НЧ Fe RadChem через ∆t = 2–4 ч после облучения (доза 15 кГр) – спектр 1; НЧ Fe Chem после введения водного раствора ионов Fe2+ в раствор 150 мкМ Qr/0.15 М АОТ/изооктан – спектр 2; и образцов НЧ Fe SA в 0.15 М АОТ/изооктан после введения ионов – спектр 3.
Можно отметить, что наибольшую интенсивность спектров поглощения имеют образцы НЧ Fe RadChem, а образцы НЧ Fe Chem, т.е. без внешнего воздействия (облучения), а образцы НЧ Fe SA и без восстановителя Qr, имеют близкие спектры и по интенсивности, и по форме.
Изменение спектров образцов ОМР НЧ Fe Chem (ω = 5.0) и НЧ Fe SA (ω = 5.0), зарегистрированных при первом измерении, ∆t < 2 ч (рис. 6), и через 4 мес., можно сравнить с представленными спектрами на рис. 7. Если при первом измерении оптическая плотность при λмакс ~ 275 нм и для НЧ Fe Chem и НЧ Fe SA была почти одинаковой и равной ~1.0, то через 4 мес. ОП при λмакс ~ 285 нм для НЧ Fe Chem (спектр 3) выросла до ~2.2, а для НЧ Fe SA (спектр 6) – только до ~1.4.
Рис. 7.
Спектры оптического поглощения НЧ Fe в ОМР: спектры НЧ Fe Chem (1–3), НЧ SA (4–6) записаны через 4 меc. хранения образцов: ω = 1.5 (1, 4), ω = 3.0 (2, 5), ω = 5.0 (3, 6). Вставка: УФ – часть спектров НЧ Fe Chem и НЧ SA в диапазоне от 190 до 240 нм.

Таким образом, при изучении оптических свойств обратномицеллярных растворов НЧ Fe RadChem, НЧ Fe Chem и НЧ Fe SA, полученных методами “молекулярной сборки”, при использовании различных способов инициирования реакций восстановления, за счет вклада процессов самоорганизации самопроизвольного образования упорядоченных пространственных структур в ОМР обнаружено увеличение интенсивности плазмонного электронного резонанса и изменения оптических характеристик спектров НЧ Fe в видимой и в УФ-области спектра. Для объяснения формирования НЧ Fe SA можно предположить, что поляризованная вода в водных пулах мицелл может выполнять в обратномицеллярных системах роль “восстановителя”.
Подтверждение формирования именно металлических НЧ Fe в процессах Chem и SA получено методом просвечивающей электронной микроскопии (ПЭМ) с использованием комплекса на базе электронного микроскопа LEO 912 ab. Микрофотографии ПЭМ и дифракционные картины образцов НЧ Fe SA и НЧ Fe Chem представлены на рис. 8.
ЗАКЛЮЧЕНИЕ
В результате проведенных спектрофотометрических исследований оптических свойств ОМР НЧ Fe, синтезированных при различных способах инициирования первичных актов реакций восстановления ионов железа и последующего формирования наноструктур методом “молекулярной сборки” позволило зарегистрировать появление наноразмерных частиц в пост-радиационный период при RadChem и при хранении образцов при Chem синтезе. В RadChem методе в короткие промежутки времени воздействия импульсов ускоренных электронов в ОМР появляются промежуточные частицы ${\text{е}}_{{{\text{сольв}}}}^{ - }{\text{,}}$ атомы Н, R(i) – короткоживущие компоненты радиолиза Н2О в водном пуле мицелл, обладающие высокими восстановительными потенциалами. Реакции восстановления ионов металлов в Chem синтезе в ОМР в аэробных условиях протекают в присутствии катализатора кверцетина. Оценить роль процессов самоорганизации образования упорядоченных наноструктур, т.е. процессов, не требующих направленных воздействий или присутствия катализаторов, удалось при исследовании методами спектрофотометрии и ПЭМ формирования НЧ Fe в ОМР, того же химического состава, как и в RadChem и Chem методах. На основании данных рентгеновской дифракции дано подтверждение SA – формированию НЧ Fe, размеры которых зарегистрированы в диапазоне от 1.0 до 3.0 нм.
Таким образом, на каждой стадии формирования НЧ Fe проявляются четко присущие конкретному методу синтеза (RadChem или Chem) особенности поведения НЧ в ОМР и различный вклад процессов самоорганизации в общий процесс формирования наноструктур. Зарегистрированные эффекты позволяют сделать предположение, что механизм формирования НЧ Fe SA в обратных мицеллах основан на способности поляризованной воды в пуле мицеллы выполнять роль “восстановителя” ионов металла.
Изучение механизма формирования НЧ металлов в ОМР, включая процессы самоорганизации, является важным для понимания процессов эволюционного образования в аэробных условиях наноразмерных объектов в самоорганизующихся системах живой природы. Исследование процессов самоорганизации – одно из многообещающих междисциплинарных научных направлений последних лет [22].
Авторы выражают благодарность доценту кафедры физики полимеров и кристаллов физического факультета МГУ им. М.В. Ломоносова С.С. Абрамчуку за помощь в проведении исследований методом ПЭМ.
Исследования выполнены с использованием ускорителя УЛВ-10-10-C-70 “Центра коллективного пользования физическими методами исследования ИФХЭ РАН”.
Работа частично выполнена при поддержке Российского фонда фундаментальных исследований (проект № 16-03-00665).
Список литературы
Petit C., Lixon P., Pileni M.-P. // J. Phys. Chem. 1993. V. 97. P. 12974.
Докучаев А.Г., Мясоедова Т.Г., Ревина А.А. // Химия высоких энергий 1997. Т. 31. № 5. С. 353.
Egorova E.M., Revina A.A. // Colloids and Surfaces A. 2000. V. 73. P. 87.
Танасюк Д.А., Ревина А.А., Ермаков В.И. // Наукоемкие технологии. 2012. Т. 13. № 2. С. 9.
Ревина А.А. Патент РФ № 2312741. Препарат наноразмерных частиц металлов и способ его получения. Бюл. № 35. 20.12.2007. (Chem).
Ревина А.А. Патент РФ № 2322327 // Б.И. 2008. № 11.
Revina A.A., Kuznetsov M.A., Chekmarev A.M., Boyakov E.E. , Zolotarevskii V.I. // Protection of Metals and Physical Chemistry of Surfaces, 2018, vol. 54, Issue 1, pp. 43–50.
Grzelczak Marek, Vermant Jan, Furst Eric M. et al. // www.acsnano.org. AcsNano. 2010. V. 4. № 7. P. 3591.
Бухтияров В.И., Слинько М.Г. // Успехи химии. 2001. Т. 70. Вып. 2. С. 167.
Ревина А.А., Кезиков А.Н., Козлов А.И и др. Патент РФ № 2270831 // Б.И. 2006. № 6.
Ревина А.А. // Физикохимия поверхности и защита материалов. 2009. Т. 45. № 1. С. 58.
Ревина А.А., Зайцев П.М. // Электрохимия. 2012. Т. 48. № 3. С. 1.
Ревина А. А., Воропаева Н.Л., Мухин В.М., Чекмарь Д.В. // Нетрадиционные природные ресурсы, инновационные технологии и продукты. 2016. Вып. 23. С. 30.
Штыков С.Н., Горячева И.Ю. // Оптика и спектроскопия. 1997. Т. 83. № 4. С. 698.
Воейков В.И. // Труды IV Международного конгресса Слабые и сверхслабые поля и изучения в биологии и медицине. 2006. С. 46.
Волошин В.П., Желиговская Е.А., Маленков Г.Г., Наберухин Ю.И., Тытик Д.Л. Структуры сеток водородных связей и динамика молекул воды в конденсированных водных системах // Российский химический журнал, 2001. Т. XLV. № 3. С. 31.
Zheng J.M., Wexler A., Pollack G.H. // J. Colloid. Interface Sci. 2009. V. 332. P. 511.
Танасюк Д.А., Цетлин В.В., Ревина А.А., Ермаков В.И. // Наукоемкие технологии. 2013. Т. 14. № 1. С. 44.
Ермаков В.И., Ревина А.А. Обратномицеллярные системы: Электромагнитные свойства и структура. Н. Новгород: НИУ РАНХи ГС, 2017. 200 с.
Nishirnoto J., Iwamoto E., Fujiwara T., Kurnarnaru T. // J. Chem. Soc. Faraday Trans. 1993. V. 89. № 3. P. 535–538.
Ревина А.А., Дайнеко С.В., Большакова А.Н. и др. // Наукоемкие технологии. 2011. Т. 12. № 1. С. 68.
Арсланов В.В. Нанотехнология. Коллоидная и супрамолекулярная химия. Энциклопедический справочник. М.: ЛЕНАНД. 2015. 400 с.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов



