Физикохимия поверхности и защита материалов, 2019, T. 55, № 5, стр. 513-521
Адсорбция формальдегида из водных растворов геополимерными сорбентами на основе метакаолина
Л. А. Новикова 1, *, Д. С. Богданов 1, Л. И. Бельчинская 1, Д. Колушек 2, Б. Доушова 2, М. Лготка 2, Г. А. Петухова 3
1 ФГБОУ ВО “Воронежский государственный лесотехнический университет им. Г.Ф. Морозова”
394087 Воронеж, ул. Тимирязева, 8, Россия
2 Химико-технологический университет в Праге
Прага, Чешская Республика
3 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
Москва, Ленинский проспект, 31, Россия
* E-mail: chem@vglta.vrn.ru
Поступила в редакцию 15.11.2018
После доработки 15.03.2019
Принята к публикации 15.04.2019
Аннотация
Образцы геополимеров, полученные щелочной активацией метакаолина при варьируемых условиях синтеза (100°C (14 ч); 130°C (3 ч); клиноптилолитовый наполнитель), использованы в качестве сорбентов формальдегида из водных растворов. Структура и физико-химические свойства геополимерных сорбентов изучены методами XRD, XRF, SEM, адсорбции-десорбции N2, химическими методами. Синтезированные образцы характеризовались преобладанием фазы цеолита А среди структурных составляющих (цеолит А, гидроксисодалит, кварц). Введение клиноптилолитового наполнителя при синтезе геополимеров привело к некоторому росту значений их удельной поверхности и объема пор. В водных растворах формальдегида (0.064–0.366 M) образцы геополимерных сорбентов проявили высокую адсорбционную способность к молекулам сорбата. Вероятной причиной высокой адсорбционной способности геополимеров к формальдегиду явилась их катионообменная емкость, которая в 2–3 раза превысила таковую для образца природного клиноптилолита. Природа обменного катиона (Na+, ${\text{NH}}_{4}^{ + },$ Cu2+) определяла величину и, очевидно, преимущественный механизм сорбционного поглощения формальдегида (физическая адсорбция, хемосорбция, комплексообразование). Более высокие значения адсорбции формальдегида получены для ${\text{NH}}_{4}^{ + }$- и Cu2+-форм геополимерных сорбентов по сравнению с Na+-формой.
Геополимеры представляют собой новое семейство синтетических алюмосиликатных материалов, получаемых при щелочной активации различного алюмосиликатного сырья (зола уноса, природные глины, цеолиты, полевые шпаты и др.) [1–3]. Эти экологически чистые материалы составляют серьезную конкуренцию строительным материалам на основе портланд-цемента, т.к. при их производстве отсутствуют выбросы СО2, затраты минимальны, а прочностные показатели превышают таковые для других материалов [4–6].
Структура геополимеров представлена цепочками чередующихся атомов кремния и алюминия, которые, согласно Дж. Давидовичу [4, 5] разделяются на полисилаты (–Si–O–Al–O–), поли(силаты-силоксо) (–Si–O–Al–O–Si–O–) и поли(силаты-дисилоксо) (–Si–O–Al–O–Si–O–Si–O–). Аналогично цеолитам, кремне- [SiO4]4– и алюмокислородные [AlO4]5– тетраэдры геополимеров образуют двух- и трехмерные сетки, избыточный отрицательный заряд которых компенсируется обменными катионами Na+, K+, Ca2+ [1]. Однако, в отличие от цеолитов, структура геополимеров является в основном аморфной с примесями цеолитных фаз, соотношение между которыми сильно зависит от условий синтеза [7–9]. Добавление щелочного активатора (NaOH, Na2SiO3, KOH, K2SiO3) к источнику кремния и алюминия приводит к их растворению и последующей реакции полимеризации с образованием геополимерной сетки Si–O–Al–O и получению материала, обладающего превосходными вяжущими свойствами, механической прочностью и термической стойкостью. Низкое содержание кальция придает геополимерам повышенную стойкость к действию кислот и растворов солей по сравнению с портланд-цементом. Благодаря этим свойствам геополимеры широко используются не только в строительной индустрии, но и для обезвреживания и захоронения промышленных отходов [10, 11].
Цеолитоподобная структура, катионобменные свойства, микропористость проявляются в сорбционной активности геополимеров и возможности их использования для очистки промышленных сточных вод от поллютантов различной природы (тяжелые металлы, ионы аммония, органические красители). Геополимеры на основе метакаолина на 46% эффективнее (21.07 мг/г) удаляют ионы аммония из модельных растворов и стоков с полигонов [9] по сравнению с цеолитом на основе клиноптилолита-гейландита (14.42 мг/г). За счет геополимеризации изменяется химическая структура метакаолина, увеличивается удельная поверхность и средняя ширина пор, что повышает способность сорбента к удалению аммония.
Для повышения механической прочности и адсорбционной способности геополимеров к поллютантам на стадии синтеза в качестве наполнителя вводят цеолиты [12, 13], вследствие чего возрастает прочность материала на сжатие, увеличивается адсорбция метиленового голубого и ионов меди (7.8 мг Cu2+/г [12]) из водных растворов. Более того, диспергирование частиц Cu2O в геополимерной матрице нового фотоактивного композита [14] позволяет удалять метиленовый голубой из воды или воздуха, комбинируя адсорбцию и последующую его фотодеградацию при УФ-освещении без вреда структуре геополимера или фотоактивному Cu2O.
Геополимеры эффективно сорбируют ионы различных тяжелых металлов (Pb2+, Cu2+, Cr3+, Cd2+) из водных растворов, в особенности ионы Pb2+ [15], а также одновременно ионы Ni2+, As3+ и Sb3+ из стоков шахт [16], обеспечивая 90–100% очистку. Адсорбционные данные для геополимеров наилучшим образом описываются уравнениями изотерм Лэнгмюра-Фрейндлиха, а кинетика извлечения ионов подчиняется уравнению кинетики псевдо-второго порядка [15, 16]. Примечательно, что отработанные геополимерные адсорбенты могут быть регенерированы растворами 0.2 М NaCl и 0.1 M NaOH [7].
В [17, 18] синтезированы цеолитоподобные материалы из метакаолина, золы и NaOH, которые отличались повышенной адсорбцией формальдегида из воздуха помещений и были использованы в воздушных фильтрах. Формальдегид является чрезвычайно распространенным токсикантом 2-го класса опасности, пары которого обладают раздражающим действием на слизистые оболочки, канцерогенным и мутагенным эффектом [19, 20]. Содержанием паров формальдегида в воздухе жилых и рабочих помещений, в водной среде, а также материалах и изделиях строго регламентируется и не должно превышать соответственно 0.2 мг/м3 (ПДКс.с.), 0.5 мг/м3 (ПДКр.з.) и 0.5 мг/л (ПДКв.) [21, 22].
Целью данной работы явилось изучение адсорбционных характеристик геополимеров в водных растворах формальдегида, являющегося основным компонентом сточных вод деревообрабатывающей и мебельной промышленности [23, 24].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы геополимерных сорбентов были получены геотермальным синтезом из следующих компонентов (мас. %): (1) G-14/100 – метакаолин (41), NaAlO2 (41), вода (18), t = 100°C (14 ч); (2) G-3/130 – метакаолин (41), NaAlO2 (41), вода (18), t = 130°C (3 ч); (3) G-Clin-3/130 – метакаолин (39), NaAlO2 (41), вода (18) и природный клиноптилолит (Нижний Грабовец, Словакия) (2), t = = 130°C (3 ч). Метакаолин получен прокаливанием каолина (Sedlec, Чешская Республика) при 650°С в течение 4 ч.
Реагенты смешивали в фарфоровых чашах в указанных пропорциях и помещали в сушильный шкаф. По завершении синтеза образцы промывались дистиллированной водой для удаления остатков щелочи. Полученные образцы геополимеров представляли собой сыпучий материал с размером гранул 200–300 мкм и не рассеивались на фракции.
Для характеристики структуры, химического состава и физико-химических свойств полученных материалов использовали методы рентгеновской дифракции, рентгенофлюоресцентного анализа, адсорбции-десорбции азота, а также сканирующую электронную микроскопию.
XRD-исследования
Рентгенограммы порошковых образцов получали на приборе 3000P Seifert instrument (Германия) с CoKα источником излучения. Каждый образец измерялся в диапазоне 5–70 2Q (шаг 0.05 2Q/с) для качественного определения индивидуальных фаз. Для количественного анализа каждый образец измерялся 3 раза с шагом 0.02 2Q/с.
Изучение химического состава
Химический анализ образцов проводился с использованием рентгенофлуоресцентного метода на спектрометре Axios mAX (PANalytical, Нидерланды). Образцы высушивались при 110°С и готовились сплавлением с тетраборатом лития при 1200°C.
Адсорбция-десорбция азота
Удельная поверхность (SBET и St-plot) образцов, анализ микропор и распределение пор по размерам были определены из данных измерений низкотемпературной адсорбции-десорбции азота, полученных на анализаторе ASAP 2020 (Micromeritics, Norcross, GA, USA). Для расчета соответствующих значений использовали метод БЭТ (SBET), t-plot анализ и метод Баррэта–Джойнера-Халенды (BJH) для распределения пор по размерам. Вакуумирование образцов проводили при 250°С в течение 8 ч.
Сканирующая электронная микроскопия
Образцы исследованы методом полевой эмиссионной сканирующей микроскопии (FE-SEM) на сканирующем электронном микроскопе Hitachi S-4700, оснащенном EDS анализатором от ThermoNoran D-6823. Микроскоп работает в диапазоне напряжений от 500 эВ до 30 кэВ. Режим высокого напряжения требуется для записи аналитических сигналов образцов, низкое напряжение используется для непроводящих образцов, в которых металлическое покрытие нежелательно.
Определение катионообменной емкости и ионный обмен
Предполагалось, что синтезированные образцы геополимеров находятся в Na-форме. С помощью реакций ионного обмена определенное количество каждого образца было переведено в ${\text{NH}}_{4}^{ + }$- и Cu2+-формы, которые были использованы для последующего определения катионообменной емкости (КОЕ) образцов и адсорбции формальдегида. Для перевода в ионные формы к 0.5–1.0 г сорбента прибавляли 50 мл 1 М NH4Cl или 1 М CuSO4, перемешивали 30 мин на магнитной мешалке, отфильтровывали, промывали небольшим количеством дистиллированной воды и высушивали сорбент при 100оС до постоянной массы.
Катионообменную емкость образцов определяли по количеству ионов Ca2+, вступивших в реакцию между ${\text{NH}}_{4}^{ + }$-формой сорбента и ионами Ca2+ во внешнем растворе. Для этого 0.5 г образца в ${\text{NH}}_{4}^{ + }$-форме помещали в колбу с 50 мл 0.05 M CaCl2 на 30 мин при перемешивании (t = 20°C). Концентрацию Ca2+ в фильтрате определяли комплексонометрически.
Адсорбция формальдегида из водных растворов
Адсорбцию формальдегида геополимерными сорбентами в разных ионных формах определяли из водных растворов с концентрацией 0.064–0.366 M, приготовленных на основе раствора формалина (32% раствор формальдегида, АО “ЛенРеактив”, Россия). Время достижения адсорбционного равновесия (1 ч) устанавливали по кинетической кривой адсорбции формальдегида из 0.13 М раствора навеской сорбента (0.5 г) при времени контакта 0.5; 1; 2; 4 ч при 20°С. Количественное определение формальдегида проводилось с использованием сульфитного метода.
Количество адсорбируемого формальдегида (a, ммоль/г) рассчитывали по выражению:
где С0 – исходная концентрация сорбата в растворе (моль/л), Ср – равновесная концентрация сорбата в растворе (моль/л), V – объем раствора сорбата (л), m – массам сорбента (г).РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика образцов геополимеров
Рентгенограммы синтезированных образцов геополимеров (рис. 1) представлены в основном рефлексами цеолита А, гидроксисодалита, иллита, кварца и оказались относительно похожими для полученных образцов.
Рис. 1.
Рентгенограммы синтезированных образцов геополимеров: (а) G-14/100; (б) G-3/130; (в) G-Clin-3/130.

В табл. 1 представлены данные о фазовом составе образцов геополимеров, полученные из рентгенограмм.
Таблица 1.
Фазовый состав образцов геополимеров
| Образец геополимера | Содержание, % | Всего, % | ||||
|---|---|---|---|---|---|---|
| цеолит А | гидроксисодалит | гиббсит | иллит | кварц | ||
| G-14/100 | 70.0 | 10.6 | 7.8 | 7.5 | 4.2 | 100.1 |
| G-3/130 | 79.7 | 1.6 | 9.4 | 6.8 | 2.6 | 100.1 |
| G-Clin-3/130 | 69.4 | 13.9 | 5.2 | 6.6 | 4.9 | 100.0 |
Как следует из табл. 1, основной структурной составляющей в образцах геополимеров является фаза цеолита А. Повышение температуры от 100 до 130°С и одновременное сокращение времени (с 14 до 3 ч) синтеза незначительно повышает выход цеолита А для образца G-3/130 и практически не влияет на содержание цеолита А при введении клиноптилолита в качестве наполнителя. Другая цеолитовая фаза – гидроксисодалит, в заметном количестве отмечена только для образцов G‑14/100 (~10%) и G-Clin-3/130 (~14%), тогда как для образца G-3/130 отмечено снижение ее содержания (до 1.6%).
Фаза гидроксисодалита является более термодинамически стабильной, что способствует ее образованию при большем времени кристаллизации, например, как в случае с образцом G-14/100. При сокращении времени синтеза (для образца G-3/130) происходит снижение ее содержания. Однако, при введении 2% наполнителя клиноптилолита ее содержание снова возрастает.
В табл. 2 представлен химический состав образцов геополимеров, а также природного клиноптилолита, используемого в качестве наполнителя.
Таблица 2.
Химический состав геополимерных сорбентов и наполнителя
| Образец | Химический состав, мас. % | SiO2/(Al2O3 + + Fe2O3) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| SiO2 | Al2O3 | Na2O | MgO | K2O | CaO | TiO2 | Fe2O3 | ZrO2 | CuO + ZnO | SO3, Cl, P2O5 | Всего, % | ||
| G-14/100 | 38.8 | 43.4 | 15.5 | 0.2 | 0.8 | 0.3 | 0.2 | 0.6 | 0.1 | 0.04 | 0.05 | 99.99 | 0.9 |
| G-3/130 | 38.7 | 43.4 | 15.6 | 0.15 | 0.8 | 0.3 | 0.2 | 0.6 | 0.07 | 0.04 | 0.06 | 99.92 | 0,9 |
| G-Clin-3/130 | 40.7 | 42.7 | 13.9 | 0.2 | 0.9 | 0.4 | 0.2 | 0.7 | 0.1 | 0.06 | 0.13 | 99.99 | 0.9 |
| Clin | 68.1 | 12.2 | 0.7 | 0.9 | 3.9 | 3.9 | 0.2 | 1.3 | - | - | П.П.П. | 100.0 | 5.0 |
| 8.8 | |||||||||||||
По химическому составу образцы геополимеров отличаются высоким содержанием оксида алюминия, тогда как природный клиноптилолит, использованный в качестве наполнителя в образце G-Clin-3/130, высоко кремнистый. Как следствие, значение силикатного модуля для образца Clin в 5 раз выше, чем для образцов геополимеров.
Содержание оксидов щелочных и щелочноземельных металлов определяет ионы Na+ в качестве основных обменных катионов в образцах геополимеров, в то время как ионы Ca2+, K+ являются таковыми в образце природного клиноптилолита. Общее содержание оксидов щелочных и щелочноземельных металлов в образцах геополимеров (15–16%) превышает таковое для образца клиноптилолита (9.4%), что указывает на их большее высокую катионообменную способность, которая может быть использована в адсорбционных процессах.
Варьирование условий синтеза проявилось в изменении морфологических особенностей поверхности геополимерных сорбентов. На рис. 2 представлены изотермы адсорбции-десорбции азота образцами геополимеров, по которым судили о величине их удельной поверхности и пористости.
Как следует из рис. 2, S-образная форма и гистерезис на изотермах адсорбции-десорбции азота исследуемых образцов геополимеров и наполнителя соответствуют IV типу изотерм согласно классификации ИЮПАК, что характерно для мезопористых (2–50 нм) сорбентов. Начальный участок изотерм указывает на присутствие микропор, тогда как резкий подъем вблизи P/P0 = 1 обусловлен вкладом макропор. Форма гистерезиса последовательно меняется при переходе от образца G-3/130 к G-14/100 и затем G-3/130-Clin и Clin образцам, что свидетельствует об изменении формы и количества мезопор при изменении условий синтеза.
Слабее всего гистерезис выражен для образца G-3/130, для которого ветви гистерезиса расположены очень близко, а изотерма лежит ниже всех остальных. Очевидно, это обусловлено его слабой пористостью и как, следствие, слабой сорбционной активностью в отношении азота. Протяженная и ярко выраженная петля гистерезиса для образца G-14/100 говорит о развитии системы мезопор разного размера при более длительном осуществлении синтеза (14 ч при 100°С). Для образцов G-3/130-Clin и Clin вид изотерм и форма гистерезиса похожи, что, очевидно, определяется присутствием, свойствами и пористостью клиноптилолитового наполнителя, введение которого повышает количество сорбированного азота геополимерным образцом.
Значения объема пор и удельной поверхности (SBET), рассчитанные на основании изотерм адсорбции-десорбции азота представлены в табл. 3.
Таблица 3.
Удельная поверхность (SBET) и объем пор исследуемых алюмосиликатов
| Образец | SBET, м2/г | Объем пор, V × 103, см3/г | Диаметр пор, D, нм | |
|---|---|---|---|---|
| Vmicro | VΣ | |||
| G-14/100 | 13 | 2.0 | 30.0 | 4.8–25.0 |
| G-3/130 | 9 | 1.7 | 18.3 | 4.3–24.8 |
| G-Clin-3/130 | 16 | 2.4 | 38.0 | 5.0 |
| Clin | 31 | – | 107.0 | 16.2 |
Как следует из табл. 3, образцы геополимеров характеризуются не высокими значениями удельной поверхности и объемом пор. Сокращение длительности геотермального синтеза приводит к снижению удельной поверхности (образец G-3/130), т.к. при этом система пор не успевает развиться. Введение наполнителя, наоборот, несколько повышает объем пор и удельную поверхность.
Распределение пор по размерам (рис. 3) указывает на отсутствие предпочтительного диаметра пор в образцах G-14/100 и G-3/130 и его варьирование в диапазоне 5–25 нм. После добавления клиноптилолита геополимерный материал приобретает некоторую долю мезопор с диаметром около 5 нм.
SEM-фотографии поверхности синтезированных образцов геополимеров (рис. 4а–4е) иллюстрируют присутствие кристаллитов размером около 1 мкм, очевидно, кристаллитов цеолита А в качестве основных морфологических элементов, формирующих рельеф поверхности. Транспортные поры представлены макропорами неправильной формы, доля и размер которых, очевидно, увеличиваются для образца G-3/130 (рис. 4в–4г). Мезо- и микропористость неразличима при использованном разрешении снимков.
Рис. 4.
SEM-фотографии поверхности образцов геополимеров: (а, б) G-14/100; (в, г) G-3/130; (д, е) G-Clin-3/130.

Адсорбционные свойства геополимеров в водных растворах формальдегида
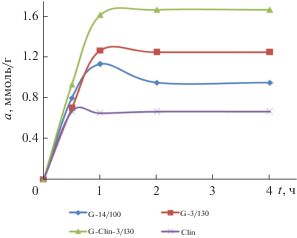
Кинетические кривые адсорбции формальдегида исследуемыми сорбентами представлены на рис. 5. Адсорбционное равновесие установилось в течение 1 ч для образцов G-14/100, G-3/130, G‑Clin-3/130 и через 0.5 ч для образца Clin, что вполне согласуется с более крупным размером частиц и меньшим диаметром пор образцов геополимеров в сравнении с образом клиноптилолита (табл. 3). Однако, рост значений адсорбции формальдегида (ммоль/г) из 0.13 М водного раствора в ряду Clin (0.67) < G-14/100 (0.95) < G-3/130 (1.25) < G-Clin-3/130 (1.67) не согласуется со значениями удельной поверхности и характеристиками пористости сорбентов (табл. 3). Вероятно, сорбционные центры поверхности геополимеров обладают более высокой активностью к сорбату по сравнению с таковыми для образца Clin, несмотря на их меньшую доступность.
Экспериментальные изотермы адсорбции формальдегида (рис. 6) обнаружили присутствие максимума поглощения в диапазоне концентраций 0.13–0.2 моль/л для всех образцов алюмосиликатов за исключением G-3/130.
Рис. 6.
Изотермы адсорбции формальдегида из водных растворов образцами геополимеров и клиноптилолита.

Согласно классификации Ч. Гильса [25, 26], такой вид изотерм соответствует типу S5, для которых характерен вогнутый начальный участок и наличии максимума, обусловленного сильным взаимодействием между молекулами адсорбтива с одновременным ослаблением взаимодействия “адсорбтив-адсорбент”, а также изменением состояния растворенного вещества при повышении его концентрации. Действительно, в водных растворах молекулы формальдегида представлены в виде его гидратной формы (НО–СН2–ОН), склонной к образованию димеров и полимеров (параформ) [27]. С уменьшением количества воды, а также при наличии каталитического эффекта структурных элементов матрицы алюмосиликата (Бренстедовские и Льюисовские центры), количество полимерной формы формальдегида существенно возрастает.
Сравнение адсорбционной способности геополимеров с таковой для других природных алюмосиликатов, как глинистые минералы (палыгорскит, нонтронит, каолинит) [23], цеолиты [24] в водных растворах формальдегида показывает, что их адсорбционная емкость в 2–2.5 раза выше. Вероятнее всего, более высокие значения катионообменной емкости геополимеров (~5 ммоль/г) по сравнению с природным клиноптилолитом (~1.5 ммоль/г) или монтмориллонитом (~0.7 ммоль/г) могут способствовать большей адсорбции формальдегида в связи с их большим поляризующим воздействием.
Для подтверждения данного предположения, были определены значения катионообменной емкости сорбентов в различных ионных формах, а также величины адсорбции формальдегида полученными сорбентами (табл. 4).
Таблица 4.
Катионообменная емкость и адсорбционная способность геополимеров в различных ионных формах из 0.2 М раствора формальдегида
| Образец | КОЕ, ммоль-экв/г | Адсорбция формальдегида, ммоль/г | ||
|---|---|---|---|---|
| ионная форма | ||||
| Na+ | Cu2+ | ${\text{NH}}_{4}^{ + }$ | ||
| G-14/100 | 2.03 | 0.81 | 1.69 | 1.69 |
| G-3/130 | 2.67 | 1.06 | 1.31 | 1.94 |
| G-Clin-3/130 | 2.72 | 1.94 | 1.06 | 2.94 |
| Clin | 0.82 | 1.56(Ca2+) | 3.94 | 1.00 |
Как следует из табл. 4, образцы геополимеров действительно обладают более высокими (в 2–3 раза) значениями КОЕ по сравнению с исследованным образцом клиноптилолита, что обусловлено соотношением компонентов при синтезе образцов. При переходе от образца G-14/100 к G-Clin-3/130 значения КОЕ несколько увеличиваются, что может быть обусловлено как доступностью ионообменных центров, так и изменением в фазовом составе образцов.
Адсорбция формальдегида геополимерными сорбентами в Na+- и ${\text{NH}}_{4}^{ + }$-формах возрастает при повышении КОЕ сорбентов, причем для ${\text{NH}}_{4}^{ + }$-формы сорбентов значения адсорбции и КОЕ близки, что может свидетельствовать о стехиометрическом взаимодействия формальдегида с ионами ${\text{NH}}_{4}^{ + }$ с образованием имина (а также уротропина) и преимущественном вкладе химического механизма в сорбционный процесс. Влияние Na-формы проявляется, главным образом, в усилении поляризующего действия обменных катионов на гидроксильные группы гидратов формальдегида и увеличении их поглощения по механизму физической адсорбции за счет усиления взаимодействий в сетке водородных связей поляризованных молекул воды и молекул сорбата.
Обратная зависимость значений адсорбции формальдегида от КОЕ была получена для сорбентов в Cu2+-форме: наибольшая адсорбция формальдегида получена для образца природного клиноптилолита и наименьшая для образца G‑Clin-3/130. Вероятно, что ионы Cu2+ координируют вокруг себя несколько молекул гидратов формальдегида и образуют крупные комплексы, чему способствовали более широкие поры клиноптилолита по сравнению с таковыми для образцов геополимеров.
ЗАКЛЮЧЕНИЕ
Образцы геополимерных сорбентов на основе метакаолина, полученные геотермальным синтезом, проявили высокую адсорбционную способность к молекулам формальдегида в водных растворах. Повышение температуры и снижение длительности синтеза геополимеров, а также введение в качестве наполнителя природного цеолита клиноптилолита незначительно повлияло на изменение морфологических характеристик сорбентов – удельная поверхность и пористость несущественно варьировались. Решающим в обеспечении адсорбционной способности геополимеров к формальдегиду явилась величина катионообменной емкости сорбентов, которая в 2–3 раза превышала таковую для образца природного клиноптилолита. При этом, природа обменного катиона также определяла величину и, вероятно, преимущественный механизм сорбционного поглощения формальдегида. Возрастание величины катионообменной емкости сорбентов в Na+-форме проявилось в симбатном увеличении адсорбции формальдегида за счет усиления поляризующего действия обменных катионов на гидроксильные группы гидратов формальдегида и молекул воды. ${\text{NH}}_{4}^{ + }$-форма обеспечила преимущественно химическую адсорбцию формальдегида в стехиометрическом количестве. Cu2+-форма геополимеров, наоборот, обусловила более низкие значения адсорбции формальдегида в виде координационного соединения, молекулы которого по стерическим причинам сорбировались в большей степени образцом клиноптилолита, чем геополимерами.
Авторы выражают благодарность Грантовому агентству Чешского научного фонда за финансовую поддержу исследований в рамках проекта № 16-13778S.
Список литературы
Geopolymers: structure, processing, properties and industrial application. Ed. Provis J.L., van Deventer J.S.J. Woodhead Publishing Limited, Cambridge, UK, 2009. 464 p.
Чекмарев А.С., Сео Д.К., Скорина Т.В., Чекмарева Г.Д. // Вестник Казанского технологического университета. 2012. Т. 15. № 20. С. 50–55.
Al Bakri Abdullah M.M., Yun Ming L., Cheng Yong H., Mohd Tahir M.T. // InTechOpen, 2018. https://doi.org/10.5772/intechopen.74438
Skvara F. // Ceramics – Silikáty. 2007. V. 51. № 3. P. 173–177.
Davidovits J. Geopolymer Cement, a review, 2013. https://www.geopolymer.org/fichiers_pdf/GPCement2013.pdf
Burduhos Nergis D.D., Abdullah M.M.A.B., Vizureanu P., Tahi M.F.M. // IOP Conf. Ser.: Mater. Sci. Eng. 374 (2018) 012019 https://doi.org/10.1088/1757-899X/374/1/012019
Kolousek D., Brus J., Urbanova M., Andertova J., Hulinsky V., Vorel J. // J. Mater. Sci. 2007. V. 42. P. 9267–9275. https://doi.org/10.1007/s10853-007-1910-5
Naghsh M., Shams K. // Applied Clay Science. 2017. V. 146. P. 238–245.
Luukkonen T., Sarkkinen M., Kemppainen K., Ramo J., Lassi U. // Applied Clay Science. 2016. V. 119. P. 266–276. Part 2. https://doi.org/10.1016/j.clay.2015.10.027
Perna I., Hanzlíček T. // J. Cleaner Production. 2014. V. 84. P. 657–662.
Bassam I. El-Eswed, 2018. Solidification Versus Adsorption for Immobilization of Pollutants in Geopolymeric Materials: A Review, Solidification Alicia Esther Ares, IntechOpen, p. 77–110. https://doi.org/10.5772/intechopen.72299. Available from: https://www.intechopen.com/books/solidification/solidification-versus-adsorption-for-immobilization-of-pollutants-in-geopolymeric-materials-a-review10.5772/intechopen.72299
Alshaaera M., Zaharaki D., Komnitsas K. // Desalination and Water Treatment. 2014. P. 1–8. https://doi.org/10.1080/19443994.2014.938306
Yousef, R.I., El-Eswed B., Alshaaer M., Khalili F., Khoury H. // J. Hazardous materials. 2009. V. 165. № 1–3. P. 379–387.
Fallah M., Kenneth J.D. MacKenzie, John V. Hanna, Samuel J. // J Mater Sci. 2015. V. 50. № 22. P. 7374–7383. https://doi.org/10.1007/s10853-015-9295-3
Cheng T.W., Lee M.L., Ko M.S., Ueng T.H., Yang S.F. // Applied Clay Science. 2012. V. 56. P. 90–96.
Luukkonen T., Runtti H., Niskanen M., Emma-Tuulia Tolonen E-T., Sarkkinen M., Kemppainen K., Rämö J., Lassi U. // J. Environmental Management. 2016. V. 166. P. 579–588. https://doi.org/10.1016/j.jenvman.2015.11.007
Herman C.C., Marra S., Spearing D.R., Vance L., Vienna J.D. // Environmental Issues and Waste Management Technologies in the Ceramic and Nuclear Industries in XI: Proceedings of the 107th Annual Meeting of The American Ceramic Society, Baltimore, Maryland, USA 2005, Ceramic Transactions, V. 176. John Wiley & Sons, 2012. 260 p.
Huang Y., Han M. // J. Hazardous Materials. 2011. V. 193. P. 90–94.
WHO Guidelines for Indoor Air Quality: Selected Pollutants. Geneva, World Health Organization, 2010.
Zhang L. // Formaldehyde: Exposure, Toxicity and Health Effects. Royal Society of Chemistry, 2018. 389 p.
Гигиенические нормативы ГН 2.1.6.1338-03 “Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест”.
Гигиенические нормативы ГН 2.1.5.1315-03. “Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования”.
Novikova L., Belchinskaya L. // Adsorption of industrial pollutants by natural and modified aluminosilicates in G.M. do Nascimento (ed.) Clays, Clay Minerals and Based Ceramics Clay Minerals, InTechOpen, 2016. P. 89–128.
Bel’chinskaya L.I., Khodosova N.A., Strel’nikova O.Yu., Petukhova G.A., Ciganda L. // Protection of Metals and Physical Chemistry of Surfaces. 2015. V. 51. № 5. P. 779–786.
Giles C.H., Smith D., Huitson A. // J. Colloid and Interface Science. V. 47. № 3. 1974. P. 755–765. https://doi.org/10.1016/0021-9797(74)90252-5
Практикум по физической химии НГУ. Химическая термодинамика и кинетика. Адсорбция из растворов на твердой поверхности: метод. пособие / О.В. Нецкина; Новосиб. гос. ун-т. Новосибирск: РИЦ РГУ, 2015. 17 с.
Уокер Дж.Ф. Формальдегид. Пер. со 2-го изд. (Нью Йорк: American Chemical Society Monograph Series, 1953) M.: Госхимиздат, 1957. 608 с.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов