Физикохимия поверхности и защита материалов, 2019, T. 55, № 5, стр. 507-512
Кинетика адсорбции ионов никеля(II) и меди(II) модифицированными алюмосиликатами
Е. Г. Филатова 1, *, Ю. Н. Пожидаев 1, О. И. Помазкина 1
1 Иркутский национальный исследовательский технический университет
Иркутск, Россия
* E-mail: efila@list.ru
Поступила в редакцию 16.08.2018
После доработки 13.04.2019
Принята к публикации 15.04.2019
Аннотация
Изучена кинетика адсорбции ионов никеля(II) и меди(II) алюмосиликатами, модифицированными N,N'-бис(3-триэтоксисилилпропил)тиокарбамидом (БТМ-3) и НСl с использованием кинетических моделей псевдопервого и псевдовторого порядков. Показано, что при модификации алюмосиликатов, сокращается время установления равновесия. В 1.33 раза при адсорбции ионов меди(II) и в 2 раза для ионов никеля(II). Увеличивается скорость и энергия адсорбции. Установлено, что кинетику адсорбции исследуемых ионов наилучшим образом описывает модель всевдовторого порядка. Значения коэффициентов корреляции составило при этом 0.997–0.998. Максимальное значение константы скорости адсорбции 33.7 × 10–5 г/(ммоль мин) соответствует ионам никеля(II) для алюмосиликатов, модифицированных НСl. Начальная скорость адсорбции составила при этом 8.70 × 10–3 ммоль/(г мин). Ионам Cu(II) соответствует максимальное значение константы скорости адсорбции 2.91 × 10–5 г/(ммоль мин) для алюмосиликатов, модифицированных БТМ-3.
ВВЕДЕНИЕ
Непрерывно возрастающее негативное воздействие антропогенной нагрузки на природную среду влечет за собой создание приоритетных технологий рационального использования природных ресурсов. А также повышение экологической безопасности производства в целом. При этом использование природных материалов – алюмосиликатов, в качестве недорогих адсорбентов весьма перспективно и экологически оправдано. К эффективным показателям практического применения адсорбентов можно отнести их стоимость, адсорбционную емкость, время наступления равновесия в системе адсорбат-адсорбент, скорость адсорбции и др. Результаты исследования кинетики адсорбции ионов токсичных металлов представлены в работах [1–3, 6–8].
В работе [1] исследована кинетика адсорбции ионов Pb(II), Cu(II) и Zn(II) природным цеолитным туфом из Марамуреша Каунти (Северная Румыния) при температурах 25 и 50°С. В результате изучения кинетики адсорбции исследуемых ионов тяжелых металлов были получены различные кинетические модели (псевдопервого порядка, псевдовторого порядка и Weber–Morris). При этом наилучшие результаты получены при использовании модели псевдопервого порядка.
Авторами [2] изучена конкурентная адсорбция ионов Cd(II), Cu(II), Ni(II) и Pb(II) из промышленных сточных вод с использованием иранского природного алюмосиликата. Изучение скорости адсорбции и установления равновесия проводили на одно- и многокомпонентных растворах. Оптимальные условия процесса очистки исследованы путем наблюдения за влиянием рН, присутствием конкурирующих ионов, изменением массы алюмосиликата и различным временем контакта. Кинетику адсорбции на алюмосиликате описывали реакцией первого порядка, показывающей, что удаление около 100% ионов Pb(II) происходит в течение 40 мин, а достижение равновесного состояния для ионов Cd(II), Cu(II), Ni(II) в течение 24 ч.
В работе [3] дана оценка использования каолина и бентонита в качестве материалов для наноразмерного нуль-валентного железа, применяемого для одновременного удаления ионов Cu(II) и Zn(II) из водного раствора. Из трех составляющих наиболее эффективным для одновременного удаления ионов Cu(II) и Zn(II) оказался бентонит. Из водного раствора, содержащего 100 мг/дм3 ионов Cu(II) и Zn(II), удалено 92.9% – Сu и 58.3% – Zn. Исследования кинетики показали, что удаление Cu(II) и Zn(II) наноразмерным материалом хорошо согласуется с моделью псевдопервого порядка.
Известно, что адсорбционную емкость природных адсорбентов можно увеличить, используя модифицирование адсорбентов [4, 5]. Авторами в работе [6] использован иранский природный клиноптилолит туфа, который предварительно обработан и измельчен на микро- и наночастицы механическим способом. Модифицирование микро- и наночастиц, а также их Ni-замещенных форм проведено с помощью диметилглиоксима (ДMГ). Удаление ионов Ni(II) на модифицированных и немодифицированных образцах исследованы периодическим способом. Обнаружено, что наночастицы модифицированные (ДМГ) имеет более высокую способность к удалению ионов Ni(II). Сравнение двух кинетических моделей показывает, что кинетическая адсорбция может быть хорошо описана уравнением псевдо- второго порядка, которое указывает, что ограничение скорости процесса связано с химической реакцией.
В публикации [7] авторы получили композитный материал, содержащий альгинат кальция, клиноптилолит, уголь, гуминовые кислоты. Полученные образцы изучены в качестве адсорбентов для удаления кадмия, ртути и свинца. Данные для каждого иона металла на всех адсорбентах показали хорошее соответствие кинетической модели псевдо-второго порядка. Равновесные данные установлены с помощью моделей Лэнгмюра, Фрейндлиха, Дубинина–Радушкевича и изотермы Темкина.
В исследовании [8] изучена возможность использования синтетического цеолита 4А для удаления ионов Cu(II) из водных растворов. Исследовано влияние рН и температуры на процесс адсорбции. Оптимальное значение рН адсорбции равно 8. Скорость реакции описывали моделью псевдовторого порядка. Эксперименты по адсорбции ионов Cu(II) проводили при комнатной температуре 25°С, для описания изотермы использовали уравнения Лэнгмюра и Фрейндлиха. Максимальное удаление меди, полученное из серии исследований, составило 99.99%.
Из краткого обзора представленных работ следует, что кинетику адсорбции на природных алюмосиликатах наилучшим образом описывает модель псевдопервого порядка, для модифицированных и синтетических образцов – преимущественно псевдовторого порядка. Целью работы явилось исследование кинетики адсорбции ионов Ni(II) и Cu(II) из водных растворов модифицированными алюмосиликатами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объекта исследования использовали природные алюмосиликаты Забайкальского месторождения. В экспериментах использовали предварительно отсеянную на сите фракцию размером 1.0 мм.
Рентгенофазовый анализ проводили на автоматизированном рентгеновском дифрактометре D8 ADVANCE, оснащенном зеркалом Гёбеля и детектором VÅNTEC-1 PSD. Съемку проводили в пошаговом режиме в диапазоне углов 20 от 5 до 70 град, с использованием Cu-излучения. Расчет рентгенограммы выполнен с помощью программного обеспечения дифрактометра. Для идентификации фаз использовали базу порошковых дифрактограмм PDF-2. Содержание минеральных компонентов в пробе рассчитано по программе TOPAS.
Модифицирование алюмосиликатов осуществляли следующим образом: 10 г алюмосиликата контактировали при перемешивании с 100 г 30%-ного раствора N,N'-бис(3-триэтоксисилилпропил)тиокарбамида (БТМ-3) в гексане [9]. Перемешивание осуществляли в течение 3 ч при температуре 50°С. По истечении указанного времени, алюмосиликат отделяли от раствора, высушивали на воздухе и выдерживали в сушильном шкафу в течение 1 часа при 110°С. Полученный продукт охлаждали в вакуум-эксикаторе и определяли изменение массы в процессе модификации.
Модификацию алюмосиликатов НСl осуществляли в соответствии с методикой: 10 г высушенных до постоянной массы при температуре 120–150°С алюмосиликатов перемешивали 24 ч с 200 мл 12%-ного раствора HCl в воде. Затем суспензию фильтровали и промывали дистиллированной водой до нейтральной реакции. Полученные модифицированные алюмосиликаты сушили до постоянной массы и анализировали на содержание основных элементов. При этом увеличение массы алюмосиликата составило 20%.
Кинетику адсорбции модифицированных алюмосиликатов изучали в статических условиях. В работе использовали модельные растворы, приготовленные из реактивов NiSO4 ⋅ 7H2O и CuSO4 ⋅ ⋅ 5H2O квалификации “х. ч.” и дистиллированную воду. Содержание ионов металлов в растворах определяли по стандартным методикам [10, 11]. Исходная концентрация ионов Ni(II) составила 160 мг/дм3, Cu(II) – 120 мг/дм3. Масса исследуемых адсорбентов – 1 г. Исследуемые растворы готовили объемом 0.1 дм3. Массовое отношение жидкой и твердой фаз составляло 1 : 100. Величину адсорбции (А, ммоль/г) вычисляли по формуле:
где С0 и Сравн – исходная и равновесная концентрации металла в растворе, ммоль/дм3; V – объем раствора, дм3; m – масса адсорбента, г.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно результатам рентгенофазового исследования установлено, что образец алюмосиликатной породы состоит из гейландита Ca[Al2Si7O18] · 6H2O – 64.3%, а также примесной породы – санидина КАlSi3O8 – 20.5% и кристобалита SiO2 – 15.2% (рис. 1).
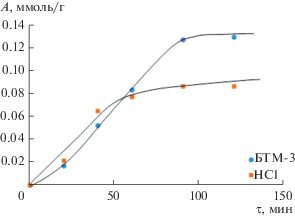
Исследование кинетики адсорбции проводили с помощью построения и обработки кинетических кривых (рис. 2 и 3).
Адсорбционное равновесие, отвечающее постоянству составу концентраций ионов металлов в системе адсорбат-алюмосиликат, составило 60 мин для ионов Ni(II) (рис. 2) и 90 мин для Cu(II) (рис. 3). В случае природных алюмосиликатов время достижение равновесия при адсорбции ионов Ni(II) и Cu(II) составляло 120 мин [12]. Как видно, из представленных данных (рис. 3) алюмосиликаты, модифицированные БТМ-3, значительно лучше адсорбируют ионы Cu(II). Высокое значение адсорбции в данном случае, можно объяснить благодаря присутствию в составе аппрета химически-активных тиокарбамидных групп, исследуемый процесс в этом случае сопровождается образованием на поверхности материала устойчивых координационных соединений [13], что обусловливает большую эффективность таких материалов. Если сравнивать их адсорбируемость с алюмосиликатами, модифицированными НСl, то величина адсорбции для БТМ-3 возрастает в 1.5 раза. Если сравнивать с природными аналогами [12] – в 1.7 раза. Значение адсорбции ионов Ni(II) модифицированными образцами расходятся незначительно (рис. 2 и табл. 1). Если сравнивать величину адсорбции для природных [12] и модифицированных алюмосиликатов, то ее значение увеличивается в последнем случае более чем в 2 раза.
Таблица 1.
Величина адсорбции модифицированных алюмосиликатов
| Ионы | Модифицированные БТМ-3 | Модифицированные HCl | ||
|---|---|---|---|---|
| А, ммоль/г | А, мг/г | А, ммоль/г | А, мг/г | |
| Ni(II) | 0.214 | 12.6 | 0.197 | 11.6 |
| Cu(II) | 0.128 | 8.1 | 0.085 | 5.4 |
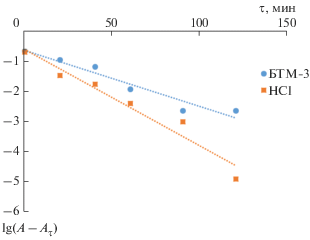
Кинетику адсорбции обычно описывают уравнением псевдопервого порядка
(2)
$\lg \left( {А - {{А}_{\tau }}} \right) = \lg А - {{k\tau } \mathord{\left/ {\vphantom {{k\tau } {2.303}}} \right. \kern-0em} {2.303}},$Для определения константы скорости адсорбции k и коэффициента корреляции R2 использованы линейные зависимости lg (А – Аτ) = = f(τ) (рис. 4 и 5).
По тангенсу угла наклона, представленных зависимостей (рис. 4 и 5) получены значения константы скорости адсорбции для ионов Ni(II) и Cu(II). Определены коэффициенты корреляции (табл. 2).
Таблица 2.
Константы скорости уравнения псевдопервого порядка
| Ионы | Модифицированные БТМ-3 | Модифицированные HCl | ||
|---|---|---|---|---|
| k × 102, мин–1 | R2 | k × 102, мин–1 | R2 | |
| Ni(II) | 1.85 | 0.947 | 3.18 | 0.950 |
| Cu(II) | 2.28 | 0.958 | 0.72 | 0.936 |
Максимальное значение константы скорости адсорбции 3.18 × 10–2 мин–1 соответствует ионам Ni(II), минимальное 0.72 × 10–2 мин–1 – Cu(II). Значение коэффициента корреляции варьируется от 0.936 до 0.958. Отсюда можно сделать заключение, что кинетику адсорбции ионов Ni(II) и Cu(II) модифицированными образцами можно описывать уравнением псевдовторого порядка.
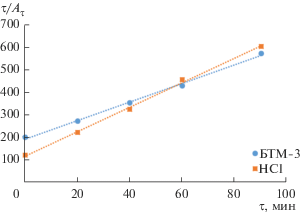
Уравнение адсорбции псевдовторого порядка
По величине отрезков, полученных при пересечении представленных прямых с осью ординат (рис. 6 и 7), определены значения начальной скорости адсорбции и константы скорости псевдовторого порядка для ионов Ni(II) и Cu(II). Получены коэффициенты корреляции (табл. 3).
Таблица 3.
Константы скорости уравнения псевдовторого порядка
| Ионы | Модифицированные БТМ-3 | Модифицированные HCl | ||||||
|---|---|---|---|---|---|---|---|---|
| 1/h | h × 103, ммоль/(г мин) | k × 105, г/(ммоль мин) | R2 | 1/h | h × 103, ммоль/(г мин) | k × 105, г/(ммоль мин) | R2 | |
| Ni(II) | 190 | 5.26 | 24.1 | 0.998 | 115 | 8.70 | 33.7 | 0.998 |
| Cu(II) | 563 | 1.78 | 2.91 | 0.997 | 517 | 1.93 | 1.40 | 0.998 |
Начальная скорость адсорбции ионов Ni(II) составила 8.70 × 10–3 ммоль/(г мин) алюмосиликатами, модифицированными HCl, и 5.26 × × 10–3 ммоль/(г мин) – для образцов, модифицированных БТМ-3. Максимальное значение константы скорости адсорбции 33.7 × 10–5 г/(ммоль мин) соответствует ионам Ni(II), минимальное 1.40 × 10–5 г/(ммоль мин) – Cu(II) для модификаций HCl. Значение коэффициента корреляции составляет 0.997–0.998. Отсюда можно сделать заключение, что адсорбция ионов Ni(II) и Cu(II) модифицированными алюмосиликатами может быть описана уравнением всевдовторого порядка. Ранее установлено, что адсорбцию ионов Ni(II) и Cu(II) на алюмосиликатах, модифицированных БТМ-3, наиболее адекватно описывает модель адсорбции Ленгмюра и Фрейндлиха [9]. При модификации НСl наиболее применима модель адсорбции Ленгмюра [14].
Таким образом, установлено, что при модифицировании алюмосиликатов, сокращается время установления адсорбционного равновесия. В 1.33 раза при адсорбции ионов Cu(II) и в 2 раза для ионов Ni(II). Увеличивается скорость и энергия адсорбции. Так значение свободной энергии адсорбции ионов Ni(II) 17.74 и 12.50 кДж/моль для Cu(II), указывают на ионообменный механизм [9, 15], а закрепление ионов тяжелых металлов имеет химическую природу.
ВЫВОДЫ
1. Изучена кинетика адсорбции ионов Ni(II) и Cu(II) алюмосиликатами, модифицированными БТМ-3 и НСl с использованием кинетических моделей псевдопервого и псевдовторого порядков.
2. Показано, что при модификации алюмосиликатов, сокращается время установления равновесия. В 1.33 раза при адсорбции ионов Cu(II) и в 2 раза для ионов Ni(II). Увеличивается скорость и энергия адсорбции.
3. Установлено, что кинетику адсорбции исследуемых ионов модифицированными алюмосиликатами наилучшим образом описывает модель всевдовторого порядка. Значения коэффициентов корреляции составило при этом 0.997–0.998.
4. Максимальное значение константы скорости адсорбции 33.7 × 10–5 г/(ммоль мин) соответствует ионам Ni(II) для алюмосиликатов, модифицированных НСl. Начальная скорость адсорбции составила при этом 8.70 × 10–3 ммоль/(г мин).
5. Ионам Cu(II) соответствует максимальное значение константы скорости адсорбции 2.91 × × 10–5 г/(ммоль мин) для алюмосиликатов, модифицированных БТМ-3. Начальная скорость адсорбции составила при этом 1.78 × 10–3 ммоль/(г мин).
Работа выполнена при финансовой поддержке проекта Российского фонда фундаментальных исследований 18-08-00718.
Список литературы
Smical I. // AACL Bioflux. 2011. V. 4. № 4. P. 481.
Merrikhpour H., Jalali M. // Clean Technologies and Environmental Policy. 2013. V. 15. № 2. P. 303.
Shi L.-N., Zhou Y., Chen Z., Megharaj M., Naidu. R. // Environmental Science and Pollution Research. 2013. V. 20. № 6. P. 3639.
Mthombo T.S., Mishra A.K., Mishra S.B., Mamba B.B. // J. Applied Polymer Science. 2011. V. 121. № 6. P. 3414.
Liang Y.M., Yu L., Hua T.J., Cong S. // Advanced Materials Research. 2011. V. 299–300. P. 764.
Nezamzadeh-Ejhieh A., Kabiri-Samani M. // J. Hazardous Materials. 2013. V. 260. № 9. P. 339.
Dogan H. // Toxicological and Environmental Chemistry. 2012. V. 94. № 3. P. 482.
Dizadji N., Vossoughi S.S.S., Dehpouri S. // Chemical Engineering Transactions. 2012. V. 29. № 3. P. 1519.
Помазкина О.И., Филатова Е.Г., Пожидаев Ю.Н. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 3. С. 255.
Лурье Ю.Ю., Рыбникова А.И. Химический анализ производственных сточных вод. М.: Химия, 1974. 336 с.
Марченко З. Фотометрическое определение элементов. М.: Мир, 1971. 502 с.
Филатова Е.Г., Пожидаев Ю.Н., Помазкина О.И. // Физикохимия поверхности и защита материалов. 2016. Т. 52. № 3. С. 285.
Физическая химия адсорбционных явлений / А.Ю. Цивадзе, А.И. Русанов, А.А. Фомкин и др. М.: Граница, 2011. 304 с.
Филатова Е.Г., Помазкина О.И., Пожидаев Ю.Н. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 6. С. 596.
Filatova E.G., Pomazkina O.I., Pozhidaev Y.N. // J. Water Chem. Technol. 2014. V. 36. № 6. P. 303.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов