Физикохимия поверхности и защита материалов, 2019, T. 55, № 6, стр. 568-572
Изучение влияния наличия и расположения функциональных групп на поверхности углеродного сорбента на адсорбцию азотсодержащих соединений
Д. Д. Матюшин 1, *, А. Н. Уклеина 1, И. А. Полунина 1, А. К. Буряк 1
1 ФГБУ науки Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119071 Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: dm.matiushin@mail.ru
Поступила в редакцию 30.01.2019
После доработки 28.02.2019
Принята к публикации 04.03.2019
Аннотация
Изучение физикохимии адсорбции на углеродных сорбентах представляет собой важную задачу с теоретической и практической точки зрения. На термодинамику адсорбции влияют дефекты поверхности сорбента, в том числе кислородсодержащие функциональные группы. В рамках данной работы выполнено моделирование адсорбции ряда ароматических и алифатических аминов и нитрилов на поверхности графитированной термической сажи методом Монте-Карло. Результаты расчета сопоставлены с результатами экспериментов. Рассмотрены случаи одиночного и парного расположения функциональных групп, выявлены закономерности взаимодействия разных классов азотсодержащих соединений с такими дефектами. На основе сравнения с экспериментальными данными сделаны предположения о наличии и распределении гидроксилов на поверхности графитированной термической сажи.
ВВЕДЕНИЕ
Поверхность углеродных сорбентов часто рассматривают как плоскую, однородную, состоящую из sp2-гибридизированных атомов углерода [1]. В то же время на практике известно, что на поверхности активных углей, графитированных саж, углеродных нанотрубок имеются дефекты и остаточные ковалентно связанные полярные функциональные группы [2–4]. Точные строение и природа таких функциональных групп зачастую неизвестны. Одним из методов изучения наличия и распределения функциональных групп на поверхности углеродного сорбента является молекулярно-динамическое моделирование и сопоставление результатов расчета с экспериментальными данными по адсорбции. Такие работы выполнялись для саж [2, 3], для активных углей [5], для углеродных нанотрубок [4].
Хроматография является экспрессным и надежным методом измерения константы адсорбции при малых степенях заполнения поверхности. Сочетание хроматографии с другими физико-химическими методами, в частности вычислительными, является распространенным способом исследования физикохимии поверхности различных веществ, в том числе углеродных [6, 7]. Изучение физикохимии адсорбционных взаимодействий на поверхности углеродных материалов имеет большое значение, так как такие соединения широко используются в аналитической химии [8] и для поглощения вредных соединений, включая азотсодержащие экотоксиканты [9, 10].
Целью данной работы является изучение адсорбции азотсодержащих соединений на графитированной термической саже, содержащей полярные функциональные группы на своей поверхности; оценка влияния наличия поверхностной концентрации и расположения функциональных групп на адсорбцию. Изучение проводится посредством сравнения результатов моделирования с литературными экспериментальными данными.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Моделирование выполнялось в классическом атом-атомном приближении. Взаимодействие Ван-дер-Ваальса азотсодержащих молекул и sp2-атомов углерода базисной грани графита описывалось атом-атомными потенциалами в форме Леннард-Джонса. Использованы параметры и правила смешивания из работы [11]. Для атомов углерода использовались параметры ε = 0.295 кДж/моль; r = 1.908 Å. Из литературы известно [12], что глубина потенциальной ямы при взаимодействии с атомами графита несколько меньше, чем для ароматических атомов углерода. Данные параметры были выбраны после предварительной оптимизации с использованием данных по адсорбции молекул этана и метана [1].
Внутримолекулярная энергия, а также заряды атомов оценивались в соответствии с алгоритмом [13] без каких-либо изменений. Для атомов, составляющих функциональные группы на поверхности сорбента, принимались стандартные для этой модели параметры потенциалов Ван-дер-Ваальса, соответствующие атомам гидроксила, соединенного с ароматической системой.
В качестве функциональных групп рассматривались неподвижные жесткие гидроксильные группы. Атом кислорода принимался расположенным на расстоянии 1.4 Å от поверхности базисной грани. Угол между связью O–H и базисной гранью составлял 18.5°. Длина связи O–H составляла 1.4 Å. Заряд атомов кислорода и водорода был принят равным +0.5 и –0.5, соответственно. Такие (и близкие к таким) параметры функциональных групп на графитоподобной поверхности использовались в работах [2, 4].
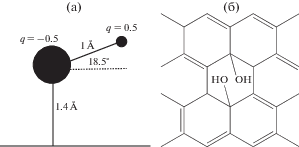
Рассматривались как одиночные функциональные группы, так и расположенные парами друг напротив друга. На рис. 1 показана схема гидроксила на плоской поверхности сорбента и схема расположения пары гидроксилов.
Рис. 1.
Использованная модель функциональной группы (O–H) (а) – на поверхности сорбента и (б) – пример парного расположения функциональных групп.
Поверхность предполагалась равномерно заполненной атомами углерода [1, 14], использовалось аналитическое интегрирование по поверхности графитового листа. Детальное строение функциональной группы и соседних с ней атомов углерода не рассматривалось.
Все расчеты проведены для температуры 473 К. Моделирование велось с помощью алгоритма Метрополиса. В качестве шагов алгоритма Метрополиса использовались изменение молекулы сорбата во внутренних координатах (поворот вокруг одинарных связей, изменение длин связей и углов) и перемещение молекулы как целого.
Экспериментальные данные взяты из работы [15]. Данные о константах Генри адсорбции получены с помощью газовой хроматографии на предварительно обработанной водородом графитированной саже при высокой температуре.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 приведено схематическое изображение расположения функциональных групп на поверхности сорбента. Расстояние между функциональными группами варьировалось в пределах 15–60 Å для одиночных гидроксилов и 60–120 Å для пар гидроксилов (расстояние между соседними парами). В табл. 1 приведены экспериментальные константы Генри, результаты расчета константы Генри адсорбции на графитированной термической саже (ГТС) для всех рассмотренных соединений при различных концентрациях гидроксилов на поверхности.
Таблица 1.
Константы Генри адсорбции (ln K1 [см3/м2]) на графитированной саже для азотсодержащих соединений при 473 К: экспериментальные данные и расчеты для различного расположения и поверхностной концентрации функциональных групп на поверхности сорбента (1/Å2). I — одиночные функциональные группы; II — функциональные группы, расположенные парами друг напротив друга (см. рис. 1, 2). Также приведены коэффициенты корреляции между расчетными и экспериментальными данными
| Соединение | Эксперимент | I | II | ||||
|---|---|---|---|---|---|---|---|
| 0 | 3 × 10–4 | 0.001 | 0.004 | 10–4 | 0.0006 | ||
| Октиламин | 1.63 | 2.74 | 3.10 | 3.43 | 3.87 | 3.68 | 4.31 |
| Дециламин | 3.54 | 5.06 | 5.52 | 5.82 | 6.29 | 5.77 | 6.53 |
| Додециламин | 5.43 | 7.44 | 7.85 | 8.11 | 8.56 | 8.13 | 8.73 |
| ди-н-Бутиламин | 1.41 | 2.82 | 2.99 | 3.16 | 3.74 | 3.41 | 3.42 |
| Дипропиламин | –0.11 | 0.41 | 0.59 | 0.74 | 1.10 | 0.74 | 1.04 |
| Диизобутиламин | 0.89 | 2.07 | 2.49 | 2.38 | 2.48 | 2.39 | 2.87 |
| ди-н-Пентиламин | 3.33 | 5.18 | 5.57 | 5.60 | 5.99 | 5.67 | 5.88 |
| Триэтиламин | –0.43 | –0.21 | –0.15 | –0.11 | –0.02 | –0.12 | –0.05 |
| три-н-Бутиламин | 3.97 | 6.24 | 6.25 | 6.37 | 6.25 | 6.48 | 6.65 |
| три-н-Пентиламин | 6.19 | 9.73 | 9.90 | 9.84 | 9.97 | 10.09 | 9.93 |
| Бензонитрил | 0.51 | 0.94 | 1.36 | 1.50 | 2.07 | 2.23 | 3.43 |
| 2-Фенилпропилнитрил | 0.87 | 1.51 | 1.98 | 2.51 | 3.22 | 4.65 | 5.72 |
| Анилин | –0.09 | –0.02 | 0.36 | 0.66 | 1.50 | 0.57 | 1.13 |
| 1-Фенилэтиламин | 0.77 | 1.20 | 1.48 | 1.73 | 1.97 | 1.65 | 2.31 |
| N-Метиланилин | 1.27 | 1.46 | 1.96 | 2.39 | 3.40 | 2.09 | 2.76 |
| N,N-Диметиланилин | 2.07 | 2.52 | 2.92 | 3.18 | 3.67 | 2.86 | 3.26 |
| N,N-Диэтиланилин | 2.78 | 3.45 | 3.65 | 3.73 | 3.53 | 3.57 | 3.53 |
| орто-Метиланилин | 1.20 | 1.41 | 1.79 | 2.01 | 2.90 | 1.70 | 2.14 |
| мета-Метиланилин | 0.73 | 1.39 | 1.74 | 2.13 | 2.81 | 1.98 | 2.47 |
| пара-Метиланилин | 1.45 | 1.46 | 1.99 | 2.17 | 3.12 | 2.08 | 2.82 |
| 1-Нафтиламин | 4.83 | 5.68 | 6.13 | 6.43 | 6.97 | 5.99 | 6.12 |
| 2-Нафтиламин | 5.03 | 5.70 | 5.96 | 6.38 | 6.94 | 6.21 | 6.58 |
| Дифениламин | 5.89 | 5.50 | 6.14 | 6.07 | 5.80 | 6.09 | 5.98 |
| Индол | 2.12 | 2.73 | 2.98 | 3.21 | 2.98 | 3.05 | 3.09 |
| 2-Метилиндол | 3.51 | 4.23 | 4.51 | 4.52 | 4.48 | 4.54 | 4.51 |
| 3-Метилиндол | 3.42 | 4.22 | 4.55 | 4.49 | 4.55 | 4.57 | 4.46 |
| 2,3-Диметилиндол | 4.90 | 5.82 | 6.15 | 5.88 | 5.93 | 6.07 | 6.06 |
| Коэффициент корреляции R2 | 0.94 | 0.95 | 0.95 | 0.91 | 0.88 | 0.81 | |
Использованная условная модель функциональных групп на поверхности графита не рассматривает их реального строения и того, как именно они прикреплены к поверхности. Существует множество вариантов их структуры и имеющиеся данные не позволяют однозначно выбрать один из них.
Многочисленные исследования показывают, что точный учет расположения атомов графита на поверхности практически не влияет на потенциал взаимодействия [14]. Это связано с тем, что расстояние между соседними атомами значительно меньше, чем расстояние, на котором достигается минимум потенциальной энергии при нековалентном взаимодействии.
Таким образом, можно предположить, что энергия взаимодействия сорбата и поверхности графита, содержащей гидроксил, складывается из энергии взаимодействия поверхности, равномерно заполненной атомами углерода, и энергии взаимодействия с заряженной функциональной группой. А то, как именно она расположена по отношению к близлежащим атомам углерода, имеет меньшее значение.
Следует отметить, что расхождение между абсолютными значениями экспериментальных и рассчитанных констант Генри адсорбции может быть объяснено многими причинами. Например, систематической погрешностью, неверным определением параметров колонки и сорбента в эксперименте, а также неверными параметрами потенциала. Значения параметров для атома графита различаются в различных источниках [12]. Параметры потенциалов атомов сорбата [11] изначально получены для водных растворов и могут вносить систематическую погрешность при вычислении величин адсорбции. Ввиду этого более важным представляется не абсолютное соответствие констант Генри адсорбции, а правильное предсказание соотношения величин для различных веществ и воспроизведение качественных закономерностей. Для практической газовой хроматографии также важнее предсказание порядка элюирования и отношения характеристик, а не точные величины объемов удерживания.
Как видно из табл. 1, наличие функциональных групп существенно повышает время удерживания. При этом расположенные парами гидроксилы приводят к значительно большему повышению адсорбции при той же поверхностной концентрации. Так, например, если сравнивать константу для октиламина на идеальной поверхности и на поверхности, содержащей 10–3 гидроксил на Å2, разница составляет 0.69 в единицах логарифма константы Генри. В то же время, при парном расположении гидроксилов, эта разница составляет 0.94 уже при концентрации 10–4 Å–2. Аналогичная закономерность наблюдается и для других соединений.
Наибольшее увеличение при переходе от одиночного к парному расположению гидроксилов наблюдается для нитрилов. Так, для 2-фенилпропилнитрила, увеличения удерживания, аналогичные вышеприведенным для октиламина, составляют 0.47 и 3.14. По всей видимости, это связано с тем, что при таком расположении функциональных групп атом азота может образовывать прочные водородные связи с двумя гидроксилами, как показано на рис. 2. Повышение удерживания остальных веществ обусловлено той же причиной, однако менее выражено.
Существенно меньшее влияние функциональных групп наблюдается для вторичных и, особенно, третичных аминов. Так же для этих классов соединений меньше разница между расчетами для одиночного и парного расположения. Очевидно, это связано со стерическими причинами.
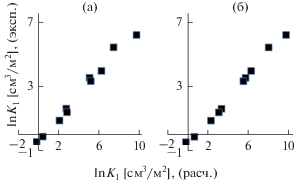
Для алифатических аминов экспериментально наблюдается меньшее удерживание вторичного изомера по сравнению с первичным (например, удерживание дибутилбензола по сравнению с октилбензолом). Однако моделирование адсорбции на однородной поверхности дает обратный результат. Введение функциональных групп с концентрацией не менее 10–3 Å–2 позволяет объяснить эту разницу. На рис. 3 приведены корреляционные зависимости для алифатических аминов без учета и с учетом наличия функциональных групп (концентрация 10–3 Å–2).
Рис. 3.
Корреляционная зависимость между экспериментальными и рассчитанными константами Генри адсорбции (lnK1 [см3/м2]) на графитированной термической саже для алифатических аминов (а) – без учета и (б) – с учетом функциональных групп (концентрация 10–3 Å–2).
Удерживание дифениламина существенно недооценено по сравнению с остальными соединениями. Причина этого неясна, однако, как показано в [16], константы адсорбции соединений, содержащих несколько бензольных колец, часто неверно предсказываются из-за того, что энергетически невыгодная конформация с близким к копланарному расположением колец стабилизирована вблизи графита, и наиболее важна точная оценка ее внутренней энергии.
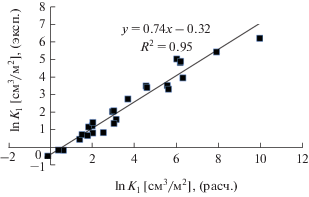
Для всех остальных соединений, без учета дифениламина, наилучшая корреляция между расчетом и экспериментом наблюдается при одиночном расположении функциональных групп и концентрации 3 × 10–4 Å–2. На рис. 4 приведена корреляционная зависимость между рассчитанными и измеренными константами адсорбции для этого случая. Данная зависимость описывается уравнением:
(1)
$\ln {{K}_{{1{\text{(эксп}}{\text{.)}}}}} = 0.74\ln {{K}_{{1{\text{(эксп}}{\text{.)}}}}} + 0.32.$Рис. 4.
Корреляционная зависимость между экспериментальными и рассчитанными константами Генри адсорбции (lnK1 [см3/м2]) на графитированной термической саже для алифатических аминов с учетом наличия функциональных групп, без учета дифениламина.
При парном расположении функциональных групп наблюдается сильное завышение констант Генри адсорбции для некоторых соединений, особенно для нитрилов. Соответствующие коэффициенты корреляции (без учета дифениламина) приведены в табл. 1.
Вывод, сделанный в работе [2] о парном расположении функциональных групп на поверхности графитированной термической сажи, не подтверждается данными этого исследования. Концентрация функциональных групп менее 4 × 10–3 Å–2, что свидетельствует об эффективном удалении функциональных групп и достаточно высокой однородности поверхности, достигаемой в результате обработки водородом при высокой температуре. Однако остаточные функциональные группы позволяют объяснить наблюдаемый порядок элюирования изомеров для алифатических аминов.
Работа выполнена при частичной поддержке программы фундаментальных исследований президиума РАН № 14П (ранее № 36 П).
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (грант № 18-08-01224).
Список литературы
Kiselev A.V., Poshkus D.P. // J. Chemical Society, Faraday Transactions 2: Molecular and Chemical Physics. 1976. V. 72. P. 950–966.
Klomkliang N., Kaewmanee R., Saimoey S., Intarayothya S., Do D.D., Nicholson D. // Carbon. 2016. V. 99. P. 361–369.
Do D.D., Do H.D. // Molecular Simulation. 2005. V. 31. № 9. P. 651–659.
Comer J., Chen R., Poblete H., Vergara-Jaque A., Riviere J.E. // ACS Nano. 2015. V. 9. № 12. P. 11761–11774.
McCallum C.L., Bandosz T.J., McGrother S.C., Müller E.A., Gubbins K.E. // Langmuir. 1999. V. 15. № 2. P. 533–544.
Mohammadi-Jam S., Waters K.E. // Advances in colloid and interface science. 2014. V. 212. P. 21–44.
Belyakova L.D., Buryak A.K., Larionov O.G. // Protection of Metals and Physical Chemistry of Surfaces. 2013. V. 49 № 6. P. 605–626. [Белякова Л.Д., Буряк А.К., Ларионов О.Г. // Физикохимия поверхности и защита материалов. 2013. Т. 49. № 6. С. 551–574.]
Trojanowicz M. // TrAC trends in analytical chemistry. 2006. V. 25. № 5. P. 480–489.
Reungoat J., Macova M., Escher B.I., Carswell S., Mueller J.F., Keller J. // Water research. 2010. V. 44. № 2. P. 625–637.
Yu J.-G., Zhao X.-H., Yang H., Chen X.-H., Yang Q., Yu L.-Y., Jiang J.-H., Chen X.-Q. // Science of the Total Environment. 2014. V. 482–483. P. 241–251.
Wang J., Wolf R.M., Caldwell J.W., Kollman P.A., Case D.A. // J. Computational Chemistry. 2004. V. 25. P. 1157–1174.
Leroy F., Liu S., Zhang J. // The J. Physical Chemistry C. 2015. V. 119. №. 51. P. 28470–28481.
Halgren T.A. // J. Computational chemistry. 1996. V. 17. № 5–6. P. 490–519.
Steele W.A. // Surface Science. 1973. V. 36. № 1. P. 317–352.
Kiselev A.V., Polotnyuk E.B., Shcherbakova K.D. // Chromatographia. 1981. V. 14. № 8. P. 478–483.
Matyushin D.D. Buryak A.K. // J. Analytical Chemistry 2019. In press.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов