Физикохимия поверхности и защита материалов, 2019, T. 55, № 6, стр. 573-581
Состояние и свойства углеродного сорбента, модифицированного биологически активным веществом
В. А. Дроздов 1, *, Л. Г. Пьянова 1, А. В. Лавренов 1, В. А. Лихолобов 1, Е. Н. Кудря 1, Л. С. Лузянина 1
1 Федеральное государственное бюджетное учреждение науки Институт проблем переработки углеводородов Сибирского отделения Российской академии наук
Омск, Россия
* E-mail: drozdov@ihcp.ru
Поступила в редакцию 30.10.2018
После доработки 15.11.2018
Принята к публикации 22.11.2018
Аннотация
Предложен и изучен способ введения низких содержаний бетулина (до 1 мас. %) в мезопористый углеродный материал с заданными значениями площади удельной поверхности 300–310 м2/г, суммарного удельного объема пор 0.35–0.40 см3/г и среднего диаметра пор 5.2–5.5 нм. Содержание бетулина в твердой углеродной матрице и в применяемых органических растворителях определяли методом газовой хромато-масс-спектрометрии. Методами сканирующей электронной микроскопии с рентгеновским микроанализом и ИК-Фурье-спектроскопии исследовано состояние бетулина на наружной и внутренней поверхности углеродных гранул разного фракционного состава, а также в тонких углеродных слоях. Установлено, что основная доля бетулина преимущественно осаждена на внешней поверхности глобулярных частиц пористого углеродного материала. Изучены свойства бетулина, импрегнированного в углеродный сорбент, и процесс его динамической десорбции в условиях, моделирующих биологическую среду желудочно-кишечного тракта.
ВВЕДЕНИЕ
Известно, что пентациклический тритерпеноид бетулин, содержащийся в экстрактах внешней коры берез, проявляет разнообразную биологическую активность и на его основе разрабатываются пищевые добавки, медицинские препараты противовоспалительного и противоопухолевого действия [1–3]. В последние годы интерес к бетулину для целей получения на его основе новых фармакологических продуктов возрастает, несмотря на сложность методов его синтеза и очистки [4]. Результаты последних исследований, показали, что использование бетулина в дисперсном состоянии позволяет усилить его биологическую активность и эффективность [5]. В связи с этим, актуальной становится задача разработки новых методик синтеза лекарственных препаратов с использованием бетулина в нанесенном дисперсном состоянии, когда соотношение поверхность/объем компонента становится высоким. Это имеет практически важное значение, так как, соответственно, процессы растворения данной формы бетулина в водных и биологических средах будут протекать гораздо быстрее, причем при этом можно регулировать действие лекарственного препарата во времени. Так как стабилизация биологически активного вещества бетулина в высокодисперсном виде возможна только в твердой пористой матрице как за счет его импрегнирования в порах, так и адсорбции на внешней поверхности, разработка экономичной технологии получения такого комбинированного препарата в виде углеродно-органического сорбента является весьма перспективной. В данной работе проведены исследования, посвященные изучению состояния и свойств бетулина в углеродном сорбенте.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы исследования
Для получения препарата ветеринарного назначения использовали микросферический наноструктурированный углеродный материал на основе дисперсного технического углерода (производство ФГБУН ИППУ СО РАН, г. Омск); биологический активный компонент – бетулин (производство ФГБУН Институт химии и химической технологии СО РАН, г. Красноярск); этиловый спирт, ректифицированный, технический по ГОСТ № 18 300 (ООО ЛВЗ “ОША”, г. Омск); глицерин по ГОСТ 6259-75 (ОАО “Жировой комбинат”, г. Саратов).
Для исследования текстурных характеристик, фазового состояния сорбента и нанесенного бетулина, процесса его динамической десорбции с поверхности полученных образцов применяли необходимые физико-химические методы анализа.
Исследование текстурных характеристик, то есть структурно-геометрических параметров удельной поверхности и пористой структуры образцов углеродного сорбента на основе технического углерода проводили адсорбционным методом согласно общепринятой методике по ASTM-D4222-03 на объемной статической вакуумной установке Sorptomatic-1900, “Carlo Erba”. Интерпретируя с помощью известных методик, получаемые низкотемпературные изотермы адсорбции-десорбции стандартного адсорбтива азота в криогенных условиях (при Т = –195.9°С), получали текстурную информацию исследуемых объектов [6–10]. Перед проведением адсорбции все образцы тренировали в вакууме при температурах в области 280–300°С в течение не менее 6–8 ч до остаточного давления не менее 1 Па. По полным изотермам адсорбции азота, измеренным в области относительных давлений паров азота Р/Р0 = 10–4 – 1, получали интегральные параметры текстуры: суммарную удельную площадь поверхности по методу БЭТ (SБЭТ, м2/г), суммарный адсорбционный объем пор (VΣ, см3/г) и объемы пор различной разновидности по размерам пор (Vмикро-, Vмезо- и оценочно Vмакро- до размеров пор по диаметру 480–500 нм [6–8]. Дифференциальные параметры пористой структуры рассчитывали как кривые распределения объема пор по эффективным размерам – диаметрам пор (КРПР) методом Доллимора–Хилла (метод DH) [9]. К осредненным общепринятым параметрам текстуры, как указано в работе [10], отнеcены средний размер пор и частиц, а также доля микро-, мезо- и макропор в гранулах сорбента.
Топологические особенности поверхности пористого углеродного материала без и в присутствии введенного бетулина, а также форму и размер частиц углерода в исследуемых образцах изучали прямым наблюдением в вакуумной камере сканирующего электронного микроскопа (СЭМ) марки JSM-6460LV, “JEOL”. Полуколичественный элементный рентгеновский микроанализ модифицированных бетулином углеродных сорбентов выполняли на энергодисперсионной приставке IncaX-act, “Оxford Instruments”.
Рентгенофазовый анализ (РФА) и субструктуру исследуемых образцов углеродного сорбента проводили на порошковом рентгеновском дифрактометре D8 Advance, “Bruker” в монохроматизированном CuKα-излучении (длина волны λ = 0.15418 нм). Образцы сканировали в области углов 10°–70° (по 2Θ) с шагом 0.05° и временем накопления 2 с в каждой точке, напряжение – 40 kV, ток накала – 40 mA. При расшифровке полученных дифрактограмм использовали базу данных по порошковой дифракции ICDD PDF-2.
Определяемыми параметрами субструктуры углеродной матрицы, которые получали из анализа рефлексов экспериментальных дифрактограмм, были [11]: кажущийся размер кристаллитов Lc (нм) или область когерентного рассеяния (о. к. р.) в направлении с перпендикулярно графеновым слоям и межплоскостное расстояние d002 (нм). Значения этой величины d002 рассчитывали по уравнению Брэгга-Вульфа
где n – порядок отражения (n = 1); λ – длина волны рентгеновского излучения (λ = 1.5418 Å); θ – угол дифракции [11]. Расчет кажущихся размеров кристаллитов Lc выполняли по известному уравнению Селякова–Шеррера: где K – коэффициент формы частиц (К = 0.89); β – ширина на половине высоты пика (FWHM), выраженная в радианах; λ – длина волны рентгеновского излучения (λ = 1.5418 Å); θ – угол дифракции [11].ИК-Фурье-спектроскопию (ИКС) качественного состава функциональных групп поверхности углеродного сорбента, модифицированного бетулином, выполняли на ИК-спектрометре Nicolet-5700, “Termo Fisher Scientific”. ИК-спектры регистрировали в спектральном диапазоне 7000–750 см–1 с разрешением 4 см–1 и числом накопления спектров 32. Спектры обрабатывали в программном пакете “ORIGIN” с коррекцией базовой линии и использованием процедуры сглаживания. Методика приготовления образца для ИК-исследования включала получение тонких однородных углеродных слоев, напыленных на оптически прозрачные BaF2-стекла методом седиментации мелких частиц углерода в специальном стеклянном цилиндре с отверстием для вдувания порций проб.
Дополнительно, исследовали порошкообразные образцы бетулина как исходного, так и осажденного из спиртовыц растворов соляной кислотой. В этом случае применяли ИК-метод диффузного отражения (ИКС-ДО). Небольшое количество образца смешивали с порошком KBr и регистрировали ИК-ДО спектры в диапазоне 400–4000 см–1 относительно чистого бромида калия.
Содержание бетулина определяли методом газовой хромато-масс-спектрометрии (ГХ/МС) на приборе 6890/5973N “Agilent Technologies” [12].
Методика количественного анализа методом ГХ/МС импрегнированного бетулина в пористом углеродном материале
Количественный анализ бетулина в пористом углеродном материале и в органических экстрактах проводился методом ГХ/МС по специально разработанной методике с учетом ранее известных ГХ/МС литературных данных [12–14].
Предложенная методика позволила анализировать бетулин в пористой углеродной матрице по разнице содержания бетулина в пропитывающем и остаточном растворе, то есть до и после контакта с пористой углеродной матрицей. В основе данной ГХ/МС методики использован метод селективного детектирования ионов с применением приготовленных калибровочных растворов и построением калибровочного графика [15]. Концентрацию извлеченного бетулина в растворенном виде определяют по площади пика относительно площади пика бетулина калибровочного спиртового раствора.
При выполнении хромато-масс-спектрометрического анализа были выбраны следующие условия хроматографирования: температура ввода пробы – 220°С, выдержка при этой температуре – 2 мин, скорость подъема температуры – 2.0°С/мин до 280°С с выдержкой при этой температуре – 2 мин, затем подъем температуры до 300°С со скоростью 10°/мин и выдержкой 15 мин. Для хроматографического разделения использовали неполярную капиллярную колонку марки HP 5ms, где в качестве неподвижной фазы используется смесь 5 мас. % фенила + 95 мас. % диметилполисилоксана. Диаметр колонки 0.25 мм, длина 30 м, толщина слоя неподвижной фазы 0.25 мкм.
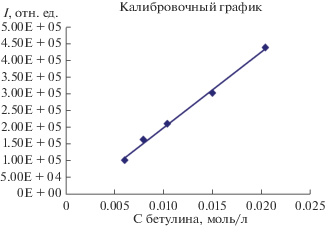
Анализатором является квадрупольный масс-спектрометрический детектор с ионизацией молекул “электронным ударом”, энергия ионизации 70 эВ. Диапазон определяемых масс 1.6–800 а. е. м. Детектируемый основной ион с m/z = 442 от молекулярного бетулина использован для начального анализа. Концентрацию бетулина, перешедшего в раствор с углеродного сорбента после экстрагирования, определяли масс-спектрометрически в режиме SIM: селективной регистрации отдельных ионов с заданными m/z, где m – масса, z – заряд и построением зависимости интенсивности сигнала от количества молекул чистого вещества – бетулина (m/z = 442), т.е. калибровочного графика. В качестве калибровочных растворов были использованы этанольные растворы бетулина с концентрацией в диапазоне 0.002–0.008 М.
Важно отметить, что описание процедуры получения калибровочного графика методом ГХ/МС для определения содержания бетулина крайне важна.
Для построения калибровочного графика готовили растворы бетулина в этаноле с концентрациями от 1 до 10 г/л. В круглодонную колбу с обратным холодильником на 100 мл вносили навеску бетулина, приливали этанол 92 об. %. Колбу нагревали на песочной бане до температуры кипения этанола (78–80°С) и кипятили до полного растворения бетулина (в течение 25–30 мин). Затем нагрев отключали и раствор оставляли на 5 мин при температуре окружающей среды для конденсации паров спирта в холодильнике до охлаждения раствора. К полученному раствору приливали глицерин в объеме около 8% от общего объема раствора и перемешивали в течение 5–10 мин. Предварительно было показано, что введение глицерина способствует процессу извлечения бетулина из твердого углеродного сорбента и не влияет на результаты количественного анализа ГХ/МС в сравнении этанольных и этанол-глицериновых растворов. Для подтверждения расчетных концентраций бетулина в приготовленных растворах применяли метод обратного титрования согласно методике “Определение йодного числа с хлоридом йода (без сулемы)” [16].
В табл. 1 приведено сопоставление расчетных данных концентрации бетулина в приготовленных калибровочных растворах этанола и полученных титриметрическим методом. Как видно, полученные результаты имеют хорошую сходимость.
Таблица 1.
Сопоставление расчетных концентраций бетулина в калибровочных спиртовых растворах и определенных методом обратного титрования
| Расчетная концентрация, М | Концентрация, определенная методом обратного титрования, М |
|---|---|
| 0.00204 | 0.00201 |
| 0.00605 | 0.00597 |
| 0.00795 | 0.00802 |
Используя приготовленные калибровочные растворы, был построен калибровочный график зависимости интенсивности сигнала от количества определяемого вещества методом ГХ/МС с селективным детектированием иона m/z = 442 (бетулин). Коэффициент линейности составлял 0.995. Полученный калибровочный график был использован при определении содержания бетулина (рис. 1).
При низком содержании бетулина в углеродной матрице, то есть при использовании для сравнения калибровочных растворов с концентрациями в интервале 0.002–0.008 М, его количество определяли отношением площади хроматографического пика исследуемого образца (содержание бетулина в исследуемой пробе) к площади пика эталонного калибровочного раствора (бетулин с известной концентрацией). При этом условно предполагали идентичность составов исследуемых и стандартных проб. Присутствие глицерина в растворе не мешало определению. Площадь хроматографического пика линейно зависела от содержания бетулина в пробе.
Таким образом, зная площадь пика Y1, полученного для калибровочного раствора с содержанием бетулина до 0.008 М (Х1), площадь пика исследуемого раствора Y2, определяли концентрацию исследуемого раствора бетулина X2 по формуле (3):
(3)
${{X}_{2}} = ({{{{Y}_{2}}} \mathord{\left/ {\vphantom {{{{Y}_{2}}} {{{Y}_{1}}}}} \right. \kern-0em} {{{Y}_{1}}}} \times K),~~$Количество нанесенного бетулина на углеродном сорбенте по разработанной методике синтеза углеродного сорбента, модифицированного бетулином из этанольно-глицеринового раствора, оценивали по изменению массы сорбента до и после модифицирования. Установлено, что разработанный способ позволяет получить препарат с массовым содержанием бетулина не превышающим 1.0 ± 0.1%.
Методика определения десорбции бетулина, нанесенного на углеродный материал, в этиловый спирт
Данная методика позволяет оценить количество бетулина, нанесенного на углеродный сорбент, при десорбции в экстрагирующий этанол. Десорбцию бетулина с поверхности углеродной матрицы модифицированного сорбента проводили в аппарате Сокслета (рис. 2).
Рис. 2.
Аппарат Сокслета для проведения десорбции бетулина с поверхности углеродной матрицы в этиловом спирте: 1 – экстрактор для аппарата Сокслета; 2 – холодильник; 3 – штатив; 4 – песчаная баня.

Нагревание осуществляли на песчаной бане. Перед началом работы за 30 мин до проведения испытания баню нагревали и подавали воду холодильник. Навеску образца массой 2.00 г помещали в фильтр (№ 391 “Filtrak”), формировали в виде кулька и завязывали шелковой нитью, фильтр аккуратно подрезали. В коническую плоскодонную колбу со шлифом объемом 250–500 см3 (аппарат Сокслета) приливали из цилиндра 50 мл этилового спирта. Фильтр с сорбентом помещали в экстрактор Сокслета и собирали аппарат. Колбу накрывали асбестовой тканью. За время начала процесса принимали время начала кипения спиртового раствора в колбе. Нагрев вели 6 ч. По завершении данного времени аппарат убирали с бани и остужали до комнатной температуры в течение 25–30 мин на керамической подставке.
Аппарат Сокслета аккуратно разбирали. Спирт с десорбированным бетулином собирали в мерном цилиндре и измеряли полученный объем. Затем рассчитывали количество десорбированного компонента согласно разработанной методике по площади пика относительно площади пика бетулина калибровочного спиртового раствора.
Методика определения бетулина при десорбции с поверхности углеродного материала в модельных условиях
Определение количества бетулина в сорбенте проводили до и после десорбции в растворах, моделирующих биологическую среду желудка (0.02 Н раствор НСl, рН 1.7) и биологическую среду кишечника (0.0025 Н раствор NaHCO3, рН 8.5). Десорбцию осуществляли в термостате при температуре 38–39°С.
При проведении процесса десорбции бетулина к навеске модифицированного сорбента 2.00 г приливали 10 мл водного 0.02 Н раствора соляной кислоты или 0.0025 Н раствора гидрокарбоната натрия. Герметично закрывали колбу парафиновой лентой и помещали в термостат. По истечении определенного времени (2, 4, 6, 16 и 24 ч) колбу вынимали из термостата, жидкую фазу декантировали. Сорбент после десорбции промывали дистиллированной водой и высушивали в сушильном шкафу при температуре 105 ± 2°С до постоянной массы. Затем рассчитывали количество десорбированного компонента в жидкой среде.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез углеродного сорбента, импрегнированного бетулином
Принципиальный фактор, сдерживающий практическое применение бетулина в фармакологии – его низкая растворимость в воде. Электронно-микроскопические снимки кристаллов бетулина представлены на рис. 3.
На сканирующих ЭМ-снимках видно, что частицы бетулина имеют игольчатую форму и собраны в небольшие агрегаты с размерами 140 × 70 мкм.
Таким образом, при разработке способа модифицирования углеродного сорбента бетулином одна из основных задач заключалась в разработке технологических приемов, обеспечивающих перевод бетулина в водорастворимое состояние при варьировании его дисперсности.
Разработанная технология получения углеродного сорбента, модифицированного бетулином из этанольно-глицеринового раствора, предусматривает диспергирование частиц бетулина при его импрегнировании углеродным сорбентом из жидких органических фаз с учетом его количества.
Определены условия нанесения (модифицирования) углеродных сорбентов бетулином:
– в качестве модификатора необходимо использовать растворы бетулина в этанол – глицериновом растворе (92 : 8% по объему соответственно);
– соотношение “носитель/раствор бетулина” – 1 : 2 по объему соответственно;
– время проведения процесса 2 ч;
– использовать перемешивание пропитывающей системы.
Процесс импрегнирования этанол-глицериновым раствором бетулина мезопористого углеродного сорбента необходимо проводить в несколько стадий (рис. 4):
Рис. 4.
Блок-схема технологического процесса получения углеродного сорбента, импрегнированного бетулином.
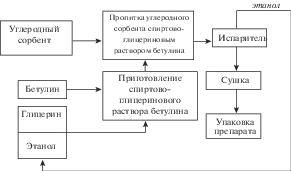
1. Приготовление этанольно-глицеринового раствора.
2. Проведение стадии пропитки углеродного сорбента этанол-глицериновым раствором бетулина.
3. Проведение стадии выделения этилового спирта из реакционной смеси: проводится в реакторе – пропитывателе по окончании процесса пропитки сорбента.
4. Сушка препарата: осуществляется при температуре 150°С.
5. Стадия упаковки опытных партий препарата: высушенный препарат охлаждается до комнатной температуры и упаковывается в полиэтиленовые канистры по 25 кг в каждую емкость.
Определение текстурных и субструктурных характеристик углеродного сорбента до и после нанесения бетулина
Импрегнирование дисперсного бетулина в углеродную матрицу приводит к достаточно выраженным изменениям текстурных характеристик исходного сорбента (табл. 2), но без существенного изменения параметров субструктуры сорбента (рис. 5).
Таблица 2.
Текстурные и субструктурные характеристики, элементный состав поверхности исследуемых образцов углеродного сорбента
| Наименование образца | Удельная площадь поверхности, SБЭТ, м2/г | Общий объем пор, V, см3/г | d002, нм |
Lc, нм |
Элементный состав, % мас. | |
|---|---|---|---|---|---|---|
| С | О | |||||
| Исходный сорбент | 306 | 0.398 | 0.348 | 2.83 | 100.00 | – |
| Углеродный сорбент, модифицированный бетулином из этанольно-глицеринового раствора | 228 | 0.363 | 0.346 | 2.78 | 94.33 | 5.67 |
| Бетулин | – | – | – | – | 89.52 | 10.47 |
Рис. 5.
Рентгенограммы немодифицированного образца (а) и углеродного сорбента, модифицированного бетулином из этанольно-глицеринового раствора (б).
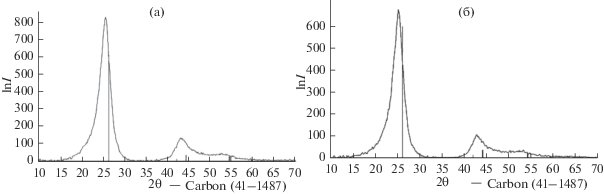
Элементный состав поверхности по данным рентгеновского микроанализа при этом меняется в сторону увеличения кислорода и, соответственно, уменьшения углерода, что естественно при модифицировании сорбента бетулином.
Топографический и морфологический анализ
Сканирующие электронно-микроскопические исследования показали (рис. 6):
Рис. 6.
Электронно-микроскопические снимки гранулы (а) и поверхности (б) углеродного сорбента, модифицированного бетулином из этанольно-глицеринового раствора.

– насыщение микросферического углеродного материала 1 мас. % этанольно-глицериновым раствором бетулина не приводит к изменению формы и размера гранул полученного ветеринарного препарата (рис. 6а);
– адсорбированные и/или конденсированные молекулы бетулина, этанола и глицерина при выбранных концентрациях неоднородно (“локально”) заполняют поверхность и доступные по размеру приповерхностные (“корочные”) поры сорбента (рис. 6б).
В итоге можно заключить, что используемый метод модифицирования практически не затрагивает структурно-морфологические объемные характеристики сорбента, несколько снижая удельную поверхность и приповерхностный объем пор. Это можно считать положительным фактом, так как основные свойства сорбента, например, общая пористость, прочность, проницаемость и, вероятнее всего, биосовместимость и т.д., должны сохраняться.
Качественный состав функциональных поверхностных групп модифицированного бетулином углеродного сорбента по данным ИКС
Методом ИКС получены спектры бетулина (рис. 7а), исходного углеродного сорбента и углеродного сорбента, модифицированного бетулином из этанольно-глицеринового раствора (рис. 7б) [17–19].
Рис. 7.
ИК-спектры бетулина (а) и ИК-спектры сорбентов (б): 1 – исходный сорбент; 2 – углеродный сорбент, модифицированный бетулином из этанольно-глицеринового раствора.
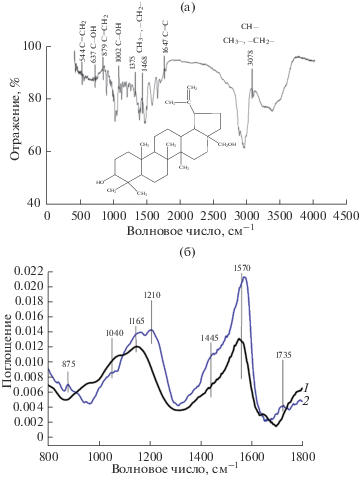
В ИК-спектре исходного образца мезопористого углеродного сорбента (рис. 7б спектр 1) наблюдаются полосы поглощения, относящиеся к валентным колебаниям связи: С–О в спиртовых и фенольных фрагментах (область 1000–1200 см–1), С–О–С в эфирных и лактонных структурах (область 1200–1230 см–1). В спектральной области 1700–1740 см–1 дополнительно регистрируется полоса поглощения, относящаяся к валентным колебаниям связи С=О. В ИК-спектре отчетливо проявляется полоса поглощения, соответствующая валентным колебаниям связи С=С в полиароматических системах (1560–1590 см–1).
Кроме того, наблюдается малоинтенсивная полоса поглощения при 1442 см–1, соответствующая колебаниям связи С–О карбонат-иона ${\text{СО}}_{{\text{3}}}^{{{\text{2}} - }}.$
При пропитке бетулином углеродного сорбента в его ИК-спектре наблюдаются интенсивные полосы поглощения в области 875 и 1445 см–1, характеризующие колебания двойной связи СН2=С– и соответствующие деформационным колебаниям группы –СН3. Отмечается смещение полос поглощения, относящихся к колебаниям двойной связи СН2=С–, с 1165 до 1210 см–1. Наблюдаемое перераспределение функциональных групп на поверхности углеродного сорбента можно объяснить внесением в его пористую структуру модификатора, имеющего в своей структуре двойную связь СН2=С– и соответствующие функциональные группы (–СН3, –СН2–, –СН–). Происходит значительное увеличение полос поглощения в области 1000–1200 см–1, соответствующих валентным колебаниям связи С–О в спиртах и фенолах (рис. 7б, спектр 2). Такие изменения в спектре, вероятнее всего, связаны с процессом модифицирования бетулином в этанольно-глицериновом растворе.
В целом можно заключить, что примененный метод ИКС позволил оценить качественный состав функциональных групп и их изменения в исследуемых углеродных материалах до и после модифицирования.
Изучение динамики десорбции бетулина с поверхности углеродного сорбента в модельных условиях
Изучение адсорбционно-десорбционных процессов в биологических средах является сложным, чаще всего многоступенчатым процессом, протекающим под воздействием нескольких факторов. Основными из них являются рН среды, температура. Эти параметры необходимо учитывать при создании модельных растворов, в которых изучаются десорбционные свойства сорбентов.
Химическое моделирование среды желудка возможно путем подбора необходимых значений рН, температуры. Известно, что условия биологической среды желудка можно смоделировать, используя водный раствор соляной кислоты со значением рН в интервале 1.4–1.8. Для моделирования среды кишечника используют раствор гидрокарбоната натрия со значением рН 8.5 [20].
Результаты проведенных нами исследований представлены на рис. 8. Установлено, что в системе “специфический сорбент–гидрокарбонат натрия” равновесие достигается в течение первых 2 ч, при этом в раствор переходит до 43 отн. % бетулина. В системе “специфический сорбент – соляная кислота” равновесие достигается в течение 16 ч, при этом с сорбента десорбируется более 36 отн. % бетулина.
Рис. 8.
Десорбция бетулина с поверхности углеродного сорбента, модифицированного бетулином из этанольно-глицеринового раствора, после контакта с растворами соляной кислоты (1) и гидрокарбоната натрия (2), имитирующими условия биологической среды желудка и кишечника, соответственно. Температура процесса 38.5 ± 0.5°С.
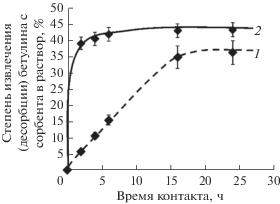
Таким образом, показано, что углеродный сорбент, модифицированный бетулином из этанольно-глицеринового раствора, проявляет пролонгированные свойства: с течением времени биологически активный компонент (бетулин) постепенно переходит с сорбента в раствор гидрокарбоната натрия (модель среды кишечника) и в раствор соляной кислоты (модель среды желудка).
ЗАКЛЮЧЕНИЕ
Разработанный синтез углеродного мезопористого сорбента, импрегнированного бетулином, позволяет получить препарат бифункционального действия.
Подобранный этанольно-глицериновый раствор обеспечивает растворение кристаллов бетулина, а установленные внешние условия импрегнирования обеспечивают миграцию биологически активного компонента на поверхность и в область приповерхностных мезопор углеродного сорбента. Показано, что при контакте модифицированного сорбента с растворами, моделирующими биологические среды, происходит постепенная (пролонгированная) десорбция дисперсного бетулина с поверхностных пористых областей углеродного сорбента, что оказывает специфическое действие данного материала.
Работа 2013–2020 гг. по направлению проект № V.45, V.45.2.8 “Научные и технологические основы создания новых углеродных наноструктурированных материалов для наноиндустрии и медицины” (номер госрегистрации в системе ЕГИСУ НИОКТР номер госрегистрации в системе ЕГИСУ НИОКТР AAAA-A17-117021450093-7).
Список литературы
Кузнецов Б.Н., Кузнецова С.А. и др. // Химия в интересах устойчивого развития. 2005. Т. 13. С. 391–400.
Кузнецова С.А., Кузнецов Б.Н. и др. // Химия растительного сырья. 2008. № 1. С. 45–49.
Толстиков Г.А., Флехтер О.Б. и др. // Химия в интересах устойчивого развития. 2005. Т. 13. С. 1–30.
Кислицин А.Н. // Химия древисины. 1994. № 3. С. 3–28.
Лавренов А.В., Пьянова Л.Г. и др. // Химия твердого топлива. 2015. № 1. С. 9–16.
Грег С., Синг К. Адсорбция. Удельная поверхность. Пористость. М.: Мир. 1984. 310 с.
Фенелонов В.Б. Пористый углерод. Новосибирск. 1995. 518 с.
Карнаухов А.П. Адсорбция. Текстура дисперсных и пористых материалов. “Наука”. Новосибирск. 1999. 470 с.
Dollimore D., Heal G.R. // J. Colloid. Interf. Sci. 1973. V. 33. № 3. P. 233–249.
Фенелонов В.Б. // Сборник научных трудов “Стандартизация методов, приборов и установок контроля качества промышленных катализаторов”. Новосибирск. 1991. С. 88–111.
Романенко А.В., Симонов П.А. // Промышленный катализ в лекциях, выпуск 7. “Калвис”. М. 2007. С. 7–110.
Кузнецова С.А., Кузнецов Б.Н., Веселова О.Ф., Кукина Т.П., Калачева Г.С., Скворцова Г.П., Редькина Е.С. // Химия растительного сырья. 2008. № 1. С. 45–49.
Кузнецова С.А., Титова Н.М., Калачева Г.С. и др. // Вестник Красноярского государственного университета. Естественные науки. 2005. № 2. С. 113–118.
Кузнецов Б.Н., Кузнецова С.А., Левданский В.А., Судакова И.Г., Веселова О.Ф. // Химия в интересах устойчивого развития. 2005. № 13. С. 391–400.
Лебедев А.Т. Масс-спектрометрия в органической химии. “Бином. Лаборатория знаний”. М. 2003. 493 с.
Петров К.П. Методы биохимии растительных продуктов, “Высшая школа”. Киев. 1978. 224 с.
Левданский В.А., Полежаева Н.И. и др. // Вестник КрасГУ. Серия “Естественные науки”. 2004. № 2. С. 68–73.
Левданский В.А., Левданский А.В. // Химия растительного сырья. 2014. № 1. С. 131–137.
Якубовский С.Ф., Линник В.Н. // Вестник Полоцкого государственного университета. Серия В: Промышленность. Прикладные науки. 2016. № 11. С. 108–114.
Пегова Р.А., Гуленова М.В., Жильцова О.Е., Клабукова И.Н., Мельникова Н.Б. // Международный журн. прикладных и фундаментальных исследований. 2015. № 10-2. С. 304–310.
Мымриков А.Н. // Провизор. 2008. № 2. С. 52–55.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов