Физикохимия поверхности и защита материалов, 2019, T. 55, № 6, стр. 626-634
Структура комплексов карбонилрутения(II) с октаэтилпорфирином
В. В. Широкова 1, В. С. Тюрин 1, *, Н. М. Станецкая 1, М. Н. Соколова 1, А. О. Шкирдова 1, И. А. Замилацков 1
1 ФГБУН Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: vst-1970@mail.ru
Поступила в редакцию 16.11.2018
После доработки 18.02.2019
Принята к публикации 26.02.2019
Аннотация
Порфириновые комплексы рутения с монооксидом углерода и другими лигандами, особенно азотными, являются удобными моделями для изучения природных энергетических центров. Рентгеноструктурный анализ монокристаллов комплексов показал структурные особенности, определяющие их свойства. В комплексе карбонилрутения(II) с β-октаэтилпорфирином, атом рутения прочно удерживается четырьмя атомами азота порфирина, а монооксид углерода выступает в качестве аксиального лиганда. Порфиринаты рутения(II) с координированными аксиальными лигандами образуют схожие кристаллические структуры островного типа триклинной сингонии, пространственная группа Р1. Первоначально полученный в реакции β-октаэтилпорфирина с додекарбонилом трирутения пяти-координационный комплекс порфирината карбонила рутения легко координирует даже слабые лиганды, такие как этанол, который легко обменивает на пиридин. Координационный полиэдр атома рутения можно описать как искаженную тетрагональную бипирамиду. Сравнение структуры комплексов порфиринатов рутения наглядно продемонстрировало особенности проявления транс-влияния лигандов. Монооксид углерода вытягивает атом рутения из плоскости, образованной четырьмя атомами азота порфирина, вызывая значительное удлинение (около 10%) и соответствующее ослабление связи рутения с транс-лигандом, занимающим шестое координационное место. Аналогично транс-лиганды влияют на связь Ru–CO в соответствии с силой лиганда. Осуществлен квантовой-химический расчет порфириновых комплексов рутения. Механизм транс-влияния лигандов проиллюстрирован анализом молекулярной электронно-волновой функции методом естественных локализованных орбиталей. Выявление структурных закономерностей и их взаимосвязи со свойствами комплексов способствует пониманию функционирования аналогичных природных комплексов железа, в том числе гема.
ВВЕДЕНИЕ
Рутениевые комплексы порфиринов представляют интерес в качестве фотосенсибилизаторов, в первую очередь для электрохимических солнечных батарей [1, 2] и в медицине для фотодинамической терапии опухолей [3–5], а также для катализа [6] и фотокатализа [7], при моделировании природных энергетических механизмов (гемоглобин, цитохром) [8–10]. В частности, изучение карбонильных комплексов порфиринатов рутения важно с точки зрения моделирования соответствующих карбонильных комплексов гемов, поскольку рутений является прямым аналогом железа в табл. Менделеева. Рутений(II) и железо(II) образуют сходные низкоспиновые диамагнитные комплексы с порфиринами типа M(CO)(L)(порфирин) с квадратно-бипирамидальной координационной геометрией. При этом двухвалентный рутений существенно более стабилен, в отличие от двухвалентного железа, которое легко окисляется, что значительно затрудняет работу с его соединениями. Кроме того, в отличие от металлов первого ряда, рутениевые комплексы порфиринов способны образовывать намного более прочные аксиальные связи, с помощью которых возможно построение стабильных супрамолекулярных ансамблей [11, 12] электронно-оптические свойства которых обуславливают перспективность применения в качестве светособирающих антенн и молекулярных информационных устройств [13]. За счет таких связей рутений в порфирине также может координировать субстраты, выполняя роль каталитического центра. При этом электронная система порфирината рутения может поглощать свет и передавать координированным субстратам энергию возбуждения. На этих свойствах основаны фотокаталитические возможности этих комплексов. Возможность рутения находиться в комплексе в различных степенях окисления благоприятствует протеканию каталитических процессов с переносом электрона [14, 15].
До настоящего времени рутениевым комплексам порфирина уделялось недостаточно внимания. Особенно мало структурных исследований порфиринатов рутения. Количество публикаций по этой теме не очень велико, особенно в сравнении с порфиринатами металлов первого переходного периода, что можно объяснить экспериментальной сложностью и неоднозначными результатами таких работ. Ранее сообщалось о структурных исследованиях аналогичных комплексов мезо-тетрафенилпорфирина [16, 17]. Однако β-замещенные порфирины более соответствуют природным тетрапиррольным комплексам, у которых мезо-положения свободны, а замещены именно β-положения. Ранее нами были начаты систематические исследования рутениевых комплексов производных природных порфиринов [18, 19], продолжением которых является данная работа по изучению структуры комплексов рутения с синтетическим аналогом природных порфиринов.
МЕТОДИЧЕСКАЯ ЧАСТЬ
Материалы. Коммерческие реагенты использованы без очистки, растворители очищены по стандартным методикам. Для колоночной и флеш-хроматографии применяли силикагель 40/60 (Merсk). Для препаративной ТСХ использовали силикагель 60 (Merck) на пластинах 20 × 20 см с толщиной слоя 1 мм. В качестве элюента использовали смесь растворителей: хлористый метилен– этанол (100 : 1 и 100 : 4 об.). β-Октаэтилпорфирин синтезировали по описанным в литературе методикам [20, 21] из коммерчески доступных реагентов.
Измерения. Электронные спектры получены на спектрофотометре HITACHI U-2900 в диапазоне длин волн 350–700 нм. Спектры ЯМР были зарегистрированы на спектрометре Bruker Avance III 600 (600 МГц) при 25°С. Масс-спектры были получены с использованием масс-спектрометра Ultraflex II Bruker Daltonics методом MALDI TOF.
Синтез комплексов
Карбонил(этанол)(2,3,7,8,12,13,17,18-октаэтилпорфиринато)рутений (Ru(CO)(EtOH)OEP).
Использовали модифицированную методику И. Лорковича и П. Форда [22], а также Д. Долфина и др. [23]. В круглодонную колбу емкостью 100 мл поместили 20 мл толуола и 20 мл о-ксилола, 107 мг β-октаэтилпорфирина (0.2 ммоль) и 320 мг Ru3(CO)12 (0.5 ммоль). Затем реакционную смесь нагревали до кипения с обратным холодильником в течение 18 ч. Температура реакционной смеси при этом была в районе 115°С. После окончания реакции растворитель упаривали в вакууме, а остаток хроматографировали с помощью препаративной тонкослойной хроматографии (ТСХ) в системе гексан-хлористый метилен 1 : 1. После упаривания элюента в вакууме продукт перекристаллизовали из системы этанол-дихлорметан 1 : 1. Получили 124 мг (87%) темно-красного мелкокристаллического порошка продукта Ru(CO)(EtOH)OEP.
Спектр 1Н ЯМР (CDCl3, δ, м. д.): 9.91 (4H, s, meso-Н), 4.02 (16Н, q, J = 7.6 Hz; CH2), 1.92 (24H, t, J = 7.6; CH3), 0.5 (1H, bs, OH), 0.15 (3H, m, CH3CH2O), –2.2 (2H, m, OCH2). ЭСП (CH2Cl2): λmax, нм (lgε) 394 (5.2), 517 (4.1), 549 (4.4).
Карбонил(пиридин)(2,3,7,8,12,13,17,18-октаэтилпорфиринато)рутений (Ru(CO)(Py)OEP).
Карбонил(этанол)(β-октаэтилпорфиринато) рутений (1) (50 мг, 0.07 ммоль) растворили в 20 мл дихлорметана и добавили 2 мл пиридина. Оставили раствор на сутки, а затем упарили в вакууме и остаток рекристаллизовали из системы дихлорметан-этанол-пиридин состава 25 : 25 : 1. Получили 49 мг (94%) темно-красного мелкокристаллического порошка комплекса Ru(CO)(Py)OEP.
Спектр 1Н ЯМР (CDCl3, δ, м. д.): 9.82 (4H, s, meso-Н), 5.82 (1H, t, J = 7.7 Гц, γ-НPy), 4.90 (2H, t, J = 7.2 Гц, β-НPy), 4.01 (16Н, m, CH2), 1.92 (24H, t, J = 7.6; CH3), 1.54 (2H, bs, α-НPy). ЭСП (CH2Cl2): λmax, нм (lgε) 396 (5.4), 518 (4.2), 549 (4.4). Спектр ЭСП соответствует ранее описанному [24].
Рентгено-структурный анализ
Рентгенодифракционные эксперименты были проведены на монокристальном дифрактометре Bruker KAPPA APEX II (MoKα-излучение, графитовый монохроматор) при температуре 100 K [25]. Параметры элементарных ячеек уточнены по всему массиву отражений [26]. Поправки на поглощение введены по методу SADABS [27]. Положение тяжелых атомов определено прямым методом (SHELXS97) [28]. На последующих разностных картах электронной плотности локализованы остальные атомы. Все неводородные атомы были уточнены как анизотропные, атомы водорода органических лигандов были размещены в геометрически вычисленных позициях с изотропным температурным фактором U = 1.2Ueq(C). Атом водорода (H2) в координированной молекуле спирта в Ru(CO)(EtOH)OEP был найден с помощью разностных карт электронных плоскостей и зафиксирован на расстоянии 0.85 Å до атома кислорода (O2), с ограничением U = 1.2Ueq(O). Уточнение структур проводили с помощью программы SHELXL-2014 [29].
Кристаллы, пригодные для РСА, были выращены методом изотермического испарения из смеси растворителей дихлорметан-этанол для Ru(CO)(EtOH)OEP и дихлорметан-этанол-пиридин для соединения Ru(CO)(Py)OEP, соответственно.
Соединения Ru(CO)(EtOH)OEP и Ru(CO) (Py)OEP кристаллизуются темно-красными иглами, среди которых для эксперимента были выбраны большие кристаллы размером 0.35 × 0.18 × 0.12 см и 0.31 × 0.18 × 0.15 см, соответственно, которые были наклеены на кончик стеклянного капилляра.
Кристаллографические данные и детали рентгеноструктурного эксперимента приведены в табл. 1, выбранные геометрические параметры – в табл. 2. Дополнительные кристаллографические параметры представлены в сопроводительной информации. Структурные данные депонированы в кристаллографическую базу данных (CCDC 1 876 316, 1 876 317).
Таблица 1.
Кристаллографические данные и детали рентгеноструктурного эксперимента для комплексов рутения
| Соединение | Ru(CO)(EtOH)OEP | Ru(CO)(Py)OEP |
|---|---|---|
| Формула | C39H51N4O2Ru | C42H49N5ORu |
| Формульный вес | 708.92 | 740.94 |
| Температура съемки | 100(2) | 100(2) |
| Кристаллическая система | Триклинная | Триклинная |
| Пространственная группа симметрии | P -1 | P -1 |
| a, Å | 10.0640(18) | 11.2667(4) |
| b, Å | 11.059(2) | 11.4510(4) |
| c, Å | 15.948(3) | 14.5684(5) |
| α, ° | 98.537(6) | 95.418(2) |
| β, ° | 97.357(8) | 96.099(2) |
| γ, ° | 96.742(6) | 104.764(2) |
| Vol., Å3 | 1723.9(5) | 1792.71(11) |
| Размер кристалла | 0.35 × 0.18 × 0.12 | 0.31 × 0.18 × 0.15 |
| Z | 2 | 2 |
| Dcalc (g cm–3) | 1.364 | 1.373 |
| μ(см–1) | 0.495 | 0.478 |
| Max and min пропускание | 0.5601/0.7450 | 0.6974/0.7456 |
| Кол-во собранных отражений | 10645 | 18238 |
| Кол-во независимых отражений Rint | 5074 | 7203 |
| Кол-во использованных | 3775 | 5808 |
| Кол-во параметров уточнения | 418 | 442 |
| Кол-во ограничений | 1 | 0 |
| 2θmax, ° | 47 | 52.5 |
| Goodnes-of-fit (GOF) on F2 | 1.044 | 1.034 |
| Largest difference peak and hole (eÅ–3) | 1.218/–1.472 | 0.452/–0.527 |
| R(F) [I > 2σ(I)] | 0.0703 | 0.0385 |
| wR(F2) [I > 2σ(I)] | 0.1649 | 0.0765 |
Таблица 2.
Некоторые межатомные расстояния и углы для комплексов рутения
| Ru(CO)(EtOH) OEP |
Ru(CO)(Py) OEP |
Ru(CO)(EtOH) TPPa |
Ru(CO)(Py) TPPb |
Ru(Py)2 OEPc |
Ru(CO)(THF) OEPd |
|
|---|---|---|---|---|---|---|
| Ru–N1 | 2.053(5) | 2.051(2) | 2.051 | 2.057 | 2.032 | 2.052 |
| Ru–N2 | 2.046(6) | 2.059(2) | 2.048 | 2.055 | 2.04 | 2.059 |
| Ru–N3 | 2.066(5) | 2.050(2) | 2.051 | 2.058 | 2.048 | 2.056 |
| Ru–N4 | 2.054(6) | 2.056(2) | 2.048 | 2.038 | 2.046 | 2.054 |
| Ru–C37 | 1.806(6) | 1.823(3) | 1.77 | 1.838 | – | 2.055 |
| Ru–N5 | – | 2.239(2) | – | 2.193 | 2.095 | 1.805 |
| Ru–O2 | 2.242(5) | – | 2.21 | – | – | – |
| C37–O1 | 1.176(8) | 1.155(3) | 1.16 | 1.14 | – | 2.242 |
| Ru–Cte | 0.11 | 0.08 | 0.07 | 0 | 1.143 | |
| <Ru–C37–O1 | 177.9(6) | 178.3(2) | 175.8 | 178.4 | – | 0.12 |
| <C37–Ru–N5 | – | 179.55(11) | – | 178.9 | – | 176.6 |
| <C37–Ru–O2 | 177.9(2) | – | – | – | – |
Квантово-химические расчеты
Все расчеты проводились методом DFT с использованием гибридного функционала B3LYP с обменным функционалом Бекке (B3) [30] и корреляционного функционала Ли–Янга–Парра (LYP) [31]. Базисный набор 3-21G использовался для описания электронно-волновых функций легких атомов. Для атома рутения использовали базисный набор с эффективным потенциалом для внутренних электронов LaNL2DZ. Структуры соединений были полностью оптимизированы без ограничения симметрии. После процедуры оптимизации геометрических параметров были проведены испытания на устойчивость волновой функции, а затем рассчитаны колебательные и термохимические параметры в стандартных условиях. Нахождение точки минимума подтверждалось отсутствием воображаемых частот колебаний. Электронная энергия соединений скорректирована с учетом нулевой колебательной энергии. Осуществлена тепловая коррекция энтальпии и свободной энергии. Все расчеты проводились с использованием программного пакета Gaussian 09 [32]. Расчитанные электронные структуры были проанализированы методом естественных орбиталей [33], реализованным в программном пакете Gaussian 09. С помощью этого метода молекулярная электронная волновая функция была представлена в базисе локализованных двухцентровых и одноцентровых орбиталей. Были определены порядки связей в базисе естественных атомных орбиталей и естественные заряды. Взаимодействия между естественными локализованными орбиталями, приводящие к их делокализации, были определены с помощью анализа матрицы Фока в базисе естественных орбиталей методом возмущения второго порядка.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез порфиринатов рутения
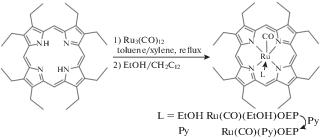
Синтез рутениевого комплекса порфирина проводили по модифицированной методике, основанной на методах И. Лорковича и П. Форда [22], а также Д. Долфина и др. [23] путем взаимодействия β-октаэтилпорфирина с додекакарбонилом рутения в смеси толуола и ксилола при кипячении при 115°С. Затем полученный продукт кристаллизовали из этанола с дихлорметаном (1 : 1), получая комплекс Ru(CO)(EtOH)OEP. Обработка комплекса Ru(CO)(EtOH)OEP пиридином в дихлорметане приводила к комплексу Ru(CO) (Py)OEP, который кристаллизовали из смеси дихлорметан-этанол-пиридин (25 : 25 : 1) (рис. 1).
При металлированиии порфирина карбонильным комплексом рутения(0) последний окисляется до рутения(II) с выделением водорода и избытка монооксида углерода. В полученном порфиринате рутений исключительно прочно удерживается внутри тетрапиррольного макроцикла, а аксиальные лиганды могут быть замещены. При этом карбонильный лиганд замещается с трудом, а лиганд, занимающий шестое координационное место, как правило, лабилен. Так, этанольный лиганд в Ru(CO)(EtOH)OEP легко заместился пиридином, приведя к комплексу Ru(CO)(Py)OEP. Предпочтительным для рутения является шестикоординационное состояние, поэтому получаемый изначально в реакции β-октаэтилпорфирина с додекакарбонилом рутения пятикоординационный комплекс карбонила порфирината рутения легко координирует даже слабые лиганды, такие как этанол, а также воду из воздуха [13, 14]. При наличии в порфириновом лиганде дополнительных периферийных лигандных центров в этом случае происходила их координация с образованием координационного полимера [11, 13].
Строение комплексов рутения
Комплексы Ru(CO)(EtOH)OEP и Ru(CO) (Py)OEP имеют триклинную кристаллическую систему, пространственная группа симметрии P-1, формульных единиц в ячейке 2. Катион рутения обладает зарядом 2+, а дианион порфирината выступает в качестве противоиона, который координируется с рутением атомами азота тетрапиррольного макроцикла (рис. 2, 3). Координационное число атома рутения равно 6, координационный полиэдр центрального атома может быть описан как искаженная тетрагональная бипирамида, основание которой составляют атомы азота порфиринового кольца, в качестве одной вершины выступает карбонильный атом монооксида углерода, а в качестве второй вершины – атом кислорода этанола в Ru(CO)(EtOH)OEP и атом азота пиридина в Ru(CO)(Py)OEP.
Рис. 2.
Структура комплекса Ru(CO)(EtOH)OEP. Эллипсоиды тепловых колебаний при 100 K приведены с вероятностью 50%.
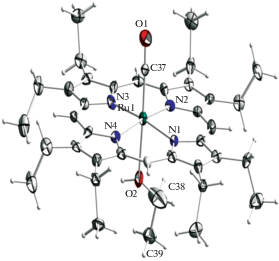
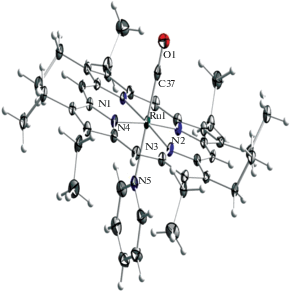
Рис. 3.
Структура комплекса Ru(CO)(Py)OEP. Эллипсоиды тепловых колебаний при 100 K приведены с вероятностью 50%.
Среднеквадратичное отклонение от плоскости в порфириновом кольце составляет 0.0223 Å для Ru(CO) (EtOH)OEP и 0.0860 Å для Ru(CO) (Py)OEP. Следует отметить, что у Ru(CO) (EtOH)OEP и Ru(CO)(Py)OEP различные конформации этильных групп в порфириновом цикле. В Ru(CO)(Py)OEP этильные фрагменты расположены симметрично относительно экваториальной плоскости тетрапиррольного макроцикла (C2–C21C22, C13–C31C32, C17–C33C34, C18–C35C36 направлены в одну сторону, в то время как C3–C23C24, C7–C25C26, C8–C27C28, C12–C29C30 в другую). В Ru(CO)(EtOH)OEP наблюдается отличная конформация этильных групп, относительно плоскости порфиринового кольца этильные фрагменты при атомах углерода C2–C21C22, C3–C23C24, C13–C31C32, C17–C33C34, C18–C35C36 направлены в одну сторону, в то время как C7–C25C26, C8–C27C28, C12–C29C30 в другую (рис. 2, 3).
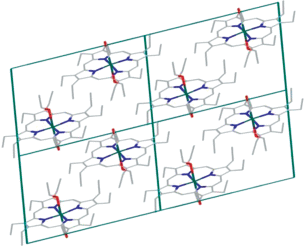
Примечательно, что гидрокси-группа этилового спирта не образует водородных связей, что, вероятно, вызвано пространственными препятствиями. В результате Ru(CO)(EtOH)OEP и Ru(CO)(Py)OEP образуют структуры островного типа. Пространственное расположение молекул в ячейке показано на рис. 4.
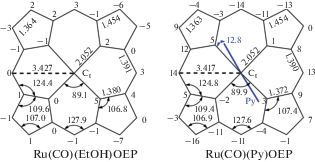
Расстояния между атомом рутения и аксиальными лигандами ясно отражают транс-влияние лигандов друг на друга. Как этанол, так и пиридин, будучи значительно более слабыми лигандами по сравнению с монооксидом углерода, образуют лабильные и существенно удлиненные (~10%) координационные связи: связь Ru-O(EtOH) в Ru(CO)(EtOH)OEP составляет 2.242 Å, а связь Ru-N(Py) в Ru(CO)(Py)OEP – 2.239 Å (табл. 2). Координационная связь Ru-C(CO) с транс-лигандом пиридином в Ru(CO)(Py)OEP составляет 1.823 Å, что заметно длиннее, чем эта связь в Ru(CO)(EtOH)OEP (1.806 Å), где более слабый транс-лиганд. Связь C=O короче в случае транс-пиридинового лиганда (1.155 Å), по сравнению с этанольным (1.176 Å). Изменение длин связей C=O и M–C обычно противоположно. Прочно связываемый монооксид углерода вызывает смещение атома рутения из плоскости тетрапиррольного макроцикла в свою сторону на 0.11 Å в Ru(CO)(EtOH)OEP и 0.08 Å в Ru(CO)(Py)OEP. В аналогичных комплексах мезо-тетрафенилпорфирина (TPP) смещение было чуть меньше: 0.07 Å (в Ru(CO)(Py)TPP) [16] и было невозможно определить из-за разупорядоченности молекул CO и EtOH [17]. Смещение, в общем случае, может быть вызвано несоответствием размеров катиона металла и порфириновой координационной полости или взаимодействием с аксиальным лигандом. В симметричном биспиридильном комплексе Ru(Pу)2OEP смещение отсутствует [34], следовательно, размер атома рутения вполне соответствует полости OEP. Следовательно, смещение атома Ru вызвано взаимодействием с лигандом CO. Порфиринат рутения Ru(Py)2OEP, в котором отсутствует карбонил, обладает плоским тетрапиррольным ядром, меньшим диаметром полости и более короткими связями атома рутения с атомами азота порфирина Ru–N(porphyrin): 2.041 Å в сравнении с 2.054 Å в Ru(CO)(Py)OEP. Таким образом, сильный лиганд CO ослабляет взаимодействие не только с транс-лигандом, но также и с цис-лигандами. Связи Ru–N(Py) в Ru(Py)2OEP были также короче в отсутствие сильного транс-влияния CO: 2.095 Å по сравнению с 2.239 Å в Ru(CO)(Py)OEP. Средняя длина связей Ru–N(porphyrin) составляет 2.055 Å в Ru(CO)(EtOH)OEP и 2.054 в Ru(CO)(Py)OEP, а в комплексах с TPP они несколько короче: 2.049 Å в Ru(CO)(EtOH)TPP и 2.052 Å в Ru(CO)(Py)TPP. Длины связей в Ru(CO)(EtOH)TPP близки к таковым в Ru(CO)(THF)OEP [35] за исключением связи C=O. Нормальный вектор плоскости пиридинового цикла составляет угол 12.8° с вектором N2–N4 (рис. 5), что довольно далеко от стерически наименее затрудненной ориентации 45°, приводя к контактам α-водородов пиридина с атомами азота порфирина: H37–N3 2.42 Å, H41–N1 2.44 Å. Более благоприятная ориентация пиридиновых колец наблюдалась для Ru(Py)2OEP и Ru(CO)(Py)TPP: 44°, 30° и 26°, соответственно. Восемь донорных этиловых заместителей в β-положениях тетрапиррольного макроцикла увеличивают электронную плотность ароматической системы, что приводит, с одной стороны, к повышению донорной способности атомов азота, а с другой, к уменьшению вклада обратного связывания с рутением. Увеличение электронной плотности на Ru, вероятно, может быть причиной более длинных связей Ru–N(Py) (0.046 Å) и Ru–O(EtOH) (0.03 Å) в комплексах OEP в сравнении с комплексами TPP. Геометрические параметры порфиринового ядра показаны на диаграмме на рис. 5.
Рис. 5.
Схема порфиринового ядра. Отображаются усредненные значения длин связей (в Å) и углов (в °). Перпендикулярные смещения (×100 Å) атомов из среднеквадратичной плоскости 24-х атомного ядра показаны вблизи соответствующих узлов. Положительные значения смещения относятся к стороне карбонильного лиганда. Ct – центр четырехугольника из пиррольных атомов азота.
DFT расчеты комплексов рутения
Квантово-химические расчеты комплексов рутения были осуществлены методами DFT с гибридным функционалом B3LYP и базисным набором 3-21G для легких атомов, а для атома рутения использовали базисный набор с эффективным потенциалом для внутренних электронов LaNL2DZ. Молекулярная волновая функция была проанализирована методом естественных орбиталей (natural bond orbitals) [36], с помощью которого были определены порядки связей в базисе естественных атомных орбиталей и естественные заряды. В табл. 3 показаны ключевые рассчитанные параметры рутениевых комплексов. Среднеквадратичные отклонения рассчитанных длин связей от экспериментальных составляют 0.025 и 0.032 Å для Ru(CO)(EtOH)OEP и Ru(CO)(Py)OEP, соответственно. Это достаточно близко, учитывая что расчет сделан для вакуума, а в кристалле дополнительно действуют силы упаковки.
Таблица 3.
Рассчитанные ключевые параметры комплексов рутения
| Параметры | Ru(CO)(EtOH) | Ru(CO)(Py) | Ru(CO)2 | Ru(CO) | RuOEP |
|---|---|---|---|---|---|
| OEP | OEP | OEP | OEP | ||
| Длины и углы связей: | |||||
| Ru–Nсрa | 2.070 | 2.071 | 2.079 | 2.065 | 2.062 |
| Ru–CO | 1.859 | 1.889 | 1.974 | 1.820 | – |
| Ru–L | 2.214 | 2.193 | – | – | – |
| C=O | 1.174 | 1.172 | 1.161 | 1.177 | – |
| <Ru–C–O | 179.5 | 179.7 | 179.9 | 180.0 | – |
| <L–Ru–CO | 176.7 | 179.8 | 180.0 | – | – |
| Порядки связей: | |||||
| Ru–Nсрa | 0.60 | 0.60 | 0.60 | 0.63 | 0.57 |
| Ru–CO | 1.28 | 1.20 | 0.96 | 1.41 | – |
| Ru–L | 0.37 | 0.45 | 0.96 | – | – |
| Σ(Ru-X)b | 4.06 | 4.05 | 4.34 | 3.91 | 2.28 |
| C=O | 2.13 | 2.13 | 2.25 | 2.10 | – |
| Заряды: | |||||
| Порфирин | –0.370 | –0.376 | –0.223 | –0.285 | –0.740 |
| Ru | –0.203 | –0.254 | –0.556 | –0.030 | 0.740 |
| CO | 0.332 | 0.341 | 0.389 | 0.314 | – |
| L | 0.241 | 0.289 | 0.390 | – | – |
| ΔHс, kcal/mol | –27.1 | –25.4 | –24.1 | –77.1d | – |
| ΔGc, kcal/mol | –15.6 | –12.8 | –14.5 | –65.6d | – |
Анализ электронно-волновой функции методом естественных орбиталей позволяет вычленить орбитали, соответствующие Льюисовской структуре, построенные из естественных локализованных орбиталей, а также их взаимодействия и делокализацию, определить порядки связей и заряды атомов [36–38]. Так, энергия взаимодействия неподеленной электронной пары атома кислорода этанола LP(1) O(EtOH) с разрыхляющей орбиталью σ-связи атома Ru с карбонилом BD*(1) Ru–CO составляет значительную величину в 14 ккал/моль (табл. 4). Очевидно, именно это взаимодействие является одной из основных причин транс-влияния в данном комплексе. В случае более сильного лиганда пиридина аналогичная энергия взаимодействия неподеленной электронной пары атома азота LP(1) N(Py) составляет около 18 ккал/моль. Близкой энергией (15 ккал/моль) обладают взаимодействия орбиталей транс-расположенных связей Ru–N: BD(1) Ru–N1 и BD*(1) Ru–N3. Энергия взаимодействия цис-расположенных связей Ru–N (BD(1) Ru–N1 и BD*(1) Ru–N2) на порядок меньше (1.2-1.3 ккал/моль). Влияние карбонильного лиганда (связи BD(1) Ru–CO) на цис-расположенные σ-связи Ru–N (BD*(1) Ru–N1) заметно сильнее: ~7 ккал/моль. Энергия взаимодействия второй неподеленной электронной пары атома кислорода этанола LP(2) O(EtOH) с разрыхляющей орбиталью почти параллельно ориентированной σ-связи BD*(1) Ru–N1 составляет 2.7 ккал/моль. При этом взаимодействия аксиальной электронной пары кислорода LP(1) O(EtOH) с экваториальными σ-связями Ru–N (BD*(1) Ru–N2 и BD*(1) Ru–N1) ничтожно малы: 0.13 и 0.07 ккал/моль соответственно. Энергия донорно-акцепторных взаимодействий валентных электронов рутения (LP(2) Ru и LP(3) Ru) с π-разрыхляющими орбиталями CO BD*(2) C=O и BD*(3) C=O, отражающих обратное связывание, составляет 32 ккал/моль для каждого. Основной вклад в связь атома рутения с шестым лигандом вносит взаимодействие неподеленных пар гетероатомов лигандов (LP(1) O(EtOH) и LP(1) N(Py)) с вакантной орбиталью рутения LP(4) Ru с энегргией порядка 100 ккал/моль. Дополнительный вклад вносят взаимодействия вакантной орбитали рутения LP(4) Ru со связывающими орбиталями O–H этанола BD(1) O–H(EtOH) и C–N пиридина BD(1) N–C16(Py) и BD(1) N–C18(Py) с энергиями порядка 16–17 ккал/моль.
Таблица 4.
Энергия взаимодействия локализованных орбиталей
| Соединение | Донорная орбиталь | Заселенность | Акцепторная орбиталь | Заселенность | Энергия взаимодействия, ккал/моль |
|---|---|---|---|---|---|
| Ru(CO)(EtOH) OEP |
LP(1) O(EtOH) | 1.765 | LP(4) Ru | 0.236 | 99.15 |
| BD(1) O–H(EtOH) | 1.985 | LP(4) Ru | 0.236 | 16.34 | |
| LP(2) Ru | 1.741 | BD*(3) C=O | 0.186 | 31.69 | |
| LP(3) Ru | 1.736 | BD*(2) C=O | 0.190 | 31.63 | |
| LP(1) O(EtOH) | 1.765 | BD*(1) Ru–CO | 0.108 | 13.95 | |
| BD(1) Ru–N1 | 1.900 | BD*(1) Ru–N3 | 0.102 | 15.29 | |
| BD(1) Ru–N1 | 1.900 | BD*(1) Ru–N2 | 0.101 | 1.22 | |
| BD(1) Ru–CO | 1.936 | BD*(1) Ru–N1 | 0.109 | 7.41 | |
| LP(2) O(EtOH) | 1.952 | BD*(1) Ru–N1 | 0.109 | 2.68 | |
| LP(1) O(EtOH) | 1.765 | BD*(1) Ru–N2 | 0.101 | 0.13 | |
| LP(1) O(EtOH) | 1.765 | BD*(1) Ru–N1 | 0.109 | 0.07 | |
| Ru(CO)(Py) OEP |
LP(1) N(Py) | 1.664 | LP(4) Ru | 0.258 | 101.34 |
| BD(1) N–C17(Py) | 1.981 | LP(4) Ru | 0.258 | 17.55 | |
| BD(1) N–C16(Py) | 1.981 | LP(4) Ru | 0.258 | 17.53 | |
| LP(3) Ru | 1.732 | BD*(3) C=O | 0.166 | 32.47 | |
| LP(2) Ru | 1.752 | BD*(2) C=O | 0.165 | 31.82 | |
| LP(1) N(Py) | 1.664 | BD*(1) Ru–CO | 0.126 | 17.56 | |
| BD(1) Ru–N1 | 1.902 | BD*(1) Ru–N3 | 0.105 | 15.12 | |
| BD(1) Ru–N1 | 1.902 | BD*(1) Ru–N2 | 0.105 | 1.29 | |
| BD(1) Ru–CO | 1.939 | BD*(1) Ru–N1 | 0.105 | 6.43 | |
| LP(1) N(Py) | 1.664 | BD*(1) Ru–N1 | 0.105 | 0.37 |
Атом рутения в комплексе шестикоординационен, но четырехвалентен, формально имея степень окисления +2. Полуторная связь Ru–CO в Ru(CO)OEP ослабляется в результате присоединения шестого лиганда. Чем сильнее лиганд, тем выше его порядок связи с рутением и сильнее степень ослабления связи Ru–CO. Распределение зарядов отражает суммарно донорный характер аксиальных лигандов, несущих заметный положительный заряд. Величина заряда коррелирует с силой лиганда. CO заряжен максимально положительно, несмотря на наличие значительного обратного связывания, при котором атом рутения отдает свои электроны лиганду. Свободная энергия образования всех комплексов Ru(CO)(L)OEP из Ru(CO)OEP и L примерно одинакова, составляя порядка 15 ккал/моль, однако на практике комплекс с двумя карбонилами Ru(CO)2OEP не получали, вероятно, вследствие того, что монооксид углерода улетучивался из реакционной смеси. Первая молекула CO при этом удерживается намного сильнее, что видно по величине свободной энергии образования Ru(CO)OEP из RuOEP и CO, составляющей около 66 ккал/моль.
ЗАКЛЮЧЕНИЕ
Порфиринаты рутения(II) с координированными аксиальными лигандами: монооксидом углерода, с одной стороны, и этанолом или пиридином, с другой стороны, образуют схожие кристаллические структуры островного типа. Лиганд, занимающий шестое координационное место в транс-положении к монооксиду углерода, обладает повышенной лабильностью. Это отражается в существенном удлинении связи лигандного центра с атомом рутения и соответствующем снижении энергии связывания. При этом удлинение связи составляет ~10% и его степень примерно одинакова как для слабого лиганда (этанол), так и для достаточно сильного (пиридин), поскольку определяется не столько силой лиганда, сколько особенностью структуры комплекса, в которой атом рутения смещен перпендикулярно плоскости макроцикла в направлении карбонильного лиганда, с которым образует прочную связь. Взаимное влияние лигандов можно рассматривать с точки зрения взаимодействия естественных локализованных орбиталей, максимальное перекрывание которых достигается в случае транс-расположения лигандов. Продолжающиеся исследования аналогичных и других порфиринатов рутения позволят выявить структурные закономерности и их взаимосвязь со свойствами комплексов, что способствует пониманию функционирования аналогичных комплексов железа в природных энергетических центрах, в том числе и в геме.
Список литературы
Shalabi A.S., Abdel Aal S., El Mahdy A.M. // Molecular Simulation. 2013. V. 39. P. 689.
Prodi A., Chiorboli C., Scandola F. et al. // J. Am. Chem. Soc. 2005. V. 127. P. 1454.
Schmitt F., Govindaswamy P., Süss-Fink G. et al. // J. Med. Chem. 2008. V. 51. P. 1811.
Lilge L. Use of Ruthenium Complexes as Photosensitizers in Photodynamic Therapy. In Ruthenium Complexes / Eds. Browne W.R., Holder A.A., Lawrence M.A. et al. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim, Germany, 2018.
Bogoeva V., Siksjø M., Sæterbø K.G. et al. // Photodiagnosis and Photodynamic Therapy. 2016. V. 14. P. 9.
Maeda K., Terada T., Iwamoto T. et al. // Org. Lett. 2015. V. 17. P. 5284.
Szulbinski W., Strojek J.W. // Inorg. Chim. Acta. 1986. V. 118. P. 91.
Wang C., Shalyaev K.V., Bonchio M. et al. // Inorg. Chem. 2006. V. 45. P. 4769.
Jiang G., Chen J., Thu H.-Y. et al. // Angew. Chem. Int. Ed. 2008. V. 47. P. 6638.
Barona-Castaño J., Carmona-Vargas C., Brocksom T. et al. // Molecules. 2016. V. 21. P. 310.
Beletskaya I., Tyurin V.S., Tsivadze A.Y. et al. // Chem. Rev. 2009. V. 109. P. 1659.
Stulz E., Scott S.M., Ng Y.-F. et al. // Inorg. Chem. 2003. V. 42. P. 6564.
Yu J., Mathew S., Flavel B.S. et al. // J. Am. Chem. Soc. 2008. V. 130. P. 8788.
James B.R., Dolphin D., Leung T.W. et al. // Canadian J. Chem. 1984. V. 62. P. 1239.
Tanaka K., Mazumder K., Siwu E.R. O. et al. // Tetrahedron Lett. 2012. V. 53. P. 1756.
Little R.G., Ibers J.A. // J. Am. Chem. Soc. 1973. V. 95. P. 8583.
Bonnet J.J., Eaton S.S., Eaton G.R. et al. // J. Am. Chem. Soc. 1973. V. 95. P. 2141.
Andreev S.V., Zverev S.A., Zamilatskov I.A. et al. // Acta Cryst. Sec. C. 2017. V. 73. P. 47.
Зверев С.А., Андреев С.В., Замилацков И.А. и др. // Журн. физ. химии. 2017. Т. 91. С. 1331.
Paine J.B., Kirshner W.B., Moskowitz D.W. et al. // J. Org. Chem. 1976. V. 41. P. 3857.
Sessler J.L., Mozaffari A., Johnson M.R. // Org. Synth. 1982. V. 70. P. 68.
Lorković I.M., Ford P.C. // Inorg. Chem. 1999. V. 38. P. 1467.
Barley M., Becker J.Y., Domazetis G. et al. // Canadian J. Chem. 1983. V. 61. P. 2389.
Antipas A., Buchler J.W., Gouterman M. et al. // J. Am. Chem. Soc. 1978. V. 100. P. 3015.
APEX2 / Bruker AXS Inc. Madison, Visconsin, USA. 2007.
SAINT-Plus Version 6.01 / Bruker AXS Inc. Madison, Visconsin, USA. 1998.
Sheldrick G.M. SADABS / Bruker AXS Inc. Madison, Visconsin, USA. 2004.
Sheldrick G.M. SHELXS97 and SHELXL97 / University of Göttingen. Germany. 1997.
Sheldrick G.M. // Acta Crystallogr. Sect. C. 2015. V. 71. P. 3.
Becke A.D. // J. Chem. Phys. 1993. V. 98. P. 5648.
Lee C., Yang W., Parr R.G. // Phys. Rev. B. 1988. V. 37. P. 785.
Frisch M.J., Trucks G.W., Schlegel H.B. et al. // Gaussian 09, Revision D.01, Gaussian Inc., Wallingford CT, USA. 2013.
Glendening E., Reed A., Carpenter J., Weinhold F. // Quantum Chem. Prog. Exchange Bull. 1990. V. 10. P. 58.
Hopf F.R., O’Brien T.P., Scheidt W.R. et al. // J. Am. Chem. Soc. 1975. V. 97. P. 277.
Rebouças J.S., Cheu E.L.S., Ware C.J. et al. // Inorg. Chem. 2008. V. 47. P. 7894.
Weinhold F. // J. Comp. Chem. 2012. V. 33. P. 2363.
Landis C.R., Weinhold F. The NBO View of Chemical Bonding. In The Chemical Bond / Eds. Frenking G., Shaik S. Wiley-VCH Verlag GmbH & Co. KGaA. Weinheim, Germany, 2014.
Weinhold F., Landis C.R., Glendening E.D. // International Reviews in Physical Chemistry. 2016. V. 35. P. 399.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов