Физикохимия поверхности и защита материалов, 2020, T. 56, № 1, стр. 85-90
Электрохимический синтез и физико-химические свойства наноструктурированных оксидных систем Al2O3–ZrO2–MgO
А. Ф. Дресвянников 1, Е. В. Петрова 1, А. И. Хайруллина 1, *
1 Казанский национальный исследовательский технологический университет
420015 Республика Татарстан, Казань, ул. Карла Маркса, 68, Россия
* E-mail: alina17xaj@mail.ru
Поступила в редакцию 30.07.2018
После доработки 24.07.2019
Принята к публикации 06.08.2019
Аннотация
Предложен способ получения оксидных систем Al2O3–ZrO2–MgO на основе использования электрогенерированных реагентов, исследованы их физико-химические свойства. Показано, что применение коаксиального электрохимического реактора позволяет реализовать гидродинамический режим, обеспечивающий гомогенизацию продуктов реакций и формирование наноразмерных частиц прекурсоров оксидных систем. Установлено, что изменение состава электролита и плотности анодного тока позволяют регулировать фазовый состав, морфологию и размер частиц прекурсоров. Показано, что в процессе синтеза тройной оксидной системы Al2O3–ZrO2–MgO формируется шпинель Al2MgO4, рост содержания которой способствует стабилизации тетрагональной фазы t-ZrO2 вплоть до температуры 1600°С.
ВВЕДЕНИЕ
В последнее время востребованы керамические материалы на основе бинарных систем Al2O3–ZrO2, где диоксид циркония стабилизирован в тетрагональной модификации оксидами металлов, ионный радиус которых близок к ионному радиусу циркония (CaO, MgO, Y2O3, оксиды РЗЭ) [1, 2].
Керамика на основе Al2O3–ZrO2, содержащая фазу t-ZrO2, характеризуется высокой трещиностойкостью, прочностью, твердостью, вязкостью разрушения, устойчивостью к воздействию агрессивных сред, температурой плавления, биологической совместимостью [3–5], которые обусловливают ее применение в различных областях промышленности (высокотемпературные огнеупоры, режущие и абразивные инструменты, детали двигателей и т.д.) [4]. Комбинация Al2O3 с ZrO2 тормозит низкотемпературную деградацию керамического материала во влажных средах за счет неконтролируемого фазового перехода t-ZrO2 → m-ZrO2, сопровождающегося увеличением объема.
Фазовый состав, структура, морфология, размер частиц порошков на основе Al2O3–ZrO2, могут меняться в значительной степени в зависимости от способа получения, количества и вида модифицирующей добавки [6].
Согласно литературным данным [7–9], на кинетику фазовых превращений и рост кристаллитов в процессе термической обработки алюмоциркониевых оксидных порошков большое влияние оказывает не только природа, но и способ получения, а также количество вводимого модификатора, который может влиять на изменение границ температурного интервала тетрагонально-моноклинного фазового перехода ZrO2 [10]. Возможность методов соосаждения может быть расширена за счет применения дополнительных воздействий, например, электрического поля, на реакционную смесь и осадок.
Однако, число исследований, посвященных исследованию процессов получения наноструктурированных порошков алюмоциркониевой оксидной системы, модифицированной ионами Mg2+, с помощью электролиза водных растворов соответствующих соединений солей циркония и магния и последующей термообработкой продуктов, крайне невелико [11].
Поэтому целью работы является создание способа получения предшественников оксидной системы Al2O3–ZrO2–MgO, в условиях воздействия внешнего электрического поля в коаксиальном реакторе-электролизере с растворимым алюминиевым анодом и существенно различающимися площадями электродов, а также оценка его влияния на физико-химические свойства этой системы и фазовые переходы, протекающие в ней при повышенной температуре.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактор – электролизер, используемый для получения прекурсоров высокодисперсных оксидов в водных растворах, содержит коаксиально расположенные цилиндрические электроды с существенно отличающимися площадями (102 ≤ Sвнешн/Sвнутр < 103). Конструктивно он аналогичен конденсатору с сильно неоднородным электрическим полем [7]. Центральный электрод (катод) изготовлен из стали Х18Н10Т, анодом являлся алюминиевый цилиндр (алюминий марки А5).
При получении высокодисперсных предшественников оксидных систем в качестве электролита использовали раствор хлорида натрия с концентрацией 0.5 моль/л, с добавлением соответствующего объема растворов MgCl2 и Zr(NO3)4. Регулирование содержания ZrO2 и MgO в составе алюмоксидной системы обеспечивали за счет варьирования концентрации вводимого модификатора. Процесс проводили при плотности анодного тока 84 А/м2, выбранной исходя из результатов предварительных экспериментов.
После окончания процесса осадок подвергали старению в маточном растворе. Далее его отфильтровывали и промывали бидистиллятом до нейтральной реакции.
Определение фазового состава синтезированных образцов проводили на рентгеновском дифрактометре D2 PHASER, Bruker с использованием CoKα-излучения. Идентификацию кристаллических фаз осуществляли путем сопоставления полученных экспериментальных значений межплоскостных расстояний и относительных интенсивностей с эталонными, приведенными в международной картотеке PDF-2. Расчет значений областей когерентного рассеяния D(ОКР) рассчитывали с помощью программы EVA.
Рентгенофлуоресцентный анализ на предмет установления элементного состава синтезированных образцов проводили с помощью рентгенофлуоресцентного спектрометра “S1 TITAN”, Bruker.
Для определения гранулометрического состава использовали лазерный анализатор Mastersizer 2000, Malvern.
Исследование морфологии полученных образцов осуществляли методом сканирующей электронной микроскопии на высокоразрешающем автоэмиссионном электронном микроскопе Auriga CrossBeam, Carl Zeiss.
Определение удельной поверхности методом БЭТ проводили посредством анализатора NOVA 1200.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Получение индивидуальных и смешанных оксидов в растворах это сложный многостадийный процесс, включающий стадии гидролиза, конденсации и агрегирования частиц. В конечном итоге условия осаждения – это один из основных факторов, определяющих физико-химические свойства оксидных систем [12].
В работах [13–16] показано, что активация алюминия при анодной поляризации обусловлена образованием на поверхности металла промежуточных комплексов с частичным переносом заряда $\left[ {{\text{AlC}}{{{\text{l}}}_{{\beta }}}} \right]_{s}^{{ - {\beta + \sigma }}},$ где σ – заряд иона металла (σ < 3). Промежуточный комплекс рассматривается как низковалентная частица, которая при взаимодействии с компонентами раствора (водой или ионами гидроксония) окисляется, что объясняет явление отрицательного дифференц-эффекта (ОДЭ). Увеличение ОДЭ (скорости выделения водорода) при анодно-анионной активации обусловлено процессами на границе раздела металл/раствор в порах, а изменение потенциала электрода отражает совокупность электрохимических процессов на электроде, включая миграцию анионов хлора в капиллярно-пористом пространстве оксидно-гидроксидной пленки [13, 17–19].
Кривизна поверхности электрода обуславливает неравномерность электрического поля и его высокую напряженность. Чем выше напряженность поля и величина заряда, тем больше пондеромоторные силы, отрывающие пузырек от поверхности электрода и меньше его размер [20]. Таким образом, дисперсия пузырьков газа и электролита движется вверх, и в силу непрерывности потока в закрытом пространстве образует вихрь. Это позволяет уменьшить толщину диффузионного слоя у поверхности твердых частиц в результате роста скорости жидкости, и суспендировать сформировавшиеся частицы твердого вещества в объем более равномерно, а также равномерно распределить компоненты реакционной смеси в объеме жидкости за счет возникшей турбулентности.
Поэтому интенсивное выделение водорода на центральном электроде и его разогрев приводят к конвективному переносу продуктов реакций на этом электроде по торообразной траектории по направлению от центра к периферии. Это позволяет в течение короткого времени доставлять продукты катодной реакции, например, ОН-ионы, радикалы и т.п. вплоть до поверхности анода [20].
За счет высокой скорости движения пузырьков газа, а следовательно и жидкости (до нескольких десятых метра в секунду), имеет место быстрое смешивание реагентов. В то же время этот процесс препятствует взаимной адгезии частиц. Специфический гидродинамический режим, реализующийся в коаксиальном бездиафрагменном электролизере позволяет обеспечить перенос генерирующих на центральном электроде (катоде) OH-ионов от центра к периферии реактора за счет интенсивного выделения водорода на узкоцилиндрическом катоде, что приводит к быстрому смешиванию реагентов и, в тоже время, препятствует агрегированию формирующихся частиц [21].
В результате совокупности протекания процессов анодного растворения алюминия, а также взаимодействие ионов гидроксила с ионами металлов (электрогенерированными и присутствующими в электролит) в объеме реактора протекает формирование первичных частиц высокодисперсных предшественников оксидов (табл. 1) и их дальнейший рост.
Таблица 1.
Состав полученных образцов в пересчете на оксиды
| № | Состав образцов в пересчете на оксиды, ω, мас. % | n(H2O), моль/г | ||
|---|---|---|---|---|
| Al2O3 | ZrO2 | MgO | ||
| 1 | 100 | – | – | 0.022 |
| 2 | 95 | 5 | – | 0.030 |
| 3 | 92 | – | 8 | 0.025 |
| 4 | 88 | 9 | 3 | 0.022 |
| 5 | 88 | 8 | 4 | 0.024 |
| 6 | 88 | 6 | 6 | 0.023 |
Устойчивость суспензий к агломерации характеризуются значениями ξ-потенциала, который зависит от различных свойств дисперсной фазы, в частности, размера частиц, химического и фазового состава, а также природы дисперсионной среды [22].
Избыток ОН–-ионов, поступающих от катода, постепенно приводит к гидроксилированию поверхности частиц сообщая им отрицательный заряд, а одновременное присутствие в составе электролита разновалентных ионов металлов (Al3+, Zr4+ и Mg2+), отличающихся коагулирующей способностью, может привести к адсорбции противоионов в сверхэквивалентных количествах. Совокупность этих факторов определяет склонность частиц к изменению знака ξ-потенциала [22, 23].
При получении прекурсора Al2O3 в реакторе-электролизере формируется положительно заряженные частицы, характеризующиеся дзета потенциалом ξ 25 мВ. В результате гидроксилирования поверхности частиц вследствие непрерывного генерирования ОН–-ионов на катоде с течением времени заряд и его знак может меняться. Введение ионов Zr4+ (рис. 1) в электролит позволяет повысить величину ξ-потенциала по сравнению с таковой для частиц Al2O3, а дополнительное введение ионов Mg2+ в систему Al2O3–ZrO2 способствует формированию устойчивых, положительно заряженных частиц.
Определение удельной поверхности и диаметра пор методом тепловой адсорбции азота (метод БЭТ) показывает, что увеличение оксида магния в образцах приводит к снижению величины удельной поверхности с 48 до 30 м2/г; при этом средний диаметр пор увеличивается с 17 до 27 нм.
Исследование полученных образцов с помощью сканирующей электронной микроскопии выявило, что частицы индивидуального оксида алюминия (рис. 2а) и алюмоциркониевой оксидной системы (рис. 2б) полученные с электрогенерированием реагентов в реакторе с растворимым анодом представлены высокодисперсными частицами, имеющими форму близкую к сферической, размером ~50 нм, а также агрегатами размером до 200 нм [24]. Для систем Al2O3–MgO (рис. 2в) и Al2O3–ZrO2–MgO (рис. 2г) характерна пластинчатая форма частиц с закругленными углами с размерами в пределах 20–80 нм.
Известно, что индивидуальный диоксид циркония неустойчив к фазовому переходу t-ZrO2 → m-ZrO2 и теряет тетрагональную фазу при нагревании до 900°С [25]. Превращение тетрагональной фазы в моноклинную имеет мартенситный характер и сопровождается значительным объемным эффектом. Моноклинная m-ZrO2 фаза имеет меньшую плотность, чем тетрагональная, объем материала при фазовом превращении t → m увеличивается на 3–5%, что приводит к разрыхлению [25]. Последнее неблагоприятно сказывается на физико-механических свойствах материала.
По результатам исследования гранулометрического состава (рис. 3) можно заключить, что для исследуемых оксидных систем характерно монодисперсное распределение частиц по размерам. Средний размер агрегатов находится в пределах 12–30 мкм.
Рис. 3.
Распределение частиц по размерам, для образцов, полученных электрохимическим способом и прокаленных при 1100°С.
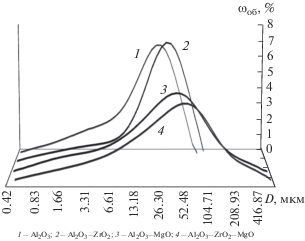
Для систем, модифицированных ионами Mg2+ также характерно монодисперсное распределение частиц по размерам; средний размер агрегатов увеличивается примерно в два раза в зависимости от количества введенного MgO.
Согласно данным рентгенофазового анализа образцы индивидуального оксида алюминия при 80°С, представлены фазами бемита и байерита и аморфной составляющей, которые в результате термообработки при 750°С трансформируются в смесь оксидов η + γ-Al2O3. Термическая обработка при 750°С приводит также к формированию метастабильных модификаций t-ZrO2 и γ-Al2O3. Прокаливание при 1100°С способствует переходу γ-Al2O3 → θ-Al2O3, с сохранением тетрагональной фазы диоксида циркония Дальнейшее повышение температуры прокаливания до 1100°С способствует образованию θ-Al2O3, переходящего в корунд при 1200°С.
В случае системы Al2O3–MgO фазовые переходы алюмоксидной составляющей можно представить в виде условной схемы
Для образцов тройной оксидной системы Al2O3–ZrO2–MgO фазовые превращения зависят от содержания оксида магния. Так, для образцов № 4–5 вплоть до температуры 1100°С сохраняются метастабильные формы оксида алюминия θ-Al2O3 (образец № 4) и γ + θ-Al2O3 (образец № 5), на фоне которых наблюдаются рефлексы t-ZrO2 и шпинели Al2MgO4.
С ростом содержания MgO до 6 мас. % (образец № 6) при 1100°С на дифрактограмме наблюдаются четко выраженные рефлексы α-Al2O3, t-ZrO2 и шпинели Al2MgO4 (рис. 4). Дальнейшее повышение температуры способствует появлению и моноклинной кристаллической модификации m‑ZrO2, доля которой увеличивается с ростом температуры (рис. 4). При этом следует отметить, что повышение температуры до 1400°С приводит к сохранению тетрагональной фазы t-ZrO2, а средний размер кристаллитов увеличивается незначительно.
Рис. 4.
Рентгеновские дифрактограммы системы Al2O3–ZrO2–MgO (обр. № 6) при различных условиях термического воздействия.

Рассчитанные значения ОКР приведены в табл. 2 демонстрируют небольшой рост размеров кристаллитов в процессе термического воздействия, который связан преимущественно с фазовыми превращениями.
Таблица 2.
Результаты исследования рентгенофазового и рентгеноструктурного состава тройной оксидной системы Al2O3–ZrO2–MgO (обр. № 6) при различных условиях термообработки
| Tемпература термообработки, °С | Содержание фазы, мас. %/ОКР, нм | |||||
|---|---|---|---|---|---|---|
| t-ZrO2 | α-Al2O3 | θ-Al2O3 | γ-Al2O3 | Al2MgO4 | m-ZrO2 | |
| 1100 | 38/27 | 31/63 | 3/– | 4/– | 24/25 | – |
| 1200 | 13/58 | 62/37 | – | – | 24/40 | 1/– |
| 1400 | 10/50 | 65/51 | – | – | 24/35 | 1/– |
| 1600 | 6/52 | 65/58 | – | – | 25/48 | 4/27 |
Таким образом, оксидные системы Al2O3–ZrO2–MgO, полученные путем соосаждения в объемном пространстве бездиафрагменного коаксиального электролизера с существенно различающимися площадями электродов и последующей термической обработки осадка, состоит из α‑Al2O3, t-ZrO2 и Al2MgO4, демонстрируя при этом стабильность фазы t-ZrO2 вплоть до высоких температур 1400–1600°С.
ЗАКЛЮЧЕНИЕ
Установлено, что при использовании реактора-электролизера с существенно различающими площадями электродов и растворимым алюминиевым анодом в результате взаимодействия электрогенерированных реагентов с компонентами электролита, получены предшественники сложных оксидных систем Al2O3–ZrO2–MgO.
Исследовано влияние термического воздействия на фазовый состав и размер кристаллитов оксидной системы Al2O3–ZrO2–MgO. Установлено, что алюмоциркониевая оксидная система, не содержащая атомов магния, содержит метастабильную тетрагональную фазу t-ZrO2. Дальнейшее увеличение температуры до 1200°С и выше вызывает появление моноклинной кристаллической модификации m–ZrO2, доля которой постоянно растет с повышением температуры отжига. Введение магния до 6 мас. % приводит к стабилизации тетрагональной фазы ZrO2 с размерами частиц до 100 нм вплоть до 1600°С.
Работа выполнена на оборудовании Центра коллективного пользования научным оборудованием “Наноматериалы и нанотехнологии” Казанского национального исследовательского технологического университета при поддержке РФФИ и Правительства Республики Татарстан в рамках научного проекта № 18-43-160027.
Список литературы
Lvarez-Clemares I., Borrell A., Agouram S., Torrecillas R., Fernández A. // Scripta Materialia. 2013. V. 68. № 8. P. 603–606.
Бардаханов С.П., Ким А.В., Лысенко В.И., Номоев А.В. // Неорганические материалы. 2009. Т. 45. № 3. С. 379–384.
Погребенков В.М., Ушакова Т.В., Андриец С.П., Горбатенко В.В. // Огнеупоры и техническая керамика. 2013. № 4–5. С. 28–34.
Meng F., Liu C., Zhang F., Tian Z., Huang W. // J. Alloys and Compounds. 2012. V. 512. № 1. P. 63–67.
Подзорова Л.И., Шворнева Л.И., Ильичева А.А., Аладьев А.А., Пенькова О.И. // Неорганические материалы. 2013. Т. 49. № 4. С. 389–394.
Габелков С.В., Тарасов Р.В., Полтавцев Н.С., Курило Ю.П., Старолат Н.Ф. // Неорганические материалы. 2007. Т.43. № 4. С. 462–470.
Романова Р.Г., Петрова Е.В. // Журн. физической химии. 2006. Т. 80. № 6. С. 1110–1116.
Кульков С.Н., Буякова С.П. // Российские нанотехнологии. 2007. Т. 2. № 1–2. С. 119–132.
Xike Tian, Yanling Zeng, Ting Xiao, Chao Yang, Yanxin Wang, Suxin Zhang // Microporous and Mesoporous Materials. 2011. V. 143. P. 357–361.
Rezaei M., Alavi S.M., Sahebdelfar S., Zi-Feng Yan. // J. Porous Mater. 2009. № 1. P. 497–505.
Kucza W., Oblakowski J., Gajerski R., Labus S., Danielewski M., Malecki A., Morgiel J., Michalski A. // J. Thermal Analysis and Calorimetry. 2007. V. 88. № 1. P. 65–69.
Bondioli F., Leonelli C., Manfredini T., Ferrari A.M., Caracoche M.C. et al. // J. Amer. Ceram. Soc. 2005. V. 88. № 3. P. 633–638.
Попов Ю.А. // Успехи химии. 2005. Т. 74. № 5. С. 435–451.
Curioni M., Scenini F. // Electrochimica Acta. 2015. V. 180. P. 712–721.
Alwitt R.S. // Oxides and oxide films. 1976. V. 4. P. 169–254.
Thiruchitrambalam M., Palkar V.R., Gopinathan V. // Materials Letters. 2004. V. 58. P. 3063–3066.
Колотыркин Я.М. // Успехи химии. 1962. Т. 3. С. 322–325.
Изотова С.Г. // Журн. прикладной химии. 1985. № 9. С. 2115–2118.
Зарцын И.Д., Самарцев В.М., Маршаков И.К. // Физикохимия поверхности и защита материалов. 1994. Т. 30. № 1. С. 45–47.
Дресвянников, А.Ф., Дресвянников Ф.Н., Ситников С.Ю. Электрохимическая очистка воды. Казань: Изд-во КНИТУ, 2004. 207 с.
Батаронов И.Л. // Международный научный журн. Альтернативная энергетика и экология. 2007. № 1. С. 118–126.
Huang S., Vanmeensel K., Van der Biest O., Vleugels J. // Materials Science and Engineering. 2010. V. 527. № 3. P. 584–589.
Stepova N., Kushka O. // Chemistry and chemical technology. 2011. V. 5. № 2. P. 155–160.
Петрова Е.В., Дресвянников А.Ф., Дарякенари М.А., Хайруллина А.И. // Журн. физической химии. 2016. V. 90. № 5. С. 762–767.
Chen F., Hong Q., Guo-Qin Xu, Andy Hor T.S., Shen S. // J. Amer. Ceram. Soc. 2005. V. 88. № 9. P. 2649–2651.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов




