Физикохимия поверхности и защита материалов, 2020, T. 56, № 1, стр. 3-7
Адсорбция метана на микропористом углеродном адсорбенте с бимодальным распределением пор по размерам
А. А. Фомкин 1, *, А. А. Прибылов 1, А. Г. Ткачев 2, **, Н. Р. Меметов 2, А. В. Мележик 2, А. Е. Кучерова 2, И. Н. Шубин 2, А. В. Школин 1, И. Е. Меньщиков 1, А. Л. Пулин 1, С. А. Жедулов 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119071 Москва, Ленинский просп., 31, Россия
2 ФГБОУ ВО Тамбовский государственный технический университет Министерства науки и высшего образования Российской Федерации
392000 Тамбов, ул. Ленинградская, 1, Россия
* E-mail: fomkinaa@mail.ru
** E-mail: nanotam@yandex.ru
Поступила в редакцию 16.07.2019
После доработки 03.09.2019
Принята к публикации 10.09.2019
Аннотация
На микропористом углеродном адсорбенте МПУ-007 с широким распределением пор по размерам исследована адсорбция метана при давлениях до 40 МПа и температурах 303, 313, 323, 333 К. Максимальная величина адсорбции метана достигает 43.36 мас. % при 303 К и 40 МПа. На основе полученных данных построены изостеры адсорбции, которые хорошо аппроксимируются линейными зависимостями в координатах lnP–1/Т при постоянной величине адсорбции. Рассчитаны зависимости дифференциальных мольных изостерических теплот адсорбции метана на углеродном микропористом адсорбенте МПУ-007 от величины адсорбции при температурах 303, 313, 323, 333 К. Теплота адсорбции метана 14 кДж/моль постоянна в начальной области заполнений микропор до ≈5 ммоль/г, а затем плавно снижается до 8 кДж/моль при 25 ммоль/г, 303 К и до 2 кДж/моль при 24 ммоль/г при 323 К. Такой ход кривых теплоты адсорбции может быть следствием широкого распределения пор по размерам и образования ассоциатов в адсорбате.
ВВЕДЕНИЕ
Метан является основным компонентом природного газа, широко применяемого в современной энергетике. Из-за низкой плотности его применение требует использования технологий, позволяющих увеличить плотность, потому наибольшее распространение получили технологии компримированного природного газа (КПГ) и сжиженного при 111.4 К природного газа (СПГ). В технологии КПГ сжатие газа сопряжено с высокими энергозатратами. Для транспортировки газа используются трубопроводы и сосуды высокого давления, выполненные из специальных сталей. В технологии СПГ хранение природного газа в ожиженном состоянии осуществляется при криогенных температурах и атмосферном давлении, и реализуется с применением специального высокотехнологичного оборудования. Для систем СПГ характерна неизбежная потеря газа из-за его испарения. Этот способ наиболее эффективен и широко используется при хранении и транспортировке газа в сверхбольших объемах [1]. Системы КПГ и СПГ имеют высокие риски пожаро- и взрывоопасности.
Адсорбированный природный газ (АПГ) может стать еще одним перспективным способом хранения и транспортировки газа [2, 3]. Увеличение плотности метана при физической адсорбции в микропористых адсорбентах позволяет существенно повысить удельный объем газа в системе хранения. При этом в зависимости от пористости адсорбента, при одном и том же количестве запасаемого газа в системе, давление может быть снижено в несколько раз, по сравнению с технологией КПГ и повышена пожаро- и взрывобезопасность.
В работах [2‒11] показано, что для адсорбции метана наиболее адсорбционно-активными являются углеродные микропористые адсорбенты. Однако задача выбора оптимального адсорбента на сегодняшний день не решена в полном объеме. В [9] показано, что наиболее перспективными адсорбентами для аккумулирования метана являются так называемые “прецизионные” адсорбенты. Для них важно химическое состояние поверхности, задающее высокую энергию взаимодействия молекул метана с поверхностью адсорбента, оптимальное сочетание размеров пор и диаметров молекул метана, высокий удельный объем микропор. Хотя большинство существующих микропористых углеродных адсорбентов не соответствуют вышеупомянутым требованиям, тем не менее, важно исследовать адсорбцию метана на адсорбенте с высоким объемом микропор, определяющем интегральную адсорбционную активность адсорбента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Адсорбент
В работе использовали микропористый углеродный адсорбент МПУ-007 [10]. Адсорбент получали методом химической активации смеси кукурузного декстрина, этиленгликоля и фенолформальдегидной смолы, импрегнированной гидроксидом калия. Активацию проводили при 750°С. После активации реакционную смесь промывали для удаления щелочи, обрабатывали соляной кислотой для растворения примесей соединений металлов, промывали водой до нейтрального рН. Полученный адсорбент сушили при 110°С до постоянства массы.
Структурно-энергетические характеристики (СЭХ) адсорбента МПУ-007 определяли по изотерме адсорбции азота при температуре 77 К, измеренной на установке Autosorb iQ фирмы Quantachrome Intsruments. Результаты определения СЭХ адсорбента по теории объемного заполнения микропор Дубинина (ТОЗМ) представлены в табл. 1.
Таблица 1.
Структурно-энергетические характеристики микропористого углеродного адсорбента МПУ-007
| Удельный объем микропор (W0 = W01 + W02), см3/г | 1.44 |
| Удельный объем микропор первой моды, W01, см3/г | 0.94 |
| Удельный объем микропор второй моды, W02, см3/г | 0.50 |
| Стандартная характеристическая энергия адсорбции по бензолу (первая мода), ${{E}_{{{\text{01(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}}{\text{)}}}}}$, кДж/моль | 15.6 |
| Стандартная характеристическая энергия адсорбции по бензолу (вторая мода), ${{E}_{{{\text{02(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}}{\text{)}}}}}$, кДж/моль | 4.3 |
| Диаметр (ширина) микропор первой моды, Х01, нм | 1.5 |
| Диаметр (ширина) микропор второй моды, Х02, нм | 3.5 |
| Удельная поверхность по азоту SБЭТ, м2/г | 2520 |
| Насыпная плотность, d, г/дм3 | 120 |
Стандартные характеристические энергии по бензолу определяли с использованием коэффициента подобия β = 0.33. Эффективную ширину микропор определяли как X0 = ${{24} \mathord{\left/ {\vphantom {{24} {{{Е}_{{{\text{0(}}{{{\text{С}}}_{{\text{6}}}}{{{\text{Н}}}_{{\text{6}}}}{\text{)}}}}}}}} \right. \kern-0em} {{{Е}_{{{\text{0(}}{{{\text{С}}}_{{\text{6}}}}{{{\text{Н}}}_{{\text{6}}}}{\text{)}}}}}}}$ (нм) [11].
Метан
В работе использовали газообразный метан (CH4) высокой чистоты 99.999%. По данным [12] метан обладает следующими физико-химическими характеристиками: молекулярная масса: µ = 16.0426 г/моль; нормальная температура кипения T0 = 111.66 K; критическая температура Tс = 190.77 K; критическое давление pс = 4.626 МПа.
Методика измерения адсорбции
Адсорбцию метана измеряли при давлениях в интервале 0.01‒40 МПа при температурах 303, 313, 323, 333 К объемно-весовым методом [13] как абсолютную величину по изменению массы ампулы с адсорбентом, заполненной метаном.
(1)
$a = ({{m}_{a}}--{{{{m}_{g}})} \mathord{\left/ {\vphantom {{{{m}_{g}})} {{{m}_{o}}}}} \right. \kern-0em} {{{m}_{o}}}},~$Погрешности измерений по давлению и температуре составили соответственно ±0.015 МПа и ±0.3 K, по адсорбции ± 4 × 10–4 г с доверительной вероятностью 0.95. Абсолютную адсорбцию метана определяли, как полное содержание вещества в микропорах; объем адсорбента ‒ как сумму объемов углеродного скелета (≈2.0 г/см3) адсорбента, определенного калибровкой по гелию и удельного объема микропор W0 = 1.44 см3/г.
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
На рис. 1 представлены изотермы адсорбции метана на микропористом углеродном адсорбенте МПУ-007 при температурах 303, 313, 323, 333 К.
Рис. 1.
Изотермы адсорбции метана на микропористом углеродном адсорбенте МПУ-007 при температурах: 1 – 303, 2 – 313, 3 – 323, 4 – 333 К.
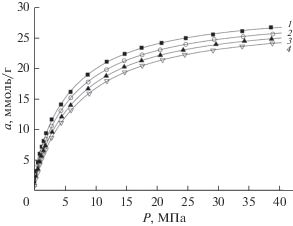
Из рис. 1 следует, что адсорбция метана обратима, резко возрастает в начальной области при давлениях до 12 МПа, затем рост адсорбции замедляется, проявляется тенденция к насыщению.
В табл. 2 представлены массовые характеристики адсорбции метана при давлениях, которые могут быть востребованы в реальных системах хранения газа.
Таблица 2.
Адсорбция метана на микропористом углеродном адсорбенте МПУ-007, а, мас. %
| Давление, МПа | 303 К | 313 К | 323 К | 333 К |
|---|---|---|---|---|
| 1.0 | 9.28 | 8.32 | 7.04 | 6.64 |
| 3.5 | 19.52 | 18.56 | 16.32 | 14.72 |
| 7 | 27.36 | 25.76 | 23.52 | 22.24 |
| 10 | 31.36 | 29.6 | 27.68 | 26.08 |
| 20 | 38.08 | 36.64 | 34.88 | 33.44 |
| 40 | 43.36 | 41.6 | 39.68 | 37.76 |
Как следует из табл. 2, максимальная адсорбция метана достигает 43.36 мас. % при 303 К и 40 МПа.
С практической точки зрения важно знание количества запасаемого метана в единице объема системы хранения, заполненного адсорбентом Va.
Здесь ${{v}_{g}}$ ‒ объем газовой фазы вне адсорбента, ρ ‒ плотность метана при заданных давлении и температуре (p, T), a ‒ адсорбция, d ‒ насыпная плотность адсорбента. На рис. 2 представлены изотермы зависимости объемной емкости аккумулирования метана от давления в системе с адсорбентом Va и без адсорбента V0 при температурах 303, 313, 323, 333 К.
Рис. 2.
Зависимость удельной объемной емкости аккумулирования метана в системе хранения от давления при температурах, К: 1, 1 ' – 303; 2, 2 ' – 313; 3, 3 ' – 323; 4, 4 ' – 333. Обозначения кривых со штрихом – системы без адсорбента; кривые без штриха – система с адсорбентом МПУ-007.

Изостеры адсорбции
По экспериментальным изотермам адсорбции метана построили изостеры адсорбции (рис. 3).
Рис. 3.
Изостеры адсорбции метана на микропористом углеродном адсорбенте МПУ-007 при адсорбции, а, ммоль/г: 1 – 2; 2 – 4; 3 – 6; 4 – 8; 5 – 10; 6 – 12; 7 – 14; 8 – 16; 9 – 18; 10 – 20; 11 – 22; 12 – 24.

Из рис. 3 следует, что изостеры адсорбции метана на микропористом адсорбенте МПУ-007 во всем диапазоне исследованных температур и давлений в хорошем приближении аппроксимируются прямыми линиями.
Свойство линейности изостер адсорбции характерно для многих адсорбционных систем “микропористый адсорбент–газ” [14–16]. Оно может быть использовано для расчета адсорбционных равновесий в области параметров, существенно выходящих за пределы проведенного экспериментального исследования.
Дифференциальная мольная изостерическая теплота адсорбции
Дифференциальная мольная изостерическая теплота абсолютной адсорбции в общем случае, кроме зависимости от адсорбции и температуры, должна учитывать неидеальность газовой фазы при высоких давлениях, отражающуюся в отличии коэффициента сжимаемости Z(Р, Т) от 1 и изменение объема адсорбента при адсорбции ‒ адсорбционную деформацию, т.е. зависимость V = V(a, T). В расчетах использовали общее уравнение (5) [16, 17]
(3)
$\begin{gathered} {{q}_{{st}}} = - RZ{{\left( {\frac{{\partial (\ln P)}}{{\partial \left( {\frac{1}{T}} \right)}}} \right)}_{a}}\left\{ {{{1 - {{{\left( {\frac{{\partial V(a)}}{{\partial a}}} \right)}}_{T}}} \mathord{\left/ {\vphantom {{1 - {{{\left( {\frac{{\partial V(a)}}{{\partial a}}} \right)}}_{T}}} {{{V}_{g}}}}} \right. \kern-0em} {{{V}_{g}}}}} \right\} - \\ - \,\,{{\left( {\frac{{\partial P}}{{\partial a}}} \right)}_{T}}\left[ {V(a,T) - T{{{\left( {\frac{{\partial V(a)}}{T}} \right)}}_{a}}} \right], \\ \end{gathered} $В [18] было показано, что относительная адсорбционная деформация адсорбентов при адсорбции в области высоких давлений не превосходит 1%. Для адсорбции метана на адсорбенте МПУ-007 вклад члена V(a, T)(дP/дa)T составляет менее 2%. Вклад термической деформации углеродных адсорбентов (дV(a)/дТ)а также мал. Основные поправки в qst вносит коэффициент сжимаемости Z(Р, Т), который может изменяться в критической области на ≈70%, а также член, связанный с учетом адсорбционной деформации (дV(a)/дa)T, который сам по себе мал, но в критической области становится малым удельный объем равновесной газовой фазы Vg. Соотношение этих двух величин может также вносить значительный вклад в qst в критической области. В первом приближении член (дV(a)/дТ)а близок к среднемольному объему адсорбата в микропорах (W0/а)Т [19].
Результаты расчетов дифференциальной мольной изостерической теплоты адсорбции метана на микропористом углеродном адсорбенте МПУ-007 представлены на рис. 4.
Рис. 4.
Зависимость дифференциальной мольной изостерической теплоты адсорбции метана на микропористом углеродном адсорбенте МПУ-007 при температурах: 1 – 303; 2 – 313; 3 – 323; 4 – 333 К.

Как следует из рис. 4, в начальной области заполнений микропор, до ≈5 ммоль/г, теплота адсорбции метана на МПУ-007 составляет 14 кДж/моль и при всех температурах практически постоянна. В зависимости от температуры теплота адсорбции затем падает до ≈8 кДж/моль при ≈25 ммоль/г, 303 К и до ≈2 кДж/моль при ≈24 ммоль/г. Такой ход кривых теплоты адсорбции вероятно является следствием особенностей пористой структуры адсорбента – бимодальностью структуры. С молекулярной точки зрения само падение теплоты адсорбции при высоких заполнениях, по-видимому, связано с нарастанием энергии отталкивания между молекулами в адсорбате на малых расстояниях.
ВЫВОДЫ
1. На микропористом углеродном адсорбенте МПУ-007 с широким распределением пор по размерам исследована адсорбция метана при давлениях до 40 МПа и температурах 303, 313, 323, 333 К. Максимальная величина адсорбции метана достигает 43.36 мас. % при 303 К и 40 МПа.
2. Рассчитана дифференциальная мольная изостерическая теплота адсорбции метана на МПУ-007. В начальной области заполнений микропор, до 5 ммоль/г дифференциальная мольная изостерическая теплота адсорбции метана на МПУ-007 составляет 14 кДж/моль и при всех температурах практически постоянна. В зависимости от температуры теплота адсорбции затем падает до ≈8 кДж/моль при ≈25 ммоль/г (303 К) и до ≈2 кДж/моль при адсорбции ≈24 ммоль/г (323 К). Падение теплоты адсорбции при высоких заполнениях, по-видимому, связано с нарастанием энергии отталкивания между молекулами в адсорбате на малых расстояниях.
Работа выполнена по государственному заданию, тема № 01201353185 с использованием оборудования Центра коллективного пользования ИФХЭ РАН.
Список литературы
Бармин И.В., Кунис И.Д. Сжиженный природный газ. Вчера, сегодня, завтра. М.: Изд-во МГТУ им. Н.Э. Баумана, 2009.
Shkolin A.V., Fomkin A.A., Tsivadze A.Yu., Anuchin K.M., Men’shchikov I.E., Pulin A.L. // Prot. Met. Phys. Chem. Surf. 2016. V. 52. P. 955. [Физикохимия поверхности и защита материалов. 2016. Т. 52. С. 563.]
Fomkin A.A., Tsivadze A.Y., Pribylov A.A., Shkolin A.V., Men’shchikov I.E., Aksyutin O.E., Ishkov A.G., Romanov K.V., Teterevlev R.V., Müller U., Arnold L., Piontek M. // Prot. Met. Phys. Chem. Surf. 2018. V. 54. № 3. P. 347.
Goetz V., Pupier O., Guillot A. // Adsorption. 2006. № 12. P. 55.
Стриженов Е.М., Фомкин А.А., Жердев А.А., Прибылов А.А. // Физикохимия поверхности и защита материалов. 2012. Т. 48. № 6. С. 521.
Шевченко А.О., Прибылов А.А., Жедулов С.А., Меньщиков И.Е., Школин А.В., Фомкин А.А. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 2. С. 120.
Rios R.B., Silva F.W.M., Torres A.E.B., Azevedo D.C.S. et al. // Adsorption. 2009. V. 15. I. 3. P. 271.
Цивадзе А.Ю., Аксютин О.Е., Ишков А.Г., Меньщиков И.Е., Фомкин А.А., Школин А.В., Хозина Е.В., Грачев В.А. // Успехи химии. 2018. Т. 87. № 10. С. 950–983.
Меньщиков И.Е., Фомкин А.А., Школин А.В., Яковлев В.Ю., Хозина Е.В. // Изв. АН. Сер. хим. 2018. № 10. 1814.
Фомкин А.А., Прибылов А.А., Ткачев А.Г. и др. // Коллоиднный журн. 2019. Т. 81. № 5. С. 660–666.
Дубинин М.М. Адсорбция и пористость. М.: ВАХЗ, 1972.
Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей. 1972. М.: Наука, 1972.
Прибылов А.А., Калашников С.М., Серпинский В.В. // Изв. АН СССР. Сер. хим. 1990. № 6. С. 1233
Barrer R.M., Papadopoulos R. // Proc. R. Soc. London. 1972. A326. P. 315.
Yakovlev V.Yu., Fomkin A.A. // Colloid J. 2009. V. 71. № 6. P. 877.
Fomkin A.A. // Adsorption. 2005. V. 11. №3/4. P. 425.
Бакаев В.А. Изв. АН СССР. Сер. хим. 1971. № 2. С. 2648.
Школин А.В., Фомкин А.А. // Коллоидный журн. 2009. Т. 71. № 1. С. 116.
Фомкин А.А., Серпинский В.В., Беринг Б.П. // Изв. АН СССР. Сер. хим. 1975. № 9. С. 1931.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов


