Физикохимия поверхности и защита материалов, 2020, T. 56, № 1, стр. 8-12
Численное моделировние адсорбционных равновесий газов на микропористых активных углях
А. М. Толмачев 1, *, П. Е. Фоменков 1, М. Р. Гумеров 1, Т. А. Кузнецова 1
1 Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: amtolmach@yandex.ru
Поступила в редакцию 05.06.2019
После доработки 04.09.2019
Принята к публикации 10.09.2019
Аннотация
Показано, что изотермы адсорбции на микропористых активных углях, рассчитанные методом молекулярной динамики при температурах больше критических для адсорбтивов, количественно совпадают с экспериментальными изотермами при проведении расчетов в микропорах конечных размеров, выборе ширины микропоры в соответствии с теорией объемного заполнения микропор и с правильно подобранным силовым полем.
ВВЕДЕНИЕ
Методы молекулярной динамики и Монте-Карло широко используются при анализе структур углеродных адсорбентов, динамики и равновесия адсорбционных процессов и структурных характеристик адсорбатов в порах адсорбентов [1–9].
Количественное совпадение экспериментальных изотерм адсорбции на микропористых активных углях с изотермами, рассчитанными методом молекулярной динамики, полученное нами ранее [6, 7] при температурах ниже критических для адсорбтивов, показало, что при расчетах необходимо соблюдение трех условий:
– В численном эксперименте необходимо использовать модель щелевидной микропоры конечных размеров (например, 5 × 5 нм), что позволяет рассчитывать не только равновесные заданному давлению количества молекул в микропоре (m), но и предельное количество молекул (ms), которое может быть помещено в микропору. Это позволяет сравнивать рассчитанную и экспериментальную изотермы в относительных координатах
где: a, a0 (моль кг–1) – равновесные и предельная величины адсорбции, находимые в физическом эксперименте. Такая организация численного эксперимента дает возможность определять количество модельных микропор в одном килограмме адсорбента и сравнивать рассчитанные и экспериментальные изотермы.– Различия в энергии адсорбции на микропористых активных углях определяется шириной щелевидной микропоры. Поскольку в реальных адсорбентах наблюдается некоторое, достаточно узкое, распределение микропор по ширинам, изотермы в физическом эксперименте относят к средней эффективной (h) ширине микропор. В теории объемного заполнения микропор (ТОЗМ) [10] был разработан метод расчета (h) на основе определенной методом углового рассеивания электронов связи между характеристической энергией адсорбции (Е0 для бензола) и шириной щели:
(2)
$h\,\,({\text{нм}}) = \frac{{{\text{24}}\,\,{\text{(кДж}}\,\,{\text{нм)}}}}{{{{E}_{{0,{\text{бенз}}}}}({\text{кДж}})}},\,\,\,\,\frac{{{{E}_{{0,{\text{бенз}}}}}}}{{{{E}_{{0,i}}}}} = \frac{{{{{\text{П}}}_{{{\text{бенз}}}}}}}{{{{{\text{П}}}_{i}}}},$Характеристическая энергия адсорбции определялась при обработке экспериментальных изотерм по уравнению Дубинина–Радушкевича [10]:
(3)
$\ln {{a}_{i}} = \ln {{a}_{{0i}}} - {{\left( {\frac{{RT}}{{{{E}_{{0i}}}}}} \right)}^{2}}{{\ln }^{2}}\frac{{{{P}_{{is}}}}}{{{{P}_{i}}}}.$При молекулярно-динамических расчетах изотерм соотношение (2) было подтверждено, поскольку совпадение рассчитанных и абсолютных экспериментальных изотерм наблюдалось при выборе ширины модельной поры в соответствии с этим соотношением.
Таким образом, при молекулярно-динамическом расчете абсолютных изотерм необходима одна экспериментальная изотерма на данном микропористом активном угле для расчета эффективной ширины поры по соотношениям (2).
Использование ширины щели, рассчитываемой по уравнению (2), позволяло надежно характеризовать каждый адсорбент и приводило к количественному соответствию рассчитанных и экспериментальных изотерм [6, 7].
– Для количественного совпадения рассчитанных и экспериментальных изотерм необходимо убедиться, что параметры используемого универсального силового поля для данного адсорбтива (группы адсорбтивов) надежно определены. Так в работе [7] было показано, что при расчетах изотерм адсорбции органических веществ (метан, этилен, бензол, этанол и т.д.) количественное совпадение изотерм наблюдается при использовании универсального силового поля OPLS-AA [11]. В общем случае необходимо иметь одну экспериментальную изотерму данного адсорбтива при одной температуре на микропористом активном угле для выбора соответствующего силового поля и последующих расчетов на других активных углях в широком интервале температур.
Для дополнительного доказательства возможности замены физического эксперимента на численные расчеты в широком интервале температур ниже и выше критических для адсорбтивов мы в настоящей работе провели сравнение рассчитанных методом молекулярной динамики и абсолютных изотерм, полученных в физическом эксперименте при температурах выше критических.
МЕТОДИКА ЭКСПЕРИМЕНТА
В связи с выше сказанным для проведения молекулярно-динамических расчетов в ячейку (12 × × 12 × 12 нм) с подвижными стенками и периодическими граничными условиями помещалась щелевидная микропора, ограниченная квадратными пластинами графена размером 5 × 5 нм (рис. 1). Атомы водорода на границах графеновых пластин не показаны.
Рис. 1.
Схема модельной ячейки с микропорой. Атомы водорода на границах графеновых пластин не показаны. Пояснения в тексте.

Ширина пор варьировалась от 0.7 до 1.3 нм. В ячейку добавлялось около 10 000 молекул адсорбтива и проводился расчет молекулярно-динамических траекторий. В этом случае адсорбция осуществлялась как внутри пор так и на их внешних поверхностях, что хорошо видно из рис. 2. Отметим структурирование слоев метана у графеновых стенок, как в микропоре, так и на внешних поверхностях.
Элементарный шаг интегрирования уравнения движения составил 1 фс. Длина траектории составила 1 нс. Координаты системы сохранялись каждую пикосекунду. Анализ траекторий проводился по последним 500 пикосекундам. Постоянная температура поддерживалась за счет коллизионного термостата [12], а давление поддерживалось с помощью баростата [13]. Обрезание кулоновских и ван-дер-ваальсовских взаимодействий происходило, если расстояние между атомами составляло больше 1.2 нм. Учет электростатических взаимодействий дальнего порядка не производился из-за незначительного вклада электростатики в общую энергию системы. В результате расчетов получали равновесные значения m(P) для адсорбции в микропоре и на внешних графеновых поверхностях и соответствующие давления. Распределение плотностей метана в ячейке при температурах больших критической показано на рис. 3.
Рис. 3.
Распределение плотностей метана в ячейке (пора 1.1 нм) при 370 К (Т > Tкр) и давлениях (бар) в ячейке: 70 (▲), 200 (◆), 633 (◼), пунктирные линии обозначают графеновые поверхности.
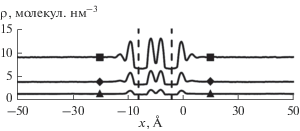
Из рис. 3 видно, что при Т $ \gg $ Ткр адсорбция (конденсация) метана в поре размером 1.1 нм сопровождается при относительно низких давлениях практически мономолекулярной адсорбцией на двух внешних поверхностях поры. Однако, как и при адсорбции в микропорах, наличие адсорбционного поля приводит к “конденсации” адсорбата и во втором слое при относительно высоких давлениях. На основании этих данных получали равновесные значения чисел молекул в микропорах и в первом слое на внешней поверхности поры m(P) и соответствующие равновесные давления, т.е. изотермы адсорбции в микропорах и на графеновых поверхностях.
Необходимо подчеркнуть, что проведение расчетов в модельных порах конечных размеров отличает нашу методику от большинства аналогичных расчетов, в которых использовались полубесконечные или бесконечные поры. Это обстоятельство улучшало статистические характеристики расчетов, но не позволяло корректно сравнивать рассчитанные и экспериментальные изотермы.
ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Прежде всего отметим, что при переходе к температурам выше критических молекулярно-динамические расчеты позволили решить важную термодинамическую проблему, связанную с нахождением при температурах выше критических аналогов равновесно согласованных стандартных давлений (Ps) и соответствующей адсорбции (а0, ms) при Т < Ткрит, использованных при выводе уравнений (3) и уравнений решеточной модели [14].
Этот результат позволяет распространить уравнения ТОЗМ (3) и решеточной модели, полученных ранее для температур, ниже критических, на описание абсолютных изотерм адсорбции газов, что очень важно для современных адсорбционных технологий, поскольку параметры этих уравнений являются весьма информативными характеристиками соответствующих адсорбционных систем [14–16].
При молекулярно-динамических расчетах изотерм адсорбции газов в микропорах и на графеновых поверхностях при соблюдении обозначенных выше условий было показано, что так же, как в случае адсорбции паров, рассчитанные изотермы в микропорах количественно совпадают с экспериментальными изотермами [17].
В качестве примеров на рис. 4–6 приведены соответствующие данные для адсорбции метана, этана и пропана.
Рис. 4.
Экспериментальные (линии) и рассчитанные (◇, ⬜, △, ⚪) изотермы метана (Ткр = 190.6 К) при 170 (◇), 240 (◻), 303 (△) и 370 (⚪) на ПАУ-10 (ширина поры 1.1 нм).

Рис. 5.
Экспериментальные (линия) и рассчитанные (⚪, ◻) изотермы этана при 293 (⚪) и 333 К (◻) на активном угле “Нуксит” (ширина поры 1.2 нм).
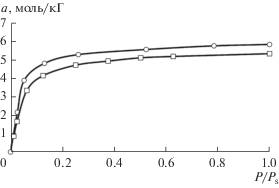
Рис. 6.
Экспериментальные (линии) и рассчитанные (◻, △, ⚪) изотермы пропана при 333 (◻), 373 (△) и 400 К (⚪) на активном угле “Нуксит” (ширина поры 1.2 нм).

Из приведенных данных видно количественное совпадение рассчитанных и экспериментальных изотерм.
Важно подчеркнуть, что дополнительным критерием корректности молекулярно-динамических расчетов изотерм является соблюдение линейной зависимости lna0 от температуры в широком интервале температур ниже и выше критических для адсорбтива в соответствии с уравнением Дубинина-Николаева (см. рис. 7, 8) [8]
Рис. 7.
Зависимость lna0 от температуры для адсорбции метана на микропористом угле ПАУ-10 в широком интервале температур.

Отклонение от прямой для метана при Т > 370 К, связанное по-видимому с изменением физического состояния адсорбата или, что более вероятно, с термическим изменением структуры микропоры, может приводить к изменению параметров силового поля и несовпадению рассчитанной и экспериментальной изотерм, что и наблюдается на рис. 4. Например, в случае кристаллического адсорбента – цеолита такого отклонения не наблюдается.
ЗАКЛЮЧЕНИЕ
Результаты проведенных расчетов подтверждают возможность замены физического эксперимента на расчеты методом молекулярной динамики.
Отметим также, что численный эксперимент имеет очевидные преимущества по сравнению с физическим экспериментом. Например, в численном эксперименте получают изотермы абсолютной адсорбции, в то время как в физическом эксперименте всегда получают избыточные изотермы, которые нужно пересчитывать в абсолютные на основе модели адсорбционной фазы, а определение абсолютных изотерм при адсорбции бинарных смесей усложняется необходимостью аналитического определения состава равновесных фаз.
Физический эксперимент требует значительных затрат рабочего времени сотрудников, специальных, достаточно сложных установок для снятия изотерм при высоких температурах и давлениях, что приводит к техническим ограничениям, не позволяющим, например, снимать изотермы таких веществ как этанол, бензол и т.п. при сверхкритических температурах.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-33-00333.
Список литературы
Yu L., Yanming Z., Wu L., Jianhua X., Yang W., Jiahong L., Fangu Z. // J. Nat. Gas Sci. Eng. 2016. V. 30. P. 119.
Mosher K., He J., Liu Y., Rupp E., Wilcox // J. Coal Geo. 2013. V. 109. P. 36.
Jiang W., Lin W. // J. Nat. Gas Sci. Eng. 2018. V. 49. P. 241.
Wu H., Chen H., Liu H. // J. Phys. Chem. C. 2015. V. 119. P. 13652.
Sha H., Faller R. // Comput. Mater. Sci. 2016. V. 114. P. 160.
Tolmachev A.M., Anuchin K.M., Kruchenkova N.G., Fomkin A.A. // Prot. Met. Phys. Chem. Surf. 2011. V. 47. P. 150.
Анучин К.М. // Дис. канд. хим. наук. Москва. ИФХЭ РАН. 2011.
Dubinin M.M. // Progress in Surface and Membrane Science. N.Y.: Acad. Press. 1975. V. 9. P. 1.
Толмачев А.М., Фоменков П.Е., Кузнецова Т.А., Анучин К.М., Гумеров М.Р. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 5. С. 411.
Гумеров М.Р., Фоменков П.Е., Крюченкова Н.Г., Толмачев А.М. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 2. С. 115.
Jorgensen W.L., Maxwell D.S., Tirado-Rives J. // J. Am. Chem. Soc. 1996. V. 118. P. 11225.
Grest G.S., Kremer K. // Phys. Rev. A. 1986. V. 33. P. 3628.
Feller S.E., Zhang Y., Pastor R.W. // J. Chem. Phys. 1995. V. 103(11). P. 4613.
Фоменков П.Е., Гумеров М.Р., Толмачев А.М. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 4. С. 374.
Кузнецова Т.А., Фоменков П.Е, Крюченкова Н.Г., Толмачев А.М. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 3. С. 243.
Толмачев А.М., Кузнецова Т.А., Крюченкова Н.Г., Фоменков П.Е. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 5. С. 465.
Tolmachev A.M., Godovikov I.A., Kuznetsova T.A., Kruchenkova N.G. // http://w.w.w.adsbank.chem.msu.Ru.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов




