Физикохимия поверхности и защита материалов, 2020, T. 56, № 1, стр. 13-22
Адсорбция из водных растворов некоторых веществ на ультрадисперсном наноалмазе
Н. А. Скорик 1, *, Е. Н. Вострецова 1, А. В. Нам 1
1 Национальный исследовательский Томский государственный университет
Томск, Россия
* E-mail: skorikninaa@mail.ru
Поступила в редакцию 05.03.2019
После доработки 13.03.2019
Принята к публикации 27.03.2019
Аннотация
Представлены результаты адсорбции из водного раствора на ультрадисперсном наноалмазе марки УДА-СП синтезированного фолата лития Li2C19H17N7O6 · 5H2O, бычьего сывороточного альбумина, кислотно-осно́вных индикаторов и некоторых красителей. Данные по адсорбции катионного и анионного красителей, измерению суспензионного эффекта и ζ-потенциала могут свидетельствовать об отрицательно заряженной поверхности наноалмаза в рабочем интервале pH адсорбции (6.0–7.5). Изотермы фолат-иона, иона лития и бычьего сывороточного альбумина относятся к изотермам типа Ленгмюра, предельные величины сорбции составляют 1.05, 1.14 ммоль/г и 180 мг/г соответственно. Определены также константы равновесия процессов сорбции-десорбции ионов фолата лития.
ВВЕДЕНИЕ
Адсорбция электролитов и неэлектролитов неорганической и органической природы из растворов на твердых адсорбентах является одним из важнейших изучаемым физико-химическим процессом. Для понимания механизма сорбции сложных по структуре органических молекул (аминокислот, карбоновых кислот, гетероциклов, белков, витаминов, лекарственных препаратов и др.) требуются новые исследования. Основными факторами, влияющими на адсорбцию органических веществ, которые обладают свойствами слабых электролитов, являются рН раствора, структура молекул и характер их функциональных групп. Одним из адсорбентов ценных органических веществ, в частности, для извлечения водорастворимых витаминов, например, фолиевой кислоты, могут быть гидрозоли ультрадисперсного наноалмаза, на поверхности частиц которого имеются различные функциональные группы (=С=О, ≡С–О–С≡, ≡С–ОН, –СООН, ≡С–NH2). Многие авторы изучают поверхность наноалмаза и указывают, что его адсорбционные свойства не уступают адсорбционным свойствам некоторых углеродных сорбентов [1].
Практическая значимость исследования адсорбции органических веществ на УДА обусловлена несколькими факторами: возможностью получения ассоциатов адсорбируемых веществ и нетоксичного УДА, в связи с чем такие ассоциаты могут применяться в медицине (так, для целевой доставки терапевтического средства в клетки в состав различных наночастиц включают фолиевую кислоту C19H19N7O6); использованием процесса сорбции для регенерации ценных биологически активных веществ из биологических жидкостей и для сорбционного концентрирования из растворов физиологически активных веществ (например, фолиевой, молочной кислот); использованием углеродных адсорбентов для очистки сточных вод с целью выделения и утилизации ценного продукта, такого, как белок.
ТЕОРЕТИЧЕСКИЙ АНАЛИЗ
В состав фолиевой кислоты входят три составные части: птерин, остаток n-аминобензойной кислоты, связанный с птерином метиленовой группой, и один остаток L-глутаминовой кислоты:
Кислота образует, в основном, моно- и дизамещенные растворимые соли с гидроксидами, карбонатами, гидрокарбонатами щелочных металлов и аммиаком, а также малорастворимые соединения с солями щелочноземельных, d-металлов [2].
Фолиевая кислота и ее соединения находят широкое применение. В литературе описан синтез гидрозолей нанозолота, стабилизированных фолатом натрия, которые потенциально могут использоваться для терапии онкологических заболеваний [3]. Авторы предполагают, что стабилизация наночастиц золота фолатом натрия достигается в результате образования связи золота с NH2-группой фолат-аниона. Получены ассоциат фолиевой кислоты с наночастицами серебра [4], ассоциаты фолиевой кислоты с композиционными наночастицами (Zn)ZnS, (Cd)CdS [5].
Содержащая в своем составе различные функциональные группы, фолиевая кислота с молекулярными веществами образует конъюгаты, поверхностные комплексы, некоторые из них находят использование в терапии опухолей, в биологии и медицине как биомаркеры в диагностике и адресной доставке лекарственных препаратов в клетку. В работе [2] описан синтез конъюгата фолиевой кислоты с имидазолом C3H4N2 (Im) состава H2Fol · 3Im · 2H2O. Сорбируемая из водных растворов на поверхности нанокристаллического диоксида церия фолиевая кислота образует в зависимости от рН среды разнообразные по строению поверхностные комплексы [6]. Авторы высказывают мнение, что если анионы фолиевой кислоты связываются с адсорбентом через карбоксильные группы, то активная группировка птеринового кольца кислоты остается доступной для взаимодействия с фолат-рецепторами поврежденных клеток.
Проведено изучение сорбции фолиевой кислоты на поверхности активного угля, полученного термической обработкой скорлупы грецкого ореха [7]. Такой активный уголь является достаточно перспективным материалом для концентрирования из воды и различных биологических сред витамина В9 и лекарственных препаратов с последующим их определением. Пористый микродисперсный детанационный наноалмаз также является подходящим сорбентом для концентрирования таких водорастворимых витаминов, как В2, В6 и В12 из водных растворов с концентрацией 1.1 × 10–4 моль/л [8].
Ультрадисперсные алмазы детонационного синтеза значительно различаются по своим поверхностным свойствам. Понимание процессов сорбции требует знания кислотно-осно́вных свойств поверхности, которые можно изучать индикаторным методом Гаммета. Авторами работы [9] при изучении адсорбции красителей осно́вного (метиленовый голубой), кислотного (кислотный оранжевый) и амфотерного (метиловый оранжевый) типов установлено, что на поверхности пористого микродисперсного детонационного наноалмазе имеются как кислотные, так и осно́вные группы, с которыми могут взаимодействовать молекулы органических оснований, кислот и амфотерных соединений. В работе [10] установлено, что изучаемый УДА адсорбирует кислотные с окрашенным анионом R– красители, такие как кислотный оранжевый и кислотный синий антрахиноновый, и практически не адсорбирует осно́вный с окрашенным катионом R+ краситель, такой как метиленовый синий, вследствие преобладания на поверхности адсорбента положительно заряженных осно́вных групп. На заряженной поверхности адсорбента чаще всего адсорбируются те ионы, знак заряда которых противоположен знаку заряда адсорбента.
Бычий сывороточный альбумин (БСА) и другие белки также используются в качестве модифицирующих агентов для придания различных свойств бионанокомпозитам, которые перспективны для синтеза новых лекарств и других материалов. При адресной доставке наночастиц к пораженным клеткам через кровеносную систему нужно исключить возможность образования ассоциатов белка крови с наночастицами. Поэтому необходимо исследовать взаимодействие наночастиц с основными белками сыворотки крови (особенно с альбумином), изменение конформации адсорбированных белковых молекул, влияния белковых молекул на агрегативную устойчивость золей. Это особенно важно при использовании наночастиц in vivo. В [11] различными методами показано отсутствие взаимодействия между БСА и наночастицами кремния в водных растворах в диапазоне рН 3–7 и заданных концентрациях. Сравнение спектра комбинационного рассеяния биоконъюгата БСА с шунгитовым наноуглеродом в водной нанодисперсии со спектрами исходных компонентов биоконъюгата свидетельствует о том, что структура и свойства белка в составе комплекса претерпевают лишь незначительные изменения, относящиеся ко вторичной структуре белка [12]. Адсорбция молекул БСА на частицах золя золота, стабилизированных цитрат-ионами, повышает стабильность золя [13]. Это дает основание предположить, что введение в кровь небольшого количества золя золота в лечебных целях из-за адсорбции белков крови на его поверхности предотвратит коагуляцию золя в живом организме.
В работе [14] для адсорбции БСА используют адсорбент – модифицированное хитозаном углеродное волокно. Нанесение полупроницаемой пленки хитозана, имеющего в своем составе концевые аминогруппы, придает биосовместимость адсорбенту с извлекаемым белком, и количество адсорбированного белка возрастает.
Цель настоящего исследования состояла в выявлении закономерностей в поведении поверхности УДА (марка УДА-СП) по отношению к воде, водным растворам электролита (фолат лития), неэлектролита (БСА) и некоторым индикаторам.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве адсорбента взят наноалмаз марки УДА-СП, в качестве адсорбатов – водные растворы синтезированного нами фолата лития Li2C19H17N7O6 · 5H2O, БСА, набора индикаторов с pKa в интервале –0.29–12.80. При исследовании использованы методы рН-потенциоментрии (pH-метр-673), ИК-спектроскопии (спектрометр Agilent Cary 630 FTIR в частотном диапазоне 400–4000 см–1), спектро- и фотометрии (спектрофотометр LEKI SS 2107UV, фотоэлектроколориметр КФК-2-УХЛ 4.2), пламенной фотометрии (пламенный фотометр SOLAAR серии S). Фолат-анион и индикаторы в адсорбате определяли спектрофотометрически, белок – фотометрически, литий – методом пламенной фотометрии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
С целью установления физико-химического характера поверхности УДА-СП изучали взаимодействие наноалмаза с водой снятием кинетических кривых суспензий в координатах pH–τ (где τ – время) с оценкой pK1 доминирующих функциональных групп поверхности [15]. Изменение pH во времени взвесей 0.05 г УДА в 10 мл воды фиксировали pH-потенциометрически при непрерывном барботировании через суспензию очищенного азота. Наблюдалось снижение исходного значения pH воды (6.67) до 5.6 при внесении в нее навески УДА (рис. 1). Параллельные опыты по изменение pH во времени в системе УДА-СП–H2O удовлетворительно сходятся: для пробы 1 pK1 = 4.39, пробы 2 pK1 = 4.49. Поверхностные группы с pK 2.5–4 могут быть отнесены к карбоксильным группам, с pK 5–7 могут принадлежать второй ступени диссоциации карбоксильных групп или лактонным группам (сложным эфирам гидроксикислот).
Рис. 1.
Изменение pH во времени в системе УДА-СП–H2O для пробы 1 (Vр-ра = 10 мл; 0.05 г УДА-СП). Результаты расчета: R2 = 0.990; pH (равновес.) 5.57; pH0 (эксп.) 6.67; pH0 (рассч.) 6.75; pK1 = 4.39.

Для регистрации кислотно-осно́вных центров поверхности УДА-СП применяли индикаторный метод Гаммета, описанный в [16], с использованием девяти индикаторов со значениями pKa в интервале –0.29–12.80. В основе метода лежит процесс адсорбции индикаторов, рКа которых отвечает кислотной силе соответствующих центров поверхности адсорбента. Для выбора рабочей длины волны при работе с индикаторами были сняты их спектры поглощения. Исходные растворы индикаторов и равновесные адсорбаты имели pH в интервале 5–7 (за исключением нильского синего, 3.6–4.9). Определение равновесной концентрации индикаторов, оптическая плотность которых не зависит от рН в указанном интервале, проводили по градуировочным характеристикам. Для кристаллического фиолетового и хризоидина, оптическая плотность которых зависит от рН в рабочем интервале, определение их равновесной концентрации проводили, сравнивая оптическую плотность адсорбата с плотностью раствора индикатора известной концентрации и рН, равному равновесному рН адсорбата. Для определения адсорбции индикаторов в ряд пробирок помещали 0.05 г УДА-СП, вносили по 10 мл раствора индикатора с определенным значением концентрации и оптической плотности D0 и рН0. Полученную суспензию выдерживали в течение 25 ч (из них 5 ч встряхивания) для установления адсорбционно-десорбционного равновесия. Далее измеряли рН суспензии, ее центрифугировали, в центрифугате измеряли оптическую плотность индикатора D1 и рН1. Одновременно проводили “холостой” опыт-1, учитывающий взаимодействие образца УДА с растворителем (изменение рН среды дисперсии по сравнению с начальным рН воды) и вследствие этого изменение оптической плотности в процессе адсорбции индикатора. Для этого навеску адсорбента УДА-СП помещали в 10 мл дистиллированной воды, встряхивали 5 ч, затем выдерживали 20 ч, суспензию центрифугировали и далее в определенном объеме этого центрифугата создавали необходимую концентрацию индикатора. После установления равновесия измеряли рН2 и оптическую плотность D2. Учитывая, что в течение длительного времени (25 ч) происходит изменение оптической плотности и рН раствора индикатора даже в отсутствие адсорбента, одновременно проводили и другой “холостой” опыт-2, для чего измеряли D3 и рН3 раствора индикатора после его выдерживания в течение 25 ч. На рис. 2 показано относительное содержание кислотно-осно́вных центров на поверхности УДА-СП, определенное при равновесных условиях (но при непредельной величине адсорбции).
Поскольку фолиевая кислота является малорастворимым соединением (растворимость ~1 × 10–4 моль/л) для изучения адсорбции был взят хорошо растворимый в воде фолат лития, синтезированный нами по реакции взаимодействия карбоната лития с фолиевой кислотой
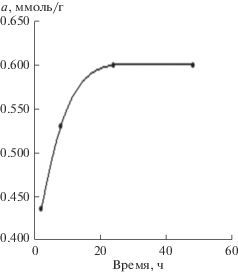
Адсорбция фолата лития на ультрадисперсном наноалмазе марки УДА-СП проведена в статических условиях. На рис. 3 показано время достижения гетерогенного равновесия адсорбции фолата лития при периодическом встряхивании суспензии (~25 ч).
Рис. 3.
Зависимость величины адсорбции фолата лития от времени (Vобщ = 10 мл, mУДА-СП = 0.05 г, $С_{{{\text{Fol}}}}^{0}$ = = 7.6 × 10–3 моль/л, рН 7.02, D490, l = 10 мм).
Была выбрана следующая методика работы: исходные адсорбаты 5 ч встряхивали с 0.05 г наноалмаза, суспензии выдерживали еще в течении 20 ч и после измерения pH их центрифугировали (3200–4000 об./мин) в течении 30 мин, в адсорбатах в интервале длин волн 300–500 нм определяли содержание фолата-аниона и методом пламенной фотометрии – иона лития. Ошибка измерений величины сорбции в параллельных опытах составляла 5–7%. В адсорбатах и калибровочных растворах фолата лития различной концентрации pH находился в интервале 6.4–7.0. Как видно из табл. 1 в интервале pH 6.5–7.0 наблюдается незначительное отличие оптической плотности раствора фолата лития.
Таблица 1.
Зависимость оптической плотности раствора фолата лития от рН раствора (СFol = 1.00 × 10–2 моль/л, lкюв = 10 мм)
| рН | 5.5 | 6.0 | 6.5 | 7.0 | 7.5 |
| D490 | 0.269 | 0.258 | 0.241 | 0.238 | 0.211 |
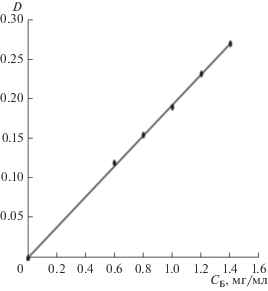
Стандартные растворы для построения градуировочных характеристик (рис. 4), необходимых для определения фолат-аниона в равновесном адсорбате, получены разбавлением раствора Li2C19H17N7O6 · 5H2O, приготовленного по точной навеске. Оптическую плотность и pH калибровочных растворов снимали через 30 мин после их приготовления. Измерения концентрации ионов лития в адсорбате выполнены на пламенном фотометре в пропан-бутан-воздушном пламени (смесь подавалась под давлением 2 атм). Градуировочные характеристики на основе стандартных растворов фолата лития (СLi = 0.1–1.0 мг/л) представляли линейную зависимость интенсивности фототока I эмиссии лития от его концентрации при длине волны 670.8 нм (рис. 5).
Рис. 5.
Зависимость фототока эмиссии лития от концентрации ионов лития в растворе фолата лития (R2 = = 0.991).

Величину адсорбции (a, ммоль/г) ионов соли вычисляли по формуле
Рис. 8.
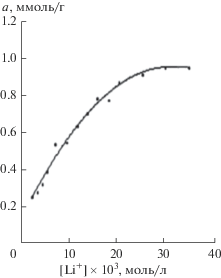
Линеаризация начального участка изотермы катиона лития. Результаты расчета: R2 = 0.942, а∞ = = 1.14 ммоль/г, К = 109.6 л/ммоль.

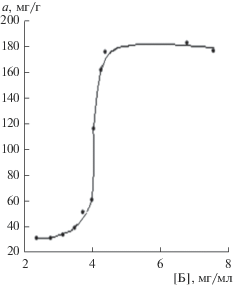
Адсорбция бычьего сывороточного альбумина изучалась также в стационарных условиях. Содержание белка в равновесном адсорбате находили фотометрически по поглощению при λэф = 540 нм окрашенного комплекса белка с ионами меди(II) в щелочной среде (метод Бенедикта), растворами сравнения служили раствор соли меди той же концентрации или вода. Градуировочная характеристика для БСА и изотерма сорбции бычьего сывороточного альбумина приведены на рис. 9, 10. Как видно из изотермы сорбции, максимальная адсорбция БСА составляет ~180 мг/г. Для выявления взаимодействия БСА с поверхностью УДА-СП были сняты ИК спектры БСА, УДА-СП и БСА + УДА-СП.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Вследствие ионизации поверхностных функциональных групп адсорбента (или избирательной адсорбции ионов из раствора) на поверхности частиц наноалмаза возникает заряд. Наличие поверхностного заряда влечет за собой электростатическое взаимодействие между заряженной поверхностью наноалмаза и ионами, присутствующими в растворе фолата лития, а также заряженными участками белковой молекулы БСА. Это является одним из основных факторов, обуславливающих адсорбцию этих веществ на адсорбенте. Но фиксирование частиц фолата лития и белка из раствора на сорбенте возможно и за счет ван-дер-ваальсовых взаимодействий между функциональными группами фолата (–O–H, =C=O, =N–H) и функциональными группами белка с поверхностью УДА. Процесс адсорбции белка определяется, в основном, ионными, ван-дер-ваальсовыми, водородными и гидрофобными видами взаимодействий.
Как следует из рис. 2, на поверхности УДА имеются кислотные центры (pKa –0.29–5.50), на которых адсорбируются индикаторы-основания, и осно́вные центры, на которых происходит адсорбция индикаторов-кислот. На поверхности УДА наблюдается высокое содержание центров с рКа 4.80, данное значение близко к среднему значению рКа = 4.44, определенного кинетическим методом. На кислотных и осно́вных центрах УДА могут адсорбироваться соответственно ионы лития и фолат-ионы. В равновесном адсорбате (при начальной концентрацией фолата лития в интервале 1.85 × 10–3–1.98 × 10–2 моль/л) мольное соотношение ионов Li+ : Fol2– (рН ~ 6.9) изменяется от 1.35 : 1 до 2.35 : 1 (табл. 2).
Таблица 2.
Мольные соотношения Li+ : Fol2– в равновесном адсорбате фолата лития
| № | [Li+], моль/л | [Fol2–], моль/л | [Li+] : [Fol2–] | № | [Li+], моль/л | [Fol2–], моль/л | [Li] : [Fol2–] |
|---|---|---|---|---|---|---|---|
| 1 | 2.42 × 10–3 | 1.79 × 10–3 | 1.35 : 1 | 8 | 1.38 × 10–2 | 6.00 × 10–3 | 2.30 : 1 |
| 2 | 3.56 × 10–3 | 1.94 × 10–3 | 1.84 : 1 | 9 | 1.59 × 10–2 | 6.45 × 10–3 | 2.47 : 1 |
| 3 | 4.56 × 10–3 | 2.21 × 10–3 | 2.06 : 1 | 10 | 1.83 × 10–2 | 7.94 × 10–3 | 2.30 : 1 |
| 4 | 5.46 × 10–3 | 2.45 × 10–3 | 2.23 : 1 | 11 | 2.04 × 10–2 | 8.94 × 10–3 | 2.28 : 1 |
| 5 | 7.21 × 10–3 | 3.48 × 10–3 | 2.07 : 1 | 12 | 2.52 × 10–2 | 1.02 × 10–2 | 2.47 : 1 |
| 6 | 9.64 × 10–3 | 3.94 × 10–3 | 2.44 : 1 | 13 | 2.99 × 10–2 | 1.29 × 10–2 | 2.32 : 1 |
| 7 | 1.18 × 10–2 | 4.61 × 10–3 | 2.56 : 1 | 14 | 3.48 × 10–2 | 1.48 × 10–2 | 2.35 : 1 |
Адсорбция ионов является более сложным процессом, чем молекулярная адсорбция. Она связана с образованием заряженной поверхности и формированием вокруг нее двойного электрического слоя на границе раздела твердой и жидкой фаз. Адсорбция ионов чаще всего является избирательной, т.е. на данном адсорбенте катионы и анионы адсорбируются неодинаково. В работе [17] было установлено, что на поверхности микродисперсного спеченного детонационного наноалмаза способны адсорбироваться как катионы (Fe3+, Al3+, Cu2+, Mn2+, Zn2+, Cd2+, Co2+, Ni2+), так и анионы (CH3COO–, Cl–, ${{{\text{B}}}_{{\text{4}}}}{\text{O}}_{7}^{{2 - }},$ ${\text{ClO}}_{4}^{ - }{\text{,}}$ I–, ${\text{SO}}_{4}^{{2 - }}{\text{,}}$ ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}{\text{,}}$ ${\text{PO}}_{4}^{{3 - }}$). Авторами продемонстрирована доминирующая адсорбция анионов над катионами. Во всех случаях адсорбция на таком наноалмазе подчиняется закону Ленгмюра. В [18] адсорбционные свойства детонационного наноалмаза по отношению к анионам многих оксокислот были применены к методу предварительного концентрирования вольфрамат-иона в образцах воды, поскольку прямое определение вольфрама в экологических водах затруднено из-за его низкого содержания и наличия большого количества компонентов. Автором работы [19] показано, что ионы щелочных металлов, в частности ионы лития, натрия и калия, адсорбируются, в основном, на сильно кислотных группах сульфоугля (при pKa = –0.29).
Считается, что в случае адсорбции ионов невозможна полислойная адсорбция, фактически речь может идти только о заполнении ионами первого монослоя. Таким образом, изотерма адсорбции ионов должна быть схожей с изотермой молекулярной адсорбции Ленгмюра, что имеет место в случае изотерм адсорбции ионов фолата лития и БСА на УДА. По мнению Пампуры [20], не только природа лиганда, но и его концентрация влияет на вид изотермы сорбции ионов металлов.
Определенная нами величина суспензионного эффекта, равная разности рН водной суспензии УДА и рН дисперсионной среды (водного центрифугата), $\Delta {\text{pH}} = {\text{p}}{{{\text{H}}}_{{{\text{сусп}}}}} - {\text{ p}}{{{\text{H}}}_{{{\text{ц/ф}}}}}$ [21], в системе УДА-СП–H2O (рН 6–7) меньше нуля (табл. 3), что свидетельствует об отрицательно заряженной поверхности наноалмаза в рабочем интервале рН процесса адсорбции фолата лития и БСА. При сравнении pHсусп и pHц/ф в случае адсорбции индикаторов, фолата лития на УДА также величина ∆pH < 0 и лежит в интервалах (–0.12–(–0.25), (–0.06–(–0.12) соответственно. Отрицательный заряд поверхности при pH > 5.5 подтверждается и значениями ζ-потенциала УДА-СП (табл. 4), определенном на приборе Nano-ZS на фоне 0.01 моль/л раствора KCl.
Таблица 3.
Изменение рН среды суспензии УДА-СП–H2O (V (H2O) = 10 мл; mУДА = 0.05 г) при центрифугировании
| рН0 (H2O) | рНсусп | рНц/ф | ΔрН |
|---|---|---|---|
| 6.13 | 5.25 | 5.59 | –0.34 |
| 6.44 | 5.51 | 5.73 | –0.22 |
| 6.35 | 5.46 | 5.61 | –0.15 |
Таблица 4.
Изменение ζ-потенциала водной суспензии УДА-СП в зависимости от рН (dчастиц 330–900 нм)
| pHсусп | 0.81 | 1.73 | 3.06 | 5.12 | 5.65 | 6.25 | 9.10 | 10.55 |
| ζ, mv | 14.4 | 27.3 | 30.0 | 4.31 | –1.74 | –4.62 | –23.0 | –28.6 |
Заряд поверхности УДА в зависимости от pH среды подтверждается и адсорбцией красителей: адсорбция анионного метилового оранжевого ([C14H14N3O3S]–Na+, МО) с увеличением рН уменьшается, а катионного малахитового зеленого ([C23H25N2]+Cl–, МЗ) – увеличивается (табл. 5). Различные значения pH в исходном адсорбате красителей создавались растворами HCl и NaOH, определение равновесной концентрации красителей проводили по калибровочным растворам, в которых создавали pH, равный pH равновесного адсорбата.
Таблица 5.
Адсорбция метилового оранжевого и малахитового зеленого на УДА в зависимости от рН равновесного адсорбата ($С_{{{\text{МО}}}}^{0}$ = 3.3 × 10–4 моль/л, $С_{{{\text{МЗ}}}}^{0}$ = 1.48 × 10–5 моль/л, V = 10 мл, mУДА = 0.05 г)
| Метиловый оранжевый | Малахитовый зеленый | ||||
|---|---|---|---|---|---|
| рНадс | λ, нм | aМО, ммоль/г | рНадс | λ, нм | аМЗ, ммоль/г |
| 2.05 | 590 | 0.0511 | 2.13 | 490 | 0.0006 |
| 5.82 | 540 | 0.0384 | 5.51 | 490 | 0.0017 |
| 6.18 | 540 | 0.0285 | 5.70 | 490 | 0.0028 |
| 6.64 | 540 | 0.0206 | 6.04 | 540 | 0.0029 |
Этот факт можно объяснить тем, что в кислой среде (рН < 5) отрицательно заряженный окрашенный анион [C14H14N3O3S]– МО взаимодействует с положительно заряженными центрами поверхности УДА-СП. При увеличении рН поверхность УДА приобретает все больший отрицательный заряд, поэтому сорбция метилового оранжевого уменьшается. В случае окрашенного катиона малахитового зеленого [C23H25N2]+ зависимость величины сорбции от pH носит противоположный характер. В работе [22] так же показано, что адсорбция анионного, кислотного красителя метанилового желтого (HR ↔ H+ + R–) протекает на доступных активных центрах поверхности углеродного материала преимущественно осно́вного характера, заряженных положительно. Катионный индикатор метиленовый синий адсорбируется на активных центрах углеродной поверхности (нефтяной кокс) как кислотного, так и осно́вного характера.
Из данных табл. 6 видно, что с ростом pH адсорбция метиленового синего (МС, катионный индикатор) возрастает, поскольку заряд поверхности УДА-СП от положительного переходит к отрицательному.
Таблица 6.
Данные по адсорбции метиленового синего на УДА-СП ($С_{{{\text{МС}}}}^{0}$ = 2.4 × 10–4 моль/л, λ 540 нм)
| Равновесный адсорбат | а, ммоль/г | |
|---|---|---|
| p[H] | [МС], моль/л | |
| 3.30 | 1.81 × 10–4 | 118 |
| 5.40 | 8.05 × 10–5 | 191 |
| 5.53 | 8.00 × 10–5 | 192 |
| 6.50 | 2.41× 10–5 | 259 |
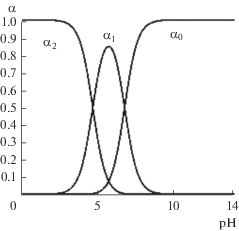
Данные по сорбции красителей на УДА-СП, измерению ζ-потенциала и суспензионного эффекта могут свидетельствовать об отрицательно заряженной поверхности наноалмаза в интервале pH 6–7 процесса сорбции, что может объяснить невысокий процент сорбции фолат-аниона в указанной области pH. Используя данные изотерм сорбции фолата лития на УДА-СП, можно оценить возможность извлечение фолат-аниона из ценных биологических жидкостей с рН ~7, при котором в случае фолиевой кислоты в растворе, как видно из диаграммы выхода (рис. 11), доминируют частицы HFol– и Fol2–. Так, при начальной концентрации фолата лития 4.95 × 10–3 моль/л адсорбция фолат-аниона составляет ~30%, иона лития – 27%. Учитывая высокую поляризующую способность иона лития и возможность образования им комплексных частиц с анионом фолиевой кислоты, на другом анионном фоне адсорбция иона лития может отличаться от адсорбции на фоне фолат-аниона.
Рис. 11.
Диаграмма выхода фолиевой кислоты: α0 – Fol2–, α1 – HFol–, α2 – H2Fol (взяты общие константы протонизации кислоты как двухосновной: lgB1 = = 6.75, lgB2 = 11.40 [23]).
При анализе ИК спектров УДА, БСА и адсорбированного на УДА белка наблюдается сдвиг полосы пептидной группировки СОNН: это полоса связи N–H белка 3299 см–1, сместившаяся к 3320 см–1, а также полоса, обусловленная валентными колебаниями С=О-связи (амид I) и характеристичной для α-спирали белка, сместившаяся с 1654 к 1662 см–1, что может указывать на изменение перераспределения вкладов различных конформаций белка при взаимодействии его с поверхностью УДА. Авторы работы [24] на ИК спектре БСА, адсорбированного на поверхности наноразмерных частиц CoFe2O4, присутствие полос поглощения белка при 1669.8 и 1531.7 см–1 связывают с иммобилизацией БСА на адсорбенте. Как в случае наноразмерного CoFe2O4, так и в случае нашего адсорбента, значительная адсорбция БСА (~200 мг/г) наблюдается при значениях pH ниже изоэлектрической точки, когда молекула белка становится положительно заряженной, так же как и поверхность указанных адсорбентов. Поскольку белки относятся к классу полиэлектролитов, то они несут как положительные, так и отрицательные заряды (положительные заряды локализуются на группах пептидной цепи белка, а отрицательные заряды – на группах СОО–). Вероятно, механизм адсорбции белка не может быть объяснен только электростатическим взаимодействием, важными являются и гидрофобные взаимодействия. В наших опытах предельная адсорбция БСА на УДА-СП ($С_{{\text{Б}}}^{0}$ = 6 мг/мл) при повышении pH снижается (при pH 6.8, 8.3 соответственно 179, 163 мг/г), вероятно, в результате возникновения электростатического отталкивания глобул БСА, имеющих при рН > 5 слабый отрицательный заряд, от поверхности УДА, имеющей такой же заряд.
Величина предельной сорбции БСА на УДА-СП 180 мг/г (pH 6.4) соизмерима с сорбцией на других адсорбентах (при близких равновесных концентрациях белка): изотерма адсорбции БСА из водных растворов на кремнеземном адсорбенте Силохроме С80 достигает максимальных величин адсорбции, порядка 200 мг/г, изотерма адсорбции БСА на углеродном адсорбенте Сибуните характеризуется значительно меньшей величиной адсорбции (13 мг/г) [25], и адсорбция сопровождается частичным переходом конфигурации пептидной группировки СОNН из α-спирали в более плоскую β-структуру (в ИК спектре наблюдается уширение полос поглощения амид I и амид II). Предельная адсорбция альбумина по модели Ленгмюра у немодифицированного и синтетических наноразмерных кремнийзамещенных гидроксиапатитов изменяется от 119 до 167 мг/г соответственно [26].
ЗАКЛЮЧЕНИЕ
Таким образом, на основании проведенных исследований различными методами показано, что в рабочем интервале pH 6.0–7.5 адсорбции фолата лития, БСА поверхность УДА-СП несет отрицательный заряд. Это обуславливает невысокую адсорбцию фолат-аниона и анионных красителей на данном адсорбенте в указанном интервале pH. Выявлено, что равновесие процесса сорбции ионов фолата лития и БСА на наноалмазе описывается изотермой Ленгмюра. Сорбция ионов соли, красителей осуществляется, в основном, за счет электростатического взаимодействия указанных компонентов с сорбентом УДА-СП. Механизм адсорбции белка не может быть объяснен только электростатическим взаимодействием его с адсорбентом. Метод ИК-спектроскопии указывает на некоторое изменение конформации адсорбированного белка.
На основе полученных экспериментальных результатов по адсорбции веществ различной природы, сравнения их с литературными данными, можно предположить, что УДА-СП является перспективным материалом для создания функциональных бионанокомпозитов и сорбентом для концентрирования, выделения витаминов и других субстратов, а также белков, так как обладает достаточно высокой предельной сорбцией относительно БСА.
Список литературы
Еременко А.Н., Беседина О.А, Образцова И.И. // Журн. прикл. химии. 2004. Т. 77. № 12. С. 1956.
Скорик Н.А. // Журн. неорган. химии. 2015. Т. 60. № 11. С. 1531.
Милевич И.А., Воробьева С.А., Лесникович А.И. // Вестник БГУ. Сер. 2. 2011. № 1. С. 30.
Абакшонок А.В., Еремин А.Н., Агабеков В.Е., Жавнерко Г.К. // Росс. биотерапевт. журн. 2013. Т. 12. № 2. С. 2.
Еремин А.Н., Жавнерко Г.К., Агабеков В.Е. // Докл. нац. акад. наук Беларуси. 2011. Т. 55. № 4. С. 54.
Власова Н.Н., Головкова Л.П., Стукалина Н.Г. // Поверхность. 2014. Вып. 6(21). С. 39.
Трубицина В.Н., Золотарева Н.В. Научный потенциал регионов на службу модернизации. Астрахань: АИСИ, 2012. № 2(3). С. 31.
Рычкова С.А. Дис. … канд. хим. наук. М. 2016. 256 с.
Ланин С.Н., Рычкова С.А., Виноградов А.Е. и др. // Сорбционные и хроматографические процессы. 2017. Т. 17. № 1. С. 63.
Хохлова Т.Д., Юнусова Г.Р., Ланин С.Н. // Журн. физ. химии. 2018. Т. 92. № 5. С. 811.
Аненкова К.А., Петрова Г.П., Гибизова В.В. и др. // Оптика и спектроскопия. 2013. Т. 115. № 2. С. 195.
Горюнов А.С., Борисова А.Г., Колодей В.А., Рожков С.П. // Труды Карельского научного центра РАН. 2012. № 2. С. 154.
Долинный А.И. // Электронный журнал “Структура и динамика молекулярных систем”. 2008. № 3. А. С. 416.
Земскова Л.А., Шевелева И.В., Суховерхов С.В. и др. Патент № 2289588 РФ. 2006.
Скорик Н.А., Кривозубов А.Л., Карженевский А.П., Спицын Б.В. // Физикохимия поверхности и защита материалов. 2011. Т. 47. № 1. С. 51.
Антошкина Е.Г., Смолко В.А. // Вестник ЮУрГУ. Серия: Математика. Физика. Химия. 2008. Вып. 10. № 7(107). С. 65.
Peristyy A., Paull B., Nesterenko P.N. // Adsorption. 2016. V. 22(3). P. 371.
Hiroki Sakurai, Noboru Ebihara, Eiji Osawa et al. // Anal. Sci. 2006. V. 22. Issue 3. P. 357.
Агаева З.М. Автореф. дис. … канд. хим. наук. Махачкала, 2008. 95 с.
Пампура Т.В. Дис. … канд. биол. наук. Пущино, 1996. 170 с.
Физико-химические свойства ультрадисперсных материалов. Электронный ресурс: метод. указания по лаб. работам / Сост. Г.А. Чиганова. Красноярск: ИПК СФУ, 2008. С. 30.
Балыкин В.П., Ефремова О.А., Булатов А.В. // Вестник Челяб. гос. ун-та. 2004. Т. 4. № 1. С. 46.
Досон Р., Эллиот Д., Эллиот У., Джонс К. Справочник биохимика / Пер. с англ. М.: Мир, 1991. 544 с.
Першина А.Г., Сазонов А.Э., Итин В.И. и др. // Наносистеми, наноматеріали, нанотехнології. Nanosystems, Nanomaterials, Nanotechnologies. 2008. Т. 6. № 3. С. 1019.
Эльтекова Н.А., Соколова Н.П., Горбунов А.М., Эльтеков А.Ю. // Физикохимия поверхности и защита материалов. 2013. Т. 49. № 4. С. 397.
Ле Ван Тхуан, Трубицын М.А., Габрук Н.Г. и др. // Сорбционные и хроматографические процессы. 2015. Т. 15. Вып. 1. С. 100.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов