Физикохимия поверхности и защита материалов, 2020, T. 56, № 2, стр. 186-191
Образование и катодное восстановление комплексов таурина с цинком и никелем(II)
С. Н. Гридчин 1, *, Р. Ф. Шеханов 1, А. В. Балмасов 1
1 Ивановский государственный химико-технологический университет
153000 Ивановская область, Иваново, пр. Шереметевский, 7, Россия
* E-mail: sergei_gridchin@mail.ru
Поступила в редакцию 29.12.2018
После доработки 07.01.2019
Принята к публикации 14.01.2019
Аннотация
Определены константы устойчивости комплексов цинка и никеля(II) c таурином при 25°С и значениях ионной силы 0.5; 1.0; 1.5 (KNO3). Рассчитаны величины термодинамических констант устойчивости. Исследованы процессы электроосаждения сплавов цинк-никель на сталь 08кп из электролитов с добавкой таурина и физико-химические свойства покрытий. Показано влияние соотношения компонентов сплава на химический состав и микроструктуру покрытий.
ВВЕДЕНИЕ
Для защиты черных металлов от коррозии традиционно применяются гальванические покрытия изделий цинком, кадмием, оловом. При этом введение в состав антикоррозионных покрытий металлов подгруппы железа (железо, кобальт, никель) позволяет существенно увеличить срок их защитного действия против коррозии, поскольку соответствующие бинарные сплавы характеризуются более высокой коррозионной стойкостью, чем указанные индивидуальные металлы [1]. Перспективным направлением при разработке новых составов растворов для электроосаждения металлов и сплавов является использование соединений, образующих растворимые комплексы с ионами осаждаемых металлов [2–17]. Одним из наиболее эффективных лигандов является таурин (2-аминоэтансульфоновая кислота, HL) [18, 19]:
Ранее [20] в нашей лаборатории были исследованы протолитические равновесия в водных растворах этого соединения и определены стандартные термодинамические характеристики соответствующих реакций. Целью настоящей работы является исследование реакций комплексообразования указанной аминокислоты с ионами цинка и никеля(II) и процессов осаждения гальванического сплава цинк–никель.
МЕТОДИКА ЭКСПЕРИМЕНТА
Константы устойчивости комплексов таурина с ионами цинка и никеля(II) были определены методом потенциометрического титрования при 25°С и значениях ионной силы 0.5, 1.0 и 1.5 (KNO3) в соответствии с методикой, обычно используемой в нашей лаборатории [21–23]. Для определения равновесной концентрации ионов водорода измеряли ЭДС цепи, состоящей из стеклянного электрода ЭСЛ-43-07 и насыщенного хлорсеребряного электрода ЭВЛ-1МЗ. Потенциал стеклянного электрода контролировали потенциометром Р-363/3. В качестве нуль-инструмента был использован рН-метр-милливольтметр рН-340. Точность измерения потенциала составляла ±0.1 мВ. Титрование проводили стандартными растворами гидроксида калия, содержащими “фоновый” электролит, чтобы избежать изменения ионной силы в процессе титрования за счет разбавления. Точный объем раствора таурина с заданным значением ионной силы помещали в термостатированную потенциометрическую ячейку. Начальная концентрация лиганда варьировалась от 1.0 × 10−2 до 9.9 × 10−2 моль/л при начальной концентрации ионов металла 7.2 × × 10−3–1.8 × 10−2 моль/л. Температуру потенциометрической ячейки поддерживали с точностью ±0.05°С. Перед снятием каждой кривой титрования потенциометрическую установку калибровали по стандартным растворам HNO3 и KOH, содержащими нитрат калия для создания необходимой ионной силы.
Анализ структуры покрытий проводили методом атомно-силовой микроскопии на приборе SOLVER 47 PRO (режим полуконтактный). Структуру и состав сплавов изучали с помощью настольного сканирующего электронного микроскопа с интегрированной системой энерго-дисперсионного спектрального анализа (EDS) PHENOM PRO X и с помощью сканирующего электронного микроскопа Tescan Vega 3 SBH с приставкой для элементного анализа. Покрытия осаждали с помощью лабораторного источника тока MPS-3005L-3 Matrix на предварительно подготовленные (обезжиренные и активированные) образцы из стали 08кп. Процесс осаждения проводили при температуре 50°С и катодной плотности тока 1 А/дм2. Толщина покрытий составила 9 мкм. Потенциодинамические катодные поляризационные кривые снимали с использованием потенциостата P-30J при температуре 25 и 50°С со скоростью развертки потенциала 5 мВ/с. Коррозионные испытания полученных образцов проводили в 3% растворе NaCl при температуре 25°С. Анодные кривые растворения Zn–Ni сплавов и катодную кривую восстановления водорода на стали 08кп получали со скоростью развертки потенциала 1 мВ/с.
Методом Розенфельда [24] были получены коррозионные диаграммы для сплавов цинк–никель, осажденных из тауриновых электролитов. Метод Розенфельда включает в себя построение катодной поляризационной кривой, на которую наносится потенциал системы основа – металлическое покрытие и по нему определяется ток коррозионного элемента.
ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ И ИХ ОБСУЖДЕНИЕ
Расчет констант устойчивости комплексов таурина с ионами цинка и никеля(II) выполнен по программе PHMETR [25], в основу работы которой положен принцип поиска минимума критериальной функции F путем варьирования в каждой итерации подлежащих определению значений lg K:
(1)
${\text{F}} = \Sigma {{{\text{(lg}}{{\left[ {{{{\text{H}}}^{ + }}} \right]}_{{j{\text{,эксп}}}}} - {\text{lg}}{{\left[ {{{{\text{H}}}^{ + }}} \right]}_{{j{\text{,рассч}}}}})}^{2}}~~ \to ~\,{\text{min}},$Таблица 1.
Десятичные логарифмы констант устойчивости комплексов цинка и никеля(II) с таурином при 25°С
| Процесс | I = 0.0 | I = 0.5 | I = 1.0 | I = 1.5 |
|---|---|---|---|---|
| Zn2+ + L– = ZnL+ | 3.05 ± 0.10 | 2.47 ± 0.10 | 2.45 ± 0.09 | 2.49 ± 0.11 |
| ZnL+ + L– = ZnL2 | 2.51 ± 0.11 | 2.26 ± 0.11 | 2.33 ± 0.10 | 2.37 ± 0.12 |
| Zn2+ + 2L– = ZnL2 | 5.56 ± 0.05 | 4.73 ± 0.05 | 4.78 ± 0.05 | 4.86 ± 0.05 |
| Ni2+ + L– = NiL+ | 3.35 ± 0.04 | 2.79 ± 0.04 | 2.82 ± 0.04 | 2.87 ± 0.05 |
| NiL+ + L– = NiL2 | 2.61 ± 0.06 | 2.35 ± 0.06 | 2.40 ± 0.06 | 2.44 ± 0.06 |
| Ni2+ + 2L– = NiL2 | 5.96 ± 0.04 | 5.14 ± 0.04 | 5.22 ± 0.04 | 5.31± 0.04 |
Для определения термодинамических констант устойчивости комплексов цинка и никеля(II) использовано уравнение с одним индивидуальным параметром [30]:
(2)
${\text{lg}}K~~ - ~А\Delta {{z}^{2}}{{\surd {\kern 1pt} I} \mathord{\left/ {\vphantom {{\surd {\kern 1pt} I} {(1}}} \right. \kern-0em} {(1}} + 1.6\surd {\kern 1pt} I)~\,\, = \,\,~{\text{lg}}K^\circ \,\,~ + \,\,~bI,$При исследовании процессов электроосаждения сплавов цинк-никель использовали электролиты, составы которых приведены в табл. 2.
Таблица 2.
Составы электролитов для осаждения сплавов цинк–никель
| Содержание, моль/л | № 1 | № 2 | № 3 |
|---|---|---|---|
| Таурин, H2NC2H4SO3H | 0.40 | 0.40 | 0.40 |
| Сульфат цинка, ZnSO4 · 7H2O | 0.05 | 0.08 | 0.10 |
| Сульфат никеля, NiSO4 · 7H2O | 0.10 | 0.08 | 0.05 |
| Хлорид калия, KCl | 1.68 | 1.68 | 1.68 |
| pH | 4.42 | 4.35 | 4.38 |
Поляризационные кривые, полученные в электролитах с различным содержанием ионов металлов, представлены на рис. 1.
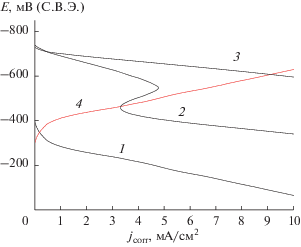
Рис. 1.
Катодные поляризационные кривые, полученные из тауриновых электролитов при температуре электролитов t = 25°C: 1 – электролит № 1; 2 – электролит № 2; 3 – электролит № 3; при температуре электролитов t = 50°C: 4 –электролит № 1; 5 – электролит № 2; 6 – электролит № 3.

На поляризационных кривых 1 и 2 (рис. 1) видны предельные токи в процессе осаждения сплавов Zn–Ni. При температуре 25°С для электролита № 1 площадка предельного тока расположена выше, чем в других электролитах, поэтому здесь имеется более широкий допустимый интервал катодных плотностей тока 0.5–2.25 А/дм2 по сравнению с электролитом № 2 0.5–1.75 А/дм2. При температуре 50°С процесс электроосаждения протекает с деполяризацией ввиду облегчения процесса включения никеля в покрытие при повышенной температуре (рис. 1, кривая 4). Поляризуемость в электролите № 1 и 2 при повышенной температуре выше, чем при той же температуре в электролите № 3 (рис. 1, кривая 6), что способствует получению более однородной мелкокристаллической структуры покрытий Zn–Ni сплавами.
С увеличением содержания никеля в покрытии его потенциал смещается в область более положительных значений. Это приводит к уменьшению ЭДС коррозионного элемента и снижению коррозионного тока (рис. 2).
Рис. 2.
Коррозионные диаграммы образцов цинк-никелевых сплавов, полученных из тауриновых электролитов. Раствор 3% NaCl. t = 25°C. 1–3 – анодные кривые сплавов, осажденных из соответствующих электролитов. 4 –катодная кривая на стальном электроде.
Установлено, что при превышении в два раза концентрации цинка над концентрацией никеля в оксалатном электролите скорость коррозии сплава цинк-никель составляет 9.50 мА/см2 и принимает максимальное значение среди рассмотренных цинк-никелевых сплавов. При двойном превышении концентрации никеля над концентрацией цинка скорость коррозии минимальна и составляет 0.25 мА/см2, что в четырнадцать раз меньше скорости коррозии, полученной из второго раствора с равными концентрациями цинка и никеля в электролите 3.50 мА/см2 и в 38 раз меньше, чем из третьего электролита (табл. 3).
Таблица 3.
Коррозионные свойства стальных образцов, покрытых сплавами Zn–Ni из тауриновых электролитов № 1–3
| Образцы с покрытиями, полученными из электролитов | Плотность тока коррозии, мА/см2 |
|---|---|
| 1 | 0.25 |
| 2 | 3.50 |
| 3 | 9.50 |
Поскольку электролитический сплав, полученный из электролита № 3 с меньшим содержанием никеля как в электролите, так и в покрытии, представлял наименьший интерес в плане своих защитных свойств, поэтому в дальнейшем исследовали покрытия, полученные из первого и второго электролитов (табл. 4).
Таблица 4.
Химический состав электролитических цинк–никелевых сплавов
| Электролиты № | Содержание Ni, ат. % |
Содержание Zn, ат. % |
|---|---|---|
| 1 | 35.9 ± 0.4 | 64.2 ± 0.4 |
| 2 | 14.8 ± 0.4 | 85.2 ± 0.4 |
С помощью атомно-силовой микроскопии исследована структура Zn–Ni покрытий. Результаты исследований структуры покрытий приведены в табл. 5.
Таблица 5.
Результаты кристаллографических расчетов цинк-никелевых покрытий
| Электролит № | S, мкм2 | Маx Z, мкм | Zср, мкм | Р, мкм | D, мкм | l, мкм | b, мкм |
|---|---|---|---|---|---|---|---|
| 1 | 0.356 | 0.375 | 0.348 | 2.647 | 0.686 | 1.176 | 0.294 |
| 2 | 0.304 | 0.518 | 0.466 | 2.471 | 0.588 | 1.294 | 0.235 |
Анализируя структуру покрытий, полученных при катодной плотности тока 1 А/дм2 (рис. 3) и результаты кристаллографических расчетов (табл. 5) можно сделать вывод, что покрытие цинк-никелевым сплавом, полученное из электролита № 2, содержащего равное количество сернокислых солей цинка и никеля, обладает наиболее однородной и мелкокристаллической структурой.
Рис. 3.
Структура Zn–Ni покрытий, полученных из тауриновых электролитов. Катодная плотность тока 1 А/дм2. Температура 50°С.

Покрытие сплавом Zn–Ni, полученное из электролита № 1 обладает неоднородной структурой, кристаллы имеют большую длину 2–3 мкм прямоугольной и треугольной формы и образуют агломераты (рис. 4). Высоколегированные никелем сплавы склонны к растрескиванию, которое наблюдалось на ряде образцов. Вероятная причина трещин, высокие внутренние напряжения в покрытиях, богатых никелем. Содержание никеля в сплавах, полученных из электролита № 1 составляет 35.8%, остальное цинк.
Рис. 4.
Микрофотография сплава Zn–Ni, полученного из электролита № 1. Катодная плотность тока 1 А/дм2. Температура 50°С.

Как и следовало ожидать, содержание никеля в сплаве увеличивается с ростом концентрации его ионов в растворе. Структура сплавов при этом меняется на более мелкокристаллическую (рис. 5), и за счет этой, более упорядоченной структуры покрытия снижается скорость коррозии сплавов Zn–Ni.
Рис. 5.
Микрофотография сплава Zn–Ni, полученного из электролита № 2. Катодная плотность тока 1 А/дм2. Температура 50°С.

Анализ микрофотографий поверхности сплавов Zn–Ni показал, что при равной концентрации цинка и никеля в тауриновом электролите структура покрытия становится более однородной по размеру кристаллов. Форма кристаллов при этом содержании никеля является круглой, размер их находится в пределах 0.25–0.5 мкм, химический состав сплава: содержание никеля 14.8 ат. %, остальное цинк (рис. 5). С увеличением содержания цинка покрытие представляет собой плотноупакованную структуру, состоящую из кристаллов преимущественно круглой формы диаметром 0.6 мкм (рис. 6).
Рис. 6.
Микрофотография сплава Zn–Ni, полученного из электролита № 3. Катодная плотность тока 1 А/дм2. Температура 50°С.

Полученные результаты свидетельствуют о перспективности применения электролитов с добавкой таурина для осаждения сплавов Zn–Ni. С увеличением концентрации ионов никеля в растворе растет его содержание в покрытии, однако при относительно меньшей концентрации в электролите никеля и равной концентрации цинка, формируются более мелкокристаллические однородные по структуре покрытия, обладающие повышенной коррозионной устойчивостью.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе:
1. Потенциометрическим методом определены константы устойчивости комплексов цинка и никеля(II) c таурином при 25°С и значениях ионной силы 0.5; 1.0; 1.5 (KNO3). Рассчитаны величины термодинамических констант устойчивости.
2. Поляризационные исследования показали, что с увеличением содержания никеля в покрытии его потенциал смещается в область более положительных значений. Это приводит к уменьшению ЭДС коррозионного элемента и снижению коррозионного тока.
3. Низкая скорость коррозии наблюдается у образцов цинк-никелевых покрытий, полученных из электролитов с равной концентрацией цинка и кобальта, а также при превышении в два раза концентрации никеля в электролите над цинком. Однако, богатые никелем сплавы могут привести к потери анодного характера защиты цинка и его сплавов по отношению к стали при определенных условиях. В связи с этим перспективной, на наш взгляд, будет считаться область для получения Zn–Ni сплавов от 14.8 ат. % Ni до 35.9 ат. % Ni при сохранении более отрицательного потенциала цинк-никелевых сплавов относительно потенциала стали.
4. С увеличением концентрации ионов никеля в растворе растет его содержание в покрытии, однако при равной концентрации цинка и никеля в электролите, формируются более мелкокристаллические однородные по структуре покрытия.
Работа выполнена в рамках государственного задания на выполнение НИР (тема № FZZW-2020-0009).
Список литературы
Окулов В.В. Цинкование. Техника и технология. М.: Глобус, 2008. 252 с.
Schlesinger M., Paunovic M. Modern electroplating. Hoboken: John Wiley & Sons, Inc., 2010.
Винокуров Е.Г., Бондарь В.В. Модельные представления для описания и прогнозирования электроосаждения сплавов. М.: ВИНИТИ РАН, 2009. 164 с.
Таранина О.А., Евреинова Н.В., Шошина И.А., Нараев В.Н., Тихонов К.И. // Журн. прикл. химии. 2010. Т. 83. № 1. С. 60.
Gharahcheshmeh M.H., Sohi M.H. // J. Appl. Electrochem. 2010. V. 40. P. 1563.
Kamel M.M., Anwer Z.M., Abdel-Salam I.T., Ibrahim I.S. // Trans. IMF. 2010 V. 88. № 4. P. 191.
Ortiz-Aparicio J.L., Meas Y., Trejo G., Ortega R., Chapman T.W., Chainet E., Ozil P. // J. Appl. Electrochem. 2011. V. 41. P. 669.
Lacnjevac U., Jovic B.M., Jovic V.D. // J. Electrochem. Soc. 2012. V. 159. № 5. P. D310.
Красиков А.В., Красиков В.Л. // Журн. прикл. химии. 2012. Т. 85. № 5. С. 735.
Hammami O., Dhouibi L., Bercot P., Rezrazi E.A. // Can. J. Chem. Eng. 2013. V. 91. P. 19.
Соцкая Н.В., Сапронова Л.В., Долгих О.В. // Электрохимия. 2014. Т. 50. № 12. С. 1271.
Vidu R., Perez-Page M., Quach D.V., Chen X.Y., Stroeve P. // Electroanalysis. 2015. V. 27. P. 2845.
Kahoul A., Azizi F., Bouaoud M. // Trans. IMF. 2017. V. 95. № 2. P. 106.
Шеханов Р.Ф., Гридчин С.Н., Балмасов А.В. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 3. С. 316.
Шеханов Р.Ф., Гридчин С.Н., Балмасов А.В. // Электрохимия. 2018. Т. 54. № 4. С. 408.
Шеханов Р.Ф., Гридчин С.Н., Балмасов А.В. // Электронная обработка материалов. 2016. Т. 52. № 2. С. 27.
Шеханов Р.Ф., Кузьмин С.М., Балмасов А.В., Гридчин С.Н. // Электрохимия. 2017. Т. 53. № 11. С. 1442.
Шеханов Р.Ф., Гридчин С.Н., Балмасов А.В. Пат. 2569618 (Российская Федерация). 2015.
Шеханов Р.Ф., Гридчин С.Н., Балмасов А.В., Шеханова Я.Р. Пат. 2603526 (Российская Федерация). 2016.
Гридчин С.Н., Шеханов Р.Ф., Пырэу Д.Ф. // Журн. физ. химии. 2015. Т. 89. № 2. С. 351.
Гридчин С.Н. // Журн. аналит. химии. 2007. Т. 62. № 6. С. 583.
Гридчин С.Н. // Журн. физ. химии. 2016. Т. 90. № 12. С. 1913.
Гридчин С.Н. // Журн. общ. химии. 2017. Т. 87. № 12. С. 2031.
Розенфельд И.Л. Коррозия и защита металлов. М.: Металлургия, 1969. 448 с.
Бородин В.А., Козловский Е.В., Васильев В.П. // Журн. неорг. химии. 1986. Т. 31. № 1. С. 10.
Химмельблау Д. Прикладное нелинейное программирование. М.: Мир, 1975. 417 с.
Васильев В.П., Бородин В.А., Козловский Е.В. Применение ЭВМ в химико-аналитических расчетах. М.: Высшая школа, 1993. 112 с.
Гридчин С.Н., Шеханов Р.Ф., Бычкова С.А. // Изв. вузов. Химия и хим. технология. 2016. Т. 59. Вып. 3. С. 95.
Назаренко В.А., Антонович В.П., Невская Е.М. Гидролиз ионов металлов в разбавленных растворах. М.: Атомиздат, 1978. 192 с.
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высшая школа, 1982. 320 с.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов


