Физикохимия поверхности и защита материалов, 2020, T. 56, № 2, стр. 152-157
PtMoS2 – стабильный бифункциональный катализатор для Li–O2 аккумулятора
О. В. Трипачев 1, *, О. В. Корчагин 1, М. В. Радина 1, С. В. Долгополов 1, В. А. Богдановская 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: tochem@rambler.ru
Поступила в редакцию 13.09.2019
После доработки 20.09.2019
Принята к публикации 27.09.2019
Аннотация
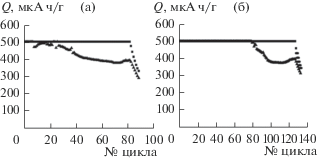
В настоящей работе в качестве катализатора для Li–O2 аккумулятора нами была предложена новая наносистема, представляющая из себя нанодисперсный сульфид молибдена, с нанесенными на него наночастицами платины. Использование платины в качестве каталитически активного материала способствовало снижению перенапряжения на заряде. Химическая устойчивость сульфида молибдена в качестве носителя позволила увеличить токовые и мощностные характеристики до 1000 мА/г (рис. 8) и возрастанию количества циклов бесперебойной работы элемента (до 130 при 500 мА/г). Таким образом, предложенная нами каталитическая система обладает не только бифункциональными свойствами, но и высокой стабильностью при циклировании.
ВВЕДЕНИЕ
Одним из важнейших направлений в области литий-кислородных источников тока является поиск катализатора для положительного электрода. Катализатор должен обладать совокупностью свойств, среди которых каталитическая активность в реакции восстановления кислорода в ходе разряда элемента и реакции разложения пероксида лития в ходе его заряда, а также устойчивость к деградации. Кроме того, катализатор не должен ускорять побочные процессы, включающие деградацию носителя и электролита. В качестве материалов для создания активного слоя (АС) положительного электрода используют углеродные материалы (УМ) [1–5], отличающиеся по пористой структуре и величине поверхности; неорганические соединения (сульфиды, оксиды переходных металлов) [6–9], моно- и биметаллические нанокатализаторы, нанесенные на углеродные носители (M1М2/С), где М1, М2 – Au, Pt, Pd, Ir [10, 11], а также иные системы [12].
В отношении металлосодержащих катализаторов существует две противоположных точки зрения: в ряде работ [10, 11, 13] полагают, что такие системы перспективно использовать в качестве материала положительного электрода литий- кислородного аккумулятора (ЛКА), поскольку при этом наблюдается снижение перенапряжения кислородной реакции. В других работах [14–17] говорится о том, что промотирование металлами малоэффективно, поскольку наночастицы металла, в частности платины [17], ускоряют деградацию электролита и носителя. Это приводит к выходу ЛКА из строя за более короткий срок по сравнению, например, с ЛКА, использующими УМ в составе активного слоя положительного электрода [14].
В работах [6, 15–17] представлены результаты исследований, посвященных изучению ЛКА с положительным электродом на основе дисульфида молибдена. Дисульфид молибдена обладает каталитической активностью в реакции восстановления кислорода [16], а введение углеродного материала в каталитический слой обеспечивает электропроводность и повышение характеристик положительного электрода на основе MoS2. Помимо этого, дисульфид молибдена обладает высокой коррозионной стабильностью, превышающей стабильность УНТ [15]. В работах [15, 16] показана возможность получения гибридных наносистем, в составе которых используется MoS2, с оптимальными свойствами в качестве материала для АС положительного электрода ЛКА. Количество циклов, в течение которых ЛКА с катодом из НТ с нанесенным МоS2 сохраняет свои характеристики, достигает 130 (при плотности тока 200 мА/г) [15].
Анализ литературных данных показывает, что бифункциональный катализатор, отвечающий всем требованиям для положительного электрода ЛКА, еще не создан и необходимы дальнейшие исследования, направленные на повышение активности и стабильности каталитической системы. В связи с этим, в данной работе исследованы два типа материалов: MoS2 и MoS2, модифицированный платиной (20 мас. % Pt/MoS2). Для повышения электропроводности при нанесении АС использовали смесь этих материалов с УМ (углеродные нанотрубки (УНТ) или сажа ХС-72).
МЕТОДИКА ЭКСПЕРИМЕНТА
В качестве материалов положительного электрода ЛКА использовали коммерческий препарат – дисульфид молибдена (ТД ХАЛМЕК, Россия), синтезированный на его основе катализатор, промотированный платиной, состава 20Pt/MoS2, а также углеродные нанотрубки (УНТ-Т) производства Тамбов (Россия). УНТ и MoS2 предварительно обрабатывали щелочью. Обработка включала выдержку образцов (при перемешивании) в течение часа в 1 M NaOH при 100°С. Далее образцы отмывали деионизованной водой до нейтральной реакции и сушили в вакуумном шкафу при 100°С.
Исследование материалов MoS2 и Pt/MoS2 в модельных условиях и в составе макета Swagelok. В первом случае использовали трехэлектродную электрохимическую ячейку с разделенными электродными пространствами при использовании стационарного дискового электрода с нанесенным тонким слоем исследуемого материала и водного электролита, содержащего 0.5 М H2SO4. В этих условиях определяли величину электрохимически активной поверхности платины по водородной области на ЦВА [из расчета 210 мкКл/см2] согласно методике, описанной в работе [18], и активность в реакции восстановления кислорода при продувке раствора кислородом. Тонкий слой дисперсного материала наносили из “чернил”, которые готовили путем диспергирования в изопропиловом спирте (500 мкл) 2 мг порошка с добавкой Нафиона [19]. Аликвоту чернил наносили на поверхность дискового электрода из расчета 100–150 мкг/см2. На рис. 1 представлена типичная вольтамперограмма, полученная на катализаторах состава MoS2 и 20Pt/MoS2 с добавками сажи. Как видно, ЦВА на сульфиде молибдена не имеет выраженных максимумов и поляризационная емкость его невелика. На ЦВА моноплатинового катализатора, синтезированного на МоS2, наблюдаются характерные для платины области адсорбции/десорбции водорода, что позволяет рассчитать величину поверхности нанесенных частиц платины. Для катализатора, содержащего 20 мас. % Pt, электрохимически активная поверхность платины составляет 12–15 м2/г, что указывает на достаточно крупные размеры наночастиц (более 10 нм). Активность в реакции восстановления кислорода, определенная по поляризационной кривой при Е = 0.9 В соответствует величине токов 38–40 А/г, а число переносимых электронов составляет n = 3.9, что указывает на преимущественное восстановление кислорода непосредственно до воды.
Рис. 1.
ЦВА на дисковом электроде с нанесенными материалами: МоS2 + 15% ХС72 (1); 20% Pt/МоS2 + + 15% ХС72 (2). 0.5 М Н2SO4, атмосфера Ar, 25°С, 0.10 В/c.

В макете ЛКА типа Swagelok использовали два типа электролитов: с высоким (ДМСО) и низким донорным числом (тетраглим). Измерения проводили при подаче кислорода (ос. ч.), содержащего ~7 ppm воды, в пространство над положительным электродом. Эксперимент производился в сухом боксе, заполненном аргоном. В качестве электролита использовали 1 М раствор соли лития LiClO4 (Aldrich, battery grade) в тетраглиме (ТГМ) или ДМСО. Содержание воды в электролите, определенное методом Фишера, не превышало 120 ppm.
Необходимость проведения измерений в атмосфере кислорода обусловлена тем, что в воздухе содержатся различные примеси, включая воду, способные вызвать быструю деградацию литиевого анода и выход аккумулятора из строя. Это затрудняет оценку эффективности функционирования материала АС.
Отрицательный электрод (1.13 см2) вырезали из литиевой фольги особой чистоты толщиной 400 мкм. Для формирования положительного электрода на газодиффузионный слой (ГДС) Sigracet 39 ВС наносили путем напыления или намазывания суспензию активного материала (MoS2 либо Pt/MoS2 в смеси с УМ) со связующим поливинилиденфторид (PVDF, M = 534 000) в 1-метил-2-пирролидоне. Суспензию наносили из расчета 0.5 мг (MoS2 + УМ)/см2. Соотношение PVDF/MoS2 + УМ составляло 1 : 4. После этого образец сушили при 100°С под вакуумом в течение 12 часов.
Положительный и отрицательный электроды были разделены сепаратором, пропитанным раствором электролита – 1 M LiClO4 в тетраглиме или в ДМСО. В качестве сепараторов использовали Celgard для электролита на основе ТГМ, и Whatman для электролита на основе ДМСО. При сборке ячейки положительный электрод помещали активным слоем к сепаратору, а кислород подавали с тыльной стороны ГДС. На литиевый электрод и сепаратор наносили электролит в количестве 40 мкл ТГМ или 60 мкл раствора на основе ДМСО.
Электрохимические измерения проводили при помощи разрядно-зарядного модуля АЗРИВК-0.05А-5В в режимах одиночного разряда при плотности тока 210 мА/г(MoS2 + УМ) и циклирования при плотности тока 500–1000 мА/г, что превышает данные большинства опубликованных работ [3, 15, 20].
Для формирования электропроводного АС было необходимо оптимизировать соотношение MoS2/C. С этой целью измеряли одиночные циклы разряда-заряда АС до глубины 2.0 В (разряд) и 4.8 В (заряд) с различным соотношением сульфида молибдена и сажи Vulcan ХС72. Данные представлены на рис. 2 и в табл. 1.
Рис. 2.
Разрядно-зарядные кривые ЛКА с АС положительного электрода состава 95% MoS2 + 5% XC72 (1), 85% MoS2 + 15% XC72 (3), а также с ГДС без АС (2). 1 M LiClO4/ТГМ. I = 210 мА/г.

Таблица 1.
Зависимость величины удельной разрядной емкости ЛКА с положительным электродом различного состава.0.5 мг (MoS2 + УМ)/см2. 1 М LiClO4/ТТГ. i = 210 мА/г (115 мкА/см2 – для ГДС)
| Состав АС положительного электрода | Емкость, мА ч/г(MoS2 + XC72) | Емкость, мкА ч/см2 |
|---|---|---|
| 95% MoS2 + 5% XC72 | 3400 | 1600 |
| 85% MoS2 + 15% XC72 | 12 700 | 6200 |
| 70% MoS2 + 30% XC72 | 10 600 | 5300 |
| 50% MoS2 + 50% XC72 | 10 300 | 5150 |
| 85% MoS2 + 15% УНТNaOH | 14 200 | 7100 |
| 100% УНТNaOH | 16 400 | 8200 |
| 100% ХС72 | 8500 | 4250 |
| Sigracet 39 ВС | – | 2850 |
Микропористый слой ГДС, образованный гидрофобизированной сажей, на поверхность которого наносится АС, имеет собственную емкость. Однако при нанесении слоя углеродного материала (или смеси УМ + MoS2) в количестве 0.5 мг/см2, имеющего толщину порядка 10–15 мкм или более, зона преимущественного формирования продукта реакции смещается из микропористого слоя в объем АС. Косвенно это проявляется в существенном снижении перенапряжения на разряде для систем MoS2-ХС72 с массовой долей сажи 15% и выше. Как видно на рис. 2, при недостаточном количестве сажи в составе АС возрастающее сопротивление в слое сульфида молибдена вызывает резкий рост перенапряжения при разряде и еще более выраженный рост его при заряде. Это приводит к резкому снижению разрядной емкости. АС, представленный практически чистым сульфидом молибдена, обладает более низкой емкостью, чем ГДС, экранируя его микропористый слой.
Как видно из табл. 1, для смеси сульфида молибдена и сажи существует оптимальный по разрядным характеристикам состав АС, который содержит 15% сажи по массе. При меньших количествах сажи электропроводность активного слоя недостаточна высока. При большем количестве сажи удельная емкость несколько снижается, что, видимо, связано с уменьшением концентрации активных центров в единице объема и увеличением толщины АС. Однако емкость АС на основе смеси XC-72 + MoS2 остается заметно выше емкости АС со 100% XC-72. Введение в состав активного слоя УНТ вместо сажи способствует росту характеристик АС положительного электрода. Это связано с тем, что пористая структура УНТ обеспечивает накопление большего количества пероксида лития при разряде. Электрод с большей загрузкой УНТ в составе активного слоя характеризуется более высокой емкостью, однако разница в разрядной емкости между АС состава 85% MoS2–15% УНТNaOH и 100% УНТNaOH, для которых количество УНТ в составе активного слоя отличается в 6 раз, невелика. Это свидетельствует о выраженном положительном влиянии MoS2 на структуру осадка пероксида лития.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты измерений при использовании электролита на основе ТГМ
Тетраглим отличается низкими летучестью и температурой замерзания. Эти свойства могут быть полезны для практического применения. Однако при испытаниях в макете Swagelok c каталитически неактивным материалом на положительном электроде перенапряжения при заряде элемента достигают больших значений – до 4.8–5.0 В и более, вследствие чего тетраглим и материал положительного электрода подвергаются быстрой деградации. В этих условиях снижение перенапряжения на заряде путем подбора бифункционального катализатора является оптимальным решением для создания стабильно работающего ЛКА.
Сопоставление ЛКА с положительными электродами на основе МоS2 и Pt/MoS2 в режиме одиночного разряда представлено на рис. 3.
Рис. 3.
Разрядно-зарядные кривые для ЛКА с положительным электродом на основе MoS2 + УНТ (1) и Pt/MoS2+ УНТ (2). i = 210 мА/г. Глубина разряда 2.0 В. 1 M LiClO4/ТГМ.

Качественно обе системы имеют аналогичные разрядные характеристики. Величины перенапряжений близки для исходной и для модифицированной платиной системы, и различие в величине удельной емкости разряда составляет около 10%. Это говорит о том, что в условиях ЛКА катализа реакции электровосстановления кислорода на Pt/MoS2 не наблюдается, что связано с блокировкой поверхности металла (Pt) молекулами электролита и другими частицами. Поведение ЛКА на заряде существенно отличается для этих двух материалов. Для сульфида молибдена, модифицированного платиной, характерно существенное снижение перенапряжения на заряде в начальной области, до величины зарядной емкости, составляющей 30% от величины разрядной емкости. При более глубоком заряде перенапряжения для двух каталитически активных материалов совпадают, что связано с энергетической неоднородностью поверхности электрода, заполненной осадком Li2O2. В случае платиносодержащего катализатора соседние с активными центрами – наночастицами платины – частицы пероксида лития окисляются легче. Совпадение зарядных кривых для ЛКА с МоS2 и Pt/MoS2, по-видимому, соответствует началу окисления частиц Li2O2, локализованных на MoS2 и углеродном материале.
Сопоставление ЛКА в режиме циклирования представлено на рис. 4.
Рис. 4.
Разрядно-зарядные кривые для ЛКА с положительным электродом на основе MoS2 (а) и Pt/MoS2 (б). i = 500 мА/г. Q = 500 мА ч/г. 1 M LiClO4/тетраглим.
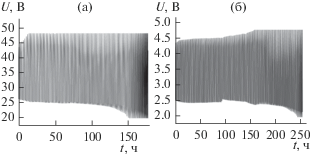
На рис. 5а, 5б отображена динамика основных параметров функционирования аккумулятора.
Рис. 5.
Изменение разрядно-зарядных характеристик ЛКА с положительными электродами на основе MoS2 (а) и Pt/MoS2 (б) в ходе циклирования при Q = 500° мА ч/г (◼ – разрядная емкость (2.0 В), ▲ – зарядная емкость (4.8 В)). 1 M LiClO4/ТГМ.
ЛКА с положительным электродом на основе модифицированного платиной сульфида молибдена характеризуется более высокой стабильностью работы, что выражается в увеличении количества циклов. Как видно из рис. 4, 5, основным фактором, вызывающим выход из строя ЛКА, является возрастание перенапряжения на заряде от 4.4 до 4.8 В. При этом наблюдается снижение удельной емкости, что можно объяснить ускорением процессов деградации электролита. Модифицирование катализатора платиной способствует снижению перенапряжения на заряде за счет более активного разложения пероксида лития на активных центрах платины. В то же время, использование в качестве носителя для наночастиц платины химически более устойчивого дисульфида молибдена [15] повышает общую стабильность такой системы. Сочетание этих свойств проявляется в возрастании времени стабильной работы ЛКА.
Электрохимические характеристики MoS2 и 20Pt/MoS2 в составе активного слоя положительного электрода при использовании электролита на основе ДМСО
ДМСО – растворитель, обладающий выраженными донорными свойствами в сравнении с тетраглимом. Механизмы образования и разложения пероксида лития в ДМСО и тетраглиме различаются. Основное отличие заключается в иной структуре формирующегося осадка пероксида лития – в ДМСО он осаждается в форме тороидов [21, 22] – образований, имеющих пористую структуру. Для сравнения, в случае тетраглима образуется пленка Li2O2 [23]. В условиях ЛКА переход от тетраглиму к ДМСО обеспечивает существенное снижение перенапряжения при заряде, что может быть обусловлено более быстрым окислением пероксида лития с поверхности тороида, чем в случае пленки.
При сопоставлении разрядно-зарядных кривых для ЛКА с АС на основе MoS2 в средах ДМСО и тетраглима (рис. 3, кривая 1 и рис. 6) можно сделать вывод, что влияние высокодонорного растворителя проявляется в основном на заряде, и выражено в снижении плато электроокисления пероксида лития – на величину порядка 0.3 В.
Рис. 6.
Разрядно-зарядная кривая для ЛКА с положительным электродом на основе MoS2. i = 210 мА/г. Глубина разряда 2.0 В. 1 M LiClO4/ДМСО.

Для двух каталитических систем, исследуемых в качестве материала положительного электрода, проводились также испытания в режиме циклирования. Сопоставление стабильности работы ЛКА с положительными электродами такого состава (на основе сульфида молибдена и сульфида молибдена, модифицированного платиной) показало, что модифицирование катализатора платиной, как и для элементов, содержащих в качестве растворителя тетраглим, улучшает циклируемость аккумулятора (рис. 7).
Рис. 7.
Изменение разрядной емкости ЛКА с положительными электродами на основе MoS2 ( ) и Pt/MoS2 (
) и Pt/MoS2 ( ) в ходе циклирования при Q = 500 мА ч/г и динамика напряжения разряда в процессе работы ЛКА с положительными
электродами на основе MoS2 (▲) и Pt/MoS2 (◼). 1 M LiClO4/ДМСО.
) в ходе циклирования при Q = 500 мА ч/г и динамика напряжения разряда в процессе работы ЛКА с положительными
электродами на основе MoS2 (▲) и Pt/MoS2 (◼). 1 M LiClO4/ДМСО.

Снижение перенапряжения на заряде, связанное с катализом разложения пероксида лития наночастицами платины, способствует снижению роли процессов разложения растворителя, что в конечном итоге приводит к существенному росту циклируемости ЛКА в сравнении с недопированным платиной катодом.
ЗАКЛЮЧЕНИЕ
Вопрос о роли электрокатализа в кислородной реакции в ЛКА все еще остается открытым. Несмотря на то, что в условиях реального ЛКА гетерогенного электрокатализа прямой реакции электровосстановления кислорода не наблюдается либо он крайне слабо выражен, каталитическое разложение пероксида лития в ходе заряда ЛКА характерно для многих каталитически активных систем.
Как установлено в последнее время рядом независимых исследователей, использование в качестве катализатора положительного электрода систем состава Pt(Pd, Ru)/C малоэффективно, так как наряду с катализом кислородной реакции эти металлы ускоряют процессы деградации компонентов ЛКА – носителя, электролита и т.д.
Нами была предложена новая наносистема, представляющая из себя нанодисперсный сульфид молибдена, с нанесенными на него наночастицами платины. Использование платины в качестве каталитически активного материала способствовало снижению перенапряжения на заряде. Химическая устойчивость сульфида молибдена в качестве носителя позволила увеличить токовые и мощностные характеристики до 1000 мА/г (рис. 8) и возрастанию количества циклов бесперебойной работы элемента (до 130 при 500 мА/г). Таким образом, предложенная нами каталитическая система обладает не только бифункциональными свойствами, но и высокой стабильностью при циклировании.
Список литературы
Xu Sh.-M., Liang X., Ren Zh.-Ch., Wang K.-X., Chen J.-Sh. // Angew. Chem. Int. Ed. Engl. 2018. V. 57(23). P. 6825–6829.
Beattle S.D., Manolescu D.M., Blair S.L. // J. Electrochem. Soc. 2009. V. 156. P. A44–A47.
Wang M., Yao Y., Tang Zh., Zhao T., Wu F., Yang Y., Huang Q. // ACS Appl. Mate. Interfaces. 2018. V. 10(38). P. 32212–32219.
Xu Sh., Yao Y., Guo Y., Zeng X., Lacey S. D., Song H., Chen C., Li Y., Dai J., Wang Y., Chen Y., Liu B., Fu K., Amine K., Lu J. Hu L. // Adv. Mater. 2017. V. 30. P. 17049071–17049078.
Bogdanovskaya V.A., Korchagin O.V., Tarasevich M.R., Andreev V.N., Nizhnikovskii E.A., Radina M.V., Tripachev O.V., Emets V.V. // Protection of Metals and Physical Chemistry of Surfaces. 2018. V. 54(3). P. 373–388.
Asadi M., Kumar B., Liu C., Phillips P., Yasaei P., Behranginia A., Zapol P., Klie R.F., Curtiss L.A., Salehi-Khojin A. // ACS Nano. 2016. V. 10(2). P. 2167–2175.
Lin X., Zhou L., Huang T., Yu A. // Int. J. Electrochem. Sci. 2012. V. 7. P. 9550–9559.
Lai N.-Ch., Cong G., Liang Zh., Lu Y-Ch. // Joule. 2018. V. 2. P. 1–11.
Anandan V., Kudla R., Adams J., Karulkar M., Drews A. Mixed Metal Oxide Catalysts for Rechargeable Lithium-Air Batteries // 220th ECS Meeting. 2011. Abstract # 1330.
Yang H., Xia J., Bromberg L., Dimitrov N. // J. Solid State Electrochem. 2017. V. 21. P. 463–468.
Cui Zh., Li L., Manthiram, Goodenough J.B. // J. Am. Chem. Soc. 2015. V. 137(23). P. 7278–7281.
Song S., Xu W., Zheng J., Luo L., Engelhard M.H., Bowden M.E., Liu B., Wang C., Zhang J.-G. // Nano Lett. 2017. V. 17(3). P. 1417–1424.
Galiote N.A., Ulissi U., Passerini S., Huguenin F. // J. Phys. Chem. C. 2018. V. 122 (28). P. 15826–15834.
Wong R.A., Yang Ch., Dutta A., Hong M., Thomas M.L., Yamanaka K., Ohta T., Waki K., Byon H.R. // CS Energy Lett. 2018. V. 3(3). P. 592–597.
Hu A., Long J., Shu Ch., Liang R., Li J. // ACS Appl. Mater. Interfaces. 2018. V. 10. P. 34077−34086.
Asadi M., Sayahpour B., Abbasi P., Ngo A.T., Karis K., Jokisaari J.R., Liu C., Narayanan B., Gerard M., Yasaei P., Hu X., Mukherjee A., Lau K.Ch., Assary R.S., Khalili-Araghi F., Klie R.F., Curtiss L.A., Salehi-Khojin A. // Nature. 2018. V. 555. P. 502–507.
Li Sh., Dong Y.-F., Wang D.-D., Chen W., Huang L., Shi Ch.-W., Mai L.-Q. // Front. Phys. 2014. V. 9(3). P. 303–322.
Watt-Smith M.J., Friedrich J.M., Rigby S.P., Ralph T.R., Walsh F.C. // J. Phys. D: Appl. Phys. 2008. V. 41. P. 174004(1–8).
Богдановская В.А., Тарасевич М.Р., Лозовая О.В. // Электрохимия. 2011. Т. 47. № 7. С. 902–917.
Chatterjee A., Wing Or S., Cao Y. // Nanomaterials. 2018. V. 8. P. 308.
Geaney H., O’Dwyer C. // Phys. Chem. Chem. Phys. 2015. V. 17. P. 6748–6759.
Kim G., Liu T., Temprano I., Petrucco E.A., Barrow N., Grey C.P. // Johnson Matthey Technol. Rev. 2018. V. 62. P. 332–340.
Geaney H., O’Dwyer C. // J. Electrochem. Soc. 2016. V. 163. P. A43–A49.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов



