Физикохимия поверхности и защита материалов, 2020, T. 56, № 3, стр. 231-237
Модифицирование поверхности магнитных оксидов железа фосфоновыми комплексонами
Т. Н. Кропачева 1, *, А. С. Антонова 1, А. Ю. Журавлева 1
1 Удмуртский государственный университет
426034 Ижевск, ул. Университетская, 1, Россия
* E-mail: krop@uni.udm.ru
Поступила в редакцию 11.11.2018
После доработки 05.01.2020
Принята к публикации 10.01.2020
Аннотация
Исследованы условия химического модифицирования поверхности синтетических магнитных оксидов железа (магнетит Fe3O4, маггемит γ-Fe2O3) фосфоновыми комплексонами (ФБТК, ОЭДФ, ГЭИДФ, НТФ, ЭДТФ). Показано, что максимальная концентрация привитых групп наблюдается при обработке оксидов железа водными растворами комплексонов, содержащих две или три фосфоновые группы, при рН 2–3 и температуре 50–60°С в течении 2–6 ч. Для характеристики привитого слоя были использованы различные физико-химические методы исследования (РФА, ИК-Фурье спектроскопия, метод БЭТ, термический анализ, кислотно-основное титрование, сорбция из растворов). Установлено, что модифицирующее покрытие значительно увеличивает сорбционную способность магнитных оксидов железа по отношению к катионам металлов (Cu(II), Cd(II)). Предложен механизм связывания ионов металлов модифицированными сорбентами.
ВВЕДЕНИЕ
Среди множества неорганических сорбентов-носителей в настоящее время особый интерес вызывают магнитные оксиды железа (МОЖ) – магнетит (Fe3O4) и маггемит (γ-Fe2O3). Помимо того, что МОЖ широко распространены в окружающей среде и нетоксичны, они обладают таким уникальным свойством как ферримагнетизм, что облегчает их извлечение/регенерацию при концентрировании и разделении органических и неорганических веществ, при использовании в качестве подложки в гетерогенном катализе, при иммобилизации биологических молекул с целью создания магнитных маркеров и пр. Для более эффективного удерживания целевых компонентов поверхность МОЖ зачастую необходимо химически модифицировать закреплением дополнительных соединений, несущих различные функциональные группы, которые определяют свойства полученного поверхностно-модифицированного носителя [1–4]. Одним из новых подходов к функционализации поверхности различных оксидов, включая оксиды железа, является использование в качестве модификаторов соединений, содержащих фосфоновую группу –РО(ОН)2, которая обладает высоким сродством к поверхности оксидов и может выступать в качестве хорошего “якоря” для модификатора [5–7]. В частности, если речь идет о применении МОЖ для разделения, извлечения, концентрирования ионов различных металлов, включая тяжелые (Hg(II), Pb(II), Cu(II), Cd(II), Ni(II), Zn(II)), благородные (Ag(I), Au(III), Pt(II)), радиоактивные [2, 8–10], то большой интерес как потенциальные модификаторы могут представлять фосфоновые комплексоны [11], которые наряду с –РО(ОН)2 группами, содержат и другие функционально-активные центры, при одновременной координации которых с ионом металла, образуются устойчивые хелатные циклы. Такие комплексообразующие магнитные сорбенты могут иметь преимущества перед широко известными хелатирующими сорбентами на основе модифицированного диоксида кремния (этилендиамин-SiO2, аминокислота-SiO2, иминодиуксусная кислота-SiO2 [6]) или комплексообразующими полимерными смолами [12]. В литературе имеются сведения по модификации оксидов железа, включая магнитные, фосфоновыми производными (алкилфосфоновые кислоты, амино/гидрокси/карбоксифосфоновые кислоты и др.) [5–7], однако, среди используемых модификаторов отсутствуют фосфоновые комплексоны. В связи с этим, в настоящей работе были изучены оптимальные условия модифицирования поверхности магнетита и маггемита несколькими фосфоновыми комплексонами (ФК) и проведено исследование физико-химических свойств полученных носителей, включая сорбционные.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Используемые в работе препараты МОЖ были получены по методикам, описанным в литературе [13]. Синтез магнетита проводили путем неполного окисления соли Fe(II) в щелочной среде при 90°С (3FeSO4 ⋅ 7H2O + KNO3 + 6KOH = Fe3O4 + + KNO2 + 24H2O + 3K2SO4). Полученный осадок Fe3O4 черного цвета после многократного промывания дистиллированной водой сушили на воздухе при 75°C. Маггемит был получен из магнетита путем окисления на воздухе при 250°С в течение 2 ч (4Fe3O4 + О2 = 6 γ-Fe2O3), при этом цвет оксида менялся с черного на коричневый. Полученные сорбенты (в виде сухих порошков и суспензий) сильно притягиваются постоянным магнитом, что позволяет легко отделять их от водной фазы.
В работе использовали коммерческие препараты фосфоновых комплексонов (табл. 1) фирмы Zschimmer and Schwarz серии Cublen®: НТФ (АР 1), ОЭДФ (К 60), ЭДТФ (Е 34135Р), ГЭИДФ (R 60), ФБТК (Р 50). Растворы комплексонов (0.05 моль/дм3) готовили путем растворения навески препаратов в дистиллированной воде с последующей стандартизацией методом потенциометрического титрования. Модифицирование поверхности МОЖ проводили путем обработки сорбентов раствором ФК (1 ммоль ФК /г сорбент) при выбранных значениях кислотности среды (рН 2–11), температуры (20, 55°С) и времени обработки (2, 24 ч). После модификации сорбент отфильтровывали, промывали дистиллированной водой и сушили на воздухе. Содержание ФК на поверхности определяли по его остаточной концентрации в растворе спектрофотометрическим методом (реакция образования фосфорномолибденовой сини), после предварительного окисления комплексона персульфатом аммония. Эксперименты по десорбции ФК с поверхности МОЖ проводили путем обработки водным раствором с различными значениями рН (рН 2, 6, 11) в течение 24 ч.
Изучение кислотно-основных свойств МОЖ проводили рН-метрическим титрованием (иономер И-160 МИ) суспензии (концентрация 1 г/дм3) стандартным раствором KOH при постоянной ионной силе раствора (I = 0.1 моль /дм3, KNO3).
Сорбцию ионов металлов (Cu(II), Cd(II)) на МОЖ изучали в статическом режиме при 20°С при непрерывном встряхивании в течение 30 мин в присутствии фонового электролита (0.1 моль/дм3 KNO3). Необходимую кислотность среды создавали растворами HNO3 и КОН. Сорбент отфильтровывали через бумажный фильтр (“синяя лента”), измеряли рН равновесного раствора и определяли в нем остаточную концентрацию ионов металлов. Остаточную концентрацию катионов Cu(II) и Cd(II) определяли методом анодной инверсионной вольтамперометрии с помощью универсального полярографа ПУ-1. При этом использовалась система из трех электродов: углеситалловый (рабочий), платиновый (вспомогательный) и насыщенный хлорсеребряный (электрод сравнения). Вольтамперограммы снимались на фоне 0.05 моль/дм3 HCl с добавлением 10–4 моль/дм3 Hg(NO3)2 при следующих параметрах: потенциал накопления –0.8 В; время накопления 60 с; амплитуда развертки от –0.8 до 0.2 В; скорость развертки 50 мВ/с, потенциал регенерации 0.4 В; время регенерации 60 с.
Порошковые рентгенограммы МОЖ были получены на дифрактометре ДРОН-6 (FeKα излучение, интервал углов рассеяния 20°–120° с шагом 0.05°). Удельная площадь поверхности МОЖ была определена на основании изотерм низкотемпературной сорбции азота четырехточечным методом БЭТ на приборе Sorbi-M®. Термические характеристики сорбентов были получены на дериватографе Diamond TG/DTA (Perkin-Elmer) (воздушная атмосфера, интервал температур 50–1050°С, скорость нагрева 10°/мин). ИК-Фурье спектры образцов (в виде таблеток с KBr) регистрировали на ИК-спектрометре ФСМ 2201 в диапазоне частот 400–4000 см–1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
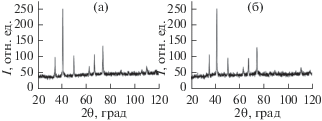
Полученные дифрактограммы синтезированных МОЖ (рис. 1) хорошо согласуются с литературными данными [14] и указывают на изоструктурность магнетита и маггемита (структура шпинели). Средний размер сферических кристаллитов МОЖ был рассчитан по формуле Дебая–Шеррера: D = Kλ/β cos θ, где K = 0.89 (постоянная Шеррера); λ = 0.19360 нм (длина волны рентгеновского излучения); β – ширина рефлекса на полувысоте (в радианах, в единицах 2θ); θ – угол дифракции. Полученное значение D одинаково для обоих МОЖ и составляет 30.2 (±0.1) нм. Удельная площадь поверхности МОЖ, определенная методом БЭТ составила: Sуд = 36.8 (±4.1) м2/г (магнетит) и Sуд = 35.7 (±3.3) м2/г (маггемит).
Для характеристики изменений, связанных с хемосорбцией на поверхности МОЖ фосфоновых комплексонов, был использован метод ИК-спектроскопии. На ИК-спектрах МОЖ (рис. 2) присутствуют характерные полосы при 559 и 632 см–1 (маггемит) и при 580 см–1 (магнетита), обусловленные валентными колебаниями связи Fe–O [13], а также полосы при 3450 и 1633 см–1 (валентные и деформационные колебания О–Н, соответственно, поверхностных ОН-групп и молекул сорбированной воды). Небольшие “посторонние” пики при 1140 и 1020 см–1 связаны с хемосорбированными ${\text{SO}}_{4}^{{2 - }}$-ионами, поскольку прекурсором синтеза МОЖ является FeSO4. На ИК-спектрах чистых препаратов ФК в области колебаний фосфоновой группы (900–1400 см–1) присутствуют характеристические полосы, относящиеся к валентным колебаниям фосфорильной группы Р=О (1112 см–1 (ОЭДФ), 1147 см–1 (НТФ)) и валентным колебаниям связи P–O (ассиметричным и симметричным) ${\text{PO}}_{3}^{{2 - }}$- и ${\text{HPO}}_{3}^{ - }$-групп (1024 и 931 см–1 (ОЭДФ); 1002 и 939 см–1 (НТФ)) [15]. В спектрах модифицированных МОЖ по сравнению с исходными образцами происходит значительное увеличение интенсивности поглощения в области колебаний фосфоновых групп, что однозначно свидетельствует о закреплении модификатора на поверхности. Форма полосы поглощения поверхностно-закрепленной фосфоновой группы значительно отличается от того, что наблюдается для самих комплексонов, как это отмечалось и в работе [16]. При закреплении ФК на поверхности тонкая структура полосы становится значительно менее выраженной (по сравнению со свободными комплексонами), что указывает на присутствие в сорбированном состоянии более равноценных Р–О связей.
Рис. 2.
ИК-спектры ОЭДФ (а); НТФ (б); маггемита (1) и ОЭДФ-маггемита (2) (в); маггемита (1) и НТФ-маггемита (2) (г).

Для изучения условий, при которых модификация поверхности МОЖ происходит наиболее эффективно, была исследована зависимость поверхностного содержания ФК от времени и температуры обработки, кислотности среды и природы комплексона-модификатора. Для количественной характеристики относительного содержания ФК на поверхности МОЖ проводили численное интегрирование ИК-полосы поглощения фосфоновых групп в области от 900 до 1400 см–1. Полученное значение было далее отнесено к поглощению самого сорбента, определенное путем интегрирования в области 400–1000 см–1.
Было установлено, что при температуре модификации 20°С содержание ФК на поверхности очень незначительно, и увеличение времени модификации с 30 мин до 24 ч не приводит к его дальнейшему росту (рис. 3). С ростом температуры до 55°С наблюдается 5–7-кратное увеличение количества всех ФК на поверхности МОЖ. Сравнивая между собой результаты по содержанию закрепленных на поверхности различных фосфоновых комплексонов, следует иметь в виду неодинаковое количество в их составе фосфоновых групп (табл. 1). С учетом этого, ряд модифицирующей способности комплексонов выглядит следующим образом: НТФ ≈ ОЭДФ ≈ ГЭИДФ > ЭДТФ > > ФБТК. Комплексоны, содержащие одну (ФБТК) и четыре (ЭДТФ) фосфоновые группы, значительно хуже связываются с поверхностью МОЖ, чем комплексоны, в составе которых имеется две (ОЭДФ, ГЭИДФ) или три (НТФ) фосфоновые группы. Таким образом, одной фосфоновой группы недостаточно для прочного связывания с поверхностью МОЖ, а низкая модифицирующая активность ЭДТФ, вероятно, связана со стерическим фактором – блокировкой части поверхности этой объемной молекулой. Действительно, как это было показано авторами [17], максимальная степень сорбции ФК на гетите уменьшается в ряду ОЭДФ > НТФ > ЭДТФ > ДТПФ.
Рис. 3.
Относительное содержание различных фосфоновых комплексонов на поверхности маггемита при температуре модификации 20 и 55°С. Время модификации 2 ч, рН 1.5–2.5.

Взаимодействие ФК (HnL) с поверхностью оксидов является реакцией нуклеофильного замещения поверхностных ОН-групп фосфоновыми по схеме: ≡FeOH + Ln–↔ ≡Fe–L1 –n + OH–. Протеканию этой реакции способствует увеличение кислотности среды, что было показано для других (гидр)оксидов железа (гетит α-FeOOH) [17]. Нами было также установлено, что с увеличением щелочности используемого для модификации раствора НТФ с рН 2 до рН 6–11 при прочих равных условиях, содержание комплексона на поверхности маггемита уменьшается в ~3 раза. Изучение стабильности покрытия при обработке модифицированного МОЖ (НТФ-маггемит/магнетит) щелочными водными растворами (рН 10–11) в течении 30 мин показывает, что количество ФК на поверхности уменьшается по сравнению с исходным на 5–10%, т.е. для модификации поверхности МОЖ и стабильности образующегося покрытия необходима среда с рН < 7.
Таким образом, для эффективной модификации МОЖ фосфоновыми комплексонами необходимы следующие оптимальные условия: температура 50–60°С, время модификации 2–6 ч; кислотность используемого для модификации раствора комплексона в диапазоне рН 2–3; соотношение комплексон/сорбент = 1 ммоль ФК/г; фосфоновый комплексон должен содержать в своем составе две или три фосфоновые группы.
Таблица 1.
Фосфорорганические комплексоны, используемые для модификации поверхности магнитных оксидов железа
| Комплексон | Формула |
|---|---|
| 1-Гидроксиэтилидендифосфоновая кислота ОЭДФ, HEDP | 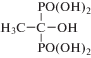 |
| N-Гидроксиэтилимино-N,N-ди(метиленфосфоновая) кислота ГЭИДФ, HEIDPH |
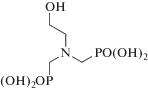 |
| Нитрилтри(метиленфосфоновая) кислота НТФ, NTМР |  |
| Этилендиамин-N,N,N',N'-тетра-(метиленфосфоновая) кислота ЭДТФ, EDTMP |
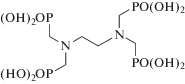 |
| 2-Фосфонобутан-1,2,4-три(карбоновая) кислота ФБТК, PBTC |  |
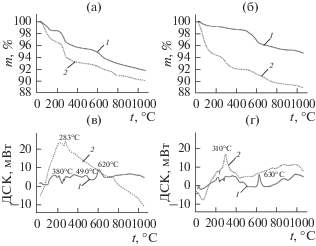
Результаты термогравиметрического (ТГ) анализа и дифференциальной сканирующей калориметрии (ДСК) показывают значительные различия для исходного и модифицированного носителей (рис. 4). Уменьшение массы (на ~1–2%) для немодифицированных МОЖ при температурах ниже 200°С связано с удалением слабосвязанной воды, а при температурах 200–300°С с удалением структурной воды (эндо-пики при 250–290°С). Для магнетита в диапазоне температур 300–500°С расположена серия малоинтенсивных экзотермических пиков, сопровождающаяся лишь незначительной потерей массы, что может свидетельствовать об окислении магнетита до маггемита 4Fe3O4 + + O2 → 6 γ-Fe2O3 (пик 380°С) и фазовом переходе маггемит γ-Fe2O3 → гематит α-Fe2O3 (пик 490°С). Интенсивный экзо-эффект с максимумом при 620°С связан с завершением фазового перехода маггемит → гематит, а также формированием гематита из остаточного магнетита, не перешедшего ранее в маггемит. В случае с маггемитом фазовый переход маггемит → гематит происходит в температурном интервале 300–700°С (интенсивный экзо-пик при 630°С). Общая потеря массы при нагревании до 1000°С составляет ~8% (магнетит) и ~5% (маггемит). Для модифицированных МОЖ потеря массы в диапазоне температур 200–600°С на 3–6% больше, чем для немодифицированных. Наблюдаемые интенсивные экзо-эффекты при этих температурах (максимумы при 283, 310°С) свидетельствуют о термодеструкции фосфоновых комплексонов с образованием различных продуктов (амино-, иминофосфоновые кислоты, фосфорная и фосфористая кислоты) [11]. Оценка содержания ФК на поверхности по данным ТГ соответствует 0.1–0.2 ммоль/г, что хорошо согласуется с данными, полученными на основании спектрофотометрического определения остаточного содержания ФК в растворах после модификации.
Рис. 4.
Кривые термогравиметрического анализа (а, б) и дифференциальной сканирующей калориметрии (в, г) для магнетита (1) и ОЭДФ-магнетита (2) (а, в); для маггемита (1) и НТФ-маггемита (2) (б, г).
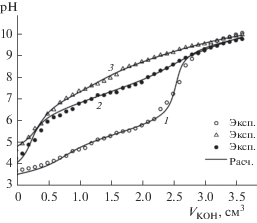
Закрепление ОЭДФ и НТФ на МОЖ приводит к изменению кислотно-основных свойств поверхности, что отражается на кривых титрования суспензии сорбентов раствором щелочи (рис. 5). Кривая титрования немодифицированного магнетита/маггемита свидетельствует о наличии на их поверхности достаточно сильных кислотных центров, в роли которых выступают протонированные гидроксо-группы $ \equiv {\kern 1pt} {\text{FeOH}}_{2}^{ + }$, образующиеся в ходе гидратации поверхности этого оксида. Рассчитанные в рамках неэлектростатической модели теории поверхностного комплексобразования cтупенчатые константы диссоциации этих групп для магнетита ($ \equiv {\kern 1pt} {\text{FeOH}}_{2}^{ + }$ ↔ ≡FeOH + H+, pKa1 = 5.5 ± 0.1; ≡FeOH ↔ ≡FeO– + H+, pKa2 = 9.8 ± 0.1), а также точки нулевого заряда поверхности (рНТНЗ = 7.7 ± 0.2) находятся в пределах значений, приводимых для магнетита в литературе [13]. Кривые титрования модифицированных МОЖ значительно отличаются от кривых титрования исходных сорбентов (рис. 5), что однозначно указывает на появление на поверхности новых кислотно-основных центров. По сравнению с растворами, где ОЭДФ является четырехосновной (H4L), а НТФ шестиосновной (H6L) кислотами [11], основность поверхностно-закрепленных комплексонов уменьшается, что связано с участием их фосфоновых групп во взаимодействии с поверхностью. Полученные кривые титрования могут быть удовлетворительно описаны моделью, включающей наличие на поверхности кислотных центров ≡Fe–LH3 (ОЭДФ-магнетит: pKa1 = 6.6 ± 0.2; pKa2 = = 7.7 ± 0.1; pKa3 = 9.3 ± 0.1) и ≡Fe–LH5 (НТФ-магнетит: pKa1 = 4.5 ± 0.3; pKa2 = 7.1 ± 0.2; pKa3 = 8.5 ± ± 0.2; pKa4 = 9.5 ± 0.1; pKa5 = 10.4 ± 0.1).
Рис. 5.
Кривые кислотно-основного титрования магнетита (1); ОЭДФ-магнетита (2); НТФ-магнетита (3). СМОЖ = 1 г/дм3, СКОН = 0.01 моль/дм3.
Таким образом, на основании совокупности полученных данных можно сделать предположение о механизме закрепления фосфоновых комплексонов на поверхности МОЖ. По данным многочисленных исследований [7] связывание фосфоновых групп c поверхностью различных (гидр)оксидов металлов может происходить в результате моно-, би- или тридентатной координации фосфоновой группы. При этом взаимодействие может осуществляться с одним, двумя или даже тремя атомами металла (моно- би-, триядерные комплексы, соответственно). В случае полифосфоновых производных, к числу которых относятся фосфоновые комплексоны (ОЭДФ, НТФ, ЭДТФ, ДТПФ), предполагаемый механизм связывания с поверхностью (гидр)оксидов железа и алюминия заключается в координации только одной из фосфоновых групп с образованием моноядерных монодентатных комплексов [16–18]. С учетом установленной нами основности поверхностно-закрепленных комплексонов, можно также допустить, что с поверхностью МОЖ связывается только одна фосфоновая группа ОЭДФ и НТФ (рис. 6а, 6б), а незадействованные в связывании с поверхностью группы ФК являются новыми функционально-активными центрами, которые могут участвовать в координации ионов различных металлов.
Рис. 6.
Схемы связывания ОЭДФ (а) и НТФ (б) с поверхностью магнитных оксидов железа; катиона металла НТФ-модифицированными магнитными оксидами железа (в).
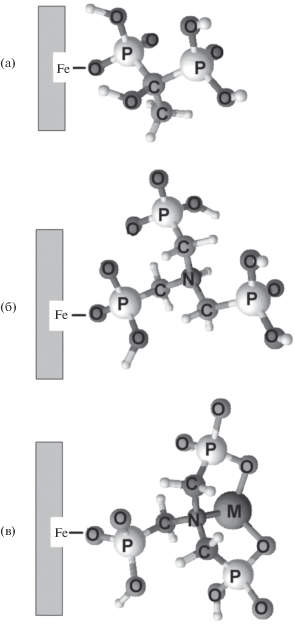
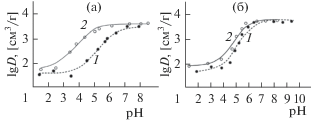
Изучение сорбции ионов металлов (Cu(II), Cd(II)) исходными и НТФ-модифицированными МОЖ в зависимости от кислотности среды (рис. 7) показало, что с увеличением рН степень извлечения, представленная как коэффициент распределения ионов D, значительно увеличивается, достигая значений порядка 5 × 103 cм3/г. Причем, для модифицированных сорбентов в кислой среде значения D в 5–10 раз выше по сравнению с исходными сорбентами. Кислотность среды, при которой наблюдается увеличение сорбции катионов на НТФ-модифицированных сорбентах соответствует областям рН + комплексообразования Cu(II) и Cd(II) c НТФ в водных растворах (комплексы МHnLn– 4 (n = 1–4) при рН 3–8, комплекс МL4– при рН 8–12 [11, 19]). Это позволяет предположить, что связывание катионов металлов с НТФ-модифицированными оксидами железа происходит аналогично процессу в растворах – в результате координирования катиона металла фосфоновыми группами, не участвующими в связывании с поверхностью, и атомом азота с образованием двух устойчивых пятичленных циклов (рис. 6в). Таким образом, привитые к поверхности фосфоновые комплексоны действуют как гетерогенизированные комплексообразующие реагенты, эффективно извлекающие катионы металлов из водных растворов.
ЗАКЛЮЧЕНИЕ
Полученные результаты свидетельствуют о высоком сродстве фосфоновых комплексонов к поверхности магнитных оксидов железа, благодаря хорошим якорным свойствам фосфоновых групп по отношению ко многим оксидным поверхностям. В оптимальных условиях модифицирования, установленных в ходе настоящей работы, максимальная плотность прививки фосфоновых комплексонов составляет 0.1–0.2 ммоль/г или 1.6–3.2 групп/нм2, что можно сопоставить с числом ОН-групп на поверхности МОЖ (в среднем 5 групп/нм2 [13]). Наибольшее количество связанного комплексона достигается при наличии в его составе двух или трех фосфоновых групп. В результате модификации фосфоновыми комплексонами на поверхности МОЖ появляются новые функциональные группы, входящие в состав комплексона и свободные от связывания с поверхностью (–PO(OH)2, –COOH, –OH, третичный атом N), которые изменяют кислотно-основные и адсорбционные свойства поверхности. Полученные модифицированные носители, как и комплексоны в растворе, прежде всего проявляют свойства комплексообразующих материалов по отношению к ионам различных металлов. В этом плане они дополняют такие известные комплексообразующие носители как химически модифицированные кремнеземы и комплексообразующие иониты. Помимо связывания ионов металлов, полученные сорбенты могут быть перспективны и для закрепления органических молекул, включая биологически важные. Недостатками модифицированных фосфоновыми комплексонами МОЖ являются относительно невысокая плотность прививки, что присуще всем оксидным носителям, и неустойчивость модифицирующего слоя в условиях щелочной среды. Важным преимуществом полученных модифицированных носителей является наличие у них сильных магнитных свойств, что является определяющим фактором для всех разнообразных направлений практического использования МОЖ, включая сорбционное извлечение, разделение, концентрирование ионов металлов.
Список литературы
Wu W., He Q., Jiang Ch. // Nanoscale Res. Lett. 2008. № 3. P. 397.
Faraji M., Yamini Y., Rezaee M. // J. Iran Chem. Soc. 2010. V. 7. P. 1.
Tartaj P., Morales M.P., Veintemillas-Verdaguer S. et al. // J. Phys. D: Appl. Phys. 2003. V. 36. P. 182.
Mohapatra M., Anand S. // Int. J. Eng. Sci. Technol. 2010. V. 2. № 8. P. 127.
Мингалев П.Г., Лисичкин Г.В. // Успехи химии. 2006. Т. 75. № 6. С. 604.
Химия привитых поверхностных соединений / Под ред. Лисичкина Г.В. М.: Физматлит, 2003. 592 с.
Queffélec C., Petit M., Janvier P. et al. // Chem. Rev. 2012. V. 112. P. 3777.
Hua M., Zhang S., Pan B. et al. // J. Hazard. Mat. 2012. V. 211–212. P. 317.
Tang S., Lo I. // Water Res. 2013. V. 47. P. 2613.
Neyaz N., Siddiqui W.A., Nair K.K. // Int. J. Environ. Sci. 2014. V. 4. № 4. P. 472.
Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и комплексонаты металлов. М.: Химия, 1988. 544 с.
Зубакова Л.Б., Тевлина А.С., Даванков А.Б. Синтетические ионообменные материалы. М.: Химия, 1978. 184 с.
Cornell R.M., Schwertmann U. The Iron Oxides. Weinheim: WILEY-VCH Verlag GmbH & Co, 2003. 694 p.
Crystallography Open Database. URL: http://www.crystallography.net/cod/.
Zenobi M.C., Luengo C.V., Avena M.J. et al. // Spectrochim. Acta, Part A. 2008. V. 70. P. 270.
Zenobi M.C., Luengo C.V., Avena M.J. et al. // Spectrochim. Acta, Part A. 2010. V. 75. P. 1283.
Nowack B., Stone A.T. // J. Colloid Interface Sci. 1999. V. 214. P. 20.
Кропачева Т.Н., Антонова А.С., Корнев В.И. // Журн. неорган. химии. 2017. Т. 62. № 2. С.155.
Academic Software. IUPAC Stability Constants Database (SC-Database, data version 4.74)). URL: http:// www.acadsoft.co.uk/.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов