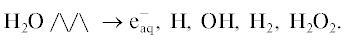Физикохимия поверхности и защита материалов, 2020, T. 56, № 4, стр. 422-427
Образование осадков пористых металлов при радиационно-химическом восстановлении ионов Pb2+ и Cd2+ в водном растворе
Г. Л. Быков a, *, Б. Г. Ершов a
a Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии
им. А.Н. Фрумкина Российской академии наук (ИФХЭ РАН)
119071 Москва, Ленинский пр-т., 31, корп. 4, Россия
* E-mail: bykov@ipc.rssi.ru
Поступила в редакцию 23.08.2019
После доработки 25.08.2019
Принята к публикации 02.09.2019
Аннотация
При облучении ускоренными электронами водных растворов солей кадмия и свинца, содержащих метиловый спирт, получены осадки металлов с плотностями 1.17 и 1.1 г/см3 и пористостью 86.5 и 90.3%, соответственно, и большей площадью поверхности. Изучен процесс осаждения металлов и рассчитаны радиационно-химические выходы, которые составили (1.7 ± 0.2) × 10–2 и (3.4 ± 0.3) × 10–2 г на 1 кГр для кадмия и свинца, соответственно, и 1.56 ± 0.05 атома металлов на 100 эВ поглощенной энергии излучения. Разработанный метод может быть перспективным для получения осадков чистых и аморфных металлов из водных растворов их солей, для разработки технологий очистки водных стоков, содержащих токсичные металлы, а также для использования пористых кадмия и свинца при изготовлении электрических устройств.
ВВЕДЕНИЕ
Восстановление ионов металлов в водных растворах представляет значительный интерес, вызванный возможностью получать высокодисперсные и чистые металлы с большой поверхностью и высокой реакционной способностью для последующего применения в катализе, электронике, синтезе новых материалов, а также как эффективный метод очистки водных стоков от токсичных металлов и примесей. Наиболее часто металлы и их сплавы получают восстановлением их солей в водных растворах с применением боргидрида натрия [1–4]. Восстановление может осуществляться также с применением других соединений при повышенной температуре – гидразина, гидроксиламина, формальдегида и др. Другой подход состоит в восстановлении ионов металлов с использованием ионизирующего излучения. Таким способом были получены гидрозоли многих металлов в виде коллоидных растворов частиц металлов размером от 5 до 100 нм в присутствии стабилизаторов [5–7].
Нами был развит такой подход как практический полезный метод выделения осадков чистых и аморфных металлов из растворов их солей. Эта работа является продолжением исследований, начатых ранее [8, 9].
В общем виде радиационно-химический метод получения осадков металлов описывается следующей схемой. Известно [10], что при действии ионизирующей радиации (γ-кванты или ускоренные электроны) в воде генерируются активные частицы радикальной природы – гидратированный электрон (${\text{e}}_{{{\text{aq}}}}^{--}$) и атом водорода (H), обладающие высоким восстановительным потенциалом (–2.7 и 2.3 В), а также гидроксильный радикал (ОН), имеющий, напротив, высокий окислительный потенциал (2.9 В) и молекулярные продукты – водород и пероксид водорода.
Для создания благоприятных условий для восстановления ионов металлов в воду добавляют органические соединения (спирты, соли органических кислот или другие соединения), которые являются эффективными акцепторами радикалов ОН. Взаимодействие радикалов ОН с органическим соединением обеспечивает трансформацию сильного окислителя – радикала ОН в органический радикал, который уже обладает свойствами сильного восстановителя. То есть, при использовании, органического соединения, условно выразим его как RH2, в результате протекания реакции
(2)
${\text{R}}{{{\text{H}}}_{2}} + {\text{OH}} \to ~\,{{\,}^{\centerdot }}{\text{RH}} + {{{\text{H}}}_{2}}{\text{O}}$(3)
${\text{M}}{{{\text{e}}}^{{n + }}}~ + \,\,~{\text{e}}_{{{\text{aq}}}}^{--}({\text{H}},{{\,}^{\centerdot }}{\text{RH}})~\,\, \to {\text{ M}}{{{\text{e}}}^{{\left( {n - 1} \right) + }}}~\,\, + \,\,({{{\text{H}}}^{ + }},{\text{R}} + {{{\text{H}}}^{ + }})~.$Последующие реакции постадийной агрегации ионов Me(n –1)+ и далее возникающих кластеров, в конечном итоге, приводят к образованию металла и его выделению в осадок.
К достоинствам радиационно-химического метода восстановления ионов металлов в водных средах можно отнести, с одной стороны, отсутствие необходимости применения специальных дорогостоящих веществ-восстановителей и, с другой, возможность использования практически любого органического вещества, которое в процессе радиолитического разложения превращается в эффективный восстановитель. Тем самым, реализуется возможность очистки водных сред одновременно от токсичных металлов и ядовитых органических загрязнителей [11–13]. Также достоинством такого способа восстановления является возможность регулирования процессом путем подбора его параметров – мощности, дозы и времени облучения.
Задачей настоящей работы является обоснование радиационно-химического способа восстановления токсичных солей переходных металлов в водных средах, содержащих ядовитые органические загрязнители, при комнатной температуре. В качестве объектов исследований были использованы соли кадмия и свинца, а также метиловый спирт. Источником ионизирующего излучения был ускоритель электронов, генерирующий электроны высокой энергии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовались реактивы: 3CdSO4 ⋅ · 8H2O (О. С. Ч. 5-4), Pb(CH3COO)2 ⋅ 3H2O (Ч. Д. А.), метиловый спирт высокой чистоты для хроматографии, дистиллированная вода.
Растворы облучались на линейном ускорителе УЭЛВ-10-10-С-70 с энергией электронов 5 МэВ. Объем облучаемого раствора составлял 30 мл. Результаты экспериментов пересчитывались на 1 л раствора. Доза облучения составляла от 10 до 80 кГр. Облучение производилось в стеклянных ампулах размером 3 × 9.5 см и объемом 100 мл с возможностью отбора проб газовой фазы. Ампулы вакуумировались.
Рентгенофазовый анализ проводился на рентгеновском дифрактометре ДРОН-3 с использованием медного излучения. Фотографии поверхности металлов и коллоидных частиц получены на бинокулярном микроскопе Revelation III (LW Scientific, US). Кинетику осаждения образующихся в результате облучения водных растворов солей свинца и кадмия частиц металлов изучали на мутномере Turb 550 IR производства США.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Было установлено, что при облучении ускоренными электронами водных растворов 0.1 M Pb(CH3COO)2 или 0.1 М CdSO4 в присутствии 1 M CH3OH выделятся коллоидный металл, который постепенно оседает на дно ампулы. Рисунок 1 иллюстрирует развитие этого процесса во времени в случае соли свинца. Видно, что сразу после облучения раствор темнеет из-за появления дисперсии металла, а далее в течение 1–2 часов происходит его выделение в осадок. С увеличением поглощенной дозы “почернение” раствора, вследствие образования коллоидного металла, увеличивается, а время выделения в осадок, напротив, уменьшается. Аналогичное явление имеет место и в случае соли кадмия.
Рис. 1
Образование коллоидных частиц свинца и его осаждение после облучения раствора 0.1 М Pb(CH3COO)2 в 1 M CH3OH. Поглощенная доза 20 кГр.

На рис. 2 показаны фотографии микрочастиц свинца в первые секунды после облучения раствора. Видно, что сразу после облучения наблюдаются частицы размером 0.2–0.5 мкм. Спустя 15 мин размер частиц увеличивается до 1–5 мкм, а после 60 мин возникают агломераты размером до 50 мкм, которые, по существу, представляют собой скопление более мелких частиц (рис. 2б). То есть, образующийся коллоидный металл агрегативно неустойчив, происходит развивающееся во времени его агломерирование и далее седиментация.
Рис. 2.
Частицы свинца в растворе сразу после облучения (а) и спустя 15 мин (б). 0.1 M Pb(CH3COO)2, 1 M CH3OH. Доза 42 кГр. Увеличение 200 раз.

Изучение процесса осаждения частиц металла во времени показало, что время полного осаждения сильно зависит от поглощенной дозы. На рис. 3 показано увеличение прозрачности раствора от времени после облучения, вызванного выделением частиц металла в осадок. При дозе 10 кГр осадок образуется за 1.5 ч, а при дозе 60 кГр уже за 0.5 ч.
Рис. 3.
Кинетика осаждения частиц свинца из раствора 0.1 М Pb(CH3COO)2 в 1 M CH3OH, облученного до доз: 1 – 10 кГр; 2 – 20 кГр; 3 – 40 кГр; 4 – 60 кГр.

Наблюдаемый эффект связан это с увеличением размера частиц. Согласно формуле Стокса [15] имеем:
(4)
${{V}_{s}} = \frac{2}{9}\frac{{{{r}^{2}}g\left( {{{\rho }_{{\text{ж}}}} - {{\rho }_{{\text{ч}}}}} \right)}}{\mu },$Исходя из нее, можно рассчитать средний радиус частиц:
(5)
$r = \sqrt {\frac{{9{{V}_{{{\text{час}}}}}\mu }}{{2g({{\rho }_{{\text{ж}}}} - {{\rho }_{{{\text{час}}}}})}}} .$В табл. 1 представлены результаты расчетов скорости осаждения и среднего размера частиц (d = 2r) с учетом того, что высота столба раствора в приборе 5 см, динамическая вязкость воды μ = = 1002 × 10–6 Па с при 20°С и g = 9.8 м/с2, ρчас – ρж = = 10.3 кг/м3. Видно, что размер частиц увеличивается с увеличением дозы облучения и, напротив, уменьшается скорость их осаждения.
Таблица 1.
Зависимости скорости осаждения и среднего размера частиц свинца, выделяющихся при облучении раствора, содержащего 0.1 М Pb(CH3COO)2 и 1 M CH3OH, от дозы облучения
| Доза облучения, кГр | 10 | 20 | 40 | 60 |
|---|---|---|---|---|
| Vчас, м/с | 9.8 × 10–6 | 10.4 × 10–6 | 18.5 × 10–6 | 27.8 × 10–6 |
| d = 2r, µm | 42 | 43 | 57.4 | 70.4 |
После осаждения мелкие частицы металла слипаются в крупные комки (рис. 4).
Рис. 4.
Образцы свинца (а) и кадмия (б), полученные при радиационно-химическом восстановлении водных растворов их солей.

На рис. 4а изображен образец выделившегося свинца, представляющего собой губчатый материал с обильными порами разного размера (рис. 5). После высушивания осадок уплотняется и его удельная масса 1.1 г/см3, что меньше удельной массы компактного металла – 11.34 г/см3 [14]. То есть, металлы, получаемые радиационно-химическим восстановлением их солей в водном растворе, имеют высокоразвитую структуру с большой удельной поверхностью (рис. 5).
Рис. 5.
Поверхность выделившегося осадка свинца из раствора 0.1 М Pb(CH3COO)2 в 1 M CH3OH, доза облучения 42 кГр. Увеличение в 200 раз.

Результаты рентгенофазового анализа показали, что выделившийся осадок – чистый 100%-ный свинец. Сравнение наблюдаемых значений углов отражения 2θ (рис. 6) и расчетных, приведенных в картотеке эталонов JCPDS, для различных межплоскостных расстояний показал их практическое совпадение. Это свидетельствует о том, что выделившийся осадок свинца имеет кристаллическую структуру, свойственную металлу.
Рис. 6.
Рентгендифракционный спектр образцов осадка, полученного при облучении раствора Pb(CH3COO)2 и 1 М СН3ОН.

При облучении раствора 0.1 М CdSO4 в присутствии 1 М метилового спирта ионы кадмия также восстанавливаются до чистого кадмия. На рис. 7 изображена кинетика осаждения частиц при разных дозах облучения. Как и в случае свинца, с увеличением дозы скорость осаждения возрастает. Однако, если просветление раствора соли свинца наступает последовательно спустя 80, 45 и 30 мин при дозах 20, 40 и 60 кГр, то для кадмия при дозах 20 и 40 кГр время просветления наступает практически одинаково и спустя 90 мин, а при дозе 60 кГр происходит резкое сокращение времени до 50 мин. То есть, имеется определенное влияние вида металла на процесс его агломерации и седиментации в воде.
Рис. 7.
Кинетика осаждения частиц кадмия, образовавшихся при облучении раствора 0.1 M CdSO4 в 1 M CH3OH до доз: 1 – 20 кГр, 2 – 40 кГр, 3 – 60 кГр.

Так же как и при облучении свинца, кадмий образуется в виде пористого материала (рис. 4б) с плотностью 1.17 г/см3 при плотности компактного металла 8.65 г/см3 [14].
На рис. 8 показана зависимость количеств кадмия и свинца, образующихся при восстановлении ионов Cd2+ и Pb2+ в 1 л 0.1 М раствора солей в присутствии 1 М метилового спирта от поглощенной дозы. Наблюдается строгая пропорциональная зависимость массы выделившихся в осадок металлов от дозы. Радиационно-химический выход кадмия составляет (1.7 ± 0.2) × 10–2 г/кГр. Исходя из величины выхода, можно оценить дозу излучения, требуемую для очистки водного раствора, загрязненного кадмием. Например, при содержании кадмия менее 10–3 М необходимая доза составляет ≤10–2 кГр. Масса образовавшегося свинца примерно в два раза больше, чем кадмия, что связано с тем, что атомная масса свинца (207.2 г) в два раза больше массы кадмия (112.4 г). Радиационно-химический выход свинца составляет (3.4 ± 0.3) × 10–2 г/кГр.
Рис. 8.
Зависимость количества выделившегося кадмия из 1 л раствора 0.1 М CdSO4 в 1М СН3ОН (1) и свинца из 1 л раствора 0.1 М Pb(CH3COO)2 в 1 M CH3OH (2) от дозы облучения.

Радиационный выход (G) обоих металлов, рассчитанный на число образующихся атомов и отнесенный к поглощенной дозе 100 эВ, практически одинаков и равен 1.56 ± 0.05 атома/100 эВ (табл. 2).
Таблица 2.
Зависимость выхода свинца и кадмия от дозы облучения
| Доза облучения, кГр | Свинец, в 1 л раствора, г | G(Pb), молек/100 эВ | Доза облучения, кГр | Кадмий, в 1 л раствора, г | G(Cd), молек/100 эВ |
|---|---|---|---|---|---|
| 10 | 0.183 | 1.54 | |||
| 21 | 0.703 | 1.56 | 20 | 0.342 | 1.47 |
| 42 | 1.217 | 1.35 | 40 | 0.854 | 1.83 |
| 63 | 2.03 | 1.50 | 60 | 1.01 | 1.45 |
| 84 | 3.37 | 1.87 | 80 | 1.38 | 1.48 |
| G(среднее) | 1.57 | 1.55 |
В процессе радиационно-химического восстановления ионов металлов образуется согласно реакциям 1–3 водород, а также ионы H+ вследствие поглощения электронов. Поэтому в процессе радиационно-химического образования кадмия рН от исходного значения 6.4 уменьшается до 2.6. Величина pH также уменьшается и в случае свинца. Однако вследствие буфферирующего эффекта ацетат-ионов это снижение менее отчетливо.
По методике, описанной в [16], микрофотографическим способом было рассчитано количество пор в осадках металлов. Для этого при увеличении в 200 раз фотографировались срезы поверхности образцов. Затем на участке 300 × 300 нм (площадь 90000 нм2) подсчитывалось количество пор разного размера и по шести фотографиям выводились средние значения. Полученные значения представлены в табл. 3. Истинную удельную площадь раздела металл–воздух (м2/м3) в единице объема рассчитывали по формуле [16]:
(6)
${{S}_{{{\text{уд}}}}} = \frac{{6\left( {{\beta } - 1} \right)\sum d_{i}^{2}{{N}_{i}}}}{{\sum d_{i}^{2}{{N}_{i}}}},$(8)
$\beta {\text{ }} = {{{{V}_{{{\text{обр}}}}}} \mathord{\left/ {\vphantom {{{{V}_{{{\text{обр}}}}}} {{{V}_{{{\text{мет}}}}}}}} \right. \kern-0em} {{{V}_{{{\text{мет}}}}}}}.~$Таблица 3.
Поверхностные характеристики пористых кадмия и свинца, выделившихся при облучении растворов их солей на площади 90 000 нм2
| Характеристики | Размер пор di, нм | Σ | β | П, % | ρ, г/см3 | |||
|---|---|---|---|---|---|---|---|---|
| 0–5 | 5–10 | 10 | 20 | |||||
| N(Pb) | 200 | 33 | 37 | 18 | 288 | 10.3 | 90.3 | 1.1 |
| Ni | 0.69 | 0.12 | 0.13 | 0.06 | 1 | |||
| Sуд, м2/м3 | 4.14 × 109 | |||||||
| N(Cd) | 230 | 80 | 10 | 3 | 323 | 7.4 | 86.5 | 1.17 |
| Ni | 0.71 | 0.25 | 0.03 | 0.01 | 1 | |||
| Sуд, м2/м3 | 3.28 × 109 | |||||||
Пористость (П) рассчитывалась по формуле:
(9)
$\Pi = (1{\text{ }}--{\rho \mathord{\left/ {\vphantom {\rho {{{\rho }_{0}}}}} \right. \kern-0em} {{{\rho }_{0}}}}){\text{ }} \times 100\% {\text{ }},$Полученные результаты расчетов представлены в табл. 3.
Видно, что в образцах присутствуют преимущественно поры размером до 20 нм, причем в образцах свинца крупных пор больше, чем в кадмии. Образцы свинца и кадмия обладают высокой пористостью (90.3 и 86.5% соответственно) и большой площадью поверхности (4.14 × 109 и 3.28 × 109 м2/м3 соответственно).
ВЫВОДЫ
Результаты экспериментов показали, что при облучении ускоренными электронами водных растворов солей кадмия и свинца в присутствии токсичных органических соединений (в данном случае метилового спирта) образуются осадки пористых металлов с удельной плотностью 1.17 и 1.1 г/см3 и пористостью 86.5 и 90.3% соответственно.
Результаты выполненных исследований подтверждают эффективность радиационно-химического способа восстановления токсичных солей переходных металлов в водных средах, содержащих токсичные органические загрязнители, при комнатной температуре. Этот метод может быть перспективным для получения осадков чистых и аморфных металлов из водных растворов их солей, а также для очистки водных стоков, содержащих эти токсичные металлы.
Работа выполнена при поддержке Министерства науки и высшего образования РФ с использованием линейного ускорителя УЭЛВ-10-10-С-70 в ЦКП ФМИ ИФХЭ РАН.
Список литературы
Klabunde K.J., Stark J.V., Koper O. et al. Chemical synthesis of nanophase materials / Ed. by Hadjipanayis G.C., Siegel R.W., Nanophase materials Synthesis–Properties–Applications. Kluwer Academic Publishers, Dordrecht, The Netherlands, 1994. P. 1–19.
Rochfort G.L., Rieke R.D. // Inorg. Chem. 1986. V. 25. P. 348–355. https://doi.org/10.1021/ic00223a024
Corrias A., Ennas G., Licheri G. et al. // Sci. Lett. 1988. V. 7. P. 407–409. https://doi.org/10.1007/BF01730759
Saida J., Inoue A., Masumoto T. // Sci. Rep. Res. Inst. Tohoku Univ. 1989. V. A-34. P. 205–2015. https://doi.org/10.1007/BF02669880
Ершов Б.Г. // Рос. хим. журн. (Журн. Рос. хим. об-ва им. Д.И. Менделеева). 2001. Т. XLV. № 3. С. 20–30.
Henglein A., Gutierrez M., Janata E., Ershov B.G.J. // Phys. Chem. 1992. V. 96. № 11. P. 4598–4602.https://doi.org/10.1021/j100190a084
Ершов Б.Г. Успехи химии. 1997. Т. 66. № 2. С. 103–116.
Быков Г.Л., Макаренков В.И., Ершов Б.Г. // Журн. прикладной химии. 2018. Т. 91. Вып. 4. С. 484–489.
Ershov B.G., Bykov G.L. // Radiation Physics and Chemistry. 2018. V. 153. P. 245–250. https://doi.org/10.1016/j.radphyschem.2018.10.006
Wardman P. // J. Phys. Chem. Ref. Data. 1989. V. 18. № 4. P. 1637–1755. https://doi.org/10.1063/1.555843
Пикаев A.K. // Химия высоких энергий. 2000. Т. 34. № 2. С. 83–103. (Pikaev A.K. // High Energy Chemistry. 2000. V. 34. № 2. P. 55–73.https://doi.org/10.1007/BF02761832
Woods R.J., Pikaev A.K. Applied Radiation Chemistry. Radiation Processing. New York: Wiley, 1994. 535 p.
Kuracz C.N., Waite T.O., Cooper W.J. // Radiât. Phys. Chem. 1995. V. 45. № 2. P. 299. https://doi.org/10.1016/0969-806X(94)00075-1
Химический энциклопедический словарь / Под ред. Кнунянц И.Л. М.: Советская энциклопедия, 1983. 792 с.
Кикоин А.К., Кикоин И.К. Молекулярная физика. М.: Наука, 1976. 478 с.
Тихомиров В.К. Пены. Теория и практика их получения и разрушения. М.: Химия, 1983. 263 с.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов