Физикохимия поверхности и защита материалов, 2020, T. 56, № 4, стр. 350-355
Адсорбция метана на металл-органической пористой структуре Fе-BDC при высоких давлениях
М. К. Князева 1, *, А. Ю. Цивадзе 1, А. А. Фомкин 1, А. В. Школин 1, О. В. Соловцова 1, А. А. Прибылов 1, А. Л. Пулин 1, В. Ю. Яковлев 1, И. Е. Меньщиков 1
1 Институт физической химии и электрохимии им. А.Н. Фрумкина, Лаборатория сорбционных процессов
им. М.М. Дубинина
119071 Москва, Ленинский проспект, 31-4, Россия
* E-mail: knyazeva.mk@phyche.ac.ru
Поступила в редакцию 21.02.2020
После доработки 01.03.2020
Принята к публикации 06.03.2020
Аннотация
Измерены изотермы абсолютной адсорбции метана на образце металл-органической пористой структуры Fe-BDC после длительного хранения при температурах 303, 313, 323 и 333 К и давлениях до 40 МПа. Рассчитаны зависимости дифференциальных мольных изостерических теплот и энтропий адсорбции метана от величины адсорбции. Показано, что учет неидеальности газовой фазы и крутизны изотермы адсорбции приводит к появлению температурной зависимости термодинамических функций адсорбции. Резкое падение теплоты адсорбции и локальный максимум на энтропии адсорбционной системы в области максимальных величин адсорбции, свидетельствуют о перестройке структуры адсорбата в микропорах и, вероятном, образовании молекулярных ассоциатов метана в микропорах исследуемого адсорбента.
ВВЕДЕНИЕ
Адсорбционное аккумулирование энергетических газов, таких как метан, водород, кислород, синтез газ, привлекает значительное внимание в связи с созданием систем альтернативной энергетики. Адсорбция газов в таких системах сильно зависит от пористой структуры адсорбента и химического состояния его поверхности [1]. Металл-органические каркасные структуры (МОКС, MOF – Metal Organic Frameworks) и их некристаллические аналоги – металл-органические пористые структуры (МОПС), считаются перспективными адсорбентами для аккумулирования газов, в частности метана [2]. Пористая структура таких адсорбентов образована полиорганическими лигандами, соединенными ионами металлов или металлсодержащими кластерами. Большое разнообразие лигандов и ионов (кластеров) металлов позволяет синтезировать широкий спектр разнообразных пористых структур, обладающих специфичной химией поверхности и позволяющих создавать высокоэффективные адсорбенты для энергонасыщенных адсорбционных систем (ЭНАС) [3].
Основными недостатками таких адсорбентов являются недостаточная термическая, механическая стабильность и малый насыпной вес [2, 4]. Важна также гидротермальная стабильность, поскольку влага обычно присутствует, по крайней мере, в небольших количествах в воздухе, а также в газовых смесях. Лабильная природа многих связей металл-кислород может привести к гидролизу MOF, тем самым необратимо разрушая структуру. Нестабильность МОПС при адсорбции воды является актуальной проблемой для практически всех полученных MOF [5]. Прочность связи металл-кислород в MOF, уменьшается в следующем порядке: Fe–O (468 кДж моль–1) > Cr–O (374 кДж моль–1) > > Cu–O (372 кДж моль–1) > Zn–O (365 кДж моль–1) [8]. Следовательно, наиболее стабильная структура МОПС образуется за счет координирования кластера железа и органического карбоксилатного лиганда. Общий механизм гидратации происходит в два последовательных этапа: 1) связывание воды с металлическим кластером; 2) смещение линкера, когда одна молекула воды фактически заменяет одно из звеньев линкера [6]. Считается, что эти два этапа происходят быстро, при условии, что в пористой структуре присутствует достаточное количество воды.
При длительном хранении и эксплуатации MOF, количество влаги адсорбированной из воздуха и технологических газовых смесей, постепенно увеличиваться и в конечном итоге вода может разрушить структуру MOF. В связи с этим представлялось важным исследование в течение времени стабильности адсорбционных свойств МОПС Fе-BDC [7], при длительном хранении в незащищенном состоянии.
Целью данной работы является исследование особенностей адсорбции метана на металл-органической пористой структуре Fе-BDC [7], которая хранилась длительное время на воздухе в незащищенном состоянии.
ОБЪЕКТЫ ИССЛЕДОВАНИЯ
Адсорбент
Изотерма адсорбции азота при 77 К на свежеприготовленном МОПС Fе-BDC представлена на рис. 1, кривая 1. Перед измерениями проводили регенерацию адсорбента при температуре 403 К на установке Quantachrome iQ.
Рис. 1.
Изотермы адсорбции–десорбции азота на МОПС Fе-BDC при 77К. 1 – свежеприготовленный образец; 2 – образец после шести месяцев выдержки при комнатной температуре на воздухе. Светлые символы – адсорбция; затемненные – десорбция. Сплошные линии – аппроксимация.
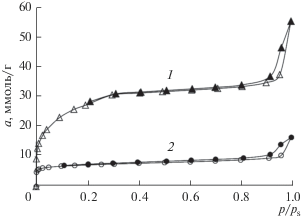
Второй образец адсорбента, на рис. 1, кривая 2, выдерживали в течение шести месяцев после синтеза и также регенерировали в аналогичных условиях.
Как следует из рис. 1, адсорбция азота при 77 К на свежеприготовленном адсорбенте (кривая 1) резко растет в начальной области давлений до p/ps = 0.3. В области высоких относительных давлений на изотерме адсорбции азота имеется петля адсорбционного гистерезиса, свидетельствующая о капиллярно-конденсационных эффектах в мезопорах. Однако после 6 месяцев хранения адсорбента, адсорбция азота при 77 К резко падает, в 4 раза, а петля адсорбционного гистерезиса становится менее выраженной.
Анализ пористой структуры адсорбентов проводили с использованием Теории объемного заполнения микропор (ТОЗМ) М.М. Дубинина. В расчетах, для перехода от азота к стандартному пару бензолу использовали коэффициент подобия β = 0.33. Результаты представлены в табл. 1.
Таблица 1.
Параметры пористых структур образцов Fe-BDC
| Образец Fe-BDC | W0, см3/г | Е0, кДж/моль | х0, нм | SБЭТ, м2/г | Ws, см3/г | Wme, см3/г |
|---|---|---|---|---|---|---|
| Свежеприготовленный | 0.83 | 13.4 | 0.90 | 2240 | 1.30 | 0.47 |
| После хранения (6 месяцев) | 0.21 | 15.4 | 0.73 | 570 | 0.26 | 0.05 |
Как следует из табл. 1 “свежеприготовленный” образец МОПС Fе-BDC после синтеза обладает хорошо развитой пористой структурой с удельным объемом микропор W0 = 0.83 см3/г; стандартной характеристической энергией адсорбции по бензолу Е0 = 13.4 кДж/моль, эффективной полушириной микропор 0.90 нм, высокой удельной поверхностью БЭТ по азоту SБЭТ = 2240 м2/г и удельным объемом мезопор Wme = 0.47см3/г. Шестимесячная выдержка образца на воздухе привела к значительной деградации пористой структуры. Удельный объем микропор W0 уменьшился в 4 раза и стал равным 0.21 см3/г; стандартная характеристическая энергия адсорбции Е0 увеличилась на 12% до 15.4 кДж/моль, эффективная полуширина микропор х0 уменьшилась до 0.73 нм, удельная поверхность по БЭТ SБЭТ уменьшилась в 3.5 раза до 570 м2/г. Удельный объем мезопор Wme уменьшился почти в 10 раз до 0.05 см3/г.
Распределение микропор по размерам определяли методом теории функционала плотности QSDFT, для цилиндрической модели пор, по изотерме адсорбции азота при 77 К. Распределение микропор по размерам d свежего МОПС Fе-BDC представлено на рис. 2а.
Рис. 2.
Распределение пор МОПС Fе-BDC по размерам, свежего, после синтеза, (a) и после 6 месяцев хранения (b), определенное методом QSDFT для цилиндрической модели пор, по изотерме стандартного пара азота при 77 К.
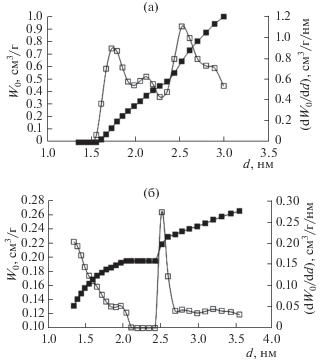
Как следует из рис. 2а, в микропористой структуре свежеприготовленного образца МОПС Fе-BDC имеются две моды при 1.7 и 2.5 нм, а на зависимости объема микропор от диаметра имеется соответствующая точка перегиба. В процессе шестимесячного хранения распределение пор по размерам изменяется. Максимум распределения микропор первой моды сместился в сторону уменьшения среднего диаметра. Вторая мода распределения микропор в процессе хранения образца в течение 6 месяцев приобрела более узкое распределение. На зависимости объема микропор от диаметра – два четко выраженных участка разной крутизны.
Адсорбат
В работе использовали метан (CH4) марки О. С. Ч., чистотой 99.999% со следующими физико-химическими свойствами [8]: молекулярная масса: µ = 16.0426 г/моль; нормальная температура кипения Tb = 111.66 K; критическая температура Tс = 190.77 K; критическое давление Pс = = 4.626 МПа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Измерение адсорбции метана на МОПС Fe-BDC проводили при температурах 303, 313, 323, 333 К и давлениях до 40 МПа на адсорбционной установке объемно-весового типа, разработанной в ИФХЭ РАН [9]. В опытах измеряли равновесные величины абсолютной адсорбции метана:
(1)
$~a = (m--{{{{m}_{{\text{g}}}})} \mathord{\left/ {\vphantom {{{{m}_{{\text{g}}}})} {{{m}_{{0~}}}}}} \right. \kern-0em} {{{m}_{{0~}}}}},$Объем адсорбента с микропорами определяли, как сумму объемов адсорбента по данным калибровки по гелию и удельного объема микропор W0 адсорбента по ТОЗМ (табл. 1). Максимальная абсолютная погрешность измерения адсорбции составляла ±0.1 ммоль/г с доверительной вероятностью 95%. Для термостатирования образцов адсорбента использовали электрический термостат, позволявший поддерживать заданную температуру с погрешностью ±0.1 К.
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Адсорбцию метана на МОПС Fe-BDC после хранения на воздухе в течение 6 месяцев измеряли при температурах 303, 313, 323, 333 К и давлениях до 40 МПа. Результаты измерений представлены на рис. 3 в полулогарифмических координатах a = = f(lnp). Равновесные величины адсорбции – десорбции метана обратимы и не зависят от последовательности измерений.
Рис. 3.
Изотермы адсорбции метана на структуре МОПС Fе-BDC после хранения на воздухе в течение 6 месяцев при температурах: 1 – 303, 2 – 313, 3 – 323, 4 – 333 К. Символы – экспериментальные значения. Сплошные линии – аппроксимация.
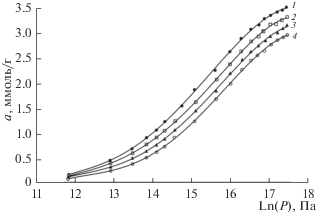
Как следует из рис. 3, адсорбция метана во всем интервале измеренных давлений растет вплоть до давлений 40 МПа и достигает 3.5 ммоль/г при температуре 303 К. При всех исследованных давлениях адсорбция растет с понижением температуры. Изотермы адсорбции в координатах а = f(lnp) имеют s-образный вид.
По изотермам (рис. 3) в координатах lnp = = f(1/T) построили изостеры адсорбции, кривые при a = const (рис. 4)
Рис. 4.
Изостеры адсорбции метана на МОПС Fe-BDC после хранения при адсорбции, а, ммоль/г: 1 – 0.035; 2 – 0.07; 3 – 0.105; 4 – 0.175; 5 – 0.315; 6 – 0.455; 7 – 0.665; 8 – 0.98; 9 – 1.26; 10 – 1.645; 11 – 1.89; 12 – 2.1; 13 – 2.275. Символы – экспериментальные значения. Сплошные линии – аппроксимация.

Как следует из рис. 4, во всем интервале давлений и температур, они хорошо аппроксимируются прямыми линиями. Этот факт также отмечался ранее в работах [10–13].
Полученные изостеры использовали для расчета дифференциальной мольной изостерической теплоты адсорбции метана на адсорбенте МОПС Fe-BDC, которые определяли по общему уравнению, приведенному, например в [14], учитывающему неидеальность газовой фазы при высоких давлениях z и неинертность адсорбента при адсорбции, т.е. зависимость V1= V1(a, T)
(1)
$\begin{gathered} {{q}_{{st}}} = - RZ{{\left( {\frac{{\partial (\ln p)}}{{\partial ({1 \mathord{\left/ {\vphantom {1 T}} \right. \kern-0em} T})}}} \right)}_{a}}\left( {1 - {{{{{\left( {\frac{{\partial \nu (a)}}{{\partial a}}} \right)}}_{T}}} \mathord{\left/ {\vphantom {{{{{\left( {\frac{{\partial \nu (a)}}{{\partial a}}} \right)}}_{T}}} {{{\nu }_{{\text{g}}}}}}} \right. \kern-0em} {{{\nu }_{{\text{g}}}}}}} \right) - \\ - \,\,{{\left( {\frac{{\partial p}}{{\partial a}}} \right)}_{T}}\left( {\nu (a) - T{{{\left( {\frac{{\partial \nu (a)}}{{\partial T}}} \right)}}_{a}}} \right), \\ \end{gathered} $Оценки показали, что при адсорбции метана в области температур, значительно превышающих критическую Tс = 190.77 K, относительная адсорбционная деформация микропористых материалов не превосходит 1% [11, 15]. При этом вклад интенсивностей адсорбционной (dV1/da)T и температурной (dV1/dT)a деформации углеродных адсорбентов считали пренебрежимо малым. Поэтому расчет теплоты адсорбции метана на МОПС Fe-BDC проводили по уравнению:
(2)
${{q}_{{st}}} = - RZ{{\left( {\frac{{\partial (\ln p)}}{{\partial ({1 \mathord{\left/ {\vphantom {1 T}} \right. \kern-0em} T})}}} \right)}_{a}} - {{\left( {\frac{{\partial p}}{{\partial a}}} \right)}_{T}}\nu (a).$На рис. 5 представлены результаты расчетов по (2) зависимостей дифференциальной мольной изостерической теплоты адсорбции метана от величины адсорбции на адсорбенте Fe-BDC с учетом неидеальности газовой фазы Z ≠ 1 и для инертного адсорбента, а также с учетом параметров при температурах 303, 313, 323, 333 К.
Рис. 5.
Зависимость дифференциальной мольной изостерической теплоты адсорбции от величины адсорбции метана на МОПС Fe-BDC после хранения при температурах, К: 1 – 303, 2 – 313, 3 – 323, 4 – 333.
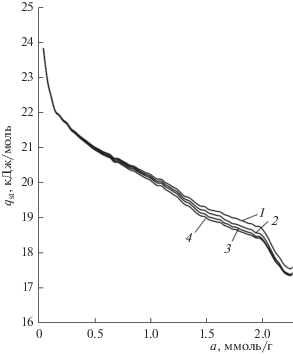
Как следует из рис. 5 дифференциальная мольная теплота адсорбции с ростом адсорбции метана имеет температурную зависимость, связанную с неидеальностью газовой фазы Z, а также с учетом крутизны изотермы адсорбции (dP/da). В начальной области адсорбции от 0 до 0.5 ммоль/г теплота адсорбции резко падает от ~25 до ~21 кДж/моль, что, вероятно, определяется адсорбцией молекул метана на наиболее энергетически выгодных адсорбционных центрах по механизму частично локализованной адсорбции. Затем, с ростом адсорбции до 2 ммоль/г наблюдается плавное падение теплоты до ~19 кДж/моль, связанное с заполнением объема микропор адсорбента. При более высоких величинах адсорбции наблюдается резкое падение теплоты адсорбции, вероятно связанное с нарастанием сил отталкивания между адсорбированными молекулами метана на малых расстояниях. Похожие явления наблюдались ранее при адсорбции метана [14] и криптона на активных углях [16].
Для более детального понимания механизмов адсорбции, процессов происходящих в порах, анализировали дифференциальную мольную изостерическую энтропию адсорбции по (3):
(3)
${{S}_{{ad}}} = {{S}_{{\text{g}}}}--{{{{q}_{{st}}}} \mathord{\left/ {\vphantom {{{{q}_{{st}}}} T}} \right. \kern-0em} T}.$На рис. 6 представлены зависимости дифференциальной мольной изостерической энтропии адсорбционной системы “метан–Fe-BDC” от величины адсорбции при различных температурах, отсчитанной от уровня энтропии газовой фазы. Данные по энтропии газовой фазы метана при соответствующих температурах и давлениях были использованы из [17].
Рис. 6.
Зависимость дифференциальной мольной изостерической энтропии адсорбции метана от величины адсорбции на МОПС Fе-BDC после хранения при T, К: 1 – 303; 2 – 313; 3 – 323; 4 – 333.
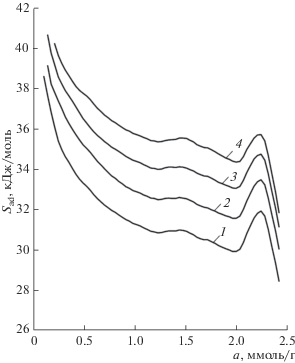
Учет неидеальности газовой фазы и арТ-параметров равновесия адсорбционной системы, приводит к температурной зависимости энтропии адсорбции, рис. 6. Как следует из рис. 6, в области величин адсорбции до ~1 ммоль/г, энтропия адсорбции интенсивно падает во всем исследованном температурном интервале, что вероятно связано с заполнением молекулами адсорбата наиболее активных адсорбционных центров, т.е. с механизмом частично локализованной адсорбции. В области адсорбции от 1 до 1.5 ммоль/г, в первом приближении наблюдается постоянство энтропии адсорбции, с дальнейшим падением в области адсорбции от 1.5 до 2 ммоль/г. Подобный ход зависимости, вероятно, связан с заполнением адсорбционных центров и переходу к механизму делокализованной адсорбции на поверхности микропор. В области относительно высоких величин адсорбции от 2 ммоль/г и выше во всем исследованном температурном интервале наблюдается максимум на энтропии адсорбции, что свидетельствует о изменении упорядоченности адсорбированных молекул и перестройке структуры, вероятно, с образованием молекулярных ассоциатов. Подобный ход кривых наблюдался также для других систем, например “СН4 – микропористый углеродный адсорбент ПАУ-10”, “Хе – цеолит NaX” [18, 19], исследованных в более широкой области а, р, Т-параметров. Для указанных систем в области высоких заполнений микропор наблюдался локальный максимум на энтропии адсорбции, как и для анализируемой системы, рис. 6.
ВЫВОДЫ
Адсорбент МОПС Fe-BDC показал значительную деградацию пористой структуры в процессе длительного хранения. За 6 месяцев объем микропор МОПС сократился в 4 раза с 0.83 до 0.21 см3/г, при этом произошло изменение пористого пространства, связанное с уменьшением среднего диаметра пор для первой моды и сужение максимума распределения микропор для второй моды. Максимальная величина адсорбции метана на адсорбенте МОПС Fe-BDC, выдержанном на воздухе при комнатных температурах в течение шести месяцев после синтеза, составила около 3.5 ммоль/г при давлениях до 40 МПа и температуре 303 К. Рассчитанные дифференциальные мольные изостерические теплоты адсорбции метана на МОПС Fe-BDC и изменения энтропии адсорбции системы имеют температурную зависимость, обусловленную неидеальностью газовой фазы и а, р, Т-параметрами адсорбции. Резкое падение теплоты адсорбции и локальные максимумы на кривых энтропии для системы “метан–МОПС Fe-BDC” в области максимальных величин адсорбции свидетельствуют о перестройке структуры адсорбата в микропорах и, вероятном образовании молекулярных ассоциатов метана в микропорах МОПС Fe-BDC после хранения в течение 6 месяцев на воздухе.
Работа выполнена в соответствии с государственным заданием. Проект № 01201353185 и планом Научного совета РАН по физической химии (тема № 20-03-460–01).
Список литературы
Дубинин М.М. Адсорбция и пористость. М.: Из-во ВАХЗ. 1972. 127 с.
Цивадзе А.Ю., Аксютин О.Е., Ишков А.Г., Князева М.К., Соловцова О.В., Меньщиков И.Е., Фомкин А.А., Школин А.В., Хозина Е.В., Грачев В.А. // Успехи химии. 2019. Т. 88. № 9. С. 925. (Tsivadze A.Yu., Aksyutin O.E., Ishkov A.G., Knyazeva M.K., Solovtsova O.V., Menshchikov I.E., Fomkin A.A., Shkolin A.V., Khozina E.V., Grachev V.A. // Russian Chemical Reviews. 2019. V. 88. № 9. P. 925.)
Князева М.К., Цивадзе А.Ю., Соловцов О.В., Фомкин А.А., Прибылов А.А., Школин А.В., Пулин А.Л., Меньщиков И.Е. // Физикохимия поверхности и защита материалов, 2019. Т. 55. № 1. С. 11. (Knyazeva M.K., Tsivadze A.Yu., Solovtsova O.V., Fomkin A.A., Pribylov A.A., Shkolin A.V., Pulin A.L., Men’shchikov I.E. // Protection of Metals and Physical Chemistry of Surfaces. 2019. V. 55. № 1. P. 9.)
Батракова М.К., Соловцова О.В., Фомкин А.А., Цивадзе А.Ю., Школин А.В., Ширяев А.А., Высоцкий В.В. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 6. С. 563. (Batrakova M.K., Solovtsova O.V., Fomkin A.A., Tsivadze A.Yu, Shkolin A.V., Shiryaev A.A., Vysotskii V.V. // Protection of Metals and Physical Chemistry of Surfaces. 2017. V. 53. № 6. P. 691.)
Cychosz K.A., Matzger A.J. // Langmuir. 2010. V. 26. P. 17198.
Qadir N.u., Said S.A.M., Bahaidarah H.M. // Microporous and Mesoporous Materials. 2015. V. 201. № 1. P. 61.
Князева М.К., Школин А.В., Фомкин А.А., Цивадзе А.Ю., Соловцова О.В., Платонова Н.П., Пулин А.Л., Меньщиков И.Е., Ширяев А.А. Цивадзе, Высоцкий В.В., Киселев М.Р. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 6. С. 537. (Knyazeva M.K., Shkolin A.V., Fomkin A.A., Tsivadze A.Yu, Solovtsova O.V., Platonova N.P., Pulin A.L., Men’shchikov I.E., Shiryaev A.A., Vysotskii V.V., Kiselev M.R. // Protection of Metals and Physical Chemistry of Surfaces. 2018. V. 54. № 6. P. 1004.)
Сычев В.В., Вассерман А.А., Загорученко В.А., Козлов А.Д., Спиридонов Г.А., Цымарный В.А. М.: Издательство стандартов, 1979. 348 с.
Прибылов А.А., Калашников С.М., Серпинский В.В. // Изв. АН СССР. Сер. хим. 1990. № 6. С. 1233.
Shen D., Bulow M. // Microporous and Mesoporous Materials. 1998. V. 22. P. 237.
Школин А.В., Фомкин А.А., Синицын В.А. // Коллоидный журн. 2008. Т. 70 № 6. С. 849. (Shkolin A.V., Fomkin A.A., Sinitsyn V.A. // Colloid J. 2008. V. 70. № 6. P. 796.)
Фомкин А.А., Меньщиков И.Е., Прибылов А.А., Гурьянов В.В., Школин А.В., Зайцев Д.С., Твардовский А.В. // Коллоидный журнал. 2017. Т. 79. № 1. С. 96. (Fomkin A.A., Men’shchikov I.E., Pribylov A.A., Gur’yanov V.V., Shkolin A.V., Zaitsev D.S., Tvardovskii A.V. // Colloid Journal, 2017. V. 79. № 1. P. 144.)
Shkolin A.V., Fomkin A.A., Men’shchikov I.E., Strizhenov E.M., Pulin A.L., Khozina E.V. // Adsorption. 2019. V. 25. № 8. P. 1559.
Школин А.В., Фомкин А.А. // Известия АН СССР, Серия Химическая. 2008. Т. 58. № 9. С. 1765. (Fomkin A.A., Shkolin A.V. // Doklady Physical Chemistry. 2008. V. 423. № 1. P. 292.)
Меньщиков И.Е., Школин А.В., Фомкин А.А. // Измерительная техника. 2017. № 10. С. 58.
Школин А.В., Фомкин А.А., Потапов С.В. // Известия Академии наук. Серия химическая. 2017. № 4. С. 607. (Shkolin A.V., Fomkin A.A., Potapov S.V. // Russian Chemical Bulletin. 2017. V. 66. № 4. P. 607.)
https://trc.nist.gov/refprop/MINIREF/MINIREF.HTM
Fomkin A.A. Adsorption, 2005. V. 11. №3/4. P. 425.
Фомкин А.А., Регент Н.И., Серпинский В.В. // Изв. АН СССР. Сер. хим. 1989. № 9. С. 2137.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов


