Физикохимия поверхности и защита материалов, 2020, T. 56, № 5, стр. 479-484
Адсорбция ионов цинка(II) и хрома(III) модифицированными цеолитами
Е. Г. Филатова 1, *, Ю. Н. Пожидаев 1, О. И. Помазкина 1
1 Иркутский национальный исследовательский технический университет
Иркутск, Россия
* E-mail: efila@list.ru
Поступила в редакцию 14.10.2019
После доработки 24.11.2019
Принята к публикации 02.12.2019
Аннотация
Представлены результаты исследования адсорбции ионов цинка(II) и хрома(III) цеолитами, модифицированными НСl. По данным элементного анализа и электронной спектроскопии цеолиты в своем составе содержат не менее 75% гейландита. При модифицировании цеолитов HCl, происходит удаление ионов алюминия, из тетраэдрического каркаса сорбента, образованного AlO4 и SiO4. Это приводит к разрушению основного компонента гейландита и уплотнению силикатного слоя. Время установления адсорбционного равновесия с системе цеолит–водный раствор составило 90 мин. Получены изотермы адсорбции ионов цинка(II) в температурном интервале 298–318 К при рН 5.6–5.8. Показано, что с ростом температуры адсорбция ионов цинка(II) возрастает. Изотермы адсорбции ионов хрома(III) получены в температурном интервале 298–318 К при рН 7.6–7.9. Установлено, что адсорбция ионов хрома(III) с увеличением температуры уменьшается. На основании изостер адсорбции рассчитаны дифференциальные теплоты адсорбции. Повышение адсорбции ионов хрома(III) сопровождается снижением дифференциальной теплоты адсорбции от 36.9 до 26.8 кДж/моль. Это может быть связано с неоднородностью поверхности адсорбента, в связи с чем, по мере насыщения более активных центров ионы металла адсорбируются на менее активных участках поверхности. Изменение дифференциальной теплоты адсорбции ионов цинка(II) с ростом степени заполнения поверхности имеет немонотонный характер. В области низких степеней заполнения поверхности дифференциальная теплота адсорбции понижается, а затем повышается, что, вероятно, обусловлено полимолекулярной адсорбцией, предполагающей наличие адсорбат–адсорбат взаимодействия. Эффективность очистки промышленных сточных вод гальванического производства при использовании модифицированных цеолитов составила более 97%.
ВВЕДЕНИЕ
Известно, что ионы цинка(II) и хрома(III) относят к токсичным загрязнениям, оказывающим негативное воздействие на окружающую среду [1]. Эти ионы, попадая в водные объекты со сточными водами различных отраслей промышленности, таких как металлургическая, химическая, оборонная, наносят непоправимый ущерб, как отдельным экосистемам, так и природе в целом. Использование передовых методов очистки сточных вод позволяет существенным образом снижать содержание токсичных загрязнений до требуемых норм качества воды.
Токсичные свойства цинка обусловлены в основном ионами, суспензиями гидроксидов и карбонатов. Отравление организма, вызванное токсичностью ионов цинка(II) приводит к малокровию, задержке роста, бесплодию [2].
В работе [3] исследована адсорбция ионов цинка(II) синтетическими цеолитами Х. Цеолиты Х получали из кальцинированного каолина гидротермальной обработкой в щелочных растворах. Молярное отношение SiO2/Al2O3 и К2О/Na2О составило 2.9 и 0.16 соответственно. Показано, что эти соотношения, необходимы для получения цеолита за минимальное время реакции. Авторы работы [4] изучили влияние рН и времени контакта на адсорбционную способность катионообменной смолы Dоwex YCR S/S по отношению к ионам цинка(II). При оптимальных условиях эффективность удаления токсичных ионов составляет более 98%. В работе [5] получены оптимальные параметры адсорбции ионов цинка(II) цеолитами NaA и NaX при очистке сточных вод промышленных зон Алжира. Авторы работы [6] синтезировали наночастицы гидроксисодалита-цеолита с различными размерами кристаллитов (37.61–64.88 нм) с использованием гидротермального метода в отсутствие и в присутствии недорогих алифатических органических кислот в качестве матриц. Установлено, что синтезированные наночастицы можно эффективно применять для очистки загрязненной воды от ионов цинка(II), максимальная адсорбционная емкость составила при этом 8.53 мг/г. Показано, что величина адсорбции ионов цинка(II) синтетическим цеолитом NaA, полученным из золы, достигает 47.78 мг/г [7].
Известно, что соединения хрома оказывают общетоксическое, раздражающее, кумулятивное, аллергенное, канцерогенное и мутагенное действия на живые организмы [2].
Авторы работы [8] исследовали факторы, влияющие на возможность использования модифицированных цеолитов при удалении ионов хрома(VI). Адсорбция исследована в лабораторных условиях в зависимости от рН, времени, количества модифицированных цеолитов и исходной концентрации хрома(VI). Установлено, что сорбционная емкость модифицированных цеолитов зависит от рН раствора. В работе [9] исследовано поглощение ионов хрома(VI) из водных растворов с помощью модифицированных природных цеолитных материалов из Захедана (Иран). Показано, что поглощение ионов хрома(VI) зависит от рН среды, а максимальное извлечение ионов хрома(VI) происходит в кислой среде при рН < 1.5. В работе [10] исследована адсорбция ионов хрома(III) катализатором FCC, преобразованным в цеолитную смесь. Изучено влияние условий на эффективность адсорбции. Авторами работы [11] определены оптимальные условия удаления хрома на модифицированной поверхности цеолита – рH 8.8, время 55 минут, температура 303.15 K, навеска цеолита 400 мг и начальная концентрация хрома 16.0 мг/л. Величина адсорбции ионов хрома(III) синтетический цеолитом NaA, полученным из золы, составила 65.98 мг/г [7]. Исследована адсорбция ионов Cr(III) на композите крахмал-трансплантат-поли (акриловая кислота)/ органо-модифицированный цеолит 4А [12]. Результаты показали, что адсорбционная способность синтезированного композита при начальной концентрации ионов хрома(III) 50 ммоль/л может достигать очень большого значения – 651.42 мг/г.
При очистке сточных вод металлургической, химической, оборонной и других отраслей промышленности стоит проблема, связанная с полнотой удаления ионов тяжелых металлов, в том числе и ионов цинка(II) и хрома(III) с помощью недорогих и эффективных сорбционных материалов.
Разработка эффективных технологий очистки сточных вод является приоритетной задачей гальванического производства, признанного одним из экологически опасных. Совершенствование методов очистки сточных вод требуется несмотря на разработку новых менее токсичных электролитов, новых способов и схем промывки деталей, и устройств для регенерации растворов. Другой, не менее значимой проблемой, связанной с технологическими процессами гальванического производства, является образование высококонцентрированных и высокотоксичных отработанных растворов электролитов. Отсутствие должного внимания к этой проблеме приводит к тому, что в сети городской канализации, а далее, через городские очистные сооружения, в поверхностные водоемы сбрасываются токсичные загрязнения в десятки и сотни раз выше допустимых для нормальной жизни животного и растительного мира водной среды.
Одним из эффективных путей решения обозначенных проблем является использование сорбционных технологий на основе доступных адсорбентов, способных обеспечить необходимую глубину обезвреживания сточных вод. К таковым можно отнести адсорбционные технологии с использованием синтетических, природных и модифицированных цеолитов [13, 14].
Целью работы явилось исследование адсорбции ионов цинка(II) и хрома(III) из водных растворов цеолитами, модифицированными НСl, а также возможность использования цеолитов для обезвреживания сточных вод гальванического производства.
ЭСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объекта исследования использовали природные цеолиты Холинского месторождения. В экспериментах использовали предварительно отсеянную на сите фракцию цеолита размером 1.0 мм.
Модификацию цеолитов НСl осуществляли в соответствии с методикой: 10 г высушенных до постоянной массы при температуре 120–150°С алюмосиликатов перемешивали 24 ч с 200 мл 12%-ного раствора HCl в воде. Затем суспензию фильтровали и промывали дистиллированной водой до нейтральной реакции. Полученные модифицированные цеолиты сушили до постоянной массы и анализировали на содержание основных элементов.
Исследование адсорбции осуществляли на модельных растворах, для приготовления которых использовали следующие реактивы: ZnSO4 · 7H2O, и Cr2(SO4)3 · 6H2O квалификации “х. ч.”. Модельные растворы готовили растворением соответствующих навесок указанных реактивов в дистиллированной воде. При этом концентрация ионов тяжелых металлов в растворах соответствовала реальной концентрации загрязнений на выходе из гальванического цеха. Содержание ионов цинка(II) и хрома(III) в растворах определяли по стандартным методикам [15, 16].
Изучение адсорбционных свойств модифицированных цеолитов по отношению к ионам цинка(II) и хрома(III) проводили в статических условиях. Для построения изотермы адсорбции в работе использовали метод неизменных навесок (1 г цеолитов) и переменных концентраций. Концентрация цинка(II) и хрома(III) в водных растворах изменялась от 10 до 100 мг/л. Исследуемые растворы готовили объемом 0.1 дм3. Массовое отношение жидкой и твердой фаз составляло 1 : 100. Величину адсорбции (А, ммоль/г) вычисляли по формуле:
где С0 и Сравн – исходная и равновесная концентрации металла в растворе, ммоль/л; V – объем раствора, л; m – масса адсорбента, г.Кислотность модельных растворов контролировали с помощью рН-метра “рН-340” по стандартной методике [17]. Температуру поддерживали с помощью термостата UTU-4, исследования проводили при температуре 298, 318 и 338 К. Перемешивание осуществляли при помощи магнитной мешалки. Условия перемешивания во всех опытах выдерживали постоянными.
Возможность практического применения цеолитов рассмотрена на примере сточных вод гальванического производства, основными загрязняющими компонентами которых являются ионы тяжелых металлов (табл. 1).
Таблица 1.
Загрязняющие вещества, их концентрации
| Наименование загрязняющих веществ |
Без очистки, мг/л |
После очистки гашеной известью, мг/л | ПДК сброса, мг/л |
|---|---|---|---|
| Ионы цинка(II) | 13.87–11.46 | 1.51 | 0.02 |
| Ионы хрома(III) | 10.12–9.86 | 1.35 | 0.50 |
| Ионы никеля(II) | 11.95–6.81 | 1.49 | 0.28 |
| Ионы меди(II) | 16.8–14.3 | 1.02 | 0.01 |
| рН | 2.5–3 | 8.5–9.5 | 6.5–8.5 |
Как видно, из представленных данных (табл. 1), после проведения известковой очистки сточных вод, содержание ионов тяжелых металлов не удается снизить до требуемых норм предельных допустимых концентраций.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Согласно результатам рентгенофазового анализа установлено, что природные цеолиты содержат гейландит кальция Ca[Al2Si7O18] ⋅ 6H2O, а также примесные породы – санидин КАlSi3O8 и кристобалит SiO2 [18]. По данным элементного анализа и электронной спектроскопии содержание цеолита в туфе составляет не менее 75 мас. % [19]. При модифицировании природных цеолитов HCl, происходит удаление ионов алюминия, из бесконечного тетраэдрического каркаса сорбента, образованного AlO4 и SiO4. Это приводит к разрушению основного компонента гейландита и уплотнению силикатного слоя, а также улучшению адсорбционных свойств материала [20].
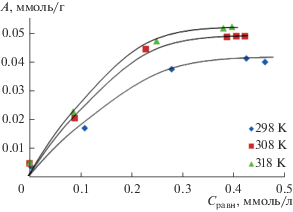
Исследована адсорбция ионов цинка(II) и хрома(III) цеолитами, модифицированными HCl. Адсорбционное равновесие, отвечающее постоянству составу концентраций ионов металлов в системе адсорбат-цеолит, составило 90 мин. Получены изотермы адсорбции ионов цинка(II) в температурном интервале 298–318 К при рН 5.6–5.8 (рис. 1).
Известно, что физическая адсорбция является экзотермическим и обратимым процессом, и повышение температуры, должно приводить к снижению адсорбции [21]. Снижение скорости адсорбции при повышении температуры связывают с ослаблением адсорбционных сил между активными центрами адсорбента и частицами адсорбата, а также между адсорбированными частицами [22].
Полученные экспериментальные данные (рис. 1) свидетельствуют о том, что с ростом температуры величина адсорбции ионов цинка(II) возрастает. В работах [23–25] показано, что адсорбция ионов тяжелых металлов является эндотермическим процессом и с увеличением температуры ее величина возрастает. Увеличение адсорбции с ростом температуры может быть связано с понятием об активированной адсорбции [24]. Кроме того, это может быть следствием химического взаимодействия между адсорбатом и адсорбентом, созданием некоторых новых центров адсорбции или увеличением скорости внутричастичной диффузии ионов металла в поры адсорбента при более высокой температуре [23]. При повышении температуры гидратированные ионы металлов способны к обезвоживанию, что благоприятствует адсорбции и определяет эндотермический характер процесса [25].
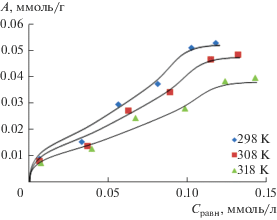
Исследовано влияние температуры на адсорбцию ионов хрома(III). Полученные изотермы интервале 298–318 К при рН 7.6–7.9 представлены на рис. 2.
Как видно из представленных данных (рис. 2), с увеличением температуры величина адсорбции ионов хрома(III) уменьшается, что подтверждает экзотермический характер исследуемого процесса. Ионы металлов, адсорбированные на поверхности алюмосиликата, при повышении температуры могут высвобождаться в водный раствор. Это связано с возрастающей тенденцией к десорбции ионов адсорбата от границы раздела в раствор при повышении температуры в случае физической адсорбции [26]. Обратная зависимость адсорбции от температуры характерна для ионообменных адсорбентов, степень диссоциации ионогенных групп которых при повышении температуры возрастает [27].
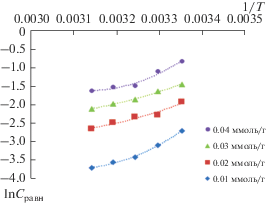
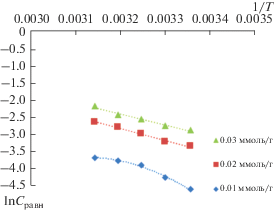
В термодинамике адсорбции важную роль играют изостеры адсорбции – кривые зависимости концентрации равновесной фазы от температуры при постоянной величине адсорбции (рис. 3 и 4).
Вид полученных изостер (рис. 3) подтверждает протекание активированной адсорбции ионов цинка(II). Линейность представленных изостер (рис. 4), свидетельствует о неизменности физического процесса адсорбции с ростом температуры. Приведенные экспериментальные данные были использованы для расчета дифференциальных теплот адсорбции по уравнению Клаузиса–Клапейрона:
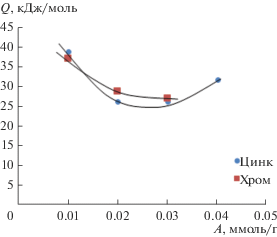
Повышение адсорбции ионов хрома(III) сопровождается снижением дифференциальной теплоты адсорбции от 36.9 до 26.8 кДж/моль (рис. 5). Это может быть связано с неоднородностью поверхности адсорбента, в связи с чем, по мере насыщения более активных центров ионы металла адсорбируются на менее активных участках поверхности [28].
Изменение дифференциальной теплоты адсорбции ионов цинка(II) с ростом степени заполнения поверхности имеет немонотонный характер (рис. 5). В области низких степеней заполнения поверхности дифференциальная теплота адсорбции понижается, а затем повышается, что, вероятно, обусловлено полимолекулярной адсорбцией, предполагающей наличие адсорбат–адсорбат взаимодействия [29, 30].
Цеолиты, модифицированные НСl, использовали при сорбционной очистке сточных вод гальванического производства. Полученные результаты представлены в табл. 2.
Таблица 2.
Результаты сорбционной очистки сточных вод
| Ионы | Содержание исходное, мг/л |
Содержание после очистки, мг/л |
Эффективность очистки, % |
|---|---|---|---|
| Цинка(II) | 1.51 | 0.02 | 98.7 |
| Хрома(III) | 1.35 | 0.03 | 97.8 |
| Никеля(II) | 1.49 | 0.04 | 97.3 |
| Меди(II) | 1.02 | 0.01 | 99.0 |
| рН | 8.5–9.5 | 7.3–7.6 | – |
Использование цеолитов для сорбционной очистки промышленных сточных вод гальванического производства позволило снизить концентрацию ионов цинка(II) до 0.02, хрома(III) до 0.03 мг/л. Эффективность очистки составляет при этом более 97%.
ВЫВОДЫ
1. Изучено влияние температуры на адсорбцию ионов цинка(II) и хрома(III) цеолитами, модифицированными HCl. Показано, что адсорбция ионов цинка(II) с увеличением температуры возрастает, а адсорбция ионов хрома(III) снижается.
2. Получены изостеры адсорбции цинка(II) и хрома(III). Рассчитаны дифференциальные теплоты адсорбции. При адсорбции ионов хрома(III) наблюдается снижением дифференциальной теплоты адсорбции от 36.9 до 26.8 кДж/моль. Изменение дифференциальной теплоты адсорбции ионов цинка(II) с ростом степени заполнения поверхности имеет немонотонный характер. В области низких степеней заполнения поверхности дифференциальная теплота адсорбции понижается, а затем повышается, что, вероятно, обусловлено полимолекулярной адсорбцией, предполагающей наличие адсорбат–адсорбат взаимодействия.
3. Использование модифицированных цеолитов для доочистки промышленных сточных вод гальванического производства позволило снизить концентрацию ионов цинка(II) до 0.02, хрома(III) до 0.03 мг/л. Эффективность очистки составляет при этом более 97%.
Работа выполнена при финансовой поддержке проекта РФФИ 18-08-00718.
Список литературы
Hall J.L. // J. Experimental Botany. 2002. V. 53. № 366. P. 1.
Корте Ф. Экологическая химия: пер. с нем. / Ф. Корте, М. Бахадир, В. Клайн, Я.П. Лай, Г. Парлар, И. Шеднерт. Под ред. Корте Ф. Москва: Мир, 1997. 396 с.
Ismael I.S. // Chinese J. Geochemistry. 2010. V. 29. № 2. P. 130.
Alyuz B., Veli S. // J. Hazardous Materials. 2009. V. 167. № 1–3. P. 482.
Nibou D., Mekatel H., Amokrane S., Barkat M., Trari M. // J. Hazardous Materials. 2010. V. 173. № 1–3. P. 637.
Abdelrahman E.A., Tolan D.A., Nassar M.Y. // J. inorganic and organometallic polymers and materials. 2019. V. 29. № 1. P. 229.
Nibou D., Amokrane S., Mekatel H., Lebaili N. // Physics Procedia. 2009. V. 2. № 3. P. 1433.
Shi H.S., Liu Y.H. // Jianzhu Cailiao Xuebao / J. Building Materials. 2006. V. 9. № 4. P. 408.
Noroozifar M., Khorasani-Motlagh M., Gorgij M.N., Naderpour H.R. // J. Hazardous Materials. 2008. V. 155. № 3. P. 566.
Gonzalez M.R., Pereyra A.M., Torres Sanchez R.M., Basaldella E.l. // J. Colloid and Interface Science. 2013. V. 408. P. 21.
Aljerf L. // J. environmental management. 2018. V. 225 P. 120.
Ma K., Zhao L., Jiang Z., Huang Y.Y., Sun X.P. // Polymer composites. 2018. V. 39. № 4. P. 1223.
Помазкина О.И., Филатова Е.Г., Лебедева О.В., Пожидаев Ю.Н. // Физикохимия поверхности и защита материалов. 2018. Т. 54. № 4. С. 393.
Филатова Е.Г., Пожидаев Ю.Н., Помазкина О.И. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 5. С. 507.
Лурье Ю.Ю., Рыбникова А.И. Химический анализ производственных сточных вод. М.: Химия, 1974. 336 с.
Марченко З. Фотометрическое определение элементов. М.: Мир, 1971. 502 с.
Васильев В.П. Аналитическая химия. В 2-х ч. М.: Дрофа, 2004. (часть 1) 384 с., (часть 2) 366 с.
Филатова Е.Г., Пожидаев Ю.Н., Помазкина О.И. // Физикохимия поверхности и защита материалов. 2016. Т. 52. № 3. С. 285.
Помазкина О.И., Филатова Е.Г., Пожидаев Ю.Н. // Физикохимия поверхности и защита материалов. 2015. Т. 51. № 4. С. 370.
Филатова Е.Г., Помазкина О.И., Пожидаев Ю.Н. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 6. С. 596.
Физическая химия адсорбционных явлений / А.Ю. Цивадзе, А.И. Русанов, А.А. Фомкин и др. М.: Граница, 2011. 304 с.
Sheela T., Nayaka Y.A., Viswanatha R., Basavanna S., Venkatesha T.G. // Powder Technology. 2012. V. 217. P. 163.
Al-Othman Z.A., Naushad M. // Chemical Engineering J. 2012. V. 184. P. 238.
Фролов Ю.Г. Курс коллоидной химии. М.: Химия, 1982. 400 с.
Zhao G., Li J., Ren X., Chen C. Wang X. // Environ. Sci. Technol. 2011. V. 45. № 24. P. 10454.
Kubilay S., Gurkan R., Savran A., Sahan T. // Adsorption-Journal of the International Adsorption Society. 2007. V. 13. P. 41.
Gode F., Pehlivan E. // J. Hazardous Materials. 2006. V. 136. P. 330.
Потапов С.В., Фомкин А.А., Синицын В.А., Школин А.В. // Вестник МГТУ им. Н.Э. Баумана. Сер. Машиностроение. 2010. Т. 2010, № k. С. 178.
Муминов С.З., Хандамов Д.А. // Сорбционные и хроматографические процессы. 2010. Т. 10. Вып. 5. С. 669.
Макаревич Н.А. Теоретические основы адсорбции / Н.А. Макаревич, Н.И. Богданович / Сев. (Арктич.) федер. ун-т им. М.В. Ломоносова. Архангельск: САФУ, 2015. 362 с.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов