Физикохимия поверхности и защита материалов, 2021, T. 57, № 1, стр. 19-24
Адсорбция метана на микропористом углеродном адсорбенте из термохимически активированной древесины
А. А. Фомкин 1, *, Б. А. Дубовик 2, Н. В. Лимонов 2, А. А. Прибылов 1, А. Л. Пулин 1, И. Е. Меньщиков 1, А. В. Школин 1
1 ФГБУН Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский проспект, 31, стр. 4, Россия
2 ОАО “Сорбент” (Зелинский групп)
614113 Пермь, ул. Гальперина, 6, Россия
* E-mail: fomkinaa@mail.ru
Поступила в редакцию 28.02.2020
После доработки 17.03.2020
Принята к публикации 24.03.2020
Аннотация
Методом термохимического синтеза на основе древесины в присутствии Н3РО4 синтезирован микропористый углеродный адсорбент ЕС-103 и исследована адсорбция метана в диапазоне температур 303‒333 K и давлений до 40 МПа. Общий объем сорбирующих пор 1.71 см3/г. Максимальные величины адсорбции метана ~14.5 ммоль/г (23.2 мас. %) получены при температуре 303 K и давлении 40 МПа. Дифференциальная мольная изостерическая теплота адсорбции метана в среднем составляет 12‒14 кДж/моль. На основе теории объемного заполнения микропор М.М. Дубинина (ТОЗМ) проведены расчеты адсорбции метана на адсорбенте ЕС-103. Показано, что наилучшее описание экспериментальных данных, при условии использования только стандартных структурно-энергетических характеристик адсорбента, достигается при использовании уравнения Дубинина–Радушкевича и базовых закономерностей ТОЗМ.
ВВЕДЕНИЕ
Адсорбционное концентрирование метана, как основного компонента природного газа, в микропористых адсорбентах может быть перспективным для создания газовых автомобильных аккумуляторов, мобильных систем транспортировки газа к удаленным потребителям, при создании локальных хранилищ природного газа у крупных потребителей. В отличие от бензина, дизельного топлива, пропан-бутановой моторной смеси, сжиженного природного газа (СПГ), метан обладает малой плотностью [1]. Поэтому, для повышения плотности в системе хранения, в существующих технологиях используется компримированный природный газ (КПГ) [2]. Одним из важных направлений является также технология сжиженного природного газа (СПГ) [3, 4].
Однако эти технологии имеют свои недостатки. Технология КПГ сопряжена с высокими энергозатратами при сжатии газа. Газ находится в тяжелых, металлоемких или дорогих сосудах из композитных материалов, высоки риски пожаро- и взрывоопасности. Хранение газа в сжиженном состоянии при криогенных температурах и близком к атмосферному давлении, реализуется только с применением специальных технических средств. Этот способ наиболее эффективен и широко применяется при хранении и транспортировке газа в сверхбольших объемах, но в сфере малых потребителей газа он недостаточно эффективен, к таким системам предъявляются высокие требования безопасности [4, 5].
Использование газового топлива имеет существенные экологические преимущества по сравнению с традиционными видами топлива на основе нефтепродуктов. Природный газ метан в качестве моторного топлива не требует присадок на основе свинца или иных тяжелых металлов для увеличения октанового числа, что приводит к отсутствию их выброса в атмосферу; в выхлопных газах отсутствуют твердые частицы от присадок и сажи, вдыхание которых человеком приводит к развитию респираторных и сердечно-сосудистых заболеваний; отсутствуют соединения серы и, как следствие, отсутствует эмиссия двуокиси серы, типичного компонента выхлопных газов [6].
Основной проблемой, сдерживающей широкое применение газового топлива для удаленных потребителей, является отсутствие энергоэффективных, пожаро- и взрывобезопасных систем хранения и транспортировки, обладающих высокой плотностью аккумулированного газа. В связи с этим в настоящее время во всем мире интенсивно ведутся работы по созданию конкурентоспособных адсорбционных систем хранения газа [7]. К адсорбентам, перспективным для систем аккумулирования метана, помимо адсорбционных требований, предъявляются также требования объемной плотности аккумулированного газа при 298 К и 35 бар – не менее 263 м3 (НТД)/м311 [8].
При этом важно, чтобы адсорбент был гидрофобен, имел достаточно высокую прочность и сравнительно невысокую стоимость.
Наилучшим образом всем перечисленным технологическим и экономическим условиям отвечают микропористые углеродные адсорбенты.
В связи с этим важной и актуальной является проблема создания адсорбентов с оптимальной пористой структурой, обеспечивающей высокую адсорбционную активность по метану.
ОБЕКТЫ ИССЛЕДОВАНИЯ
Адсорбент
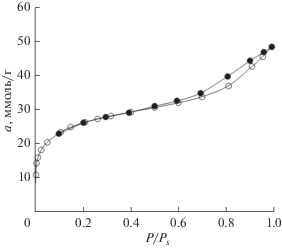
Углеродный адсорбент (ЕС-103) синтезировали путем карбонизации отходов деревопереработки при 673‒1073 К с последующей химической активацией при 1273°С в присутствии Н3РО4 и восстановлением с последующей отмывкой и сушкой. Структурно-энергетические характеристики адсорбента исследовали на установке Autosorb iQ (фирма Quantachrome Instr.) по изотерме адсорбции азота при 77 К с использованием Теории объемного заполнения микропор (ТОЗМ) М.М. Дубинина [9], уравнений БЭТ и Кельвина [10]. На рис. 1 представлена изотерма адсорбции стандартного пара азота при 77 К.
Как следует из рис. 1, изотерма адсорбции-десорбции азота при 77 К в начальной части, в области заполнения микропор, обратима, но при высоких заполнениях имеет петлю гистерезиса, что свидетельствует о наличии в структуре адсорбента микро- и мезопор. Структурно-энергетические характеристики адсорбента представлены в табл. 1.
Таблица 1.
Структурно-энергетические характеристики микропористого углеродного адсорбента ЕС-103
| Удельный объем микропор, W0, см3/г | 0.83 |
| Характеристическая энергия адсорбции по азоту, E, кДж/моль | 5.00 |
| Характеристическая энергия адсорбции по стандартному пару бензолу, E0, кДж/моль | 15.14 |
| Полуширина микропор х0, нм | 0.79 |
| Удельная поверхность адсорбента, SБЭТ, м2/г | 2170 |
| Предельный адсорбционный объем, Ws, см3/г | 1.71 |
| Удельная поверхность мезопор Sme, м2/г | 390 |
| Удельный объем мезопор Wme, см3/г | 0.88 |
Для перехода от данных по азоту к данным по стандартному пару бензолу в ТОЗМ используют коэффициент подобия ${{\beta }_{{{{{\text{N}}}_{{\text{2}}}}}}}$ = Е/Е0 = 0.33 [11]; эффективную полуширину (радиус) микропор рассчитывали по формуле х0 = 12/Е0 (нм) [11]. Коэффициент подобия для метана рассчитали по отношению парахоров азота и бензола через инкременты Сагдена ${{\beta }_{{{\text{C}}{{{\text{H}}}_{4}}}}}$ = 0.35. Удельную поверхность SБЭТ определяли по начальной части изотермы адсорбции азота при относительных давлениях до p/ps = 0.1.
На основе предварительных оценок адсорбции метана на углеродных активных углях методом численного моделирования молекулярной динамики в [12] показано, что имеются три характерных максимума плотности, соответствующих ширине пор I ~ (0.7‒0.9), II ~ (1.0‒1.1) и III ~ (1.4‒1.5) нм, при которых образуются адсорбционные ассоциаты метана в микропорах. При таких параметрах пористой структуры энергия взаимодействия “адсорбент–адсорбат” достигает максимума вследствие образования адсорбционных ассоциатов в порах, что приводит также к дополнительному увеличению за счет этого адсорбции. Синтезированный адсорбент ЕС-103, как следует из табл. 1, обладает микропористой структурой близкой структуре типа III.
Адсорбат
Использовали метан (CH4) высокой чистоты 99.999%. По данным [1] он обладает следующими физико-химическими характеристиками: молекулярная масса: µ = 16.0426 г/моль; нормальная температура кипения T0 = 111.66 K; критическая температура Tс = 190.77 K; критическое давление pс = 4.626 МПа.
ОБСУЖДЕНИЕ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
Изотермы адсорбции
Исследована адсорбция метана в интервале давлений от 0.2 до 40 МПа при температурах 303, 313, 323, 333 К объемно-весовым методом по изменению массы ампулы с адсорбентом вследствие адсорбции [13].
Адсорбцию метана определяли, как полное содержание вещества в микропорах.
(1)
$a = {{(V - {{V}_{а}}){{\rho }_{g}}} \mathord{\left/ {\vphantom {{(V - {{V}_{а}}){{\rho }_{g}}} {{{m}_{0}}}}} \right. \kern-0em} {{{m}_{0}}}}.$Здесь V – общий объем системы; Vа – объем адсорбента с микропорами; ρg – плотность газовой фазы при заданном давлении Р и температуре Т; m0 – масса регенерированного адсорбента. Погрешности измерений давления составили ±0.015 МПа, температуры ±0.3 K, адсорбции ±4 × 10–4 г.
Из табл. 1 следует, что удельная поверхность мезопор адсорбентов невелика, составляет не более 10% от общей удельной площади поверхности, потому адсорбцией на ней можно пренебречь по сравнению с адсорбцией в микропорах. Объем адсорбента Vа определяли как сумму объемов скелета адсорбента, определенного калибровкой по гелию VHe и объема микропор W0, рассчитанного по изотерме адсорбции паров бензола при 293 К с использованием уравнения Дубинина–Радушкевича.
На рис. 2 представлены зависимости адсорбции метана на углеродном микропористом адсорбенте ЕС-103 от давления при температурах 303, 313, 323 и 333 K.
Рис. 2.
Изотермы адсорбции метана на углеродном адсорбенте ЕС-103 при температурах, К: 1 – 303, 2 – 313, 3 – 323, 4 – 333 К. Символы – экспериментальные данные; линии – аппроксимация.

Из экспериментальных данных рис. 1 следует, что адсорбция метана быстро растет при давлениях до ~10 МПа, а затем, при бо́льших давлениях, проявляется тенденция к насыщению. При температуре 303 К и давлении 40 МПа адсорбция составляет ~14.5 ммоль/г (23.2 мас. %). Адсорбция метана на адсорбенте ЕС-103 обратима. С ростом температуры адсорбция падает. По экспериментальным изотермам адсорбции построили изостеры адсорбции метана (рис. 3).
Рис. 3.
Изостеры адсорбции метана на микропористом углеродном адсорбенте ЕС-103 при различных величинах адсорбции, a, ммоль/г: 1 – 1; 2 – 2; 3 – 3; 4 – 4; 5 – 5; 6 – 6; 7 – 7; 8 – 8; 9 – 9; 10 – 10; 11 – 11; 12 – 12; 13 – 13. Символы – экспериментальные данные; линии – аппроксимация.
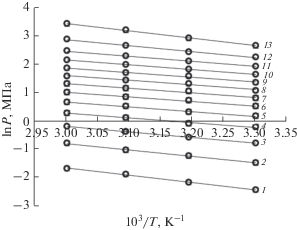
Из рис. 3 следует, что изостеры адсорбции метана в микропористом адсорбенте ЕС-103 во всем диапазоне исследованных температур и давлений хорошо аппроксимируются линейными функциями.
Полученные изостеры использовали для расчета дифференциальной мольной изостерической теплоты адсорбции метана на адсорбенте ЕС-103, которую определяли как разность мольной энтальпии газовой фазы hg и дифференциальной мольной энтальпии адсорбционной системы ha
ДИФФЕРЕНЦИАЛЬНАЯ МОЛЬНАЯ ИЗОСТЕРИЧЕСКАЯ ТЕПЛОТА АДСОРБЦИИ
Для расчета теплоты адсорбции использовали общее уравнение [14, 15], учитывающее неидеальность газовой фазы при высоких давлениях Z(P, Vg, T) ≠ 1 и неинертность адсорбента при адсорбции, т. е. зависимость V = V(a, T)
(3)
$\begin{gathered} {{q}_{{st}}} = - RZ{{\left( {\frac{{\partial (\ln P)}}{{\partial \left( {\frac{1}{T}} \right)}}} \right)}_{a}}\left\{ {1 - {{{{{\left( {\frac{{\partial V\left( a \right)}}{{\partial a}}} \right)}}_{T}}} \mathord{\left/ {\vphantom {{{{{\left( {\frac{{\partial V\left( a \right)}}{{\partial a}}} \right)}}_{T}}} {{{V}_{g}}}}} \right. \kern-0em} {{{V}_{g}}}}} \right\} - \\ - \,\,{{\left( {\frac{{\partial P}}{{\partial a}}} \right)}_{T}}\left[ {V\left( {a,Т} \right) - T{{{\left( {\frac{{\partial V\left( a \right)}}{{\partial T}}} \right)}}_{a}}} \right]. \\ \end{gathered} $В [16] было показано, что относительная адсорбционная деформация адсорбентов при адсорбции метана в области температур 303–333 К не превосходит 1%, а вклад интенсивностей адсорбционной и температурной деформации углеродных адсорбентов пренебрежимо мал. Поэтому расчет теплоты адсорбции метана на адсорбенте ЕС-103 проводили по уравнению
(4)
${{q}_{{st}}} = - RZ{{\left( {\frac{{\partial (\ln P)}}{{\partial \left( {\frac{1}{T}} \right)}}} \right)}_{a}} - {{\left( {\frac{{\partial P}}{{\partial a}}} \right)}_{а}}V,$На рис. 4 представлены результаты расчета зависимости дифференциальной мольной изостерической теплоты адсорбции метана от величины адсорбции метана на адсорбенте ЕС-103.
Рис. 4.
Зависимость дифференциальной мольной изостерической теплоты адсорбции метана на микропористом углеродном адсорбенте ЕС-103 при температурах, Т, К: 1 – 303; 2 – 313; 3 – 323; 4 – 333. Символы – экспериментальные данные; линии – аппроксимация.

Изостерическая теплота адсорбции, как следует из уравнения (3), определяется наклоном изостер адсорбции, неидеальностью газовой фазы (Z) и кривизной изотерм адсорбции (dp/da)T. Из рис. 4 следует, что изостерическая теплота адсорбции слабо падает по мере роста адсорбции от начальной величины 15.7 до 12 кДж/моль при а = = 10 ммоль/г. При больших величинах адсорбции в соответствии с уравнением (3) начинает сказываться неидеальность газовой фазы Z ≠ 1 и фактор интенсивности адсорбции (dP/da)T, что приводит к появлению веера температурных кривых теплоты адсорбции. При температуре 303 К и адсорбции метана до 10‒12 ммоль/г, замедленное падение теплоты адсорбции, вероятно связанно с заполнением объема микропор, сопровождающимся межмолекулярным притяжением между адсорбированными молекулами метана и образованием ассоциатов. Последующее резкое падение теплоты адсорбции при 12‒14.5 ммоль/г обусловлено нарастанием энергии отталкивания между адсорбированными молекулами в адсорбционных ассоциатах [17].
Данный факт, вероятно, связан с увеличением энергии притяжения молекул в адсорбате при высоких заполнениях и образованием адсорбционных ассоциатов метана в микропорах. С ростом температуры эти процессы размываются и падение теплоты адсорбции на кривых 2, 3, 4 при адсорбции между ~10 и ~14 ммоль/г вероятно связано, по уравнению (3), с уменьшением коэффициента сжимаемости Z с ростом давления [18].
РАСЧЕТ АДСОРБЦИИ МЕТАНА В ОБЛАСТИ СВЕРХКРИТИЧЕСКИХ ТЕМПЕРАТУР
Теория объемного заполнения микропор Дубинина (ТОЗМ) позволяет во многих случаях рассчитывать адсорбцию газов на микропористых адсорбентах в докритической и сверхкритической областях температур. Для этого часто используется термическое уравнение адсорбции Дубинина–Радушкевича (Д-Р) [9]:
Для нахождения fs в области сверхкритических температур используют условие линейной экстраполяции зависимости lnps от 1/T.
Величину предельной адсорбции a0 рассчитывают по уравнению Дубинина–Николаева [9]:
где $a_{0}^{0}$, [ммоль/г] – предельная адсорбция при температуре кипения T0, [К]; α, [1/К] – термический коэффициент предельной адсорбции. Для метана α= 1.52 × 10–3 K–1 [13].В области сверхкритических температур предельную величину адсорбции рассчитывают по (5) при условии (d lna0/dT)fs = const [13]. Характеристическая энергия адсорбции E конкретного газа определяется через коэффициент аффинности β = E/E0. Для метана β = 0.35 [13].
В расчетах изотерм адсорбции метана на адсорбенте ЕС-103 использовали линейную экстраполяцию зависимостей ln ps = f(1/Т) и ln a0= f(Т) в закритическую область. Результаты расчетов представлены на рис. 5.
Рис. 5.
Зависимость адсорбции метана на микропористом углеродном адсорбенте ЕС-103 от давления при температурах Т, К: 1 ‒ 303, 2 ‒ 313, 3 –323, 4 – 333. Значки – экспериментальные данные; сплошные линии – расчет с использованием уравнения Д-Р.

Из рис. 5 следует, что расчет адсорбционных равновесий адсорбции метана на углеродном микропористом адсорбенте ЕС-103 по уравнению Д-Р можно считать удовлетворительным. Самые большие отклонения расчетных величин от экспериментальных данных составляют менее 10% при lnP = 8.5.
ЗАКЛЮЧЕНИЕ
Методом термохимической активации древесины в присутствии Н3РО4 синтезирован микропористый углеродный адсорбент ЕС-103, имеющий высокую адсорбционную активность (23.2 мас. %) по метану при 303 К и 40 МПа. Рассчитаны его структурно-энергетические характеристики и дифференциальные мольные теплоты адсорбции метана. Построена зависимость дифференциальных мольных изостерических теплот адсорбции метана от величины адсорбции, из которой следует, что для увеличения адсорбции необходимо использовать структуры, позволяющие дополнительно увеличить энергию адсорбции за счет энергии ассоциирования адсорбата в микропорах. Приведены расчеты адсорбции метана в области сверхкритических температур с использованием структурно-энергетических характеристик адсорбента и термического уравнения ТОЗМ Дубинина–Радушкевича.
Список литературы
Сычев В.В., Вассерман А.А., Загорученко В.А., Козлов А.Д., Спиридонов Г.А., Цымарный В.А. Термодинамические свойства метана. М.: Издательство стандартов, 1979.
Васильев Ю.Н., Гриценко А.И., Чириков К.Ю. Газозаправка транспорта. М.: “Недра”, 1995. 435 с.
Cleaver Ph., Johnson M., Ho B. // J. Hazardous Materials. 2007. V. 140. P. 429.
Майорец М., Симонов К. Сжиженный газ – будущее мировой энергетики. М.: Альпина Паблишер, 2013. 360 с.
Лавренченко Г.К. Проблемы эффективного производства и использования КПГ и СПГ // Технические газы. 2006. № 5. С. 2.
Защита атмосферы от промышленных загрязнений. Справочник. Под ред. Калверта А.С., Инглунда Г.М. М.: Металлургия. 1988.
Цивадзе А.Ю., Аксютин О.Е., Ишков А.Г., Меньщиков И.Е., Фомкин А.А., Школин А.В., Хозина Е.В., Грачев В.А. // Успехи химии. 2018. Т. 87. № 10. С. 950. [Tsivadze A.Yu., Aksyutin O.E., Ishkov A.G., Men’shchikov I.E., Fomkin A.A., Shkolin A.V., Khozina E.V., Grachev V.A. // Russ. Chem. Rev. 2018. V. 87. P. 950.]
Advanced Research Project Agency, U.S DOE 2012. See DOE MOVE program at https://arpa-e-foa.energy.gov/
Dubinin M.M. // Progress Surface Membrane Sci. 1975. V. 9. P. 1–70.
Грег С., Синг К. Адсорбция, удельная поверхность, пористость. М.: Мир. 1984.
Дубинин М.М. Углеродные адсорбенты и их применение в промышленности. М.: Наука. 1983. С. 100.
Толмачев А.М., Анучин К.М., Крюченкова Н.Г., Фомкин А.А. // Физикохимия поверхности и защита материалов. 2011. Т. 47. № 2. С. 124.
Прибылов А.А., Калашников С.М., Серпинский В.В. // Изв. АН СССР. Сер. хим. 1990. № 6. С. 1233.
Бакаев В.А. Изв. АН СССР. Сер. хим. 1971. № 2. С. 2648.
Fomkin A.A. // Adsorption. 2005. V. 11. P. 425.
Школин А.В., Фомкин А.А. // Коллоидный журнал. 2009. Т. 71. № 1. С. 116.
Власов А.И., Бакаев В.А., Дубинин М.М., Серпинский В.В. // Докл. АН СССР. 1981. Т. 260. № 4. С. 904.
Рид Р., Праусниц Д., Шервуд Т. Свойства газов и жидкостей. Л.: Химия. 1982.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов