Физикохимия поверхности и защита материалов, 2021, T. 57, № 1, стр. 25-32
Термодинамика адсорбции на нанопористых кремнеземах с привитым метилсилоксаном и смачиваемость
Т. М. Рощина 1, *, Н. К. Шония 1, **
1 Московский государственный университет имени М.В. Ломоносова, химический факультет
119991 Москва, Ленинские горы, 1, стр. 3, Россия
* E-mail: 2474747@mail.ru
** E-mail: natalyashonija@gmail.com
Поступила в редакцию 06.02.2020
После доработки 09.02.2020
Принята к публикации 14.02.2020
Аннотация
Методом газовой хроматографии определены термодинамические характеристики адсорбции разных классов органических соединений на нанопористых кремнеземах с химически привитым метилсилоксаном. Показано, что увеличение концентрации привитых групп от 1.5 до 1.7 нм–2 приводит к росту констант Генри и теплот адсорбции и, как правило, снижению стандартных энтропий адсорбции. В отношении аренов полярность образцов практически такая же, как и жидкой фазы OV‑1. Совокупность газохроматографических и статических данных по адсорбции паров с учетом значений краевых углов смачивания водой и гексадеканом для аналогичных монослоев, закрепленных на кремниевых пластинках, позволяет сделать вывод о том, что по степени лиофобизации поверхности метилсилоксановые слои существенно превосходят гексадецильные, но уступают полифторалкильным.
ВВЕДЕНИЕ
Лиофобизация поверхностей разной природы – технологический прием широко распространенный в различных областях промышленной, научной и медико-биологической деятельности, целью которого является придание требуемых свойств материалам, используемым в различных средах. Лиофобизация защищает материалы разного происхождения, от тканевых до металлических, от нежелательного смачивания, предотвращает их загрязнение и слеживание, уменьшает адгезию, резко снижает возможности прилипания и конденсации, придает им антикоррозионные и пылезащитные свойства. Потребность в супергидрофобных, гидрофобных и олеофобных материалах, наряду с развитием новейших методов биомиметики, стимулировала дальнейшее развитие химического модифицирования поверхностей твердых тел алкильными, полифторалкильными и полимерными покрытиями, которое позволяет проводить направленный синтез материалов с заданными свойствами разного применения, в том числе в качестве адсорбентов, катализаторов и носителей [1–5]. Для этих целей из всех неорганических материалов в качестве матрицы для модифицирования наиболее широко применяется механически прочный, термически стойкий оксид кремния SiO2, давно зарекомендовавший себя, во многом, как оптимальный и удобный объект химического способа изменения поверхностных свойств. Этому способствует разнообразие предлагаемых промышленностью типов SiO2, в том числе обладающих высокой химической и геометрической однородностью структуры, а также возможностью варьирования степени гидроксилирования − важнейшего фактора в процессе модифицирования [1, 2]. Одними из популярных модификаторов на протяжении многих лет являются полиметилсилоксаны − уникальные кремнийорганические полимеры, создающие либо неполярные, химически устойчивые и термостойкие покрытия с низкой поверхностной энергией [4–6], либо являющиеся важнейшими компонентами органо-неорганических гибридных материалов разнообразного применения, в том числе в нанотехнологиях, в качестве защитных, самоочищающихся и оптических покрытий, мембран, полупроводниковых и антистатических покрытий, стойких к УФ-облучению и с водоотталкивающими свойствами [7–9]. В последние годы получила развитие новая разновидность кремнийсодержащих материалов на основе химически модифицированных как органическими, так и неорганическими соединениями полисилоксанов, обладающих улучшенными свойствами [10, 11]. Современные направления в синтезе и использовании кремнийорганических сорбционных материалов подробно освещены в обзоре [12].
Среди полисилоксанов широко распространено применение полидиметилсилоксанов (ПДМС): от смазочных добавок в буровые растворы [13] и наполнителей в полимерных материалах [14] до добавок адсорбционного типа в электролит литий-ионных аккумуляторов [15], в микроэлектронике [16, 17] и полидиметилсилоксановой микрофлюидной технологии и ее биологических применениях [8, 18]. Хорошо известно использование ПДМС в качестве неподвижных фаз в газо-жидкостной и в высокоэффективной капиллярной газовой хроматографии, в частности OV-1 и OV-101, как для разделения органических соединений разных классов [19], так и для исследования термодинамических характеристик сорбции на этих неподвижных фазах [20, 21]. Прививкой OV-101 на триметилсилированные стеклянные шарики разработаны сорбенты для выделения и концентрирования органических соединений прямой сверхкритической флюидной экстракцией и газовой хроматографии, устойчивые к отмывке растворителем [22]. В работе [23] продемонстрирован простой и эффективный способ получения супергидрофобных самоочищающихся пленок модифицированием поверхности композитных частиц из CaCO3/SiO2 сильным перемешиванием и самосборкой ПДМС. Известные высокотехнологичные свойства композитов SiО2/ПДМС, такие как термостойкость и гидрофобность оказалось возможным улучшить дополнительным модифицированием систем оксидами металлов [24, 25].
Физико-химические и эксплуатационные свойства химически модифицированных материалов, очевидно, зависят от химического строения и структуры привитых молекул. Учитывая доминирующую роль поверхностных явлений во взаимодействии их с окружающей средой представляется необходимым на начальных этапах применение адсорбционных методов исследования подобных объектов, которые могут обеспечить прогнозы относительно таких важнейших свойств как гидрофобность и олеофобность, а также их взаимосвязь с различными характеристиками привитого слоя.
В работе методом газовой хроматографии определены термодинамические характеристики адсорбции набора органических соединений, включая насыщенные и ароматические углеводороды, на нанопористых кремнеземах с химически привитым метилсилоксаном. С целью оценки лиофобности образцов сопоставлены результаты, полученные методами адсорбции и смачивания для метилсилоксановых покрытий и хорошо изученных гидрофобизованных материалов с химически привитыми гексадецильными и перфторгексильными группами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сорбенты
Химически модифицированные кремнеземы (ХМК) с привитым метилсилоксаном получены модифицированием кремнеземного носителя − аэросилогеля (обозначение в тексте ASG, удельная поверхность sуд = 100 м2/г, эффективный радиус пор 20 нм) силаном ClSi(CH3)2[OSi(CH3)2]2Cl, который относят к производным олигометилсилоксана, по методике [5, 6]. Исследованы образцы OMS‑1 (концентрация привитых групп N = 1.5 нм–2, sуд = 95 м2/г) и OMS‑2 (N = 1.7 нм–2, sуд = 94 м2/г). Согласно данным по адсорбции азота и бензола модифицирование практически не сказывается на величине эффективного радиуса пор, поскольку толщина привитого метилсилоксанового слоя менее 1 нм [5]. Результаты сопоставлены с полученными ранее [26] для гидрофобных ХМК с привитыми гексадецильными группами (С16, модификатор ClSi(CH3)2(n‑C16H33), N = 2.8 нм–2, sуд = = 77 м2/г) и перфторгексильными группами (CF, модификатор ClSi(CH3)2(CH2)3(n‑C6F13), N = 2.1 нм–2, sуд = 79 м2/г), а также на жидкой фазе метилсилоксане OV‑1 состава [ОSi(CH3)2]n (10% на Gas‑Chrom Q) [27].
Методы
Концентрацию привитых групп определяли по результатам элементного анализа на углерод (прибор Perkin Elmer 2400 CHN Analyzer, Schwarzkopf Microanalytical Lab., Woodside, NY) по формуле, приведенной в [1]. Погрешность определения ≤0.7%.
Изотермы адсорбции азота измерены на сорбтометре ASAP-2020 (Micromeritics, Norcross, GA, USA) при 77 К, а изотермы адсорбции паров воды, гексана и бензола были получены весовым статическим методом (пружинные весы Мак-Бэна–Бакра [28]) при 298 К.
Газохроматографические (ГХ) исследования выполнены на хроматографе “Хром-5” с пламенно-ионизационным детектором и на хроматографе “Agilent HP-6890” с детектором по теплопроводности (катарометр) в одноколоночном режиме. В качестве газа-носителя использовали гелий. Мертвое время в случае пламенно-ионизационного детектора определяли по метану, а в случае катарометра по воздуху. Длина стеклянных колонок составляла 1–1.2 м, а внутренний диаметр 2–2.5 мм. Пробы веществ вводили, как правило, в виде разведенных в 2–30 раз паров с помощью шприца в количестве 0.1 мл.
К преимуществам применения ГХ относятся высокая чувствительность, возможность исследования проб в нг и даже пг количествах, когда взаимодействием адсорбат-адсорбат можно пренебречь. ГХ позволяет сравнительно быстро определить термодинамические характеристики адсорбции (ТХА) широкого набора тестовых молекул. Необходимым условием подтверждения возможности применения ГХ для определения термодинамических величин является отсутствие зависимости удерживаемых объемов Va, рассчитанных из измеряемых в ГХ опыте данных, от скорости газа-носителя [28, 29]. В работе это было подтверждено для всех образцов, и, например, Va гептана и бензола на кремнеземе с метилсилоксановым слоем сохраняли постоянное значение (в пределах 1–2%) при изменении скорости потока от 11 до 32 мл/мин (рис. 1). Эти данные позволили принять, что Va численно равны константам Генри адсорбционного равновесия KГ.
Рис. 1.
Зависимости удерживаемых объемов Va от скорости газа-носителя гелия F на OMS‑2 при 403 К. 1 – гептан, 2 – бензол, 3 – гексан, 4 – пентан.

Индексы удерживания Ковача I и константы Генри адсорбционного равновесия KГ рассчитывали из ГХ параметров по формулам, приведенным в [28, 29]. В качестве стандартных состояний вещества использовали: 1 мкмоль/мл в газовой фазе; 1 мкмоль/м2 в адсорбированном состоянии.
Начальные (область Генри) теплоты адсорбции q и стандартные энтропии адсорбции ΔS ° в приближении их независимости от температуры рассчитывали из температурных зависимостей KГ по уравнению [28, 29]:
Погрешность определения q и ΔS° составляла от 2 до 7%.
Вклад СН2-групп в величины lnKГ ($\ln {{K}_{{\text{Г}}}}_{{({\text{C}}{{{\text{H}}}_{2}})}}$) н-алканов рассчитывали по уравнению [29]:
где n – число атомов углерода в молекуле н‑алкана, а – величина, отвечающая вкладу двух атомов Н в lnКГ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Дисперсионные взаимодействия. Взаимодействие насыщенных углеводородов с материалами любой природы определяется преимущественно универсальными дисперсионными силами, что характеризуется ТХА этих молекул. На OMS‑2 теплоты адсорбции q н‑алканов с числом атомов углерода в молекуле от 5 до 11 чуть выше, чем на исходном носителе (рис. 2) Уменьшение плотности привитого слоя на OMS‑1 приводит к снижению q. Эти результаты служат достаточно надежным подтверждением высказанного в [5, 6] предположения о циклическом строении привитого метилсилоксанового слоя. Дело в том, что такие модификаторы, как, например, силан состава ClSi(CH3)2[OSi(CH3)2]2Cl, имеют возможность связываться двумя атомами кремния с поверхностью, что приводит к формированию “арочных” структур, состоящих из трех звеньев Si(CH3)2O и эффективно экранирующих поверхность носителя. Вместе с тем возможна организация “арочных” структур, состоящих из шести звеньев Si(CH3)2O, образованных двумя провзаимодействовавшими с поверхностью, а также между собой радикалами с образованием силоксановой связи. Существование большего числа крупных “арок” на OMS‑2 по сравнению с OMS‑1 и может служить причиной наблюдаемого изменения энергии адсорбции. Хотя состав неподвижной жидкой фазы OV‑1 такой же, как привитых метилсилоксанов, теплоты растворения в OV‑1 меньше (рис. 2). Этот эффект объясняется влиянием поверхности кремнеземного носителя на энергетические характеристики.
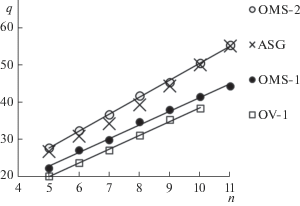
Очевидно, что величины важнейших ТХА, констант Генри KГ, определяются как энергетическими, так и энтропийными характеристиками. Из рис. 3 следует, что значения ΔS ° на OMS‑2 меньше, чем на исходном носителе. Именно этот факт доминирует в снижении KГ на OMS‑2 после модифицирования ASG (рис. 4). При этом уменьшение величин KГ на OMS‑1 по сравнению с ASG обусловлено энергетическим фактором. Сопоставление свойств привитых метилсилоксанов и других гидрофобизованных поверхностей показывает, что величины КГ являются промежуточными в этой группе ХМК, т.е. изменяются в направлении С16 > OMS‑2 > OMS‑1 > CF (рис. 4). Вклады СН2-групп в lnKГн‑алканов изменяются в том же направлении, что и константы Генри (табл. 1). Анализ данных, приведенных в [6], показывает, что величины адсорбции гексана, измеренные в статических условиях при 298 К, изменяются подобным образом (табл. 1).
Рис. 3.
Зависимости стандартных энтропий адсорбции ΔS ° (Дж/моль К) от числа атомов углерода n в молекулах н‑алканов.

Рис. 4.
Зависимости lnКГ от числа атомов углерода n в молекулах н‑алканов, а также бензола, толуола и этилбензола (арены отмечены (2)), при 403 К. Для аренов приведены значения lnКГ + 2.
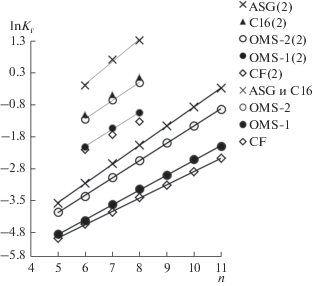
Таблица 1.
Вклады СН2-групп в величины констант Генри ($\ln {{K}_{{\text{Г}}}}_{{({\text{C}}{{{\text{H}}}_{2}})}}$), величины адсорбции а (мкмоль/м2) гексана и бензола при относительном давлении паров p/p0 = 0.2 и 298 К
| ASG | C16 | OMS‑2 | OMS‑1 | CF | |
|---|---|---|---|---|---|
| $\ln {{K}_{{\text{Г}}}}_{{({\text{C}}{{{\text{H}}}_{2}})}}$ при 403 К | 0.59 | 0.58 | 0.54 | 0.46 | 0.41 |
| $\ln {{K}_{{\text{Г}}}}_{{({\text{C}}{{{\text{H}}}_{2}})}}$ при 423 К | 0.50 | 0.50 | 0.47 | 0.41 | 0.37 |
| а (гексан) | 1.24 | 1.24 | 0.64 | 0.26 | 0.25 |
| а (бензол) | 3.18 | 0.91 | 0.51 | 0.38 | 0.09 |
В работе изучены термодинамические характеристики адсорбции адамантана (AД), транс‑декалина (Д) и декана (С10) – соединений с одинаковым числом атомов углерода в молекуле и близкой молярной массой. Подобно ТХА для линейных алканов, теплоты адсорбции AД и Д наибольшие, а энтропии адсорбции наименьшие на OMS‑2 (табл. 2). В отличие от алканов КГ AД на OMS‑2 может быть больше, чем на ASG (например, при 403 К 0.40 и 0.35 на OMS‑2 и ASG соответственно). Как следует из рис. 5, на образцах с метилсилоксановым слоем порядок выхода соединений следующий: первым из колонки выходит С10, затем Д и потом АД, причем КГ AД достигают значений, характерных для ундекана. Такие соотношения существенно отличаются от наблюдаемых на разновидностях кремнезема, где порядок выхода соединений: АД < Д < С10, и, тем более, на адсорбентах с плоской поверхностью, например, Карбопаке или WSe2, на которых отмечено весьма сильное снижение энергии взаимодействия Д и, особенно, компактной молекулы АД по сравнению с С10 [30].
Таблица 2.
Теплоты (q, кДж/моль) и стандартные энтропии (ΔS °, Дж/моль К) адсорбции
| Сорбат | ASG | OMS‑2 | OMS‑1 | |||
|---|---|---|---|---|---|---|
| Q | –ΔS ° | q | –ΔS ° | q | –ΔS ° | |
| Адамантан | 45 | 129 | 51 | 141 | 42 | 130 |
| транс-Декалин | 46 | 130 | 50 | 141 | – | – |
| Декан | 50 | 140 | 50 | 145 | 41 | 132 |
| Ацетонитрил | 56 | 148 | 47 | 143 | 43 | 140 |
| Бензол | 39 | 124 | 33 | 118 | 30 | 117 |
| Толуол | 46 | 134 | 39 | 126 | 36 | 127 |
| Этилбензол | 52 | 145 | 43 | 134 | 42 | 136 |
Рис. 5.
Зависимости lnКГ от обратной температуры для адамантана (АД), ундекана (С11), транс-декалина (Д) и декана (С10).

Более детальная информация о влиянии природы сорбента на порядок выхода каркасной (AД) и линейной (С10) молекул следует из селективности удерживания $K_{{\text{Г}}}^{{{\text{отн}}}}$ = KГ(АД)/KГ(С10), определенной в широком интервале температур. Именно подобные относительные характеристики, как и индексы Ковача I, используют при сопоставлении свойств твердых и жидких фаз для ГХ [30, 31]. Значения I на привитых метилсилоксанах практически не отличаются от полученных при растворении в жидкой фазе, в метилсилоксане OV-1, одной из самых популярных жидких фаз для ГХ (табл. 3), хотя $K_{{\text{Г}}}^{{{\text{отн}}}}$ несколько падают при переходе от OMS‑2 к OMS‑1, но остаются выше, чем на исходном носителе и, тем более, на Карбопаке (рис. 6). Следовательно, на кремнеземах со слоями метилсилоксана вероятнее всего имеет место не только адсорбция на внешней поверхности привитых групп, но и абсорбционный механизм удерживания, т.е. проникновение адсорбируемых молекул внутрь больших “арок”.
Таблица 3.
Индексы удерживания Ковача (I) при 403 К
| Сорбат | ASG | OMS‑2 | OMS‑1 | OV-1 |
|---|---|---|---|---|
| Адамантан | 969 | 1104 | 1094 | 1103 |
| транс-Декалин | 975 | 1064 | 1059 | 1060 |
| Бензол | 786 | 667 | 661 | 672 |
| Толуол | 911 | 778 | 778 | 777 |
| Этилбензол | 1012 | 877 | 885 | 867 |
| Диэтиловый эфир | 1174 | 762 | 785 | 495 |
| Этилацетат | 1321 | 914 | 945 | 600 |
| Ацетонитрил | 1110 | 835 | 854 | 571 |
Рис. 6.
Зависимости $\ln K_{{\text{Г}}}^{{{\text{отн}}}}$ ($K_{{\text{Г}}}^{{{\text{отн}}}}$ = КГ(АД)/КГ(С10)) от обратной температуры.

Специфические взаимодействия. Экранирование и замещение силанольных групп, которые сравнительно активно адсорбируют молекулы, имеющие π‑связи, приводит к обычному снижению q, но относительно небольшому изменению энтропийных характеристик аренов в результате модифицирования (табл. 2). Несмотря на малое различие в количестве привитых звеньев Si(CH3)2O на поверхности образцов с метилсилоксановым покрытием KГ углеводородов разного химического строения более чем в 2 раза больше на OMS‑2, чем на OMS‑1. Как для линейных алканов, так и аренов, величины KГ на метилсилоксанах являются промежуточными в группе гидрофобизованных поверхностей, т.е. изменяются в направлении С16 > OMS‑2 > OMS‑1 > CF (рис. 4). В целом ГХ данные неплохо согласуются с полученными при адсорбции бензола в статических условиях (табл. 1). Можно также отметить снижение константы С уравнения БЭТ по азоту от 107 на ASG до 21 на OMS‑2.
Как известно [29, 32], сопоставление температурных зависимостей относительных констант Генри $\ln K_{{\text{Г}}}^{{{\text{отн}}}}$ для молекул со сравнительно близкими размерами и поляризуемостями, включая такую пару, как бензол-гексан, позволяет охарактеризовать роль π‑связей в специфических межмолекулярных взаимодействиях. Показано, что в широкой области температур изменение концентрации привитых к поверхности метилсилоксанов мало влияет на $\ln K_{{\text{Г}}}^{{{\text{отн}}}}$ (рис. 7). Интересно, что $\ln K_{{\text{Г}}}^{{{\text{отн}}}}$ на привитых метилсилоксанах незначительно отличаются от наблюдаемых при растворении в метилсилоксане OV-1 (рис. 7). Учитывая, что OV-1 относится к неполярным жидким фазам, возможно, что арены в случае изученных ХМК взаимодействуют преимущественно со звеньями Si(CH3)2O, а роль остаточных силанолов в адсорбционном процесс невелика. В табл. 3 представлены индексы удерживания Ковача I на ряде исследованных образцов, указывающие, что согласно традиционному для ГХ параметру оценки полярности материалов роль специфических взаимодействий аренов заметно падает в результате модифицирования, но мало зависит от концентрации привитых групп. При этом в пределах 2% на OMS‑1 и OMS‑2 значения I аренов примерно такие же, как на OV‑1. Следовательно, кремнеземы с метилсилоксаном можно использовать как сорбенты в аналитической ГХ углеводородов. Иная картина наблюдается в случае сорбции ацетонитрила, диэтилового эфира и этилацетата, т.е. молекул, способных к более сильным специфическим взаимодействиям. Значения I на метилсилоксановых слоях много выше, чем на OV-1 (табл. 3). В этом случае несомненно проявляется взаимодействие ацетонитрила и эфиров с непрореагировавшими с модификатором и видимо доступными остаточными силанольными группами на поверхности ХМК. Однако значения I на метилсилоксановых слоях для таких молекул различаются не более, чем на 4%. Кроме этого степень уменьшения KГ при переходе от OMS‑2 к OMS‑1 мало зависит от природы молекул, что иллюстрирует рис. 8, где приведены температурные зависимости KГ для ацетонитрила и толуола. Следовательно, можно предположить, что концентрация остаточных силанольных групп на OMS‑2 близка к OMS‑1.
Рис. 7.
Зависимости $\ln K_{{\text{Г}}}^{{{\text{отн}}}}$ ($K_{{\text{Г}}}^{{{\text{отн}}}}$ = КГ(бензол)/КГ(гексан)) от обратной температуры.

Рис. 8.
Зависимости lnКГ от обратной температуры для ацетонитрила и толуола (отмечены (Т), линии пунктирные).

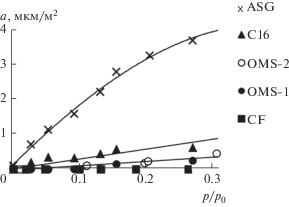
Вода относится к соединениям, которые чрезвычайно чувствительны к наличию гидрофильных центров на поверхности, в нашем случае – силанольных групп [1]. В [6] показано, что модифицирование метилсилоксанами снижает адсорбцию воды в 45 раз при p/p0 → 1 по сравнению с исходным носителем. При этом длительная, в течение 4-х месяцев экспозиция в парах воды, увеличивает адсорбцию воды на OMS‑2 от 4 мкмоль/м2 всего на 3 мкмоль/м2, оставаясь ниже предельного значения емкости условного идеализированного монослоя.
Согласно рис. 9, где приведены начальные изотермы адсорбции воды, покрытия со звеньями Si(CH3)2O независимо от плотности прививки хорошо экранируют гидрофильные группы носителя. Одинаковый ход изотерм адсорбции воды на метилсилоксановых слоях подтверждает предположение о близкой концентраций остаточных силанольных групп на OMS‑2 и OMS‑1. По водозащитным свойствам метилсилоксаны не уступают образцу С16, хотя перфторгексильные слои эффективнее в этом отношении.
Необходимо подчеркнуть, что, в противоположность сведениям о детальном исследовании кремнеземов с перфторгексильным покрытием адсорбционными и ИК-спектроскопическими методами [33, 34], уменьшение концентрации метилсилоксановых групп и, следовательно, расхода модификатора, способствует снижению адсорбционной активности материала и не влияет на его высокую гидрофобность.
Известно, что основным методом исследования лиофобности покрытий является определение краевых углов смачивания на плоских поверхностях. Соответствующие результаты, полученные в [35, 36] на химически модифицированных кремниевых пластинках, представлены в табл. 4. Привитые метилсилоксановые слои обладают редкостно высокой гидрофобностью. По степени олеофобизации поверхности метилсилоксановые слои существенно превосходят гексадецильные, но уступают полифторалкильным. Однако, низкий гистерезис смачивания на метилсилоксанах, не более 1°, в противоположность перфторгексильным покрытиям, где гистерезис смачивания достигает 20о, предполагает возможность приготовления весьма эффективных, однородных защитных слоев с помощью исследованных модификаторов [4]. Необходимо также отметить высокую термостойкость на воздухе OMS слоев: в случае OMS – нет потери массы до 623–653 К, а С16 и СF начинают разлагаться при 443–463К [5]. В целом учитывая высокую стоимость фторсодержащих реагентов и более жесткие требования к условиям синтеза, остается актуальным применение метилсилоксановых модификаторов для создания высокоэффективных покрытий, в частности, водо- и грязезащитных.
ЗАКЛЮЧЕНИЕ
Результаты совместного рассмотрения данных ГХ и адсорбционно-статических исследований кремнеземов с привитыми метилсилоксановыми, алкильными и полифторалкильными группами согласуются с литературными данными по определению краевых углов смачивания. Показано, что метод ГХ, который позволяет получить более детальное представление о наличии активных адсорбционных центров на модифицированной поверхности кремнеземов, а также о влиянии строения привитой группы на закономерности адсорбционных процессов, можно использовать в качестве несложного и доступного метода оценки лиофобности поверхности пористых тел.
В целом, учитывая высокую термостабильность, простоту получения и контроля концентрации привитых групп, метилсилоксаны целесообразно рекомендовать для приготовления сорбентов различного назначения и высокоэффективных защитных покрытий.
Работа выполнена в соответствии с Планом Научного совета РАН по физической химии, регистрационные номера темы 17-03-460–18; 19-03-460–15.
Список литературы
Химия привитых поверхностных соединений / Под ред. Лисичкина Г.В. М.: Физматлит, 2003. 592 с.
Зайцев В.Н. Комплексообразующие кремнеземы: синтез, строение привитого слоя и химия поверхности. Харьков: “Фолио”, 1997. 228 с.
Latthe S.S., Gurav A.B., Maruti C.S., Vhatkar R.S. // JSEMAT. 2012. № 2. P. 76.
Fadeev A.Y. // Encyclopedia of Surface and Colloid Science / Ed. by Somasundaran P. N. Y.: Taylor & Francis, 2006. P. 2854.
Kazakevich Y.V., Fadeev A.Y. // Langmuir. 2002. V. 18. P. 2665.
Шония Н.К., Рощина Т.М., Никольская А.Б. и др. // Журн. физ. химии. 2010. Т. 84. № 10. С. 2131.
Kuroda K., Shimojima A., Kawahara K. et al. // Chem. Mater. 2014. V. 26. № 1. P. 211.
Sia K., Whitesides G.M. // Electrophoresis. 2003. № 24(21). P. 3563.
Yoshikawa M., Wakabayashi R., Tamaia M., Kuroda K. // New J. Chem. 2014. V. 38. P. 5362.
Лакиза Н.В., Неудачина Л.К., Ятлук Ю.Г. и др. // Аналитика и контроль. 2005. Т. 9. № 4. С. 391.
Неудачина Л.К., Голуб А.Я., Ятлук Ю.Г. и др. // Неорганические материалы. 2011. Т. 47. № 4. С. 492.
Пожидаев Ю.Н. // Изв. вузов. Прикл. химия и биотехнология. Иркутский ГУ. 2014. № 4(9). С. 7.
Петров Н.А., Давыдова И.Н. // Нефтегазовое дело: электронный научный журнал. 2013. №5. С. 54.
Наполнители для полимерных композиционных материалов / Пер. с англ. / Под. ред. Бабаевского П.Г. М.: Химия, 1981. 736 с.
Куксенко С.П., Тарасенко Ю.А., Картель Н.Т. // Материалы XIII Всероссийского симпозиума с участием иностранных ученых “Актуальные проблемы адсорбции, пористости и адсорбционной селективности”. Москва-Клязьма. 20–24 апреля 2009. С. 147.
Sizov S., Anisimov D.S., AginaE.V. et al. // Langmuir. 2014. V. 30. P. 1532.
Pan T., McDonald S.J., Kai E.M. et al. // J. Micromech. Microeng. 2005. V. 15. P. 1021.
Hill S., Qian W., Chen W., Fu J. // Biomicrofluidics. 2016. V. 10. P. 054114.
Высокоэффективная газовая хроматография: Пер. с англ. / Под ред. Хайвера К. М.: Мир, 1993. 288 с.
Кудашева Н.В., Яшкин С.Н. // Сорбционные и хроматографические процессы. 2009. Т. 9. Вып. 5. С. 726.
Жабина А.А., Красных Е.Л., Леванова С.В. // Журн. физ. химии. 2014. Т. 88. № 9. С. 1425.
Kuznetsov M.P., Glazkov I.N., Revel’skiiI A., Luzyanin B.P. // J. Anal. Chem. 2006. V. 61. № 12. P. 1144.
Yang J., Wen P.Pi.X., Zheng D. et al. // Applied Surface Science. 2009. V. 255. № 6. P. 3507.
Сулим И.Я., Борисенко Н.В. // Химия, физика и технология поверхности. 2007. Вып. 13. С. 159.
Богатырев В.М., Галабурда М.В., Борисенко Н.В. // Поверхность. 2012. Вып. 4(19). С. 239.
Gurevich. K.B., Roshchina T.M., Shonia N.K. et al. // J. Coll. Interface Sci. 2002. V. 254. № 1. P. 39.
Рощина Т.М., Шепелева М.С. // Известия АН. Сер. Химия. 2005. № 1. С. 140.
Экспериментальные методы в адсорбции и молекулярной хроматографии / Под ред. Никитина Ю.С. и Петровой Р.С. М.: Изд. Моск. унив., 1990. 318 с.
Киселев А.В. Межмолекулярные взаимодействия в адсорбции и хроматографии. М.: Высш. школа, 1986. 360 с.
Рощина Т.М., Шония Н.К. // Сборник материалов Всероссийского интернет-симпозиума с международным участием “Физико-химические проблемы адсорбции, структуры и химии поверхности нанопористых материалов”. М.: ФГБУН ИФХЭ РАН, 2019. С. 109.
Руководство по газовой хроматографии / Под ред. Лейбница Э., Штруппе Х.Г. М.: Мир, 1988. Т. 2. 510 с.
Рощина Т.М., Шония Н.К., Никольская А.Б. и др. // Физикохимия поверхности и защита материалов. 2009. Т. 45. № 2. С. 165.
Рощина Т.М., Шония Н.К., Таякина О.Я. и др. // Журн. физ. химии. 2012. Т. 86. № 3. С. 508.
Рощина Т.М., Шония Н.К., Таякина О.Я. и др. // Журн. физ. химии. 2013. Т. 87. № 8. С. 1371.
Никольская А.Б., Лагутова М.С., Шония Н.К. и др. // Тез. докл. III Международной конференции по коллоидной химии и физико-химической механике. Москва. 2008. С03.
Рощина Т.М., Шония Н.К., Зубарева Н.А., Фадеев А.Ю. // Журн. физ. химии. 2003. Т. 77. № 9. С. 1650.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов