Физикохимия поверхности и защита материалов, 2021, T. 57, № 2, стр. 115-140
Закономерности сорбции ионов хрома(VI) магнетитом (обзор)
О. Д. Линников *
ФГБУН Институт химии твердого тела УрО РАН
Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: linnikov@mail.ru
Поступила в редакцию 08.09.2020
После доработки 15.09.2020
Принята к публикации 22.09.2020
Аннотация
Обзор посвящен сорбционным свойствам магнетита в отношении ионов шестивалентного хрома и возможности его использования в качестве сорбента для удаления этих токсичных ионов из загрязненных водных растворов. Рассмотрено также поведение наночастиц магнетита в водных растворах. Показано, что при сорбции ионов хрома(VI) магнетитом одновременно протекают два процесса: обычная адсорбция и хемосорбция (окислительно-восстановительная реакция между ионами шестивалентного хрома и магнетитом). Последняя сопровождается окислением железа(II) в магнетите до железа(III) и восстановлением ионов хрома(VI) до хрома(III) с образованием в поверхностном слое магнетита (или на его поверхности) маггемита и ряда других соединений, в том числе смешанных соединений хрома(III) с железом. Показано, что кинетика окислительно-восстановительного процесса между хромом(VI) и магнетитом описывается уравнением реакции первого порядка относительно концентрации ионов хрома(VI) в растворе. В результате протекания хемосорбции, в отличие от обычных сорбентов, происходит необратимое связывание хрома(VI) магнетитом, что исключает повторное попадание его ионов в окружающую среду. При этом сорбционная емкость магнетита, по мере насыщения его хромом, необратимо падает. Кроме того, сорбционная емкость магнетита по отношению к ионам хрома(VI) также снижается с ростом рН очищаемого раствора, и при рН > 11 она практически равна нулю.
ВВЕДЕНИЕ
Очистка природных и сточных вод от ионов тяжелых металлов представляет собой важную экологическую задачу в виду их высокой токсичности [1, 2]. Одними из наиболее опасных загрязнителей окружающей среды являются ионы шестивалентного хрома [3–5], которые попадают туда главным образом со стоками промышленных предприятий. Так, шестивалентный хром применяется при производстве нержавеющих сталей, текстильных красок и консервантов для дерева. Соли хрома широко используются в гальванике при хромировании, а также в кожевенной промышленности и ряде других производств. При этом соединения шестивалентного хрома легко проникают внутрь клеток живых организмов. У человека они являются одной из причин возникновения рака легких и желудка. Они могут разрушать ДНК, вызывать дермонтиты, заболевания почек, повреждать печень и нервные ткани, а также быть причиной многих других болезней [1–5]. В связи с этим в Европейском союзе директивой RoHS введено ограничение на использование соединений шестивалентного хрома в промышленности, а в России максимально допустимая концентрация ионов хрома(VI) в сточных водах, сбрасываемых в окружающую среду, ограничена значением 0.02 мг/л.
В настоящее время существует целый ряд методов удаления ионов хрома(VI) и других тяжелых металлов из загрязненных водных растворов [6–10]. Однако многие из них связаны с применением различных химических реагентов. Это приводит к изменению солесодержания и ионного состава очищаемых вод, что затрудняет их последующее использование в коммунальном хозяйстве и промышленности. Поэтому поиск новых методов очистки природных и сточных вод от ионов хрома(VI) и различных других загрязнителей продолжается.
Одним из очень перспективных способов удаления хрома(VI) из растворов является сорбционный метод. Его главное достоинство заключается в том, что он практически не вносит в очищаемый раствор новых посторонних ионов и веществ [10–12]. Это позволяет применять данный метод для регенерации ряда технологических растворов (например, в гальванике), а также использовать его для очистки загрязненных природных вод с целью их последующего использования в коммунальном хозяйстве.
Сорбционная емкость адсорбентов в значительной степени определяется их удельной поверхностью, которая возрастает при уменьшении размера частиц сорбента. Однако при этом, соответственно, усложняются процессы отделения сорбента от раствора традиционными методами отстаивания и фильтрования. Поэтому важной задачей является получение сорбентов, которые: 1) обладают хорошими сорбционными свойствами и 2) легко отделяются от раствора. Эта задача может быть решена, если в качестве сорбента использовать порошок из маленьких ферромагнитных частиц, которые после сорбции загрязнителей могут быть отделены от раствора под действием градиентного магнитного поля. Одним из примеров такого ферромагнитного сорбента является магнетит (Fe3O4).
Следует отметить, что в последние годы в литературе появилось большое количество статей, посвященных исследованию свойств магнетита и других окислов железа как сорбентов для очистки сточных и природных вод от различных загрязнителей [13–20]. Но в данной работе основное внимание будет уделено именно магнетиту и возможности его применения в качестве сорбента для удаления шестивалентного хрома из загрязненных природных и сточных вод. Перспективность применения магнетита в качестве сорбента обусловлена еще и тем, что он является недорогим материалом, который может быть получен, в частности, из отработанных травильных растворов, являющихся сточными водами целого ряда металлургических и метизных предприятий [21]. Заметим еще, что к настоящему времени накоплено достаточно большое количество экспериментальных данных по сорбции ионов шестивалентного хрома из водных растворов магнетитом, по поведению частиц магнетита в водных растворах, и данная работа является попыткой их обобщения. Особое внимание в ней уделено анализу механизма и кинетике сорбции хрома(VI) магнетитом.
СОСТОЯНИЕ ИОНОВ ХРОМА(VI) В ВОДНЫХ РАСТВОРАХ
Шестивалентный хром(VI) существует в растворе в основном в виде ионов хромовой кислоты H2CrO4. Причем в зависимости от рН раствора формы состояния ионов меняются. Равновесия между различными формами ионов хрома(VI) описываются уравнениями [8, 11, 12, 22–24]:
При рН < 1 в растворе преобладают молекулы хромовой кислоты H2CrO4, в диапазоне рН от 1 до 6.5 – ионы ${\text{HCrO}}_{4}^{ - }$, а при рН > 6.5 – уже ионы ${\text{CrO}}_{4}^{{2 - }}$. При повышении концентрации хрома(VI) свыше 1 г/л в растворе доминируют димеры ${\text{C}}{{{\text{r}}}_{2}}{\text{O}}_{7}^{{2--}}$:
Однако для таких высоких концентраций ионов хрома(VI) в растворе использовать сорбционный метод для их удаления экономически нецелесообразно из-за возрастающей стоимости очистки.
НЕКОТОРЫЕ ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА МАГНЕТИТА. ПОВЕДЕНИЕ ЕГО НАНОЧАСТИЦ В ВОДНЫХ РАСТВОРАХ
Магнетит (Fe3O4) представляет собой двойной оксид железа FeO · Fe2O3. Его главной отличительной особенностью от других оксидов железа является то, что атомы железа находятся в нем одновременно в двух степенях окисления: +2 и +3. Эта особенность придает данному соединению уникальные свойства и, в частности, высокую намагниченность. Кроме того, магнетит обладает хорошей химической и термической стойкостью. Трансформация магнетита в другие оксиды железа, маггемит (γ-Fe2O3) и гематит (α-Fe2O3), начинается только при его нагреве до температуры выше 200°С:
Магнетит устойчив в щелочной среде и плохо растворим в кислотах [25]. Это позволяет рассматривать его в качестве перспективного сорбента, пригодного для использования в растворах различного солевого состава, разной кислотности и щелочности.
Магнетит может быть синтезирован при смешении растворов солей двухвалентного и трехвалентного железа с последующим подщелачиванием раствора [13–15, 20, 23]:
Этот способ является самым распространенным и простым. Существуют и другие методы получения магнетита [21, 26–29]. Например, магнетит может быть синтезирован при осаждении щелочью двухвалентного железа с последующим нагреванием и аэрацией образовавшейся суспензии [21, 29, 30]. Суммарное уравнение совокупности происходящих при этом химических реакций выглядит следующим образом:
Данный способ позволяет получать магнетит из отработанных травильных растворов металлургических и метизных предприятий [21], что снижает стоимость его производства как сорбента. При этом, как и в большинстве других методов синтеза магнетита, образуются частицы нанометрового размера [31, 32].
Средний размер частиц в получаемых порошках магнетита может быть определен микроскопически, рассчитан исходя из их удельной поверхности (в предположении сферической формы частиц), определенной методом БЭТ, а также по области когерентного рассеяния при рентгенофазовом анализе. При этом наблюдается удовлетворительное совпадение всех полученных значений между собой. Это указывает на низкую пористость синтезированных частиц магнетита и отсутствие среди них крупных пористых агломератов [31, 32].
При помещении нанопорошка магнетита в водный раствор его частицы формируют довольно крупные агрегаты и приобретают электрический заряд, величина и знак которого зависит от рН и солевого состава раствора [14, 28, 32–37]. Так, согласно [32], порошок наномагнетита с размером частиц около 26 нм в водном растворе сульфата натрия образует устойчивые агрегаты со средним размером около 23 мкм (рис. 1а). При воздействии ультразвука эти агрегаты частично разрушаются, и их средний размер падает до 2.68 мкм, а удельная поверхность, рассчитанная по данным седиментационного метода анализа, увеличивается почти на порядок (рис. 1б). Но полного диспергирования агрегатов до исходного состояния не происходит [32].
Рис. 1.
Влияние ультразвука на гранулометрический состав агрегатов из наночастиц магнетита в растворе Na2SO4 (400 мг/л) [32]: (а) гранулометрический состав агрегатов перед обработкой суспензии ультразвуком; (б) то же самое после обработки ультразвуком. Q – массовая доля агрегатов диаметра (размера) d; dav – средний диаметр агрегатов и Sуд – их удельная площадь поверхности.

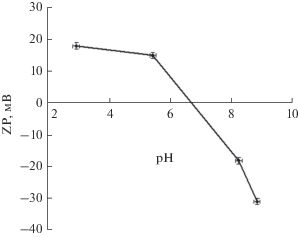
Измерение дзета-потенциала показало, что точка нулевого заряда частиц магнетита, в зависимости от состава раствора, его температуры и возраста магнетита, лежит в диапазоне рН 2–8 (чаще всего при рН 6–7) [25, 28, 33–37]. Так, в работе [28] были определены дзета-потенциал и функция распределения по размеру наночастиц магнетита со средним размером 84 нм, диспергированных ультразвуком в дистиллированной воде при разных значениях рН раствора. Полученные зависимости приведены на рис. 2 и 3.
Рис. 3.
Зависимость функции распределения (V) по размерам агрегатов из наночастиц магнетита в дистиллированной воде от ее рН [28].

Как следует из рис. 2, в нейтральной (при рН ≈ 7) и щелочной (рН > 7–8) средах частицы магнетита имеют отрицательный заряд, что является типичным для оксидов металлов [38]. В кислом растворе (при рН < 7) заряд частиц магнетита становится положительным [28]. При этом наблюдаемое изменение заряда частиц магнетита (при изменении рН раствора) оказывает некоторое влияние на вид функции распределения их по размеру, показанной на рис. 3. Видно, что она имеет два максимумами: один в области 1 мкм и второй при 5 мкм соответственно [28]. Изменение рН раствора меняет величину этих пиков. Однако положение их почти не изменяется. Все это свидетельствует о том, что в суспензии магнетита силы взаимного магнитного притяжения между частицами преобладают над силами электростатического отталкивания.
Вследствие образования довольно крупных агрегатов из наночастиц магнетита, их седиментация в водном растворе протекает довольно быстро. При этом величина рН раствора также оказывает на нее некоторое влияние [28]. Как видно из рис. 4, светопропускание суспензии нанопорошка магнетита в дистиллированной воде начинает возрастать буквально через несколько секунд после прекращения перемешивания раствора, что свидетельствует о начале осаждения порошка магнетита. При понижении рН раствора кривые роста светопропускания смещаются влево и вверх, что указывает на возрастание скорости седиментации агрегатов из наночастиц магнетита (рис. 4).
Рис. 4.
Изменение светопропускания дистиллированной воды при седиментации в ней порошка наномагнетита в зависимости от рН раствора [28].
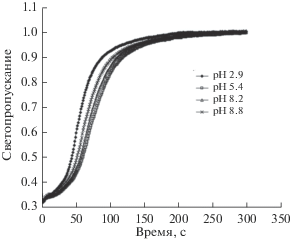
Наблюдаемый эффект не совсем понятен, так как образование наиболее крупных агрегатов из наночастиц магнетита следует ожидать при рН около 6.5, что соответствует точке нулевого заряда поверхности магнетита (см. рис. 2). При этом значении рН между частицами магнетита отсутствуют силы электростатического отталкивания и действуют только силы взаимного магнитного притяжения. Поэтому должны образовываться наиболее крупные агрегаты. Следовательно, скорость седиментации порошка магнетита при этом должна быть самой высокой. Однако на практике наблюдается другой эффект: с ростом рН скорость седиментации несколько замедляется и наоборот ускоряется в кислом растворе (рис. 4). Возможно, все это связано с тем, что у данного образца магнетита точка нулевого заряда сдвинута в кислую область (рН < 6).
Потенциометрическое титрование суспензии магнетита раствором едкого натра свидетельствует о его способности адсорбировать на своей поверхности гидроксил-ионы (рис. 5) [31].
Рис. 5.
Влияние магнетита на изменение рН раствора сульфата натрия (400 мг/л) при добавлении в него раствора NaOH [31]. VNaOH – объем добавленного 0.1 N раствора NaOH.

Так из рис. 5 видно, что суспензия магнетита, в отличие от чистого раствора сульфата натрия, ведет себя как буферный раствор, препятствуя повышению рН раствора при добавлении в него щелочи, что указывает на адсорбцию магнетитом ионов ОН–. Ионы водорода адсорбируются поверхностью магнетита, по-видимому, в меньших количествах. Об этом свидетельствуют данные рис. 2. Из представленной там зависимости видно, что с уменьшением рН раствора дзета-потенциал частиц магнетита становится положительным, возрастает и постепенно приближается к плато при значении около +20 мВ, что указывает на насыщение поверхности магнетита ионами H+. С ростом же рН раствора наблюдается другая картина: заряд частиц магнетита становится отрицательным и по абсолютной величине продолжает возрастать, что свидетельствует о способности поверхности магнетита и дальше поглощать ионы OH–. Это хорошо согласуется с кривой потенциометрического титрования суспензии магнетита щелочью на рис. 5. Видно, что там выход на плато еще не достигнут. Зависимости изменения дзета-потенциала частиц магнетита от рН раствора, аналогичные рис. 2, наблюдались также в работах [24, 33]. Там тоже при рН около 4 кривые дзета-потенциала приближались к плато при значении около +20 мВ, а при повышении рН свыше 6.5 заряд частиц магнетита становился отрицательным и продолжал падать. Схожая с рис. 2 кривая изменения дзета-потенциала частиц магнетита от рН раствора получена в [34]. Однако там, в отличие от [28, 33], при рН 8.5–9.5 удалось достичь плато для дзета-потенциала примерно при –140 мВ. С повышением температуры раствора дзета-потенциал частиц магнетита менялся: при рН < 6 он возрастал до +50–+90 мВ, а в щелочной области смещался до примерно –100 мВ [34].
СОРБЦИЯ ИОНОВ ХРОМА(VI) МАГНЕТИТОМ
После добавления порошка магнетита к водному раствору, содержащему ионы шестивалентного хрома, концентрация последних в растворе снижается. Поэтому наблюдаемое явление можно объяснить только процессом сорбции ионов хрома(VI) на поверхности частиц магнетита. Ниже мы рассмотрим влияние различных факторов на этот процесс, а также возможные механизмы его протекания. Отметим, что по своей природе сорбция может быть обратимой и необратимой. В первом случае она обусловлена простой физической (или ионообменной) адсорбцией, при которой в растворе между сорбентом и сорбатом устанавливается динамическое равновесие, и сорбент всегда может быть регенерирован до своего исходного состояния. Во втором – сорбция обусловлена хемосорбией, т.е. протеканием необратимой химической реакции между сорбатом и сорбентом, приводящей к образованию нового химического соединения с участием сорбата и сорбента. При этом для регенерации сорбента необходимо удалить (химически или механически) его поверхностный слой с этим образовавшимся новым химическим соединением.
Влияние различных факторов на сорбцию ионов хрома(VI) магнетитом
Сорбция ионов шестивалентного хрома порошками магнетита, синтезированными различными методами, была изучена в целом ряде работ [15, 16, 19, 20, 24, 25, 28, 31, 32, 36, 37, 39–42]. И это далеко не полный их перечень. Мы здесь привели работы, в которых, на наш взгляд, были получены наиболее существенные результаты по данному вопросу.
На величину сорбции сильное влияние оказывает кислотность раствора. Так, согласно [36], с повышением рН раствора эффективность сорбции хрома(VI) магнетитом снижается. Лучше всего ионы шестивалентного хрома сорбируются магнетитом при низких значениях рН. Однако при рН < 3 зависимость выходит на плато. При повышении же рН раствора до значения выше 9 эффективность сорбции хрома(VI) магнетитом линейно падает до очень низких значений [36].
Линейное снижение эффективности сорбции ионов хрома(VI) магнетитом при повышении рН от 2 до 11 обнаружено также в работе [39]. Зависимость эффективности сорбции шестивалентного хрома магнетитом, схожая с данными [36], получена в [40]. Выход на плато там также происходит при рН < 3, но при повышении рН раствора понижение эффективности сорбции ионов хрома(VI) магнетитом происходит не линейно, а по зависимости, близкой к гиперболе. Аналогичная зависимость снижения эффективности сорбции хрома(VI) магнетитом с повышением рН раствора установлена также в работе [41], где при рН > 11 величина сорбции падает практически до нуля. Интересно отметить, что при сорбции ионов шестивалентного хрома маггемитом наблюдается такое же почти линейное снижение эффективности сорбции с повышением рН раствора и с выходом на плато при рН < 3 [18].
В работе [32] было исследовано влияние структуры и размера частиц магнетита, полученного разными способами, на сорбцию им ионов хрома(VI). Физико-химические характеристики синтезированных порошков магнетита приведены в табл. 1.
Таблица 1.
Физико-химические свойства синтезированных порошков магнетита (М – намагниченность, dс – средний диаметр частиц) [32]
| № образца | Метод синтеза |
Структура | М, А м2/кг |
Sуд (по БЭТ), м2/г |
dс (БЭТ/рентген), нм |
|---|---|---|---|---|---|
| 1 | Газофазный | Орторомбическая | 81 | 44.3 | 26/22 |
| 2 | Газофазный | Орторомбическая | 70 | 71.2 | 16/21 |
| 3 | Химическое осаждение из водного раствора | Тетрагональная | 82 | 21.9 | 53/32 |
| 4 | Газофазный | Тетрагональная | 84 | 21.4 | 54/54 |
| 5 | Лазерное распыление | Кубическая | 76 | 68.8 | 17/не опред. |
| 6 | Лазерное распыление | Кубическая | 74 | 49.9 | 23/не опред. |
Сорбцию хрома(VI) изучали при периодическом перемешивании раствора с магнетитом в течение 7 суток [32]. Результаты показаны на рис. 6. Для объективного сравнения сорбционной способности синтезированных порошков магнетита по отношению к ионам шестивалентного хрома (с учетом их разной удельной поверхности), полученные экспериментальные данные были представлены в координатах: остаточная концентрация ионов хрома(VI) в растворе – общая поверхность порошка магнетита, добавленного в раствор [32].
Рис. 6.
Изменение концентрации ионов хрома(VI) в растворе после сорбции их магнетитом при температуре 25 ± 2°С в зависимости от общей площади поверхности порошков магнетита, добавленных в раствор. Начальная концентрация ионов хрома(VI) в растворе – 50 мг/л, S – общая площадь поверхности частиц магнетита, помещенных в модельный раствор, C – концентрация ионов шестивалентного хрома в растворе [32].

Из рис. 6 следует, что все экспериментальные точки для разных порошков магнетита могут быть аппроксимированы двумя прямыми. На нижнюю прямую ложатся экспериментальные данные для нанопорошков магнетита, которые были синтезированы методом газофазного синтеза (образцы 1, 2 и 4) и путем химического осаждения из водного раствора (образец 3), а на верхнюю – точки для нанопорошков магнетита, полученных методом лазерного распыления (образцы 5 и 6) [32]. Видно, что последние порошки обладают более низкой сорбционной способностью. Однако для всех синтезированных порошков магнетита, независимо от способа их получения, наблюдается отсутствие влияния структуры и размера частиц на их сорбционную эффективность. Причиной же более низкой сорбционной эффективности образцов 5 и 6 оказалось отклонение их состава от стехиометрии. Соответствующие измерения и расчеты показали, что образец 5 соответствовал составу Fe2.8O4, а порошок 6 – Fe2.82O4 [32]. По-видимому, столь небольшое отклонение от стехиометрии оказывает значительное влияние на сорбционную способность магнетита по отношению к ионам шестивалентного хрома. Однако при повышении температуры раствора отличия в сорбционной эффективности порошков магнетита практически исчезают, и все экспериментальные точки аппроксимируются одной прямой (рис. 7) [32]. При этом наблюдается значительное снижение остаточной концентрации ионов хрома(VI) в растворе (сравните рис. 6 и 7), что свидетельствует о повышении эффективности сорбции с ростом температуры.
Рис. 7.
Остаточное содержание ионов хрома(VI) в растворе при их сорбции магнетитом при температурах 60–80°С в зависимости от общей площади поверхности порошков магнетита, добавленных в раствор. Время выдержки растворов с магнетитом – 24 ч [32].

Более наглядно влияние температуры на эффективность сорбции хрома(VI) магнетитом показано на рис. 8.
Рис. 8.
Влияние температуры на остаточное содержание ионов хрома(VI) в растворе при их сорбции магнетитом в зависимости от массы (m) порошка магнетита, помещенного в раствор. Время выдержки растворов с магнетитом – 24 ч [32].
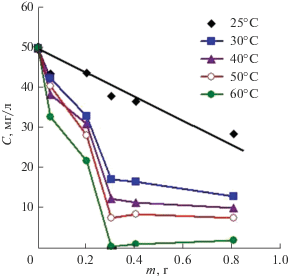
Как видно, с повышением температуры раствора остаточная концентрация ионов хрома(VI) в нем последовательно снижается, приближаясь к нулю при 60°С, что свидетельствует о росте эффективности сорбции. Аналогичный результат получен в работах [37, 41].
Как было показано выше, в водном растворе наночастицы магнетита образуют агрегаты микронных размеров. При этом возможно взаимное перекрывание их поверхностей и, соответственно, уменьшение действующей поверхности, доступной для сорбции. Однако экспериментальная проверка этого предположения показала, что это не происходит [32]. Так, на рис. 9 представлены данные по сорбции шестивалентного хрома суспензией магнетита до и после обработки ее ультразвуком. Видно, что воздействие на суспензию ультразвука, в результате которого расчетная удельная поверхность образовавшихся агрегатов из наночастиц магнетита возрастала почти на порядок (см. рис. 1), не приводило к последующему снижению остаточной концентрации ионов хрома(VI) в растворе. Это указывает на то, что ультразвук не изменял фактическую, доступную для сорбции, поверхность частиц магнетита. Об этом также косвенно свидетельствуют и данные на рис. 6, где наблюдается хорошая корреляция между остаточной концентрацией хрома(VI) в растворе и общей площадью поверхности введенных в раствор порошков магнетита независимо от размера их частиц. Следовательно, несмотря на агрегацию наночастиц магнетита в растворе, вся их поверхность доступна для сорбции.
Причиной снижения эффективности удаления ионов шестивалентного хрома магнетитом с повышением рН раствора является, по мнению большинства исследователей, электростатическое взаимодействие между положительно заряженной поверхностью частиц магнетита (при рН < 6–7) и отрицательно заряженными ионами хрома(VI), которые в широком диапазоне рН существуют в основном в виде ионов ${\text{HCrO}}_{4}^{--}$ и ${\text{CrO}}_{4}^{{2--}}.$ При высоких значениях рН раствора заряд частиц магнетита меняется на отрицательный и, соответственно, поглощение хрома(VI) магнетитом резко падает (одноименно заряженные частицы, как известно, отталкиваются). Однако, на наш взгляд, это объяснение не совсем корректно, так как изменение заряда поверхности магнетита должно оказывать влияние только на кинетику поглощения ионов хрома(VI) магнетитом, а не на его сорбционную емкость по отношению к ним. Поэтому единственным разумным объяснением наблюдаемого явления, по нашему мнению, является уменьшение доступной для сорбции ионов хрома(VI) поверхности магнетита из-за частичной адсорбции на ней гидроксильных ионов. Выше мы уже отмечали, что сорбционная емкость магнетита по ионам ОН–, по-видимому, достаточно велика. Поэтому при высоких значениях рН раствора они за счет своей адсорбции могут заблокировать для ионов хрома(VI) часть поверхности магнетита.
Повышение эффективности сорбции хрома(VI) магнетитом с ростом температуры раствора косвенным образом указывает на существенный вклад хемосорбции в общий процесс сорбции, так как при обычной адсорбции наблюдается обратный эффект – снижение величины сорбции с ростом температуры.
Кинетика сорбции хрома(VI) магнетитом
Имеющиеся в литературе данные по кинетике сорбции ионов хрома(VI) магнетитом довольно противоречивы. Так, согласно [36] сорбция ионов хрома(VI) c их начальной концентрацией в растворе 50–150 мг/л нанопорошком магнетита с размером частиц около 10 нм при рН близком к нейтральному протекает довольно быстро. Основное количество хрома(VI) в растворе поглощается магнетитом примерно через 5 мин с начала процесса, а оставшееся – по истечении 60 мин [36]. Эффективность сорбции снижается при увеличении начальной концентрации хрома(VI) в растворе, что объясняется, видимо, исчерпанием сорбционной емкости нанопорошка магнетита, помещенного в раствор. Аналогичная зависимость изменения эффективности сорбции ионов хрома(VI) магнетитом от времени наблюдалась в работе [40], где сорбцию изучали при рН 2.5 и начальной концентрации хрома(VI) в растворе 50 мг/л.
Несколько иной результат был получен в работе [37]. Там сорбцию ионов шестивалентного хрома магнетитом со средним размером частиц около 100 нм изучали при рН ≈ 2. Пересчитанные в других координатах зависимости с рис. 5 данной работы представлены на рис. 10, из которого видно, что в данном случае, в отличие от результатов [36], сорбция ионов хрома(VI) магнетитом протекала очень медленно и даже через 380 мин с начала процесса экспериментальные кривые снижения концентрации ионов хрома(VI) в растворе не выходили на плато, свидетельствующее об окончании сорбции. При повышении температуры раствора эффективность сорбции возрастала [37]. На это указывает снижение остаточной концентрации хрома(VI) в растворе при увеличении температуры процесса (рис. 10).
Рис. 10.
Кинетика сорбции ионов хрома(VI) магнетитом при разных температурах раствора. Начальная концентрация ионов хрома(VI) в растворе – 20 мг/л, рН 2, концентрация магнетита в растворе – 2 г/л [37].

Аналогичный результат был получен в работе [19]. Там общая длительность процесса сорбции хрома(VI) смешанным сорбентом, состоящим из маггемита и магнетита, при рН 3 составляла 200 мин. Причем выход на плато экспериментальной кривой эффективности сорбции от времени перемешивания раствора с сорбентом происходил примерно через 100 и 150 мин с начала процесса для начальной концентрации ионов шестивалентного хрома в растворе 1 и 2 мг/л соответственно. Концентрация сорбента в растворе была равна 0.4 г/л.
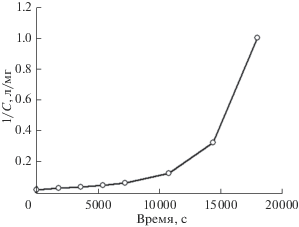
В работе [32] сорбцию ионов шестивалентного хрома из модельного раствора (400 мг/л Na2SO4 + + K2CrO4) при комнатной температуре, нейтральном рН и периодическом перемешивании раствора изучали на протяжении 80 дней (рис. 11).
Видно, что в начальный период процесса сорбции наблюдалось резкое снижение концентрации ионов хрома(VI) в растворе, а затем происходило ее медленное постепенное дальнейшее понижение [32]. Такое же существенное снижение концентрации хрома(VI) в начальный период процесса с последующим ее медленным понижением при дальнейшей выдержке магнетита в растворе отмечено также в работе [31]. Этот же эффект можно заметить и на рис. 10 (см. выше) для кривых, соответствующих температурам 40 и 50°С.
Заметное снижение концентрации ионов хрома(VI) в растворе в начальный период их сорбции при рН 4 сорбентом, состоящим из смеси маггемита и магнетита, наблюдалось и в работе [41]. После этого следовало длительное постепенное понижение содержания хрома(VI) в растворе в течение примерно 150 мин с последующим выходом на постоянное значение. Начальная концентрация ионов хрома(VI) в растворе составляла 1.5 мг/л, а концентрация сорбента – 0.4 г/л.
Таким образом, процесс сорбции хрома(VI) магнетитом можно условно разбить на две стадии: быструю и медленную, наличие которых легко объяснялось бы, если бы порошки магнетита имели высокую пористость. В этом случае первая, быстрая стадия процесса, соответствовала бы адсорбции ионов хрома(VI) на внешней поверхности частиц магнетита, а вторая, медленная, – их диффузионному переносу и последующей адсорбции на внутренней поверхности пор. Однако, как уже упоминалось выше, порошки магнетита, являются низкопористыми. Следовательно, внутрипоровый диффузионный перенос не является причиной наблюдаемой высокой длительности процесса сорбции на второй стадии процесса.
Наличие двух стадий процесса сорбции ионов шестивалентного хрома на магнетите можно объяснить, если предположить, что при сорбции хрома(VI) магнетитом одновременно протекают два процесса: 1) простая физическая (или ионообменная) адсорбция и 2) химическая реакция взаимодействия хрома(VI) с магнетитом (хемосорбция). Причем в первоначальный период сорбции первый процесс преобладает. Кроме того, на кинетику процесса, по-видимому, оказывает значительное влияние соотношение между начальной концентрацией ионов хрома(VI) в растворе и концентрацией магнетита (точнее, величиной общей площади поверхности порошка магнетита) в нем. Так, если начальная концентрация хрома(VI) в растворе мала, а концентрация магнетита велика, то, очевидно, что за счет протекания адсорбции будет наблюдаться быстрое снижение остаточной концентрации ионов хрома(VI) в растворе с последующим выходом на плато. Если же имеется обратное соотношение между концентрациями хрома(VI) и магнетита в растворе, то после быстрого первоначального снижения концентрации ионов хрома(VI) в растворе, обусловленного адсорбцией, последует период ее медленного понижения за счет хемосорбции (такой тип зависимостей показана на рис. 11). Естественно, повышение температуры приведет к росту эффективности сорбции за счет ускорения хемосорбции (рис. 8 и 10).
В общем случае кинетика адсорбции может быть описана уравнениями первого (псевдо-первого) или второго (псевдо-второго) порядка. Эти уравнения были использованы и для описания кинетики сорбции хрома(VI) магнетитом. Так, в работе [40] кинетика сорбции ионов хрома(VI) магнетитом при рН 2.5 с высокой точностью описывалась уравнением псевдо-второго порядка:
где τ – время, с; k2 – константа скорости, г/(мг с); qτ – величина сорбции в момент времени τ, мг/г или мг/м2; q – величина равновесной сорбции, мг/г или мг/м2.При этом константа скорости k2 оказалась равной 0.6 г/(мг мин) = 0.01 г/(мг с). Авторы [40] делают вывод о том, что сорбция хрома(VI) на исследованном ими образце магнетита имеет хемосорбционный характер. Однако это противоречит их другому результату, согласно которому сорбция ионов шестивалентного хрома в их экспериментах описывается изотермой Ленгмюра, которое предполагает существование динамического равновесия между сорбентом и сорбатом, что невозможно при хемосорбции.
В работе [41] кинетика сорбции ионов хрома(VI) была изучена, как уже упоминалось выше, на смеси магнетита с маггемитом. Исследование провели при трех разных температурах и рН 4. Снижение концентрации хрома(VI) в растворе от времени описывалось уравнением первого порядка, интегральная форма которого выглядит следующим образом [41]:
где k1 – константа скорости, с–1.Величина k1 для температур 10, 22 и 55°С имела значения 0.014 мин–1 (или 2.3 × 10–4 с–1), 0.02 мин–1 (или 3.3 × 10–4 с–1) и 0.03 мин–1 (или 5 × 10–4 с–1) соответственно, что указывало на небольшое увеличение скорости сорбционного процесса с ростом температуры раствора [41].
Изотермы адсорбции хрома(VI) магнетитом
Одна из первых известных нам работ по сорбции хрома(VI) магнетитом была выполнена в 1994 году [39]. Исследование проводилось при рН 9.8, длительность сорбционных экспериментов составляла 30 мин. Полученные экспериментальные данные хорошо описывались изотермой Ленгмюра для мономолекулярной адсорбции (коэффициент корреляции 0.98):
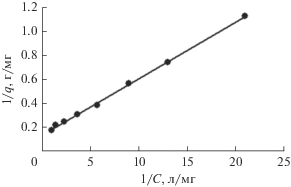
где qm – емкость адсорбционного монослоя, мг/г или мг/м2; KL – константа адсорбционного равновесия, л/мг.Расчет по экспериментальным данным, представленным на рис. 1 работы [39], дает следующие значения параметров этого уравнения: qm = 10.5 мг/г и KL = 0.017 л/мг (рис. 12).
В работе [36] сорбция хрома(VI) магнетитом описывалась эмпирическим уравнением Фрейндлиха:
где KF и n – константы (n > 1).С увеличением температуры раствора от 10 до 40°С наблюдался небольшой рост постоянной KF в этом уравнении от значения 10.38 до 12.20. Константа n напротив снижалась от величины 3.23 до 3.12. Коэффициент корреляции менялся от 0.986 до 0.994 [36]. Однако расчет по данным на рис. 2 этой работы показывает, что представленная там зависимость также хорошо может быть описана уравнением Ленгмюра с коэффициентом корреляции 0.981 и параметрами: qm = 18.94 мг/г = = 0.096 мг/м2 (удельная поверхность магнетита была равна 198 м2/г) и KL = 0.017 л/мг (рис. 13).
Аналогичный результат был получен в работе [19]. Там сорбция ионов шестивалентного хрома при рН 4.5 тоже описывалась изотермой Фрейндлиха с постоянными KF = 6 и n = 1.71. Длительность процесса сорбции составляла 24 часа. В качестве сорбента использовался не чистый магнетит, а его смесь с маггемитом (30.8% маггемита и 69.2% магнетита). Пересчет экспериментальных данных [19], представленных на рис. 7а этой работы, показывает, что они тоже хорошо описываются уравнением Ленгмюра (коэффициент корреляции 0.99) с параметрами: qm = 7.2 мг/г = = 0.15 мг/м2 (удельная поверхность сорбента равна 49 м2/г) и KL = 2.96 л/мг (рис. 14).
Сорбция хрома(VI) синтезированным порошком магнетита с удельной поверхностью 86.6 м2/г, при комнатной температуре (25 ± 2оС) и начальным значением рН раствора, равным 2.5, была изучена в работе [40]. Изотерма сорбции ионов хрома(VI) магнетитом в этой работе хорошо описывается уравнением Ленгмюра (коэффициент корреляции 0.999) с параметрами: qm = 21.7 мг/г = = 0.251 мг/м2 и KL = 0.262 л/мг. Продолжительность процесса сорбции составляла 120 мин.
В работе [41], также как и в работе [19], сорбция хрома(VI) исследовалась на смеси оксидов железа: 70% маггемита + 30% магнетита. Удельная поверхность такого смешанного сорбента была равна 49 м2/г. При этом изотерма сорбции хорошо описывается уравнением Ленгмюра с параметрами: qm = 6.9 мг/г = 0.141 мг/м2 и KL = 3.1 л/мг (приведены данные для рН 4 и температуры 22°С) [41]. Длительность процесса сорбции составляла 24 ч. При повышении температуры раствора наблюдался небольшой рост величин qm и KL.
Таким образом, опубликованные в литературе данные свидетельствуют о том, что сорбция ионов хрома(VI) магнетитом при продолжительности процесса сорбции не более 24 ч хорошо описывается уравнением Ленгмюра. Значения параметров этого уравнения, полученные в упомянутых выше работах (или рассчитанные по экспериментальным результатам этих работ), приведены в табл. 2.
Таблица 2.
Параметры уравнения Ленгмюра при сорбции ионов хрома(VI) магнетитом при температуре 22–27°С (τс – продолжительность процесса сорбции; Rc – коэффициент корреляции)
| рН | τс | qm, мг/г | qm, мг/м2 | KL, л/мг | Rc | Источник |
|---|---|---|---|---|---|---|
| 4.5 | 24 ч | 7.2 | 0.15 | 2.96 | 0.99 | 19* |
| ≈7 | 120 мин | 18.94 | 0.096 | 0.017 | 0.984 | 36 |
| 9.8 | 30 мин | 10.5 | – | 0.017 | 0.98 | 39 |
| 2.5 | 120 мин | 21.7 | 0.251 | 0.262 | 0.999 | 40 |
| 4 | 24 ч | 6.9 | 0.141 | 3.1 | 0.99 | 41** |
Составлять подобную таблицу для параметров эмпирического уравнения Фрейндлиха, найденных в [19, 36], мы не стали, так как выше было показано, что экспериментальные данные этих работ также удовлетворительно описываются уравнением Ленгмюра, которое хорошо теоретически обосновано и параметры которого имеют ясный физический смысл. Отметим, что ситуация, когда изотерма сорбции с примерно одинаковой точностью описывается уравнениями Фрейндлиха и Ленгмюра является типичной для многих сорбентов.
Из табл. 2 видно, что в размерности мг/г значения емкости адсорбционного монослоя (qm) порошков магнетита существенно различаются между собой. Однако в размерности мг/м2 эти различия сглаживаются и наблюдается взаимосвязь между емкостью адсорбционного монослоя порошков магнетита по отношению к ионам шестивалентного хрома и рН раствора. Так, при рН 2.5 емкость адсорбционного монослоя порошков магнетита равна 0.251 мг/м2, при рН 4–4.5 она составляет уже 0.141–0.15 мг/м2, а при рН > 7 снижается до 0.096 мг/м2. Эта корреляция неплохо согласуется с приведенными выше литературными данными о снижении эффективности сорбции ионов хрома(VI) магнетитом с повышением рН раствора. Графически эта зависимость показана на рис. 15. Однако для константы адсорбционного равновесия о такой же четко выраженной корреляции не приходится говорить, так как значение KL для рН 2.5, найденное в работе [40], не согласуется с данными, полученными другими исследователями (см. табл. 2).
Отметим также близость найденных значений емкости адсорбционного монослоя смешанных сорбентов (магнетит + маггемит) с соответствующими величинами для порошков чистого магнетита. Отсюда можно сделать вывод о том, что адсорбционная емкость маггемита по отношению к ионам шестивалентного хрома близка к соответствующей емкости магнетита.
Факторы, указывающие на хемосорбционный характер сорбции ионов хрома(VI) магнетитом
Практически во всех перечисленных выше работах по сорбции хрома(VI) магнетитом отмечается хемосорбционный характер этого процесса. При этом наблюдается противоречие: сорбция чаще всего описывается изотермой Ленгмюра, которая соответствует протеканию простой физической (или ионообменной) адсорбции и предполагает наличие динамического равновесия между адсорбируемым веществом и сорбентом, что невозможно, как уже отмечалось выше, при хемосорбции.
Так, в работе [39] изотерма сорбции ионов хрома(VI) магнетитом описывалась уравнением Ленгмюра, но при этом авторы отмечают наличие хемосорбции, так как многократная промывка магнетита после сорбции водой приводит лишь к частичной десорбции с него ионов хрома(VI).
Аналогичное противоречие имеется в работе [42], где для сорбции хрома(VI) использовался сложный композиционный сорбент, в составе которого был магнетит, гематит (α-Fe2O3), а также обработанные специальным образом опилки эвкалипта. Сорбция хрома(VI) на этом смешанном сорбенте также лучше всего описывалась изотермой Ленгмюра. Причем емкость сорбента возрастала с ростом температуры раствора, что косвенно указывало на вклад хемосорбции в общий процесс сорбции (так как в случае простой физической адсорбции наблюдался бы обратный эффект уменьшения емкости сорбента с ростом температуры). Рентгеновская фотоэлектронная спектроскопия (РФЭС) сорбента после сорбции показала, что хром в нем частично находился в трехвалентном состоянии, т.е. в процессе сорбции произошло восстановление хрома(VI). Ионы хрома(III) и железа(III) преобладали на поверхности магнетита, входящего в состав сорбента [42]. Все это, по сути, также является доказательством протекания хемосорбции ионов хрома(VI) на поверхности магнетита. Авторы предполагают, что это реакция окисления железа(II) до железа(III) и восстановления хрома(VI) до хрома(III) [42]. При этом, по мнению авторов, на поверхности магнетита возможно образование смешанного соединения FexCr(1 –x)(OH)3, так как ионные радиусы железа(III) (0.067 нм) и хрома(III) (0.065 нм) близки между собой. Поэтому в решетке магнетита возможна замена ионов Fe(III) на Cr(III) [42]. О протекании хемосорбции свидетельствует также отсутствие ионов хрома(III) в растворе после завершения процесса сорбции.
РФЭ-спектроскопия поверхности магнетита после сорбции хрома(VI), выполненная в работе [40], также показала пики типичные для Cr(III). Кроме того, было обнаружено небольшое изменение положений пиков железа Fe2p, что, по мнению авторов [40], может свидетельствовать о замещении ионов железа(III) в решетке магнетита на ионы хрома(III) в виду близости их ионных радиусов. Были проведены также цикличные опыты по регенерации магнетита раствором щелочи с последующей повторной сорбцией на нем ионов хрома(VI). Эти эксперименты показали, что от цикла к циклу сорбционная емкость магнетита падает, что указывает на необратимый характер сорбции хрома(VI) на магнетите. Там же авторы отмечают, что в отличие от магнетита сорбция хрома(VI) на маггемите носит обратимый характер [40].
Необратимый характер сорбции хрома(VI) на магнетите отмечен также в работе [32].
В работе [41] был проведен тщательный анализ смешанного сорбента (магнетит + маггемит) после сорбции на нем хрома(VI) с использованием рентгеновской дифракции, рентгеновской фотоэлектронной (РФЭ) и КР спектроскопии. Это исследование показало, что после сорбции содержание железа(II) в магнетите снизилось с 8.2 до 3.6%, а количество маггемита в сорбенте возросло с 70 до 89%. При этом в РФЭ спектрах обнаружены пики, соответствующие хрому(III). Данные же КР-спектроскопии свидетельствовали о том, что в сорбенте образовалось смешанное соединение между хромом и железом [41]. Все это также указывает на протекание окислительно-восстановительной реакции между железом(II) в магнетите и ионами хрома(VI) при их сорбции на поверхность магнетита.
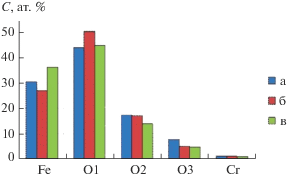
Появление хрома(III) в осадке магнетита после сорбции на нем ионов шестивалентного хрома было обнаружено и в работе [43]. Порошки магнетита были получены тремя методами: газофазным, лазерным распылением и химическим осаждением из водного раствора. Их физико-химические свойства были приведены выше в табл. 1. Был выполнен тщательных анализ этих порошков магнетита до и после сорбции на них ионов хрома(VI) с использованием рентгеновской фотоэлектронной спектроскопии [43]. Так, на рис. 16 представлены данные по химическому составу поверхности частиц порошков магнетита после сорбции хрома(VI) [43]. Видно, что в составе всех трех порошков магнетита после окончания процесса сорбции появился хром. Относительная концентрация поглощенного хрома в пересчете на содержание железа в поверхностных слоях магнетита составляет 1–2%.
Рис. 16.
Содержание железа, хрома и кислорода на поверхности частиц магнетита, синтезированных тремя методами: (а) газофазным, (б) лазерным распылением и (в) химическим осаждением из водного раствора), после сорбции на них ионов хрома(VI) [43].
На рис. 17 представлен типичный для всех образцов спектр Cr2p хрома в составе магнетита после сорбции на нем ионов хрома(VI) при возбуждении фотоэмиссии как MgKα-, так и AlKα-излучением. Видно, что в обоих случаях в спектре присутствует полоса Cr2p3/2, соответствующая энергии связи 576.6 эВ. Положение и форма спектра Cr2p однозначно указывают на то, что хром на поверхности частиц магнетита имеет степень окисления +3. Кроме того, после сорбции ионов хрома(VI) в спектрах O1s всех трех образцов присутствовала полоса от Fe(OH)2, а спектры Fe2p по своему виду приближались к таковым в Fe2O3 и Fe(OH)3 [43].
Рис. 17.
РФЭ-спектры Cr2p-хрома порошка магнетита после сорбции на нем ионов хрома(VI) при возбуждении фотоэмиссии (1) MgKα- и (2) AlKα-излучением [43].

Исследование состава порошков магнетита после сорбции хрома(VI) электрохимическим методом, выполненное в работе [44], также подтвердило наличие в нем хрома в трехвалентном состоянии.
Резкое повышение эффективности сорбции хрома(VI) магнетитом при повышении температуры раствора, обнаруженное в целом ряде работ [31, 32, 37, 41] (см. также рис. 8 и 10), тоже является свидетельством протекания хемосорбции при поглощении ионов хрома(VI) магнетитом. На это же указывает большая длительность процесса сорбции, который при комнатной температуре может продолжаться десятки часов и дней (рис. 11). При этом по данным [31] происходит изменение рН раствора (рис. 18).
Рис. 18.
Изменение рН раствора в зависимости от общей площади поверхности порошка магнетита, помещенного в раствор с ионами хрома(VI), и длительности процесса сорбции (температура 25 ± 2°С) [31].

Как видно из рис. 18, при длительной выдержке порошка магнетита в растворе рН последнего, независимо от концентрации в нем магнетита, вначале смещался в щелочную область (исходный раствор имел рН ≈ 7.5). Однако затем, через 7–38 дней выдержки, дальнейшее изменение щелочности раствора протекало неравномерно. Так, при S ≈ 20–40 м2 рН раствора по-прежнему возрастал до значений рН ≈ 9.2–9.4, а при S > 40 м2 наоборот снижался до рН ≈ 8–9.2. После 134 дней выдержки наблюдалось дальнейшее понижение рН раствора. И через 302 дня при S ≈ 20 м2 раствор имел рН 8.2, а при S > 20 м2 – рН ≈ 7.3 [31]. Наблюдаемое явление обусловлено, возможно, не только процессом хемосорбции хрома(VI) магнетитом, но и взаимодействием последнего с водой, и это требует дальнейшего изучения.
При длительной выдержке магнетита в растворе с ионами хрома(VI) процесс сорбции уже не может быть описан изотермой Ленгмюра [31]. Об этом свидетельствуют зависимости, представленные на рис. 19.
Рис. 19.
Данные по сорбции ионов хрома(VI) магнетитом при разной длительности процесса сорбции в координатах уравнения (3) [31].

Видно, что при продолжительности процесса сорбции ионов хрома(VI) магнетитом 240 мин и 28 часов экспериментальные точки хорошо аппроксимируются прямыми с разными углами наклона к оси абсцис, свидетельствующими о протекании и преобладании в этот период времени простой адсорбции, описываемой изотермой Ленгмюра [31]. Причем параметры изотермы меняются со временем, что указывает на неравновесное состояние системы. При более длительном проведении процесса сорбции (7 дней и более) зависимости приобретают уже криволинейный вид (рис. 19), что можно интерпретировать, как свидетельство преобладания хемосорбции в этот период процесса (кривые для длительности сорбции, превышающей 7 дней, на рис. 19 не показаны, чтобы его не загромождать) [31]. Данные зависимости подтверждают высказанное выше предположение о том, что при сорбции хрома(VI) магнетитом одновременно протекают два процесса: простая физическая (или ионообменная) адсорбция и химическая реакция взаимодействия ионов хрома(VI) с магнетитом (хемосорбция), приводящая к образованию смешанного соединения хрома с железом. Причем в начальный период сорбции преобладает первый процесс, а позже доминирует уже второй. На кинетических кривых процессу адсорбции соответствует, по-видимому, короткая начальная стадия резкого снижения концентрации ионов хрома(VI) в растворе, а хемосорбции – последующее ее медленное понижение (рис. 11).
Таким образом, о протекании хемосорбции при сорбции ионов хрома(VI) магнетитом свидетельствует:
– необратимы характер сорбции, приводящий к снижению емкости магнетита в отношении ионов хрома(VI) вплоть до нуля при многократном использовании сорбента, а также невозможность его полной регенерации щелочью;
– большая длительность процесса сорбции, сопровождаемая изменением рН раствора;
– невозможность описания процесса сорбции при большой его длительности изотермой Ленгмюра;
– резкое увеличении эффективности сорбции ионов хрома(VI) магнетитом при повышении температуры раствора, что невозможно при протекании простой физической или ионообменной адсорбции;
– изменение степеней окисления хрома с +6 на +3 и ионов железа c +2 на +3 в магнетите, указывающее на протекание окислительно-восстановительной реакции между ионами хрома(VI) в растворе и ионами железа(II) в магнетите;
– появление хрома(III) в магнетите, свидетельствующее об образовании смешанного соединения хрома(III) с железом и возможном частичном замещении железа(III) в магнетите хромом(III) в виду близости их ионных радиусов.
Добавим еще, что, по-видимому, именно разным вкладом адсорбции и хемосорбции в общий процесс сорбции хрома(VI) магнетитом объясняется тот имеющийся разброс данных по адсорбционной емкости магнетита по отношению к хрому(VI) (см. табл. 2) и расхождения в уравнениях, описывающих кинетику процесса сорбции.
Механизм хемосорбции хрома(VI) магнетитом
Таким образом, опубликованные литературные данные свидетельствуют о том, что при сорбции ионов шестивалентного хрома магнетитом протекает окислительно-восстановительная реакция, при которой Fe(II) в магнетите окисляется до Fe(III), а хром(VI) на поверхности магнетита восстанавливается до хрома(III). При этом в тонком поверхностном слое магнетита (или на его поверхности) образуется новое смешанное соединение хрома(III) с железом(III) или, возможно, с железом(II). Например, в работе [42] предполагают, что это соединение имеет общую формулу FexCr(1 –x)(OH)3, но экспериментально это не доказано.
По данным другой работы в поверхностном слое магнетита после его взаимодействия с ионами хрома(VI) при рН 2.5 образуется хромит железа FeCr2O4 [36]. Его формирование подтверждено рентгенофазовым анализом. Предложено уравнение реакции взаимодействия ионов шестивалентного хрома с магнетитом [36]:
(5)
$3{\text{F}}{{{\text{e}}}^{{2 + }}} + {\text{ CrO}}_{4}^{{2--}} + 4{{{\text{H}}}_{2}}{\text{O}} = {\text{C}}{{{\text{r}}}^{{3 + }}} + 3{\text{F}}{{{\text{e}}}^{{3 + }}} + 8{\text{O}}{{{\text{H}}}^{--}}.~~$Однако, на наш взгляд, это уравнение не соответствует образующемуся соединению FeCr2O4. Поэтому оно должно иметь другой вид:
(6)
$\begin{gathered} 6{\text{F}}{{{\text{e}}}^{{2 + }}} + 2{\text{CrO}}_{4}^{{2--}} + 4{{{\text{H}}}^{ + }} = \\ = {\text{C}}{{{\text{r}}}_{2}}{\text{O}}_{4}^{{2--}} + 6{\text{F}}{{{\text{e}}}^{{3 + }}} + 4{\text{O}}{{{\text{H}}}^{--}}.~ \\ \end{gathered} $В молекулярной форме реакция (6) может быть записана только в том случае, если предположить, что кроме FeCr2O4 ее дополнительными продуктами будут оксид железа(III), например, маггемит, и гидроксид Fe(OH)3. При этом получается два уравнения с различным соотношением продуктов реакции и реагирующих веществ:
(7)
$\begin{gathered} 7{\text{F}}{{{\text{e}}}_{3}}{{{\text{O}}}_{4}} + 2{{{\text{K}}}_{2}}{\text{Cr}}{{{\text{O}}}_{4}} + 11{{{\text{H}}}_{2}}{\text{O}} = \\ = {\text{FeC}}{{{\text{r}}}_{2}}{{{\text{O}}}_{4}} + 7{\text{F}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}} + 6{\text{Fe}}{{\left( {{\text{OH}}} \right)}_{3}} + 4{\text{KOH}},~~ \\ \end{gathered} $(8)
$\begin{gathered} 7{\text{F}}{{{\text{e}}}_{3}}{{{\text{O}}}_{4}} + 2{{{\text{K}}}_{2}}{\text{Cr}}{{{\text{O}}}_{4}} + 8{{{\text{H}}}_{2}}{\text{O}} = \\ = {\text{ FeC}}{{{\text{r}}}_{2}}{{{\text{O}}}_{4}} + 8{\text{F}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}} + 4{\text{Fe}}{{\left( {{\text{OH}}} \right)}_{3}} + 4{\text{KOH}}.~~~ \\ \end{gathered} $В случае протекания этих реакций взаимодействие хрома(VI) с магнетитом должно сопровождаться повышением рН раствора, что согласуется с экспериментальными данными [31]. Полосы, соответствующие Fe2O3 и Fe(OH)3 (или очень близкие к ним), были найдены в РФЭ-спектрах в работе [43]. Но образование FeCr2O4 в поверхностном слое магнетита не было больше подтверждено рентгенофазовым анализом ни в одной из известных нам публикаций.
Наряду с рассмотренными выше работами по сорбции хрома(VI) магнетитом, где обнаружено химическое взаимодействие между ионами шестивалентного хрома и железом(II) в магнетите, имеются публикации, в которых сорбция практически не принимается во внимание, а магнетит рассматривается как соединение-восстановитель для хрома(VI) [45–49]. Так, в [45] для окислительно-восстановительной реакции между ионами хрома(VI) и магнетитом предложено уравнение:
(9)
$\begin{gathered} 6{\text{F}}{{{\text{e}}}_{3}}{{{\text{O}}}_{4}} + 2{\text{N}}{{{\text{a}}}_{2}}{\text{Cr}}{{{\text{O}}}_{4}} + 4{{{\text{H}}}^{ + }} = \\ = 9\gamma {\text{ - F}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}} + 2{\text{CrOOH }} + 4{\text{N}}{{{\text{a}}}^{ + }} + {{{\text{H}}}_{2}}{\text{O}}.~ \\ \end{gathered} $Эту реакцию можно переписать в молекулярной форме:
(10)
$\begin{gathered} 6{\text{F}}{{{\text{e}}}_{3}}{{{\text{O}}}_{4}} + 2{\text{N}}{{{\text{a}}}_{2}}{\text{Cr}}{{{\text{O}}}_{4}} + 3{{{\text{H}}}_{2}}{\text{O}} = \\ = {\text{ }}9\gamma {\text{ - F}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}} + 2{\text{CrOOH }} + 4{\text{NaOH}}.~ \\ \end{gathered} $Восстановление хрома(VI) магнетитом по уравнению (10) должно сопровождаться появлением маггемита (γ-Fe2O3) в осадке и повышением рН раствора. Последнее, как уже упоминалось выше, согласуется с экспериментальными данными [31]. Образование же в сорбенте маггемита установлено в [41].
Толщина поверхностного слоя магнетита, прореагировавшего с ионами хрома(VI) при рН 7 по данным [45] составляет около 2.4 нм. Дальше реакция взаимодействия хрома(VI) с магнетитом не идет из-за пассивирующего действия этих новых соединений, образовавшихся на поверхности магнетита. Вследствие этого, как показали расчеты [45], максимальная сорбционная емкость магнетита по ионам хрома(VI) не превышает 1.1 мг/м2. Если сравнить эту величину с данными табл. 2, то видно, что она примерно на порядок выше представленных там значений для qm.
В работе [46] в результате анализа РФЭ-спектров магнетита после взаимодействия с раствором хрома(VI) делается вывод о возможном образовании на поверхности магнетита (или в его поверхностном слое) либо оксигидроксида хрома(III), либо смешанного гидроксида (твердого раствора) железа(III) с хромом(III) FexCr(1 –x)(OH)3.
Согласно экспериментальным данным [47] толщина поверхностного слоя магнетита, вступившего в реакцию с ионами шестивалентного хрома при рН 6, возрастает с увеличением концентрации последних в растворе и временем взаимодействия с магнетитом. По оценке [47] максимальное значение толщины поверхностного слоя магнетита, вступившего в реакцию с ионами хрома(VI), составляет примерно 1.5 нм. Спектроскопия рентгеновского поглощения (X-ray absorption fine structure – XAFS) показала, что хром и железо присутствуют на поверхности магнетита в степенях окисления +3. Там также обнаружено большое количество гидроксильных групп [47]. На основании этого авторы предполагают, что хром образует на поверхности магнетита оксигидроксид CrOOH или (Cr,Fe)OOH [47]. Между тем, на рис. 1 этой работы ясно видна близость рентгеновских спектров поглощения хромита железа FeCr2O4 и магнетита после выдержки последнего в растворе Na2CrO4. Однако этот факт в [47] детально не обсуждается.
Взаимодействие магнетита с ионами шестивалентного хрома при рН 1, 7 и 13 было изучено в работе [48]. При этом было обнаружено образование маггемита и гетита (α-FeOOH). С повышением рН раствора доля гетита в осадке росла, а маггемита наоборот падала. Вся совокупность происходящих процессов, по мнению авторов, может быть описана следующими химическими реакциями [48]:
(11)
${\text{F}}{{{\text{e}}}_{3}}{{{\text{O}}}_{4}} + {\text{O}}{{{\text{H}}}^{--}} + {{{\text{H}}}_{2}}{\text{O}} = \gamma {\text{ - F}}{{{\text{e}}}_{2}}{{{\text{O}}}_{3}} + {\text{ Fe}}\left( {{\text{OH}}} \right)_{3}^{ - },~$(12)
$\begin{gathered} 2{\text{Fe}}\left( {{\text{OH}}} \right)_{3}^{--} + 0.5{{{\text{O}}}_{2}} + 2{{{\text{H}}}^{ + }} = \\ = 2\alpha {\text{ - FeOOH}} + 3{{{\text{H}}}_{2}}{\text{O}},~ \\ \end{gathered} $(13)
$\begin{gathered} 3{\text{Fe}}\left( {{\text{OH}}} \right)_{3}^{--} + {\text{CrO}}_{4}^{{2--}} + 5{{{\text{H}}}^{ + }} = \\ = 2\alpha {\text{ - FeOOH}} + 2{\text{C}}{{{\text{r}}}_{x}}{\text{F}}{{{\text{e}}}_{{1{\text{ }}--{\text{ }}x}}}{\text{OOH}} + 5{{{\text{H}}}_{2}}{\text{O}}.~ \\ \end{gathered} $Видно, что тут, также как в [47], предполагается образование смешанного оксигидроксида CrxFe(1 –x)OOH. Причем восстановление хрома(VI) магнетитом, согласно этим реакциям, протекает за счет частичного растворения магнетита с образованием в твердой фазе маггемита. Отметим, что реакция (11) может объяснить наблюдавшееся в [31] понижение рН раствора при длительной выдержке в нем магнетита (см. рис. 18).
По данным очень тщательных исследований [49] на поверхности магнетита при его взаимодействии с ионами шестивалентного хрома в растворе при рН 6 образуется два слоя. Верхний слой, контактирующий с раствором, представляет собой оксигидроксид хрома CrOOH или, возможно, гидроксид Cr(OH)3. Толщина этого слоя по оценке [49] составляет около 1.5 нм. Под ним находится слой оксида железа(III), а затем – непрореагировавший магнетит. Оценить толщину слоя оксида железа(III) авторы [49] не смогли.
Таким образом, опубликованные в литературе данные по механизму взаимодействия магнетита с ионами шестивалентного хрома достаточно противоречивы. Для удобства их дальнейшего анализа они сведены в табл. 3.
Таблица 3.
Опубликованные в литературе данные о составе соединений, образующиеся в поверхностном слое магнетита (или на его поверхности), при его взаимодействии с ионами хрома(VI) в растворах, имеющих разные начальные значения рН. C0 – начальная концентрация ионов шестивалентного хрома в растворе; Cтв – концентрация магнетита в растворе
| рН | Продукты реакции | C0, мг/л | Cтв, г/л | C0/Cтв, мг/г | Источник |
|---|---|---|---|---|---|
| 1 | γ-Fe2O3 + α-FeOOH + CrxFe(1 – x)OOH | 52 | 10 | 5.2 | [48] |
| 2 | CrOOH и/или FexCr(1 – x)(OH)3 | 2–59 | 4–20 | 0.1–14.8 | [42] |
| 2.5 | γ-Fe2O3 + ??? | 50 | 5 | 5 | [40] |
| 2.5 | FeCr2O4 | 50–150 | 5 | 10–30 | [36] |
| 4 | γ-Fe2O3 + ??? | 1.5 | 0.4 | 3.8 | [41] |
| 6 | CrOOH или CrxFe(1 – x)OOH | 2.6–260 | – | – | [47] |
| 6 | CrOOH и/или Cr(OH)3 + Fe2O3 | 2.6–260 | – | – | [49] |
| 7 | γ-Fe2O3 + CrOOH | 106 | 20 | 5.3 | [45] |
| 7 | γ-Fe2O3 + α-FeOOH + CrxFe(1 – x)OOH | 52 | 10 | 5.2 | [48] |
| 7.2 | FexCr(1 – x)(OH)3 | 50 | 6.5–13 | 3.9–7.7 | [46] |
| 13 | γ-Fe2O3 + α-FeOOH + CrxFe(1 – x)OOH | 52 | 10 | 5.2 | [48] |
Из данных, приведенных в табл. 3, видно, что начальное значение рН раствора практически не оказывает влияния на состав продуктов окислительно-восстановительной реакции между магнетитом и ионами хрома(VI). Большинство исследователей сходятся во мнении (и это доказано в ряде рассмотренных выше работ), что одним из этих продуктов является маггемит [40, 41, 45, 48, 49]. В работе [48] наряду с ним обнаружено также образование гетита. По составу хромсодержащих продуктов реакции мнения расходятся. Это может быть оксигидроксид хрома CrOOH или гидроксид Cr(OH)3 [42, 45, 47, 49], либо смешанный гидроксид (твердый раствор) состава FexCr(1 –x)(OH)3 [42, 46], или оксигидроксид CrxFe(1 –x)OOH [47, 48]. Все это высказывается в публикациях в виде предположений, так как экспериментально указанные соединения различить очень трудно из-за близости их спектральных, энергетических и других характеристик. В большинстве рассмотренных работ было установлено, по сути, только появление хрома(III) на поверхности магнетита и преобладание там ионов железа(III), что указывало на протекание окислительно-восстановительной реакции между ионами хрома(VI) в растворе и магнетитом [42, 45–49].
В работе [36], как уже упоминалось, рентгенофазовым анализом доказано образование хромита железа FeCr2O4. Однако при этом не обнаружен маггемит, который согласно реакциям (7) и (8), тоже должен образовываться в системе.
Предложенный в [48] механизм образования гетита и оксигидроксида CrxFe(1 –x)OOH по реакциям (11)–(13), на наш взгляд, является маловероятным, так как растворимость магнетита в нейтральной и щелочной среде очень мала. Поэтому процесс восстановление хрома(VI) магнетитом при протекании совокупности этих реакций должен быть чрезвычайно медленным, что не соответствует реально наблюдаемой его скорости.
Если сравнить экспериментальные условия проведения реакции между хромом(VI) и магнетитом в рассмотренных выше работах, то видно, что они существенно различаются (см. табл. 3). В частности, имеются отличия и в начальном значении рН раствора, и в соотношении между начальной концентрацией ионов хрома(VI) и содержанием в магнетита в растворе C0/Cтв, от которого, по нашему мнению, зависит состав продуктов реакции. Так, при низких начальных значениях рН раствора и при небольшом значении отношения C0/Cтв, уже в первые минуты процесса следует ожидать быстрое повышение рН раствора вследствие как протекания окислительно-восстановительной реакции между хромом(VI) и магнетитом, так и частичного растворения последнего в кислой среде. Поэтому последующее взаимодействие ионов хрома(VI) с магнетитом в этих экспериментах должно происходить, по-видимому, уже при более высоком рН раствора, близком к нейтральному. Иными словами, при небольшой концентрации хрома(VI) в растворе и, напротив, высокой концентрации магнетита в нем, несмотря на низкое начальное значение рН раствора, в ходе окислительно-восстановительной реакции между ионами хрома(VI) и магнетитом, а также частичного растворения последнего в кислой среде, произойдет сдвиг рН раствора к нейтральному значению. И величина этого сдвига будет определять состав образующихся продуктов реакции.
Из табл. 3 видно, что большинство экспериментов по восстановлению хрома(VI) магнетитом было проведено именно при невысоком значении отношения C0/Cтв, не превышающем 8. Поэтому после непродолжительного начального периода основное взаимодействие хрома(VI) с магнетитом в экспериментах этих работ происходило, по-видимому, при более высоких и близких значениях рН раствора. Этим, на наш взгляд, и объясняется практическое отсутствие влияния начального значения рН раствора на состав продуктов реакции. Лишь в работе [36] эксперименты были проведены при довольно высоком отношении C0/Cтв, равном 10–30, и с повышенной начальной концентрацией ионов хрома(VI) в растворе (50–150 мг/л). В результате, возрастание рН раствора в ходе реакции взаимодействия хрома(VI) с магнетитом и его частичного растворения в растворе было, видимо, незначительным, и реакция протекала в кислой среде. Это, возможно, и привело к образованию в твердой фазе хромита железа FeCr2O4. Если это так, то становится понятно, почему в остальных рассмотренных выше работах данное соединение не было обнаружено.
Добавим еще, что при восстановлении шестивалентного хрома в растворе ионами железа(II) при рН > 3.9 также был получен смешанный рентгеноаморфный гидроксид состава Fe0.75Cr0.25(OH)3 [50]. А при восстановлении хрома(VI) металлическим железом при рН > 4 установлено образование соединений, состав которых может быть описан формулами Cr0.67Fe0.33(OH)3 или Cr0.67Fe0.33OOH [51]. Однако в некоторых случаях при начальном значении рН < 2 отмечено образование также хромита FeCr2O4 [52]. Все это, на наш взгляд, является косвенным подтверждением высказанных выше предположений о влиянии рН раствора и отношения C0/Cтв на состав продуктов реакции восстановления хрома(VI) магнетитом.
Кинетика хемосорбции хрома(VI) магнетитом
Выше было отмечено, что литературные данные по кинетике адсорбции ионов шестивалентного хрома на магнетите довольно противоречивы. Найденные там кинетические уравнения являются, на наш взгляд, эмпирическими, так как предполагают чисто адсорбционный характер поглощения ионов хрома(VI) магнетитом [40, 41]. Они не учитывают тот факт, что в данном случае при сорбции одновременно протекают два процесса: адсорбция и хемосорбция. Соотношение скоростей этих процессов может быть разным и во многом определяется условиями сорбционного эксперимента (температура, рН, начальная концентрация ионов шестивалентного хрома в растворе, концентрация магнетита в нем и т.д.). Поэтому в зависимости от условий сорбции ее кинетика может описываться разными адсорбционными кинетическими уравнениями.
Между тем, в литературе имеются работы [25, 31, 37, 45, 53], где исследовалась именно кинетика хемосорбции хрома(VI) на магнетите, а точнее кинетика окислительно-восстановительного процесса между ионами шестивалентного хрома и магнетитом. Однако при этом не принималась во внимание возможная адсорбция ионов хрома(VI) на поверхности магнетита в начальный период процесса.
Из приведенных выше данных по механизму хемосорбции видно, что, по-видимому, этот процесс представляет собой целую совокупность одновременно или последовательно протекающих химических реакций. Поэтому исследование его кинетики, возможно, позволит установить химическую реакцию, лежащую в его основе и определяющую скорость его протекания. Эти результаты, кроме того, имеют важное практическое значение для промышленного применения магнетита в качестве сорбента для удаления токсичных ионов хрома(VI) из загрязненных растворов. Однако при этом необходимо соблюсти и выполнить ряд условий, чтобы полученные данные были достоверными, и их можно было однозначно интерпретировать. Прежде всего, следует учесть или минимизировать вклад адсорбции при взаимодействии хрома(VI) с магнетитом, за счет которой может происходить значительное снижение концентрации хрома(VI) в растворе в начальный период процесса. Это можно сделать, например, проводя процесс сорбции при повышенной температуре. Далее, начальная концентрация хрома в растворе должна быть такой, чтобы последующее ее понижение за счет хемосорбции можно было зафиксировать с достаточной точностью. Кроме того, следует иметь в виду, что в данном случае протекает гетерогенная реакция, скорость которой определяется не только концентрацией ионов хрома(VI) в растворе, но также и величиной общей поверхности порошка магнетита, помещенного в раствор. Его действующая поверхность, доступная для взаимодействия с ионами шестивалентного хрома, по мере протекания окислительно-восстановительной реакции между хромом(VI) и магнетитом будет уменьшаться из-за пассивирующего действия образующихся в поверхностном слое магнетита (или на его поверхности) новых химических соединений, снижая, в итоге, и общую скорость процесса. Следовательно, чтобы исключить это влияние, в кинетических экспериментах в раствор с хромом(VI) должно быть введено такое количество порошка магнетита, чтобы уменьшением его действующей поверхности в ходе хемосорбции можно было пренебречь.
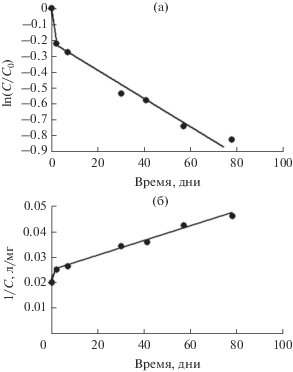
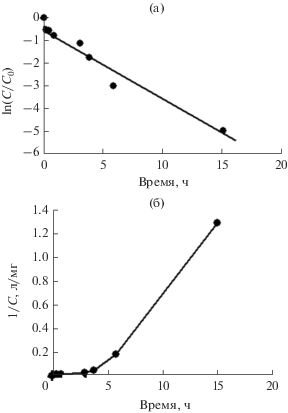
Наиболее полно перечисленные выше условия были выполнены в работе [31], где в модельный раствор сульфата натрия (400 мг/л), содержащий ионы шестивалентного хрома (K2CrO4), вводилось избыточное количество магнетита так, чтобы уменьшением его доступной для хемосорбции поверхности в ходе сорбционного процесса можно было пренебречь. Чтобы снизить влияние адсорбции, опыты проводились при повышенной температуре раствора. Для описания кинетики взаимодействия ионов хрома(VI) с магнетитом было предложено следующее уравнение [31]:
(14)
$ - \frac{{dC}}{{d\tau }} = k\frac{S}{v}\exp \left( { - \frac{E}{{RT}}} \right){{C}^{z}} = K\frac{S}{v}{{C}^{z}},$Интегрирование уравнения (14) при z = 1 дает следующую формулу:
(15)
$\ln \left( {\frac{C}{{{{C}_{0}}}}} \right) = - k\frac{S}{v}\exp \left( { - \frac{E}{{RT}}} \right)\tau = - K\frac{S}{v}\tau ,$Результаты выполненных экспериментов в координатах уравнения (15) представлены на рис. 20 и 21 [31].
Рис. 20.
Кинетика сорбции ионов хрома(VI) магнетитом при температурах 60 и 80°С в координатах уравнения (15) [31].

Рис. 21.
Кинетика сорбции ионов хрома(VI) магнетитом при температуре 98оС в координатах уравнения (15) [31].
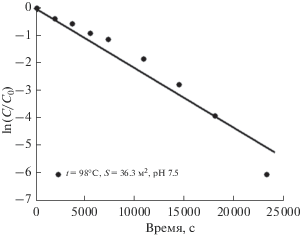
Линейный вид зависимостей, представленных на рис. 20 и 21, свидетельствует о том, что уравнение (14) адекватно описывает опытные данные при z = 1. Причем, при температурах 60 и 80°С аппроксимирующие прямые проходят не через начало оси ординат, и первые экспериментальные точки отклоняются от теоретически ожидаемой линейной зависимости (рис. 20). Это указывает на существенный вклад адсорбции в начальный момент процесса в этих экспериментах. Однако после повышения температуры до 98°С такого отклонения уже не наблюдается (рис. 21). Очевидно, что в последнем случае повышение температуры процесса до 98°С привело к тому, что скорость хемосорбции превысила скорость адсорбции. В результате, наблюдаемое при температурах 60 и 80°С отклонение аппроксимирующих прямых от начало оси ординат исчезло [31].
Для обобщения экспериментальных данных по хемосорбции при разных температурах формула (15) может быть преобразована к виду [31]:
(16)
$\ln \left[ {\frac{1}{\tau }\frac{v}{S}\ln \frac{{{{C}_{0}}}}{C}} \right] = \ln k - \frac{E}{{RT}}.$Обобщенные экспериментальные результаты для нескольких температур при рН 10.5 в координатах уравнения (16) приведены на рис. 22. Видно, что все экспериментальные точки хорошо аппроксимируются прямой, что снова подтверждает справедливость уравнения (15) [31].
Рис. 22.
Экспериментальные данные по кинетике сорбции ионов хрома(VI) магнетитом при рН 10.5, S = 54.45 м2 и температурах 68, 80 и 98°С в координатах уравнения (16) [31].

Проведенные эксперименты показали, что параметры хемосорбционного процесса зависят от начального значения рН раствора, в котором протекает сорбция (табл. 4) [31].
Таблица 4.
Зависимость параметров уравнения (14) при z = 1 от начального значения рН раствора сульфата натрия (400 мг/л), в котором протекал процесс сорбции ионов шестивалентного хрома (Sn – стандартное отклонение E, n – число экспериментальных точек, F – критерий Фишера) [31]
| рН | k, м/с | E, кДж/моль | Sn, кДж/моль | n | Rc | F |
|---|---|---|---|---|---|---|
| 3.3 | 5953.89 | 89.9 | 4.5 | 34 | 0.962 | 401.3 |
| 4.8 | 108.535 × 105 | 113.7 | 7.3 | 40 | 0.929 | 240.8 |
| 7.5 | 230.436 × 105 | 117.2 | 6.4 | 34 | 0.956 | 338.8 |
| 9.15 | 2829.84 × 105 | 126.7 | 5.5 | 23 | 0.980 | 523.7 |
| 10.5 | 25990.2 × 105 | 133.4 | 4.3 | 26 | 0.988 | 982.3 |
Данные, представленные в табл. 4, показывают, что химическая реакции взаимодействия хрома(VI) с магнетитом имеет достаточно высокую энергию активации. Поэтому при нанометровом размере частиц магнетита диффузионный перенос в растворе ионов шестивалентного хрома к поверхности частиц магнетита не будет стадией, определяющей общую скорость процесса, и даже в неперемешиваемом мешалкой растворе хемосорбция будет протекать в кинетическом режиме.
Высокие значения коэффициентов корреляции и критерия Фишера подтверждают, что формула (14) достоверно описывает полученные экспериментальные данные при z = 1 [31].
С повышением начального значения рН раствора наблюдается рост энергии активации процесса хемосорбции и предэкспоненциального множителя k в уравнении (14) (см. табл. 4). Это обусловлено, видимо, смещением заряда поверхности частиц магнетита в отрицательную область и появлением дополнительного электростатического барьера при их взаимодействии с магнетитом.
Рассмотрим другие аналогичные работы. Так, в [37] было изучено поглощение хрома(VI) магнетитом при рН 2 и трех разных температурах: 30, 40 и 50°С. Полученные зависимости показаны в [37] на рис. 5. Их обработка была произведена по нескольким кинетическим уравнениям. При этом наиболее высокий коэффициент корреляции соответствовал уравнению второго порядка относительно концентрации ионов хрома(VI) в растворе. У уравнения первого порядка он был несколько ниже [37]. Однако при этом не было учтено влияние адсорбции, которая может исказить вид кинетических зависимостей в начале процесса. Поэтому мы пересчитали эти экспериментальные данные. Результаты перерасчета в координатах уравнения (15) представлены на рис. 23.
Рис. 23.
Экспериментальные данные с рис. 5 работы [37] в координатах уравнения (15). Начальная концентрация хрома(VI) в растворе – 20 мг/л, концентрация магнетита в растворе – 2 г/л.

Как видно, зависимости на рис. 23 аналогичны тем, что были получены в работе [31] (см. выше рис. 20 и 21). Первые экспериментальные точки при температурах раствора 40 и 50°С так же, как и на рис. 20, отклоняются от прямолинейной зависимости, что можно объяснить, как и ранее, влиянием адсорбции. Однако при температуре 30°С линейная зависимость имеет место с самого начала процесса, что не совсем понятно, так как тут влияние адсорбции и, соответственно, отклонение от линейности должно быть самым сильным.
На рис. 24 эти же экспериментальные данные представлены в координатах уравнения (14) после его интегрирования при z = 2. В этом случае данное уравнение принимает вид:
(17)
$\frac{1}{C} = \frac{1}{{{{C}_{0}}}} + k\frac{S}{v}\exp \left( {\frac{E}{{RT}}} \right)\tau = \frac{1}{{{{C}_{0}}}} + K\frac{S}{v}\tau .$Видно, что тут также первые экспериментальные точки для температур 40 и 50°С отклоняются от ожидаемой линейной зависимости. Это тоже, по-видимому, объясняется влиянием адсорбции. И так же, как и на рис. 23, имеет место линейная зависимость для опытных данных при температуре 30°С. Таким образом, результаты [37] не позволяют однозначно определить каким уравнением, первого или второго порядка относительно концентрации ионов хрома(VI) в растворе, описывается кинетика поглощения шестивалентного хрома магнетитом в экспериментах этой работы. В принципе, в этом нет ничего удивительного, так как математически можно показать, что при небольшом диапазоне изменения отношения С/С0уравнения (15) и (17) примерно с одинаковой точностью описывают экспериментальные данные. И для того, чтобы получить достоверные отличия между ними необходимо увеличить диапазон изменения отношения С/С0. Для иллюстрации сказанного на рис. 25 в координатах уравнения (17) показаны экспериментальные результаты работы [31], представленные выше на рис. 21.
Из рис. 25 видно, что в данном случае диапазон изменения отношения С/С0 был достаточно широк, и в координатах уравнения (17) вместо линейной наблюдается ярко выраженная криволинейная зависимость, позволяющая однозначно сделать вывод о том, что уравнение второго порядка не подходит для описания полученных в [31] экспериментальных данных по кинетике взаимодействия ионов хрома(VI) с магнетитом.
Рассмотрим экспериментальные данные по кинетике сорбции ионов хрома(VI) нанопорошком магнетита, представленные на рис. 8 работы [32]. В настоящей статье они были показаны выше на рис. 11. Результаты их обработки по уравнениям (15) и (17) представлены на рис. 26.
Как видно, вследствие небольшого диапазона изменения отношения С/С0, полученные результаты с примерно одинаковой точностью могут быть описаны уравнением (14) с z = 1 и z = 2.
В работе [25] было исследовано восстановление ионов хрома(VI) в водных растворах натуральным и синтетическим магнетитом при рН 4, 6 и 8. Некоторые из полученных экспериментальных данных представлены на рис. 1 этой работы. Результаты их обработки по уравнениям (15) и (17) показаны на рис. 27.
Из рис. 27 следует, что хемосорбция хрома(VI) на природном магнетите тоже может быть с примерно одинаковой точностью описана уравнениями (15) и (17). Ни одному из них не может быть отдано предпочтение. Причина этого все та же – недостаточно широкий диапазон изменения отношения С/С0 в экспериментах [25] с природным магнетитом.
Результаты обработки экспериментальных данных по взаимодействию ионов шестивалентного хрома с синтетическим наномагнетитом, представленные на рис. 1с этой же работы, показаны на рис. 28.
Как видно из рис. 28а, кинетика восстановления ионов хрома(VI) синтетическим магнетитом при рН 6 и 8, как и в работах [32, 37], а также при использовании природного магнетита (рис. 27), тоже с одинаковой точностью может быть описано уравнениями (15) и (17). Однако при рН 4, где диапазон изменения отношения С/С0 был достаточно широк, картина меняется, и только формула (15) корректно описывает полученные результаты. В координатах же уравнения (17) наблюдается криволинейная зависимость (см. рис. 28б).
Восстановление ионов шестивалентного хрома магнетитом при рН 7 было исследовано в работе [45]. Результаты обработки полученных там экспериментальных данных по уравнениям (15) и (17) показаны на рис. 29.
Как видно, результаты этой работы однозначно свидетельствуют о том, что кинетика хемосорбции ионов шестивалентного хрома на магнетите лучше всего описываются уравнением (15).
В другой работе этих же авторов показано, что магнетит восстанавливает на своей поверхности ионы хрома(VI) до хрома(III), и на рис. 1 этой работы представлены данные по кинетике поглощения и восстановления хрома(VI) магнетитом [53]. Результаты обработки этих данных в координатах уравнений (15) и (17) показаны на рис. 30. Видно, что тут наблюдается такая же картина, как и выше: в координатах формулы (15) имеется хорошая линейная зависимость, подтверждающая применимость этого уравнения для описания окислительно-восстановительной реакции между ионами шестивалентного хрома и магнетитом, а в координатах формулы (17) – четко выраженная кривая, свидетельствующая о невозможности описания данного процесса этим уравнением.
Таким образом, анализ опубликованных в литературе экспериментальных данных свидетельствует о том, что кинетика восстановления хрома(VI) магнетитом (т.е. процесс хемосорбции ионов шестивалентного хрома на магнетите) хорошо описывается уравнением реакции первого порядка относительно концентрации хрома(VI) в растворе. Представляет интерес, далее, сравнить значения интегральной константы скорости процесса хемосорбции K в рассмотренных выше работах (где это возможно). Результаты этого сравнения для температуры 25°С графически представлены на рис. 31.
Как видно, между значениями K, рассчитанными по экспериментальным данным работ [25] и [31, 32], имеются значительные расхождения. Более того, значения интегральной константы скорости процесса хемосорбции, которые были рассчитаны по результатам работ [45, 53], оказались равны 1.78 × 10–10 и 1.74 × 10–10 м/с соответственно, что на несколько порядков превышает аналогичные величины для [25, 31, 32]. Поэтому они не показаны на рис. 31. Несмотря на это, на рис. 31 все же прослеживаются некоторые закономерности. Так, расчетные точки для K работ [31, 32] хорошо согласуются между собой и ложатся на одну кривую, хотя в этих работах использовались образцы магнетита, синтезированные разными методами. Общее у них было только одно – в обоих случаях сорбция проводилась в растворе сульфата натрия с концентрацией последнего 400 мг/л. Между значениями K, рассчитанными по экспериментальным данным [25], также наблюдается неплохая корреляция. Все они как для натурального магнетита, так и для синтезированного ложатся на одну кривую (пунктирная линия на рис. 31). Только одна точка для натурального магнетита при рН 8 существенно отклоняется от этой зависимости, что, по-видимому, связано с ошибкой эксперимента. Из рис. 31 также видно, что зависимости для работ [31, 32] и [25] имеют одинаковую форму и идут практически параллельно друг другу, хотя отличаются по значениям в несколько раз. Наблюдаемые отличия в величине K объясняются, видимо, влиянием химического состава раствора, в котором протекал сорбционный процесс. Так, хемосорбцию в работах [31, 32], как уже упоминалось выше, изучали в растворе сульфата натрия (400 мг/л), а в [25] – в растворе 0.01 М NaCl. В работах же [45, 53] взаимодействие ионов хрома(VI) с магнетитом исследовали в 0.1 М растворе NaCl. По данным [54] состав и концентрация фонового электролита оказывают существенное влияние на сорбцию хрома(VI) магнетитом.
Найденный первый порядок (относительно концентрации ионов шестивалентного хрома в растворе) процесса восстановления хрома(VI) магнетитом, на первый взгляд, не согласуется с рассмотренными выше, в предыдущем разделе данной статьи, уравнениями этой реакции. Однако он объясняется, очевидно, тем, что на самом деле восстановление ионов хрома(VI) до хрома(III) железом(II), которое входит в состав магнетита, происходит в результате не одной, а трех последовательных окислительно-восстановительных реакций [7]:
(18)
${\text{Cr}}\left( {{\text{VI}}} \right) + {\text{Fe}}\left( {{\text{II}}} \right) = {\text{Cr}}\left( {\text{V}} \right) + {\text{Fe}}\left( {{\text{III}}} \right),~$(19)
${\text{Cr}}\left( {\text{V}} \right) + {\text{Fe}}\left( {{\text{II}}} \right) = {\text{Cr}}\left( {{\text{IV}}} \right) + {\text{Fe}}\left( {{\text{III}}} \right),~$(20)
${\text{Cr}}\left( {{\text{IV}}} \right) + {\text{Fe}}\left( {{\text{II}}} \right) = {\text{Cr}}\left( {{\text{III}}} \right) + {\text{Fe}}\left( {{\text{III}}} \right).~$Эти реакции протекают на поверхности магнетита. Так, ион хрома(VI), после взаимодействия с ионом Fe(II) в одном месте поверхности магнетита по реакции (18), для дальнейшего своего восстановления до хрома(IV) должен мигрировать в другую точку его поверхности, где есть неокисленный ион Fe(II). Восстановившись там по реакции (19) до Cr(IV) он, затем, снова должен перескочить на новый участок поверхности магнетита, на котором также имеется ион Fe(II), и т.д. В тех местах поверхности магнетита, где произошло восстановление железа(II) до железа(III), структура твердой фазы, очевидно, меняется и образуется маггемит. Так, в работе [55] показано, что в окислительной среде происходит трансформация магнетита именно в маггемит. Появление маггемита в составе порошка магнетита после сорбции ионов шестивалентного хрома доказано, как уже упоминалось выше, во многих работах [40, 41, 45, 48, 49].
Каждая из реакций (18)–(20) имеет, как легко заметить, первый порядок относительно концентрации ионов хрома в растворе. И самая медленная из них определяет общую скорость процесса. По мнению некоторых исследователей, это реакция (19), так как она связана со сменой координационного числа лигандов у ионов хрома, с переходом от тетраэдрической конфигурации к октаэдрической [7, 56].
Соотношение между адсорбционной и полной сорбционной емкостью магнетита по отношению к ионам хрома(VI)
При использовании магнетита в качестве сорбента для удаления токсичных ионов шестивалентного хрома из загрязненных растворов необходимо знать его адсорбционную и полную сорбционную емкость по отношению к ним. Такая оценка для сульфатного раствора (400 мг/л сульфата натрия) была сделана в [31]. Полученные зависимости представлены на рис. 32.
Рис. 32.
Зависимость адсорбционной (○) и полной сорбционной ( ) емкости магнетита по отношению к ионам хрома(VI) от начального значения рН очищаемого
раствора [31].
) емкости магнетита по отношению к ионам хрома(VI) от начального значения рН очищаемого
раствора [31].

Эти зависимости описываются уравнениями [31]:
где qf – полная сорбционная емкость магнетита, мг/м2.Здесь под адсорбционной емкостью подразумевается то количество ионов хрома(VI), которое поглощается поверхностью магнетита в первые минуты сорбционного процесса, когда вкладом хемосорбции можно пренебречь. Под полной же сорбционной емкостью имеется в виду максимальное количество ионов хрома(VI), которое может поглотить магнетит при его очень длительной выдержке в очищаемом растворе или при повышенной температуре проведения сорбции, когда преобладает уже хемосорбционный процесс.
Как видно из рис. 32, с увеличением начального значения рН очищаемого раствора адсорбционная и полная сорбционная емкости магнетита по отношению к хрому(VI) падают и при рН 11 они практически равны нулю. При рН 3.3 полная сорбционная емкость магнетита почти на порядок превосходит его адсорбционную емкость.
Если сравнить между собой рис. 32 и рис. 15, то нетрудно заметить, что значения сорбционной емкости магнетита по отношению к ионам шестивалентного хрома, представленные на рис. 15, занимают промежуточное положение между зависимостями адсорбционной емкости и полной сорбционной емкости, показанными на рис. 32. Так, согласно рис. 15 сорбционная емкость магнетита по отношению к хрому(VI) при рН 6 равна примерно 0.1 мг/м2, в то время, как согласно рис. 32 адсорбционная емкость магнетита при том же значении рН раствора составляет около 0.05 мг/м2, а полная сорбционная емкость – примерно 0.35 мг/м2. Наблюдаемое соотношение вполне закономерно и объяснимо, так как значения сорбционной емкости на рис. 15 соответствуют длительности процесса сорбции около 24 ч. Понятно, что при такой продолжительности процесса становится уже заметным вклад хемосорбции, что и приводит к увеличению найденного значения сорбционной емкости. Поэтому оно превышает аналогичную величину адсорбционной емкости на рис. 32 (0.05 мг/м2). Но так как процесс хемосорбции еще прошел не до конца, то оно ниже полной сорбционной емкости магнетита при данном рН раствора (0.35 мг/м2).
По данным [45] полная сорбционная емкость магнетита при рН 7 по отношению к ионам хрома(VI), как уже упоминалось выше, составляет около 1.1 мг/м2. Эта величина примерно в три раза выше той оценки, что следует из рис. 32 и обусловлена, по-видимому, опять таки, отличием в химическом составе раствора, где происходило взаимодействие магнетита с хромом(VI). Выше уже упоминалось, что концентрация и состав фонового электролита очень сильно влияют на скорость процесса хемосорбции. В [45] фоновым электролитом был раствор 0.1 М NaCl, интегральная константа скорости процесса хемосорбции в котором примерно на два порядка выше той же величины для раствора сульфата натрия с концентрацией 400 мг/л. Вследствие этого, в [45] глубина слоя магнетита, вступившего в окислительно-восстановительную реакцию с ионами шестивалентного хрома была, видимо, больше, чем в [31], что и привело к более высокому значению полной сорбционной емкости в этой работе.
Интересно отметить еще один факт. Из рис. 32 следует, что с повышением рН раствора полная сорбционная емкость магнетита по отношению к ионам хрома(VI) падает. Это не совсем понятно, так как в данном случае протекает гетерогенная реакция, и величина общей площади поверхности частиц магнетита не меняется с изменением рН раствора. Поэтому кислотность раствора не должна оказывать влияния на полную сорбционную емкость магнетита.
Данное явление можно объяснить, если предположить, что оно обусловлено двумя факторами. С одной стороны, это замедление скорости окислительно-восстановительной реакции между хромом(VI) и магнетитом с повышением рН раствора (см. рис. 31), а с другой стороны – возможное уменьшение действующей поверхности магнетита из-за адсорбции на ней гидроксильных ионов. Выше мы уже отмечали, что с повышением рН раствора величина адсорбции этих ионов на поверхность магнетита растет (рис. 2 и 5).
ЗАКЛЮЧЕНИЕ
Таким образом, магнетит является перспективным сорбентом для удаления ионов токсичного шестивалентного хрома из загрязненных природных и сточных вод.
При сорбции ионов хрома(VI) на магнетите одновременно протекают два процесса: обычная адсорбция и хемосорбция (окислительно-восстановительная реакция между ионами шестивалентного хрома и магнетитом). Последняя сопровождается окислением железа(II) в магнетите до железа(III) и восстановлением ионов хрома(VI) до хрома(III) с образованием в поверхностном слое магнетита (или на его поверхности) маггемита и ряда других соединений, в том числе смешанных соединений хрома(III) с железом. Химический состав этих соединений определяется начальной кислотностью раствора, из которого происходит сорбция ионов хрома(VI) и соотношением между их концентрацией и количеством порошка магнетита, введенного в раствор.
Вследствие протекания хемосорбции, в отличие от обычных сорбентов, происходит необратимое связывание ионов шестивалентного хрома магнетитом, что исключает их повторное попадание в окружающую среду.
Кинетика окислительно-восстановительного процесса между хромом(VI) и магнетитом описывается уравнением реакции первого порядка относительно концентрации ионов хрома(VI) в растворе. Параметры этого уравнения определяются кислотностью и составом хромсодержащего раствора. С ростом рН скорость взаимодействия ионов хрома(VI) с магнетитом снижается.
Сорбционная емкость магнетита, по мере насыщения его хромом, необратимо падает. И для ее восстановления необходимо удаление поверхностного слоя у частиц магнетита (например, путем частичного растворения в кислоте). Сорбционная емкость магнетита по отношению к ионам хрома(VI) также уменьшается с ростом рН очищаемого раствора, и при рН > 11 она практически равна нулю.
Список литературы
Salnikow K., Zhitkovich A. // Chem. Res. Toxicol. 2008. V. 21. P. 28–44. https://doi.org/10.1021/tx700198a
Руководство по профессиональным заболеваниям / Под ред. Измерова Н.Ф. М.: Медицина, 1978.
Costa M. // Crit. Rev. Toxicol. 1997. V. 27. P. 431–442. https://doi.org/10.3109/10408449709078442
Zhitkovich A. // Chem. Res. Toxicol. 2011. V. 24. P. 1617–1629. https://doi.org/10.1021/tx200251t
Справочник по профессиональной патологии / Под ред. Грацианской Л.Н. и Ковшило В.Е. М.: Медицина, 1981.
Kurniawan T.A., Chan G.Y.S., Lo W.-H., Babel S. // Chemical Engineering Journal. 2006. V. 118. P. 83–98. https://doi.org/10.1016/j.cej.2006.01.015
Buerge I.J., Hug S.H. // Environ. Sci. Technol. 1997. V. 31. P. 1426–1432.
Jin W., Du H., Zheng S., Zhang Y. // Electrochimica Acta. 2016. V. 191. P. 1044–1055. https://doi.org/10.1016/j.electacta.2016.01.130
Mitrakas M.G., Pantazatou A.S., Tzimou-Tsitouridou R., Sikalidis C.A. // Desalination and Water Treatment. 2011. V. 33(1–3). P. 77–85. https://doi.org/10.5004/dwt.2011.2620
Owlad M., Aroua M.K., Daud W.A.W., Baroutian S. // Water Air Soil Pollut. 2008. V. 200(1). P. 59–77. https://doi.org/10.1007/s11270-008-9893-7
Mohan D., Pittman C.U., Jr. // J. Hazardous Materials. 2006. V. B137. P. 762–811. https://doi.org/10.1016/j.hazmat.2006.06.060
Venditti F., Cuomo F., Ceglie A., Ambrosone L., Lopez F. // J. Hazardous Materials. 2010. V. 173. P. 552–557. https://doi.org/10.1016/j.jhazmat.2009.08.121
Kairbekov Zh.K., Yemelyanova V.S., Shakiyeva T.V., Dossumova B.T., Dzhatkambayeva U.N., Shakiyev E.M. // Advanced Materials Research. 2015. V. 1079–1080. P. 88–94. doi: 10.4028/www.scientific.net/AMR.1079-1080.88.
Moghimi A. // Int. J. Bio-Inorg. Hybr. Nanomater. 2016. V. 5(3). P. 203–212.
Horst M.F., Alvarez M., Lassalle V.L. // Separation Science and Technology. 2016. V. 51. № 3. P. 550–563. https://doi.org/10.1080/01496395.2015.1086801
Saharan P., Chaudhary G.R., Mehta S.K., Umar A. // J. Nanoscience and Nanotechnology. 2014. V. 14. P. 627–643. https://doi.org/10.1166/jnn.2014.9053
Xu P., Zeng G.M., Huang D.L., Feng C.L., Hu S., Zhao M.H., Lai C., Wei Z., Huang C., Xie G.X., Liu Z.F. // Science of the Total Environment. 2016. V. 424. P. 1–10. https://doi.org/10.1016/j.scitotenv.2012.02.023
Hu J., Chen G., Lo I.M.C., ASCE M. // J. Environ. Eng. 2006. V. 132. P. 709–715. https://doi.org/10.1061/(ASCE)0733-9372(2006)132:7(709)
Chowdhury S.R., Yanful E.K. // J. Environmental Management. 2010. V. 91. P. 2238–2247. https://doi.org/10.1016/j.jenvman.2010.06.003
Zhao J., Guan X., Unuma H. // J. Ceramic Society of Japan. 2007. V. 115. № 8. P. 475–478.
Вайнштейн И.А. Очистка и использование сточных вод травильных отделений. М.: Металлургия, 1986. С. 82.
Gheju M. // Water Air Soil Pollut. 2011. V. 222. P. 103–148. https://doi.org/10.1007/s11270-011-0812-y
Pang Y., Zeng G., Tang L., Zhang Y., Liu Y., Lei X., Li Z., Zhang J., Liu Z., Xiong Y. // Chemical Engineering J. 2011. V. 175. P. 222–227. https://doi.org/10.1016/j.cej.2011.09.098
Gallios G.P., Vaclavikova M. // Environ. Chem. Lett. 2008. V. 6. P. 235–240. https://doi.org/10.1007/s10311-007-0128-8
Villacís-García M., Villalobos M., Gutiérrez-Ruiz M. // J. Hazardous Materials. 2015. V. 281. P. 77–86. https://doi.org/10.1016/j.jhazmat.2014.07.007
Hasany S.F., Ahmed I., Rajan J., Rehman A. // Nanoscience and Nanotechnology. 2012. V. 2(6). P. 148–158. https://doi.org/10.5923/j.nn.20120206.01
Котов Ю.А., Осипов В.В., Иванов М.Г., Саматов О.М., Азаркевич Е.И., Мурзакаев А.М., Медведев А.И., Платонов В.В. // ЖТФ. 2002. Т. 72. С. 76–82.
Medvedeva I., Uimin M., Yermakov A., Mysik A., Byzov I., Linnikov O., Rodina I., Platonov V., Osipov V. // J. Nanoparticle Research. 2012. V. 14. № 3. P. 740–750. https://doi.org/10.1007/s11051-012-0740-9
Bernal J.D., Dasgypta D.R., Mackay A.S. // Clay Miner. Bull. 1959. V. 4. № 21. P. 15–30.
Kijama M. // Ibid. 1974. V. 47. № 7. P. 1646–1650.
Линников О.Д., Родина И.В. // Вода: Химия и экология. 2016. № 2. С. 71–82. (Linnikov O.D., Rodina I.V. // Sci Revs Chem. 2018. V. 8. № 1. P. 1–17.)
Линников О.Д., Родина И.В., Шевченко В.Г., Ермаков А.Е., Медведева И.В., Мысик А.А., Уймин М.А., Щеголева Н.Н., Платонов В.В., Осипов В.В. // Вода: химия и экология. 2011. № 5. С. 68–75. (Linnikov O., Rodina I., Shevchenko V., Medvedeva I., Uimin M., Schegoleva N., Yermakov A., Platonov V., Osipov V. // Desalination and water treatment. 2014. V. 52. № 1–3. P. 324–330.)https://doi.org/10.1080/19443994.2013.786654
Barale M., Lefèvre G., Carrette F., Catalette H., Fèdoroff M., Cote G. // J. Colloid and Interface Science. 2008. V. 328. P. 34–40. https://doi.org/10.1016/j.jcis.2008.09.007
Vidojkovic S., Rodriguez-Santiago V., Fedkin M.V., Wesolowski D.J., Lvov S.N. // Chemical Engineering Science. 2011. V. 66. P. 4029–4035. https://doi.org/10.1016/j.ces.2011.05.021
Tombácz E., Illés E., Majzik A., Hajdú A., Rideg N., Szekeres M. // Croatica Chemica Acta CCACCA. 2007. V. 80. № 3–4. P. 503–515.
Hu J., Lo I.M.C., Chen G. // Water Science and Technology. 2004. V. 50. № 12. P. 139–146. https://doi.org/10.2166/wst.2004.0706
Namdeo M., Bajpai S.K. // EJEAFChe. 2008. V. 7(7). P. 3082–3094.
Фролов Ю.Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. / Изд. 2-е исправл. и допол. М.: Химия, 1988.
Лесникович А.И., Воробьева С.А., Карпенко Н.В. // ЖПХ. 1994. Т. 67. В. 3. С. 500–502. (Lesnikovich A.I., Vorobyova S.A., Karpenko N.V. // Zh. Prikl. Khim. 1994. V. 67. P. 500–502, in Russian.)
Yuan P., Liu D., Fan M., Yang D., Zhu R., Ge F., Zhu J., He H. // J. Hazardous Materials. 2010. V. 173. P. 614–621. https://doi.org/10.1016/j.jhazmat.2009.08.129
Chowdhury S.R., Yanful E.K., Pratt A.R. // J. Hazardous Materials. 2012. V. 235–236. P. 246–256. https://doi.org/10.1016/j.jhazmat.2012.07.054
Zhu Z., Zhu Y., Yang F., Zhang X., Qin H., Liang Y., Liu J. // Desalination and Water Treatment. 2014. V. 52. № 16–18. P. 3133–3146. https://doi.org/10.1080/19443994.2013.798841
Кузнецов М.В., Линников О.Д., Родина И.В. // Неорганические материалы. 2012. Т. 48. № 2. С. 213–219. (Kuznetsov M.V., Linnikov O.D., Rodina I.V. // Inorganic Materials. 2012. V. 48. № 2. P. 169–175. )https://doi.org/10.1134/S0020168512020148
Булдакова Л.Ю., Линников О.Д., Родина И.В., Янченко М.Ю. // Неорганические материалы. 2015. Т. 2. № 2. С. 180–183. (Buldakova L.Yu., Linnikov O.D., Rodina I.V., Yanchenko M.Yu. // Inorganic Materials. 2015. V. 51. № 2. P. 138–141. )https://doi.org/10.1134/S0020168515010033
Peterson M., White A.F., Brown E., Jr., Parks G.A. // Environ. Sci. and Technol. 1997. V. 31. № 5. P. 1573–1576.
Jung Y., Choi J., Lee W. // Chemosphere. 2007. V. 68. P. 1968–1975. https://doi.org/10.1016/j.chemosphere.2007.02.028
Kendelewicz T., Liu P., Doyle C.S., Brown G.E., Nelson E.J., Chambers S.A. // Surface Science. 1999. V. 424. P. 219–231.
He Thomas Y., Traina S.J. // Environ. Sci. and Technol. 2005. V. 39. P. 4499–4504.
Kendelewicz T., Liu P., Doyle C.S., Brown G.E. // Surface Science. 2000. V. 469. P. 144–163.
Eary L.E., Rai D. // Environ. Sci. and Technol. 1988. V. 22. P. 972–977.
Li X., Cao J., Zhang W. // Ind. Eng. Chem. Res. 2008. V. 47. № 7. P. 2131–2139.
Chen S.-S., Hsu B.-C., Hung L.-W. // J. Hazardous Materials. 2008. V. 152. P. 1092–1097. https://doi.org/10.1016/j.jhazmat.2007.07.086
Peterson M., Brown G.E., Parks G.A. // Colloid and Surfaces A. 1996. V. 107. P. 77–88.
Meena A.H., Arai Y. // Meena and Arai Geochem. Trans. 2016. V. 17. P. 1–13. https://doi.org/10.1186/s12932-016-0033-9
White A.F., Peterson M.L., Hochella M.F., Jr. // Geochimica et Cosmochimica Acta. 1994. V. 58. № 8. P. 1859–1875.
Tong J.Y., King E.L. // J. Am. Chem. Soc. 1960. V. 82. № 15. P. 3805–3809.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов