Физикохимия поверхности и защита материалов, 2021, T. 57, № 2, стр. 215-224
Влияние морфологических неоднородностей поверхности на микорезистентность полимерных пленок
Г. О. Рытиков 1, 2, Ф. А. Доронин 1, *, А. Г. Евдокимов 1, Ю. В. Рудяк 1, В. Г. Назаров 1
1 Московский политехнический университет
107023 Москва, ул. Б. Семеновская, 38, Россия
2 Государственный университет управления
109542 Москва, Рязанский просп., 99, Россия
* E-mail: fedordoronin@gmail.com
Поступила в редакцию 06.03.2020
После доработки 17.03.2020
Принята к публикации 24.03.2020
Аннотация
В медицине, сельском хозяйстве, машиностроении и текстильной промышленности широко применяются такие полимерные материалы, как полиэтилен, полипропилен, поливинилхлорид, полибутадиен и полиэтилентерефталат. В результате экспериментального исследования этих материалов на микостойкость к развитию и деструктивному воздействию смесевой колонии микромицет Aspergillus Niger; Aspergillus Terreus и Penicillium Cyclopium показано, что наибольшей и наименьшей микорезистентностями обладают полиэтилентерефталат и поливинилхлорид соответственно. Выдвинуто предположение о наличии нелинейной связи между значениями свободной поверхностной энергии рассматриваемых материалов и степенью их микостойкости. Предложен подход к моделированию текстур поверхностей экспериментальных образцов и количественному описанию динамики развития колоний микроорганизмов на основании анализа соответствующих оптических изображений.
ВВЕДЕНИЕ
В современных системах поддержки и обеспечения жизнедеятельности человека, домашних животных и сельскохозяйственных растений [1–5] широко применяются обладающие рядом полезных свойств и преимуществ перед другими материалами синтетические конструкционные [6–8] и функциональные [9–18] полимеры и полимерные композиты [19–32]. Однако использование этих материалов при определенных неблагоприятных условиях (повышенная влажность, низкая освещенность, отсутствие циркуляции воздуха и т.д.) может способствовать развитию колоний болезнетворных многоклеточных организмов (микромицет), вызывающих инфекционные заболевания и обширные поражения различных тканей человека [33–37], животных [38–41] и растений [42–47] (микозы).
Для предотвращения биологического загрязнения помещений и медицинского оборудования в организациях здравоохранения применяются кварцевание, термическая и химическая обработка [48–56]. При этом грибки демонстрируют высокую стойкость относительно УФ-облучения и сохраняют жизнеспособность в широком диапазоне температур, а хлорирование эффективно уничтожает колонии микромицетов при непосредственном контакте, но не всегда позволяет обеспечить уничтожение спор в труднодоступных для механической обработки зонах помещений, внутри корпусов медицинского оборудования, а также в микротрещинах и микропорах поверхностей элементов систем поддержки жизнеобеспечения пациентов (емкостей для хранения крови и лекарственных препаратов, катетеров, шприцов, соединительных трубок и т.д.) [57].
В помещениях, предназначенных для выращивания домашних животных, хранения и переработки сельскохозяйственной продукции, применение вышеуказанных мер зачастую оказывается весьма затруднительным в силу высокой токсичности специальных средств предотвращения микологического заражения [58–61]. При этом низкий уровень циркуляции воздуха, отсутствие естественного освещения и высокая влажность зачастую оказываются необходимыми условиями реализации соответствующих производственных процессов [62–66].
Благодаря биосовместимости (химической инертности, эластичности и механической прочности) широкое применение в медицине и сельском хозяйстве нашли такие материалы как поливинилхлорид (ПВХ), полиэтилен (ПЭ) и полипропилен (ПП). В качестве вспомогательных материалов также широко используются всевозможные резиновые смеси (РС) и полиэтилентерефталат (ПЭТФ) [67–76]. Все эти материалы (кроме ПЭТФ) в той или иной степени подвержены микозагрязнению, несмотря на их многочисленные полезные свойства.
Высокую патогенную активность на ткацких, бумагопрядильных и мукомольных предприятиях демонстрирует класс микромицетов Aspergillus, вызывающих различные формы аспергиллеза при заражении ингаляционным путем вследствие вдыхания работниками содержащих мицелий гриба частиц пыли [77–80]. Также относительно благоприятные условия для развития патогенных микромицетов наблюдаются на добывающих и перерабатывающих предприятиях, в вентиляционных и душевых системах, кондиционерах и увлажнителях воздуха, кулерах и холодильных установках для хранения пищевых продуктов [81–86].
Эффективное микозное поражение плодов сельскохозяйственных растений наблюдается при развитии в помещениях для их хранения класса микромицетов Penicillium [87–89]. При этом грибок обладает настолько высокой стойкостью к различным внешним воздействиям, что колонии соответствующих микроорганизмов могут впоследствии наблюдаться на продуктах переработки, а также поражать внутренности сельскохозяйственных животных, употреблявших зараженные растения в качестве корма.
Таким образом, разработка полимерных материалов, препятствующих развитию колоний плесневых грибков на соответствующих поверхностях, характеризуемых низкой микоадгезией и высокой микорезистентностью, является важной задачей современного материаловедения.
ЭКСПЕРИМЕНТ
Согласно методикам ГОСТ 9.049-91 “Материалы полимерные и их компоненты. Методы лабораторных испытаний на стойкость к воздействию плесневых грибов” и ГОСТ 9.048-89 “Изделия технические. Методы лабораторных испытаний на стойкость к воздействию плесневых грибов” в течение 29 сут выполняли исследования экспериментальных образцов (пленок ПВХ, ПЭ, ПП, ПЭТФ и резины на основе бутадиеннитрильного каучука (РС-26)) в форме квадратов со стороной 2 см) на микорезистентность в условиях, имитирующих минеральные загрязнения. Из перечня рекомендованных в ГОСТ 9.049-91 (п. 1.3), были выбраны 3 вида микроскопических грибов, наиболее агрессивных к полимерным материалам: Aspergillus Niger; Aspergillus Terreus и Penicillium Cyclopium. Оптическое фотографирование экспериментальных образцов осуществляли с помощью цифрового фотоаппарата Nikon D90 с цифровой зеркальной камерой (DSLR) со светочувствительной CMOS-матрицей (23.6 × 15.8 мм) формата Nikon DX (кроп-фактор 1.5) Sony IMX-038-BQL с разрешением ~12.3 мегапикселей. Максимальные разрешения снимков составили 4288 × 2848 пикселей.
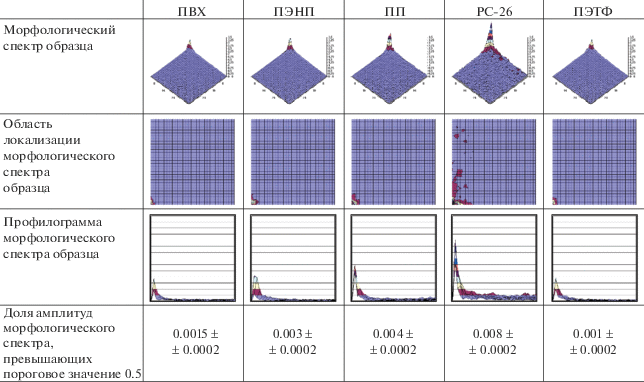
Полученные оптические изображения поверхностей экспериментальных образцов, и соответствующие цифровые модели представлены в табл. 1.
ТЕОРИЯ
Микостойкость образцов полимерных материалов отличается, вероятнее всего, вследствие различных значений свободной поверхностной энергии ${{\gamma }_{S}}$, обусловленной отличиями как химического состава, так и микротекстуры соответствующих поверхностей.
Прямое измерение свободной поверхностной энергии может быть выполнено средствами сканирующей электронной микроскопии (СЭМ) в режиме регистрации рассеяния вторичных электронов. Однако соответствующие измерения являются весьма дорогостоящими, а их результаты требуют дополнительной математической обработки для количественного описания характера распределения энергетического потенциала поверхности в пространстве. Хорошо зарекомендовавшим себя косвенным методом измерения свободной поверхностной энергии является изучение смачивания исследуемых поверхностей жидкостями.
Согласно предложенной Д.В. ван Кревеленом формуле [90]:
(1)
$\left( {\cos \theta + 1} \right){{\gamma }_{L}} = 2\sqrt {\gamma _{S}^{D}\gamma _{L}^{D}} + 2\sqrt {\gamma _{S}^{P}\gamma _{L}^{P}} $Для этого необходимо разрешить систему линейных уравнений:
(2)
$\left\{ {\begin{array}{*{20}{c}} {\sqrt {\gamma _{1}^{D}} \sqrt {\gamma _{S}^{D}} + \sqrt {\gamma _{1}^{P}} \sqrt {\gamma _{S}^{P}} = \tfrac{{{{\gamma }_{1}}}}{2}\left( {\cos {{\theta }_{1}} + 1} \right)} \\ {\sqrt {\gamma _{2}^{D}} \sqrt {\gamma _{S}^{D}} + \sqrt {\gamma _{2}^{P}} \sqrt {\gamma _{S}^{P}} = \tfrac{{{{\gamma }_{2}}}}{2}\left( {\cos {{\theta }_{2}} + 1} \right),} \end{array} } \right.$В общем случае, решение этой системы уравнений имеет вид:
(3a)
$\begin{gathered} \gamma _{S}^{D} = \\ = \,\frac{{{{{\left( {\left( {{{\gamma }_{1}}{\kern 1pt} \sqrt {\gamma _{2}^{P}} \, - \,{{\gamma }_{2}}{\kern 1pt} \sqrt {\gamma _{1}^{P}} } \right)\, + \,{{\gamma }_{1}}\sqrt {\gamma _{2}^{P}} {\kern 1pt} \cos {\kern 1pt} {{\theta }_{1}}\, - \,{{\gamma }_{2}}\sqrt {\gamma _{1}^{P}} {\kern 1pt} \cos {\kern 1pt} {{\theta }_{2}}} \right)}}^{2}}}}{{4\,{{{\left( {\sqrt {\gamma _{1}^{D}} \sqrt {\gamma _{2}^{P}} \, - \,\sqrt {\gamma _{1}^{P}} \sqrt {\gamma _{2}^{D}} } \right)}}^{2}}}}, \\ \end{gathered} $(3б)
$\begin{gathered} \gamma _{S}^{P} = \\ = \,\frac{{{{{\left( {\left( {{{\gamma }_{2}}{\kern 1pt} \sqrt {\gamma _{1}^{D}} \, - \,{{\gamma }_{1}}\sqrt {\gamma _{2}^{D}} } \right)\, - \,{{\gamma }_{1}}\sqrt {\gamma _{2}^{D}} {\kern 1pt} \cos {\kern 1pt} {{\theta }_{1}}\, + \,{{\gamma }_{2}}\sqrt {\gamma _{1}^{D}} {\kern 1pt} \cos {\kern 1pt} {{\theta }_{2}}} \right)}}^{2}}}}{{4\,{{{\left( {\sqrt {\gamma _{1}^{D}} \sqrt {\gamma _{2}^{P}} \, - \,\sqrt {\gamma _{1}^{P}} \sqrt {\gamma _{2}^{D}} } \right)}}^{2}}}}. \\ \end{gathered} $Результаты измерений краевых углов смачивания дистиллированной водой и этиленгликолем, а также результаты расчетов значений свободных поверхностных энергий экспериментальных образцов в приближении идеально гладких поверхностей представлены в табл. 2.
Таблица 2.
Краевые углы смачивания и свободные поверхностные энергии экспериментальных образцов, рассчитанные в приближении идеально гладких поверхностей
| Химическая формула | ${{\Theta }_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$, град |
${{\Theta }_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{4}}}}{{{{\text{(OH)}}}}_{{\text{2}}}}}}}$, град |
$\gamma _{S}^{D}$, мН/м |
$\gamma _{s}^{P}$, мН/м |
γs, мН/м |
|
|---|---|---|---|---|---|---|
| ПВХ | ${{\left[ { - {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - {\kern 1pt} {\text{CHCl}}{\kern 1pt} - } \right]}_{n}}$ | 87 ± 8 | 56 ± 8 | 32 ± 3 | 2.6 ± 0.5 | 34 ± 4 |
| ПЭ | ${{\left[ { - {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - {\kern 1pt} {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - } \right]}_{n}}$ | 82 ± 7 | 57 ± 4 | 23 ± 2 | 7.0 ± 0.6 | 30 ± 3 |
| ПП | ${{\left[ { - {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - {\kern 1pt} {\text{CH}}\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right){\kern 1pt} - } \right]}_{n}}$ | 81 ± 6 | 59 ± 6 | 19 ± 2 | 9.2 ± 0.9 | 28 ± 3 |
| РС-26 | ${{\left[ { - {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - {\kern 1pt} {\text{CH = CH}}{\kern 1pt} - {\kern 1pt} {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - } \right]}_{n}}$— [–CH2–CH(CN)–]m | 80 ± 5 | 60 ± 5 | 16 ± 2 | 11 ± 1 | 27 ± 3 |
| ПЭТФ | ${{\left[ { - {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - {\kern 1pt} {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} - {\kern 1pt} {\text{O}}{\kern 1pt} - {\kern 1pt} {\text{C}}({\text{O)}}{\kern 1pt} - {\kern 1pt} {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\kern 1pt} - {\kern 1pt} {\text{C}}({\text{O)}}{\kern 1pt} - {\kern 1pt} {\text{O}}{\kern 1pt} - } \right]}_{n}}$ | 60 ± 4 | 32 ± 2 | 20 ± 2 | 21 ± 2 | 41 ± 4 |
Для моделирования морфологии исследуемых на микостойкость образцов были адаптированы техники анализа изображений, представленные в [91–93]. Сформированные с помощью фотоаппарата цифровые образы анализируемых поверхностей подвергались численному разложению в двумерный ряд Фурье. Полученные амплитуды бигармоник ${{a}_{{kl}}},{{b}_{{kl}}},{{c}_{{kl}}},{{d}_{{kl}}}$ позволили сформировать амплитудно-частотные характеристики (морфологические спектры) исследуемых образцов:
(4)
${{I}_{{kl}}} = {{A}_{{kl}}}{{\left( {\sqrt {1 + {{\varphi }_{{kl}}}} + \sqrt {1 - {{\varphi }_{{kl}}}} } \right)} \mathord{\left/ {\vphantom {{\left( {\sqrt {1 + {{\varphi }_{{kl}}}} + \sqrt {1 - {{\varphi }_{{kl}}}} } \right)} 2}} \right. \kern-0em} 2},$Значения ${{I}_{{kl}}}$ характеризуют размах вариации двумерных гармонических текстур, суперпозиция которых формирует аналитическую модель отражающе-рассеивающей поверхности образца. Соответствующие морфологические спектры представлены в табл. 3.
В силу высокой степени гетерогенности химического состава наибольшей морфологической неоднородностью ожидаемо обладает резиновая смесь РС-26, представляющая собой композицию бутадиеннитрильного каучука с различными технологическими добавками. Наименьшую морфологическую гетерогенность демонстрируют экспериментальные образцы на основе ПЭТФ и ПВХ.
На рис. 1 представлены зависимости свободной поверхностной энергии, ее дисперсионной и полярной компонент от интегральной структурной характеристики поверхностей экспериментальных образцов – характерного размера области локализации морфологического спектра в пространстве векторов обратной решетки, оцениваемой количественно в соответствии с [91–93] как доля амплитуд, превышающих пороговое значение 0.5. Модель микрорельефа поверхности образца формируется как суперпозиция пространственных решеток с амплитудами, превышающими пороговое значение. Совокупность подпороговых амплитуд морфологического спектра формируют модель морфологического шума.
Рис. 1.
Зависимости свободной поверхностной энергии (1), ее дисперсионной (2) и полярной (3) составляющих от превышающих пороговое значение 0.5 долей амплитуд морфологических спектров, характеризующих изображения экспериментальных образцов. Ромбами представлены расчетные значения свободной поверхностной энергии, треугольниками и квадратами – расчетные значения дисперсионной и полярной компонент этой величины. Непрерывная (1), штриховая (2) и штрихпунктирная (3) линии соответствуют гиперболическим моделям аппроксимации экспериментальных данных, спецификация параметров которых осуществлялась методом наименьших квадратов. Треугольником и квадратом с точкой обозначены дисперсионная и полярная составляющие свободной поверхностной энергии ПЭТФ.
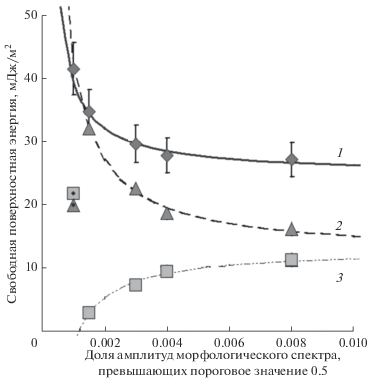
Аппроксимацию экспериментальных данных выполняли с помощью гиперболических моделей аппроксимации экспериментальных данных, спецификация параметров которых осуществлялась методом наименьших квадратов.
Видно, что, во-первых, полярная составляющая свободной поверхностной энергии обратно пропорциональна доле статистически значимых амплитуд морфологического спектра, и, во-вторых, изменение полной свободной поверхностной энергии рассматриваемых образцов в большей степени определяется вариацией дисперсионной составляющей свободной поверхностной энергии.
Таким образом, анализ трансформаций морфологических спектров оптических изображений поверхностей экспериментальных образцов, сопровождающих структурные изменения последних, позволяет с определенной точностью (относительная погрешность ~10%) прогнозировать динамику соответствующих значений свободной поверхностной энергии.
В табл. 4 представлены морфологические спектры изображений экспериментальных образцов через 18 сут после начала исследования на микостойкость.
Таблица 4.
Балльная оценка степени микозагрязнения и морфологические спектры оптических изображений экспериментальных образцов через 18 сут после начала исследования на микостойкость
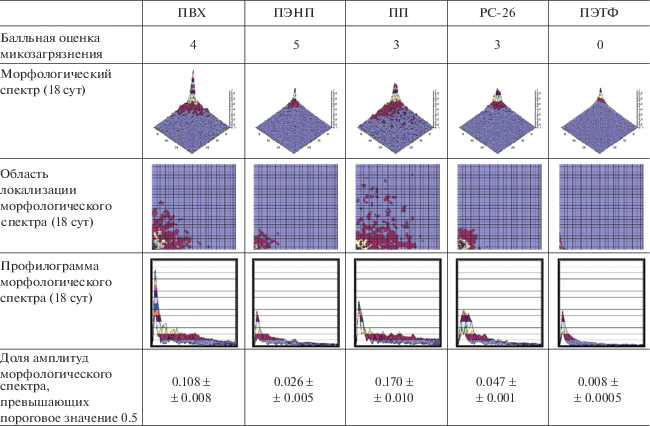
Видно, что во всех случаях, кроме ПЭТФ, морфологические спектры существенно отличаются от первоначальных, что свидетельствует либо о заселении рассматриваемых поверхностей колониями микроорганизмов, либо о результатах жизнедеятельности таких колоний, повлекших изменение поверхностной текстуры и, как следствие, оптической плотности соответствующих изображений.
Наибольшей областью локализации морфологического спектра по пороговому уровню яркости пикселей (0.5) в середине исследования обладал ПП, а наименьшей, как и в начала исследования – ПЭТФ. Это, по всей видимости, означает, что, несмотря на относительно низкую балльную оценку степени заселенности поверхности материала, образец ПП был подвержен наиболее эффективному воздействию микромицетов и/или продуктов их жизнедеятельности в течение первых двух недель исследования. При этом на образце на основе ПЭТФ микромицеты не были обнаружены, но наблюдалось некоторое изменение оптической плотности поверхности, что, вероятнее всего, можно интерпретировать как результат незначительных отклонений в условиях получения изображений в разные моменты времени и использовать в качестве дополнительной оценки погрешности выполняемых измерений.
В табл. 5 представлены морфологические спектры изображений экспериментальных образцов через 29 сут после начала исследования на микостойкость.
Таблица 5.
Балльная оценка степени микозагрязнения и морфологические спектры оптических изображений рассматриваемых образцов через 29 сут после начала исследования на микостойкость

Коэффициент корреляции Пирсона между балльной оценкой степени микозагрязнения через 29 сут после начала исследования и долей амплитуд морфологического спектра, превышающих пороговое значение 0.5, составил 0.91 ± 0.08.
Видно, что наибольшей областью локализации морфологического спектра по пороговому уровню яркости пикселей (0.5) обладает ПВХ, а наименьшей – ПЭТФ. Это означает, что через 29 сут с начала исследования поверхность ПВХ приобрела наибольшую в рассматриваемой выборке “оптическую” неоднородность, что, по всей видимости, свидетельствует об эффективном воздействии смешанной колонии микроорганизмов на этот материал. Микозагрязнение ПЭНП также сопровождается постепенной деструкцией его поверхности, что может свидетельствовать об использовании этих материалов микромицетами в качестве пищи и среды обитания.
Уменьшение оптической неоднородности поверхности ПП, сопровождаемое увеличением значения балльной оценки степени микозагрязнения, по всей видимости, свидетельствует о заполнении микромицетами и продуктами их жизнедеятельности неоднородностей поверхности, наблюдавшихся через 18 сут с начала исследования. Таким образом, механизм микодеструкции полипропилена предполагает наличие по крайней мере двух стадий – формирование поверхностных неоднородностей, например, в результате воздействия одной из компонент смеси микроорганизмов, и последующее “выравнивающее” заселение соответствующих неоднородностей представителями другой компоненты использованной смеси микроорганизмов. По всей видимости, аналогичным, но выраженным менее ярко, является механизм микозагрязнения РС-26. В результате жизнедеятельности развившихся на этом образце микроорганизмов оптическая неоднородность через 29 сут с начала исследования существенно падает, что может свидетельствовать о заполнении микромицетами и/или их спорами микротрещин и микропор, сформированных за первые 18 сут исследования. Также возможным является частичное подавление жизнедеятельности колонии микроорганизмов в результате высвобождения газообразных биоцидов из замкнутых объемных микропор в результате нарушения их целостности вследствие микоразложения анализируемых полимеров.
Отсутствие изменений в морфологическом спектре ПЭТФ интерпретируется как высокая степень микологической резистентности этого полимера, вероятнее всего обусловленная существенными отличиями его химического состава и строения от остальных экспериментальных образцов.
ЗАКЛЮЧЕНИЕ
Наиболее высокую и самую низкую микорезистентность показали образцы на основе ПЭТФ и на основе ПВХ соответственно. Видно, что максимальное отклонение от наблюдаемого среднего значения оптических плотностей изображений колоний микроорганизмов соответствует наибольшему количеству заселенных микромицетами фрагментов анализируемой поверхности. При этом балльная оценка степени микозагрязнения может рассматриваться преимущественно как инструмент качественной оценки уровня развития колонии микроорганизмов и малопригодна для количественного описания динамики роста таких колоний.
Микостойкость ПЭТФ, вероятнее всего, объясняется особенностями химического состава и структуры. Для остальных рассмотренных материалов вероятность первичной адгезии (скорее всего, спор) микромицетов оказалась тем выше, чем более гладкими являются их поверхности. Это означает, что для рассмотренных и подобных им полимеров доминирует адгезионный механизм первичного биозагрязнения соответствующих поверхностей. Характер динамики оптической плотности биомасс колоний микромицетов свидетельствует о вероятном использовании микроорганизмами не содержащих кислород полимеров в качестве пищи, о чем свидетельствует увеличение области локализации морфологических спектров, связанное с возникновением новых малозаметных невооруженным глазом неоднородностей поверхностей экспериментальных образцов. Уменьшение средней шероховатости заселенного микромицетами ПП и РС-26 относительно наблюдавших через 18 сут с начала исследования значений, вероятнее всего, объясняется преимущественным заполнением колонией микроорганизмов микротрещин на поверхностях экспериментальных образцов, обусловленным большими значениями свободной поверхностной энергии в этих зонах. Для повышения микорезистентности экспериментальных образцов в дальнейшем будет выполнена их поверхностная модификация методами фторирования, сульфирования и плазмохимической обработки [94–96].
В результате применения разработанного метода количественной характеризации изображений поверхностей полимерных материалов показано, что наблюдается высокий уровень корреляции между балльной оценкой степени микозагрязненности и долей надпороговых (по уровню яркостей пикселей 0.5) амплитуд морфологических спектров. Учитывая возможность осуществлять фотографирование образцов с практически любой периодичностью и без изменения сформировавшейся искусственной среды обитания изучаемых микроорганизмов, разработанный метод представляет значительный интерес для высокоточного объективизированного количественного анализа динамики развития колоний микромицетов на поверхностях различных полимеров и композиционных материалов на их основе.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта 18-29-05037 мк).
Список литературы
Юрисов А.О., Гальченко Б.В., Плотников Б.В. Барокомплекс // Патент на изобретение RUS 2062085 02.06.1992.
Батов В.А., Лагерев Г.А. Медицинский регулятор вакуума // Патент на изобретение RUS 2294214 11.05.2005.
Марченко Н.М., Марченко А.Н., Лобачевский Я.П., Личман Г.И., Педай Н.П., Михеев В.В., Рогачев В.Р., Тыкушин А.А. Способ и устройство дифференцированного припосевного внесения основных и стартовых доз минеральных удобрений // Патент на изобретение RUS 2452167 01.11.2010.
Измайлов А.Ю., Лобачевский Я.П. // Сельскохозяйственные машины и технологии. 2013. № 6. С. 6–10.
Мирошников С.А., Сизова Е.А. // Вестник мясного скотоводства. 2017. № 3(99). С. 7–22.
Коржиков В.А., Влах Е.Г., Тенникова Т.Б. // Высокомолекулярные соединения. Серия А. 2012. Т. 54. № 8. С. 1203.
Антонова Л.В., Насонова М.В., Кудрявцева Ю.А., Головкин А.С. // Бюллетень сибирской медицины. 2012. Т. 11. № 1. С. 128–134.
Хараев А.М., Бажева Р.Ч., Чайка А.А., Лукожев Р.В., Инаркиева З.И. // Пластические массы. 2013. № 9. С. 22–26.
Nazarov V.G. // Kolloidnyj Zhurnal. 1997. V. 59(2). P. 226–232.
Белошенко В.А., Варюхин В.Н., Возняк Ю.В. // Успехи химии. 2005. Т. 74. № 3. С. 285–306.
Помогайло А.Д. // Высокомолекулярные соединения. Серия А. 2008. Т. 50. № 12. С. 2090–2101.
Nazarov V.G., Stolyarov V.P., Baranov V.A., Evlampieva L.A. // Russian J. General Chemistry. 2009. 79(3). P. 565–577.
Шибаев В.П. // Высокомолекулярные соединения. Серия А. 2009. Т. 51. № 11. С. 1863–1929.
Nazarov V.G., Volynskii A.L., Yarysheva L.M., Stolyarov V.P., Bakeev N.F. // Polymer Science – Series A. 2012. V. 54(9). P. 679–683.
Пьянова Л.Г., Бакланова О.Н., Лихолобов В.А., Дроздов В.А., Саланов А.Н., Талзи В.П., Седанова А.В., Княжева О.А. // Физикохимия поверхности и защита материалов. 2013. Т. 49. № 4. С. 408–417.
Kharitonov A.P., Simbirtseva G.V., Nazarov V.G. Kharitonov A.P., Simbirtseva G.V., Nazarov V.G., Stolyarov V.P., Dubois M., Peyroux J. // Progress in Organic Coatings. 2015. V. 88. P. 127–136.
Багровская Н.А., Алексеева О.В. // Физикохимия поверхности и защита материалов. 2012. Т. 48. № 2. С. 197–200.
Барсукова М.О., Сапченко С.А., Дыбцев Д.Н., Федин В.П. // Успехи химии. 2018. Т. 87. № 11. С. 1139–1167.
Nazarov V.G. // Doklady Akademii Nauk. 1997. V. 352(1). P. 60–63.
Попов В.К., Краснов А.П., Воложин А.И., Хоудл С.М. // Перспективные материалы. 2004. № 4. С. 49–57.
Озерин А.Н., Зеленецкий А.Н., Акопова Т.А., Павлова-Веревкина О.Б., Озерина Л.А., Сурин Н.М., Кечекьян А.С. // Высокомолекулярные соединения. Серия А. 2006. Т. 48. № 6. С. 983–989.
Кодолов В.И., Благодатских И.И., Ляхович А.М., Лялина Н.В., Шарипова А.Г., Тринеева В.В. // Химическая физика и мезоскопия. 2007. Т. 9. № 4. С. 422–429.
Охлопкова А.А., Петрова П.Н., Попов С.Н., Федоров А.Л. // Трение и износ. 2008. Т. 29. № 2. С. 177–180.
Озерин А.Н., Перов Н.С., Зеленецкий А.Н., Акопова Т.А., Озерина Л.А., Кечекьян А.С., Сурин Н.М., Владимиров Л.В., Юловская В.Д. // Российские нанотехнологии. 2009. Т. 4. № 5–6. С. 76–79.
Соколова Ю.А., Шубанов С.М., Кандырин Л.Б., Калугина Е.В. // Пластические массы. 2009. № 3. С. 18–23.
Бадамшина Э.Р., Гафурова М.П., Эстрин Я.И. // Успехи химии. 2010. Т. 79. № 11. С. 1027–1064.
Рощина Т.М., Китаев Л.Е., Глазкова С.В., Гурьев Ю.В. // Физикохимия поверхности и защита материалов. 2010. Т. 46. № 4. С. 353–360.
Герасин В.А., Антипов Е.М., Карбушев В.В., Куличихин В.Г., Карпачева Г.П., Тальрозе Р.В., Кудрявцев Я.В. // Успехи химии. 2013. Т. 82. № 4. С. 303–332.
Кропотин О.В., Машков Ю.К., Егорова В.А., Кургузова О.А. // Журн. технической физики. 2014. Т. 84. № 5. С. 66–70.
Баронин Г.С., Бузник В.М., Юрков Г.Ю., Завражин Д.О., Кобзев Д.Е., Худяков В.В., Мещерякова Ю.В., Фионов А.С., Овченков Е.А., Ашмарин А.А., Бирюкова М.И. // Перспективные материалы. 2014. № 7. С. 50–61.
Песецкий С.С., Мышкин Н.К. // Полимерные материалы и технологии. 2016. Т. 2. № 4. С. 6–29.
Кряжев Ю.Г., Вольфкович Ю.М., Мельников В.П., Рычагов А.Ю., Тренихин М.В., Солодовниченко В.С., Запевалова Е.С., Лихолобов В.А. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 3. С. 266–269.
Сергеев А.Ю., Сергеев Ю.В. // Consilium Medicum. 2003. Т. 5. № 3. С. 128–135.
Сергеев А.Ю., Сергеев Ю.В. // Иммунопатология, аллергология, инфектология. 2004. № 1. С. 6–14.
Лесовой В.С., Липницкий А.В., Очкурова О.М. // Проблемы медицинской микологии. 2004. Т. 6. № 2. С. 19–23.
Иванова Л.В., Баранцевич Е.П., Шляхто Е.В. // Проблемы медицинской микологии. 2011. Т. 13. № 1. С. 14–17.
Доршакова Е.В., Елинов Н.П., Павлова И.Э., Богомолова Т.С., Чилина Г.А., Васильева Н.В. // Проблемы медицинской микологии. 2012. Т. 14. № 3. С. 53–58.
Женихова Н.И., Бадова О.В., Абрамов А.В., Шилова Е.Н. // Аграрный вестник Урала. 2013. № 12(118). С. 29–31.
Ндайишимийе Э.В., Хаммадов Н.И., Осянин К.А., Фаизов Т.Х., Шуралев Э.А., Мукминов М.Н. // Ветеринарный врач. 2015. № 2. С. 3–9.
Портянко А.В., Гофман А.А., Лыско С.Б., Красиков А.П. // Птицеводство. 2017. № 9. С. 34–38.
Решетников А.Д., Неустроев М.П., Тарабукина Н.П., Барашкова А.И., Скрябина М.П. // Известия Самарского научного центра Российской академии наук. 2017. Т. 19. № 5–2. С. 373–380.
Хадеев Т.Г., Таланов И.П., Фомин В.Н. // Защита и карантин растений. 2010. № 6. С. 30–32.
Холод Н.А., Яковенко В.В., Семенова Л.Г. // Плодоводство и виноградарство Юга России. 2012. № 18(6). С. 80–88.
Якуба Г.В. // Плодоводство и ягодоводство России. 2013. Т. 36. № 2. С. 355–360.
Глинушкин А.П., Кошеваров Ю.А., Соловых А.А., Райов А.А., Хилько Л.Н. // Вестник Орловского государственного аграрного университета. 2013. № 1(40). С. 54–57.
Ефимова И.Л., Якуба Г.В. // Плодоводство и ягодоводство России. 2013. Т. 36. № 1. С. 175–181.
Мищенко И.Г. // Плодоводство и виноградарство Юга России. 2014. № 29(5). С. 76–87.
Эвентов В.Л., Андрианова М.Ю., Богорад И.В. // Вестник интенсивной терапии. 1998. № 2. С. 43–46.
Шандала М.Г. // Дезинфекционное дело. 2002. № 3. С. 19–26.
Бахир В.М., Вторенко В.И., Леонов Б.И., Паничева С.А., Прилуцкий В.И. // Дезинфекционное дело. 2003. № 1. С. 29‑36.
Акимкин В.Г. // Журн. микробиологии, эпидемиологии и иммунобиологии. 2005. № 1. С. 21–25.
Носик Н.Н., Носик Д.Н. Вирусные инфекции и дезинфекция // РЭТ-инфо. 2006. № 3(59). С. 13–17.
Еремеева Н.И., Кравченко М.А., Канищев В.В., Федорова Л.С. // Дезинфекционное дело. 2007. № 3. С. 35–38.
Зуева Л.П., Колосовская Е.Н., Любимова А.В., Асланов Б.И., Гончаров А.Е., Светличная Ю.С. // Дезинфекционное дело. 2011. № 2. С. 45–48.
Шестопалов Н.В., Шандала М.Г. // Дезинфекционное дело. 2013. № 3. С. 17–21.
Шестопалов Н.В., Шандала М.Г. // Журн. микробиологии, эпидемиологии и иммунобиологии. 2014. № 1. С. 66–70.
Григоров B.C., Корнеева О.С., Фурсова Т.И. // Хранение и переработка сельхозсырья. 2008. № 3. С. 46–49.
Бутко М.П., Тиганов В.С., Фролов В.С., Лапко В.С., Герасимов В.Н., Денисенко В.И., Соколов Д.С. // Ветеринария. 2009. № 2. С. 33–36.
Николаенко В.П., Климов М.С., Зарытовский А.И., Михайлова А.В. // Птицеводство. 2013. № 2. С. 39–42.
Николаенко В.П., Климов М.С., Михайлова А.В. // Ветеринария. 2014. № 5. С. 48–52.
Попов Н.И., Мичко С.А., Бутко М.П. // Российский журнал Проблемы ветеринарной санитарии, гигиены и экологии. 2015. № 2(14). С. 32–36.
Сахапова Л.Р. // Ученые записки Казанской государственной академии ветеринарной медицины им. Н.Э. Баумана. 2011. Т. 208. С. 163–167.
Шкуратова И.А., Шилова Е.Н., Соколова О.В. // Российский журнал Проблемы ветеринарной санитарии, гигиены и экологии. 2015. № 3(15). С. 60–63.
Биттиров А.М., Кагермазов Ц.Б., Пашаев В.Ш. // Аграрная Россия. 2015. № 6. С. 11–12.
Вендин С.В. // Инновации в АПК: проблемы и перспективы. 2016. № 2(10). С. 3–11.
Тутельян А.В., Юшина Ю.К., Соколова О.В., Батаева Д.С., Фесюн А.Д., Датий А.В. // Вопросы питания. 2019. Т. 88. № 3. С. 32–43.
Харивуло А.Г., Хохлов Н.Н., Махова Т.А. Устройство для внутривенной лазерной терапии // Патент на изобретение RUS 2058166 04.03.1992.
Родионов Ю.Т., Зефиров А.С., Бедный В.М., Шмаков Е.Н., Бутковский М.И. Аппарат перистальтического действия с системой плавной подачи лекарств // Патент на изобретение RUS 2111018 06.05.1995.
Петрушин Г.Г., Шутак О.С. Медицинская транспортная складная шина Петрушина–Шутака // Патент на изобретение RUS 2140232 10.07.1998.
Лазарева Е.А., Лиходед В.А., Чемикосова Т.С., Тенякова Л.Л. Карандаш для лечения пародонтита // Патент на изобретение RUS 2175865 17.07.2000.
Nazarov V.G., Makhmutov F.A. // Colloid J. Russian Academy of Sciences: Kolloidnyi Zhurnal. 2000. V. 62(5). P. 594–599.
Чои С.Х., Ли С.М., Мун Д.С. Многослойная пленка для контейнеров для медицинских растворов и контейнер, включающий эту пленку // Патент на изобретение RUS 2447996 19.12.2008.
Маннебах Г., Безелен К., Шмидт К.У., Маурер Т., Мюллер Й., Верц А., Фройденштайн М. ПЭНП высокого давления для использования в медицине // Патент на изобретение RUS 2564023 10.11.2010.
Кудашев С.В., Урманцев У.Р., Табаев Б.В., Арисова В.Н., Даниленко Т.И., Желтобрюхов В.Ф. // Физикохимия поверхности и защита материалов. 2015. Т. 51. № 1. С. 73–78.
Фридман А.Я., Цивадзе А.Ю., Морозова Е.М. // Физикохимия поверхности и защита материалов. 2015. Т. 51. № 6. С. 635–655.
Жорин В.А., Киселев М.Р., Котенев В.А. // Физикохимия поверхности и защита материалов. 2017. Т. 53. № 4. С. 418–425.
Шляга И.Д., Редько Д.Д., Шевченко Н.И. // Медицинская панорама. 2008. № 13. С. 64–66.
Чеботарев А.Г. // Горная промышленность. 2012. № 3(103). С. 24–27.
Сюрин С.А. // Гигиена и санитария. 2015. Т. 94. № 1. С. 68–72.
Громов И.Н. // Наше сельское хозяйство. 2016. № 6. С. 18–22.
Петренко О.Д. // Экология человека. 2008. № 10. С. 37–39.
Никифорова Т.В. // Клиническая дерматология и венерология. 2009. Т. 7. № 4. С. 45–48.
Антонов В.Б. // Журн. инфектологии. 2009. Т. 1. № 2–3. С. 7–12.
Сюрин С.А., Петренко О.Д. // Безопасность и охрана труда. 2012. № 3(52). С. 79–81.
Красавина Е.К. // Здравоохранение Российской Федерации. 2013. № 5. С. 33–34.
Разнатовский К.И., Дохов М.А., Якубова И.Ш., Аликбаев Т.З., Сидоров А.А., Петрова Н.Н., Рыжко А.Л., Крутикова Н.Н., Ермолаев-Маковский М.А. // Гигиена и санитария. 2017. Т. 96. № 4. С. 371–376.
Скрипникова Е.В., Скрипникова М.К. // Плодоводство и ягодоводство России. 2010. Т. 24. № 2. С. 228–234.
Каштанова Ю.А., Белошапкина О.О. // Вестник П3. Алтайского государственного аграрного университета. 2014. № 11(121). С. 88–91.
Авазов С.Э. // Наука и Мир. 2017. Т. 2. № 4(44). С. 18–20.
Ван Кревелен Д.В. // Свойства и химическое строение полимеров/ Под редакцией Малкина А.Я. М.: “Химия”.
Копачев Е.С., Ноздрачев С.А., Петрушин В.Н., Рудяк Ю.В., Рытиков Г.О., Назаров В.Г. // Физическая мезомеханика. 2015. Т. 18. № 6. С. 98–110.
Drozdov S.A., Nazarov V.G., Nozdrachev S.A., Rudyak Yu.V., Rytikov G.O. // Nanosystems: phys., chem., math. 2017. V. 8. № 1. P. 137–145.
Petrushin V.N., Rudyak Yu.V., Rytikov G.O. // ITM Web of Conferences. 2018. V. 18. P. 01007.
Nazarov V.G. // Polymer Science – Series B. 1997. V. 39(3–4). P. 142–145.
Nazarov V.G. // J. Applied Polymer Science. 2005. V. 95(5). P. 1198–1208.
Nazarov V.G., Stolyarov V.P., Evlampieva L.A., Baranov V.A., Gagarin M.V. // Polymer Science – Series A. 2009. V. 51(3). P. 340–349.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов