Физикохимия поверхности и защита материалов, 2021, T. 57, № 3, стр. 255-261
Сорбционные свойства угольного сорбента МИУ-С по отношению к ионам никеля(II)
О. Д. Линников 1, *, И. В. Родина 1, И. В. Бакланова 1, А. Ю. Сунцов 1
1 ФГБУН Институт химии твердого тела УрО РАН
620049 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: linnikov@mail.ru
Поступила в редакцию 27.05.2019
После доработки 23.06.2019
Принята к публикации 12.01.2021
Аннотация
Изучены физико-химические и сорбционные свойства углеродного сорбента МИУ-С. Исследования проводились на модельном растворе сульфата никеля(II), содержащем дополнительно 400 мг/л сульфата натрия в диапазоне рН 5–8. Показано, что сорбент МИУ-С способен удалять из раствора ионы никеля(II) по механизму простой мономолекулярной адсорбции, описываемой уравнением Ленгмюра. Определены параметры этого уравнения для разных значений рН модельного раствора. Установлено, что с ростом рН раствора от 5 до 8 эффективность сорбции ионов никеля(II) сорбентом МИУ-С возрастает. Проведено сопоставление сорбционных свойств МИУ-С по отношению к ионам никеля(II) со свойствами других углеродных (угольных) сорбентов, описанных в литературе.
ВВЕДЕНИЕ
Углеродные сорбенты различных марок широко используются в промышленности. Наибольшее применение они нашли для очистки воды от нефти и нежелательных органических соединений [1, 2]. Кроме того, их также используют для удаления катионов тяжелых металлов из загрязненных вод [3–7]. При этом, несмотря на промышленное применение, свойства таких сорбентов изучены порой еще недостаточно. Это затрудняет проведение корректных технологических расчетов перед их использованием.
Целью данной работы является исследование сорбционных свойств угольного сорбента МИУ-С, выпускаемого ООО “МИУ-Сорб” (г. Москва), по отношению к ионам никеля(II). Данный сорбент производится из природных длиннопламенных углей (каменный уголь марки Д). Материал МИУ-С представляет собой твердый неорганический полимер, состоящий из нескольких угольных слоев, которые связаны между собой силами Ван-дер-Ваальса. Эти слои содержат в своем составе ароматические структуры и алифатические цепи углеводородов с атомами водорода, кислорода, азота и серы [8–10]. В настоящее время МИУ-С применяется в промышленности для очистки вод от ионов железа, аммония, бактериального загрязнения, сероводорода, нефтепродуктов, фенолов, красителей и других загрязнителей [8–10]. Однако в литературе отсутствуют данные о способности данного сорбента удалять из загрязненных растворов катионы тяжелых металлов, например, ионы никеля(II). Данная работа является попыткой заполнить этот пробел. Кроме того, представляет интерес сравнение сорбционных свойств МИУ-С по отношению к ионам никеля(II) с другими углеродными (угольными) сорбентами. Отметим еще, что ПДК ионов никеля в сточных водах, сбрасываемых в окружающую среду, в реки и озера, является очень низкой и не должна превышать 0.01 мг/л (ПДК для вод водоемов рыбохозяйственного значения). Поэтому разработка методов глубокой очистки сточных вод до столь низкой остаточной концентрации ионов никеля в них является очень важной задачей, а использование сорбентов может быть одним из способов ее решения, особенно на стадии финишной доочистки сточных вод.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Угольный сорбент марки МИУ-С выпускается в нескольких модификациях, отличающихся крупностью частиц (МИУ-С1, МИУ-С2, МИУ-С3 и МИУ-С4). Модификация МИУ-С4 имеет размер частиц 0.06–0.6 мм. Именно она была выбрана для изучения сорбционных свойств. Этот выбор был обусловлен удобством проведения лабораторных исследований.
Все эксперименты проводили при комнатной температуре (25 ± 2°С) на модельном растворе, имитирующем природные и сточные воды, который готовили путем растворения в дистиллированной воде сульфатов натрия и никеля (Na2SO4 и NiSO4). Концентрация сульфата натрия в модельном растворе была равна 400 мг/л.
Перед проведением опытов по сорбции были выполнены эксперименты по осаждению гидроксида никеля из модельного раствора едким натром. Целью этих опытов было определение остаточной концентрации ионов никеля(II) в модельном растворе в зависимости от его рН. Это было необходимо для того, чтобы в дальнейших экспериментах по сорбции исключить осаждение никеля из раствора в виде гидроксида.
Опыты по осаждению гидроксида никеля(II) проводили следующим образом. К модельному раствору (рН 5.4–6.5) с концентрацией ионов никеля в нем 100 мг/л, при непрерывном его перемешивании на магнитной мешалке, добавляли разное количество щелочи в виде раствора NaOH (5 г/л). Затем, после перемешивания в течение 2-х ч, раствор выдерживали еще не менее 24-х ч до установления в нем постоянного значения рН, и потом, после повторного перемешивания, отфильтровывали через бумажный фильтр “синяя лента”. В фильтрате определяли остаточную концентрацию ионов никеля в растворе.
Эксперименты по сорбции были выполнены при разных значениях рН модельного раствора. В этих опытах в модельный раствор, при непрерывном его перемешивании на магнитной мешалке, добавляли разное количество сорбента, а затем с помощью 0.1 N растворов серной кислоты и NaOH проводили корректировку рН раствора до требуемого значения, которое контролировали и поддерживали на постоянном уровне с помощью рН-метра АНИОН 4100. При этом электроды рН-метра были погружены в модельный раствор с сорбентом в течение всего сорбционного эксперимента. Начальная концентрация ионов никеля в модельном растворе в сорбционных опытах была разной и менялась от 10 до 30 мг/л. Она была выбрана исходя из результатов предыдущих экспериментов по осаждению гидроксида никеля(II) едким натром. Длительность сорбционных опытов составляла 60 мин. Как показали предварительные эксперименты, этого времени было достаточно для установления равновесия между раствором и твердой фазой.
В дополнение к сорбционным экспериментам был проведен опыт по изучению взаимодействия сорбента с раствором сульфата натрия (400 мг/л). В этом эксперименте навеску МИУ-С выдерживали в растворе сульфата натрия при непрерывном перемешивании образовавшейся суспензии магнитной мешалкой в течение некоторого времени, с периодическим измерением рН раствора и последующим химическим анализом последнего в конце опыта.
Определение концентрации ионов никеля в растворе проводили на фотоколориметре КФК-2 фотоколориметрическим методом с диметилглиоксимом [11]. Чтобы исключить возможное искажение результатов анализа из-за сорбции части ионов никеля на бумажном фильтре, при фильтровании первые порции отфильтрованных растворов объемом 50 мл отбрасывали и для анализа брали оставшиеся объемы фильтратов. Процесс фильтрации занимал 20–30 мин. Таким образом, общее время контакта раствора с сорбентом составляло 80–120 мин.
Значение водородного показателя (pHZPC), при котором поверхность сорбента имеет нулевой заряд (рН точки нулевого заряда) определяли потенциометрическим методом. Для этого одна проба раствора Na2SO4 (400 мг/л), объемом 50 мл, была оттитрована 0.0105 N раствором H2SO4, а другая такая же – 0.01017 N раствором NaOH. Затем аналогичное титрование провели для двух проб суспензии 0.5 г/л МИУ-С в таком же растворе сульфата натрия. Точка пересечения этих кривых титрования дает значение pHZPC данного сорбента. Отметим, что перед приготовлением суспензии для потенциометрического титрования сорбент МИУ-С был тщательно отмыт от примесей (CaCO3, MgCO3 и т.п.), слегка повышающих рН его суспензии.
Морфологию частиц сорбента изучалась с помощью сканирующего электронного микроскопа JSM JEOL 6390LA.
КР спектры снимали в диапазоне 50–4000 см–1 при комнатной температуре на спектрометре RENISHAW-1000 (λ = 532 нм, Р = 25 мВт). ИК спектры поглощения порошкообразных образцов (таблетки в CsI) регистрировали на ИК Фурье спектрометре VERTEX 80 (BRUKER) в диапазоне 4000–500 см–1.
Удельная поверхность МИУ-С4 была определена методом БЭТ по низкотемпературной адсорбции азота на установке Gemini VII 2390 V1.03 (USA).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Физико-химические свойства МИУ-С
На рис. 1 показана морфология и поверхность угольного сорбента МИУ-С. Как видно, данный сорбент имеет слоистое строение и у него отсутствует пористая структура. Особенно это хорошо заметно на рис. 1б. Проведенные измерения показали, что удельная поверхность выбранного нами образца сорбента составляет 22.27 м2/г. При этом поверхность пор равна всего 0.25 м2/г. Таким образом, доля поверхности пор от общей удельной поверхности сорбента составляет приблизительно 1%.
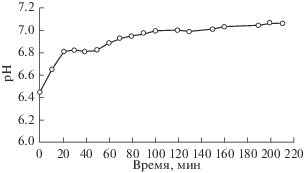
При введении навески сорбента в раствор сульфата натрия (400 мг/л) наблюдалось небольшое повышение его рН (рис. 2), что было вызвано, по-видимому, присутствием в МИУ-С небольших количеств карбонатов кальция и магния. На это указывают, в частности, результаты химического анализа раствора после выдержки в нем сорбента, которые показали наличие в растворе бикарбонатных ионов (30.5 мг/л), ионов кальция (4 мг/л) и магния (2.4 мг/л). Из рис. 2 также видно, что значение рН суспензии стабилизируется примерно через 80–120 мин с начала ее перемешивания мешалкой.
Рис. 2.
Кинетика изменения рН раствора сульфата натрия (400 мг/л) при выдержке в нем угольного сорбента МИУ-С (концентрация сорбента в растворе CS = 2 г/л).
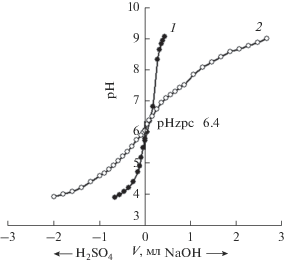
Результаты потенциометрического титрования раствора сульфата натрия (400 мг/л) и суспензии МИУ-С растворами 0.0105 N H2SO4 и 0.01017 N NaOH показаны на рис. 3. Как видно, точка нулевого заряда поверхности угольного сорбента МИУ-С соответствует рН 6.4 (pHZPC 6.4). Подчеркнем еще раз, что перед потенциометрическим титрованием навеска сорбента была тщательно отмыта от примесей (CaCO3, MgCO3 и т.п.), слегка повышающих рН суспензии МИУ-С (см. рис. 2).
Рис. 3.
Определение точки нулевого заряда (pHZPC) поверхности угольного сорбента МИУ-С методом потенциометрического титрования: 1 – титрование раствора Na2SO4; 2 – титрование суспензии МИУ-С в растворе Na2SO4 (V – объем титранта).
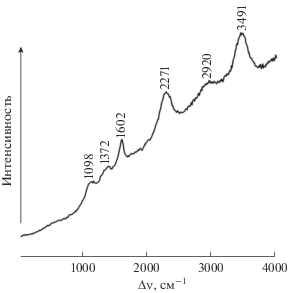
КР и ИК спектры МИУ-С приведены на рис. 4 и 5. Из рис. 4 видно, что в КР спектре присутствуют две линии, характерные для аморфного углерода: D-линия при 1372 см–1 и G-линия при 1602 см–1. Положение и интенсивность G-линии при 1602 см–1 позволяет определить степень графитизации углерода, поскольку она отвечает колебаниям атомов с sp2-типом гибридизации, находящихся в хорошо упорядоченных графитовых плоскостях. Линия при 1372 см–1 обусловлена связями С–С с sp3-типом гибридизации, а также она ответственна за структурное разупорядочение и служит характеристикой степени дефектности фазы углерода, ее незначительное уширение и низкая интенсивность свидетельствуют о том, что углерод в исследуемом сорбенте частично находится в аморфном состоянии. Наряду с линиями D и G, в спектре КР наблюдаются пики второго порядка, также характерные для аморфного углерода (2271 и 2920 см–1). Валентным колебаниям связей групп ОН отвечает линия при 3491 см–1, а другая линия вблизи 1100 см–1 – деформационным колебаниям гидроксила.
Соотношение между интегральными интенсивностями линий G и D (т.е. G/D) является, как известно, показателем кристалличности. Расчет по данным рис. 4 дает G/D = 1.51.
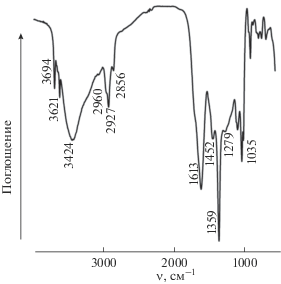
Из рис. 5 видно, что на ИК спектре МИУ-С, также как и на КР спектре, наблюдаются характеристические полосы поглощения воды: валентные колебания при 3424 см–1 и деформационные колебания при 1613 см–1. Две узкие интенсивные полосы при 3694 и 3621 см–1 соответствуют валентным колебаниям гидроксильных групп, а вблизи 1035 см–1 расположены деформационные колебания связей ОН. Валентные асимметричные и симметричные колебания связей C–H характеризуются интенсивными узкими полосами при 2960, 2927 и 2856 см–1, деформационные колебания – слабой полосой 1452 см–1. В области частот веерных деформационных колебаний группы C–H наблюдается узкая полоса малой интенсивности при 1279 см–1. Полоса при 1359 см–1 принадлежит асимметричным валентным колебаниям нитрат – иона (примесь в матрице иодида цезия). Наличие полос поглощения связей С–Н и ОН свидетельствует о присутствии в МИУ-С спиртов.
Осаждение гидроксида никеля
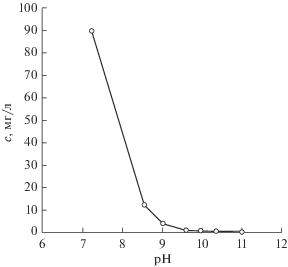
Зависимость остаточной концентрации ионов никеля(II) в модельном растворе от его рН приведена на рис. 6, из которого видно, что с увеличением рН раствора концентрация ионов никеля в нем снижается. При этом сравнение с данными [12] показывает, что в условиях нашего эксперимента остаточная концентрация никеля в растворе при рН 9.5 несколько превышает справочное значение. Так, из табл. 34 [12] следует, что при такой щелочности раствора концентрация ионов никеля в нем не должна превышать 0.6 мг/л, в нашем же случае эксперимент дает около 1 мг/л. Такое же отклонение имеет место и при рН 7.7. Согласно данным [12] концентрация ионов никеля в растворе в этом случае не должна превышать 58.7 мг/л. Наш же эксперимент дает примерно 70 мг/л. Наблюдаемые расхождения обусловлены, видимо, влиянием ионной силы нашего раствора, а также возможным комплексообразованием ионов никеля с сульфат-ионами.
Из данных, представленных на рис. 6, следует, что при проведении процесса сорбции, например, при рН 8, концентрация ионов никеля в растворе, чтобы избежать его осаждения в виде гидроксида, не должна превышать 45 мг/л. Однако для того, чтобы гарантированно избежать последнего процесса, в дальнейших экспериментах по сорбции мы задавали концентрацию никеля в растворе во всех экспериментах не выше 30 мг/л.
Сорбционные свойства по отношению к ионам никеля
Изменение остаточной концентрации ионов никеля в модельном растворе в зависимости от его рН и концентрации в нем сорбента показано на рис. 7.
Рис. 7.
Зависимость остаточной концентрации ионов никеля в модельном растворе от его рН и концентрации в нем угольного сорбента МИУ-С.
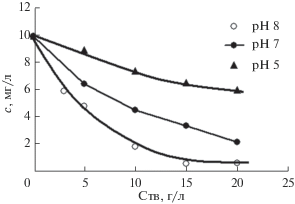
Видно, что с увеличением концентрации МИУ-С в растворе остаточная концентрация ионов никеля в нем последовательно снижается, что указывает на их сорбцию поверхностью сорбента. Причем с ростом рН модельного раствора эффективность сорбции увеличивается. Так, при концентрации сорбента 10 г/л остаточная концентрация ионов никеля в растворе при рН 5 составляет 7.46 мг/л, при рН 7 она снижается до 4.6 мг/л, а при рН 8 падает уже до 1.89 мг/л.
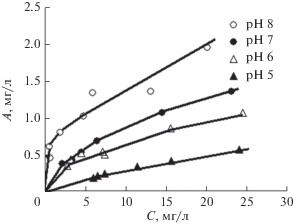
Зависимости величин адсорбции (A) ионов никеля на поверхности МИУ-С от остаточной (равновесной) концентрации никеля в растворе и рН последнего приведены на рис. 8, из которого следует, что полученные изотермы относятся к L-типу. Такой тип изотерм сорбции обычно хорошо описывается классическим уравнением Ленгмюра для мономолекулярной адсорбции:
где A – величина адсорбции, мг/г или мг/м2; A∞ – емкость адсорбционного монослоя сорбента, мг/г или мг/м2; K – константа адсорбционного равновесия, л/мг.Результаты обработки полученных экспериментальных данных по этому уравнению представлены на рис. 9.
Рис. 9.
Экспериментальные данные по сорбции ионов никеля из модельного раствора угольным сорбентом МИУ-С в координатах линейной формы уравнения (1).
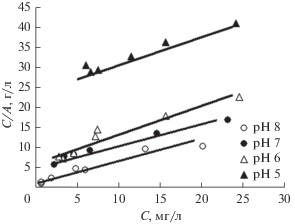
Как видно из рис. 9, все экспериментальные точки хорошо ложатся на прямые, что подтверждает применимость уравнения (1) для описания сорбции ионов никеля угольным сорбентом МИУ-С. Рассчитанные по этим данным параметры уравнения Ленгмюра приведены в табл. 1.
Таблица 1.
Зависимость параметров уравнения (1) для угольного сорбента МИУ-С от рН модельного раствора, в котором протекал процесс сорбции ионов никеля (Rc – коэффициент корреляции)
| рН | A∞, мг/г | A∞, мг/м2 | K, л/мг | Rc |
|---|---|---|---|---|
| 5 | 1.51 | 0.068 | 0.026 | 0.943 |
| 6 | 1.44 | 0.065 | 0.107 | 0.855 |
| 7 | 2.00 | 0.090 | 0.087 | 0.956 |
| 8 | 2.02 | 0.091 | 0.338 | 0.873 |
Из данных табл. 1 видно, что с повышением рН модельного раствора адсорбционная емкость сорбента МИУ-С по ионам никеля(II) несколько возрастает. Одновременно с этим наблюдается экспоненциальный рост константы адсорбционного равновесия.
Представляет интерес сравнить сорбционные свойства МИУ-С в отношении ионов никеля с другими угольными сорбентами. Так, в работе [3] была изучена сорбция катионов ряда тяжелых металлов активированным углем БАУ-А и угольным сорбентом АУВ. Согласно [3], для БАУ-А найдено A∞ = 2.4 мг/г ≈ 0.003 мг/м2 (удельная поверхность образца БАУ-А, изученного в [3], составляла 740–840 м2/г), а для АУВ – A∞ = 5.4 мг/г = 0.004 мг/м2 (удельная поверхность АУВ была равна 1280 м2/г). Как видно, в размерности мг/г адсорбционная емкость активированного угля БАУ-А по ионам никеля близка к емкости монослоя МИУ-С, а у сорбента АУВ она примерно в два раза выше. Однако с учетом удельной поверхности сорбентов, т.е. в размерности мг/м2, как для БАУ-А, так и для АУВ они почти на порядок ниже по сравнению с МИУ-С и практически равны между собой.
Пересчет экспериментальных данных [4] для сорбции ионов никеля наноуглеродным сорбентом УНЧ при рН 4 дает следующие значения параметров уравнения Ленгмюра: A∞ = 59.8 мг/г = = 0.033 мг/м2 (удельная поверхность УНЧ – 1800 м2/г). В данном случае адсорбционная емкость данного сорбента в размерности мг/м2 близка к емкости монослоя МИУ-С.
Сорбция ионов никеля углеродными сорбентами марки АД-05-2 и Сибунит была изучена в работе [5]. Пересчет полученных там данных дает следующие значения для параметров уравнения (1): АД-05-2 – A∞ = 0.00301 моль/г = 176.7 мг/г = = 0.276 мг/м2, K = 6000 л/моль = 0.102 л/мг; Сибунит – A∞ = 0.000375 моль/г = 22 мг/г = 0.049 мг/м2, K = 4500 л/моль = 0.077 л/мг. Видно, что как в размерности мг/г, так и в размерности мг/м2, адсорбционная емкость сорбента АД-05-2 по ионам никеля значительно превышает аналогичную величину для МИУ-С и других рассмотренных выше сорбентов. У сорбента Сибунит емкость адсорбционного монослоя также высока, но ниже, чем у углеродного сорбента УНЧ, но в размерности мг/м2 сопоставима с адсорбционной емкостью МИУ-С и УНЧ. Константы же адсорбционного равновесия для АД-05-2 и Сибунита близки к аналогичной величине для МИУ-С.
По данным работы [7] сорбция ионов никеля из водного раствора при рН 6 изученным там углеродным сорбентом DHHC описывается уравнением Ленгмюра со следующими параметрами: A∞ = 29.7 мг/г = 0.833 мг/м2, K = 0.135 л/мг. Сравнение с данными других исследователей свидетельствует, что сорбционная емкость по ионам никеля(II) разных сорбентов меняется в широких пределах, от 0.03 до 435 мг/г [7].
ЗАКЛЮЧЕНИЕ
Таким образом, проведенные исследования показали, что углеродный сорбент МИУ-С способен удалять из раствора ионы никеля(II) по механизму простой мономолекулярной адсорбции, описываемой уравнением Ленгмюра. Определены параметры этого уравнения для разных значений рН раствора. Установлено, что с ростом рН раствора от 5 до 8 эффективность сорбции ионов никеля(II) сорбентом МИУ-С возрастает. Сопоставление сорбционных свойств МИУ-С по отношению к ионам никеля(II) со свойствами других углеродных (угольных) сорбентов показывает, что материал МИУ-С по эффективности адсорбировать ионы никеля почти на порядок превосходит материал активированного угля БАУ-А и сорбента АУВ, и близок к свойствам углеродных сорбентов УНЧ и Сибунит, описанных в литературе. Однако уступает сорбентам АД-05-02 и DHHC. Наблюдаемые отличия связаны, по-видимому, с различиями в структуре и свойствах поверхностей этих углеродных материалов.
Работа выполнена в соответствии с государственным заданием и планами НИР ИХТТ УрО РАН.
Список литературы
Мухин В.М., Курилкин А.А., Воропаева Н.Л., Лексюкова К.В., Учанов П.В. // Сорбционные и хроматографические процессы. 2016. Т. 16. № 3. С. 346–353.
Смирнов А.Д. Сорбционная очистка воды. Л.: Химия, 1982. 168 с.
Гималаева А.Р., Валинурова Э.Р., Игдавлетова Д.К. и др. // Сорбционные и хроматографические процессы. 2011. Т. 11. № 3. С. 350–356.
Милютина А.Д., Колесников В.А., Колесников А.В. // Успехи в химии и химической технологии. 2016. Т. XXX. № 1. С. 42–43.
Сырых Ю.С. Автореф. дис…. канд. техн. наук. Иркутск, 2010. 29 с.
Филатова Е.Г., Анциферов Е.А., Помазкина О.И. и др. // Сборник научных статей IX Международной научно-технической конференции наука, образование, производство в решении экологических проблем (ЭКОЛОГИЯ-2012), Уфа, 2012. Т. 2. С. 259–263.
Sivrikaya S., Albayrak S., Imamoglu M., Gundogdu A. et al. // Desalination and water treatment. 2012. V. 50. P. 2–13.
Тарнопольская М.Г., Соловьева Е.А. // Вода: Химия и экология. 2011. № 3. С. 52–57.
Тарнопольская М.Г. // Водоснабжение и санитарная техника. 2006. № 7. С. 35–39.
Тарнопольская М.Г., Hagger I. // Водоочистка, водоподготовка, водоснабжение. 2012. № 9. С. 56–63.
Новиков Ю.В., Ласточкин К.О., Болдина З.Н. Методы исследования качества воды водоемов. Изд. 2-е, дополненное и переработанное. М.: Медицина, 1990. 400 с.
Лурье Ю.Ю. Справочник по аналитической химии. Москва. Химия. 1989. 448 с.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов