Физикохимия поверхности и защита материалов, 2021, T. 57, № 3, стр. 249-254
Сорбционное взаимодействие ионов хрома(VI) с углеродными адсорбентами
О. В. Рыбарчук 1, А. В. Драгунский 1, В. И. Дударев 1, *, Г. А. Петухова 2, **
1 Федеральное государственное бюджетное образовательное учреждение ВО Иркутский национальный исследовательский технический университет
664074 Иркутск, ул. Лермонтова, 83, Россия
2 Федеральное государственное бюджетное учреждение науки Институт физической химии и электрохимии
им. А.Н. Фрумкина РАН
119991 Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: vdudarev@mail.ru
** E-mail: petukhova@phyche.ac.ru
Поступила в редакцию 15.11.2018
После доработки 21.02.2020
Принята к публикации 12.01.2021
Аннотация
Изучено сорбционное взаимодействие ионов хрома(VI) с углеродными адсорбентами физико-химическими методами энергодисперсионной рентгеновской спектроскопии, ИК-спектроскопии, моделирования с помощью программы Firefly801. Предложен вероятный механизм сорбции, который можно рассматривать как сумму процессов, определяемых внешней и внутренней диффузией ионов, электростатического взаимодействия и реакций ионного обмена.
ВВЕДЕНИЕ
Хром является одним из широко используемых металлов для защиты поверхности разнообразных производственных и художественных изделий [1]. Прочностные и декоративные свойства хромовых покрытий, несмотря на сложности нанесения его на поверхность, позволяет гальваническому производству не только сохраняться, но и развиваться [2]. Одним из серьезных экологических вопросов в технологии хромовых покрытий является утилизация отработанных растворов, которые зачастую содержат значительные количества хрома [3]. Проблемой являются и сточные воды, содержащие ионы хрома(VI), которые образуются в результате промывки деталей после хромирования, при удалении некачественных покрытий, хроматировании и электрохимического полирования технических деталей [4]. Сорбционные методы зарекомендовали себя как весьма эффективные для решения вышеуказанных проблем машиностроительных производств [5]. Применение сорбционных методов извлечения хрома из техногенных растворов позволяет сократить выбросы загрязняющих веществ в водные объекты, минимизировать затраты на материалы, а также создать оборотное водопользование на предприятиях имеющих гальванопроизводства [6]. Одним из перспективных материалов для извлечения хрома является углеродный адсорбент, который разработан Иркутским национальным исследовательским техническим университетом [7]. Для повышения эффективности целевого использования углеродного адсорбента целесообразно определить механизм его взаимодействия с ионами хрома(VI), что и явилось предметом настоящего исследования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследования сорбционного взаимодействия ионов хрома(VI) проводили с использованием углеродного адсорбента полученного на основе длиннопламенных каменных углей Кузнецкого угольного бассейна. Адсорбент представляет собой черные гранулы неправильной формы размером 0.5–2 мм, удельной поверхностью 550 м2/г, механической прочностью 82%, суммарным объемом пор (по воде) 0.61 см3/г, сорбционной активностью по йоду 84%, объемом микропор 0.24 см3/г насыпной плотностью 550 г/дм3. При изучении сорбционной способности адсорбентов по отношению к ионам хрома(VI) использовали физико-химические методами энергодисперсионной рентгеновской спектроскопии, ИК-спектроскопии и моделирования структур с помощью программы Firefly801.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
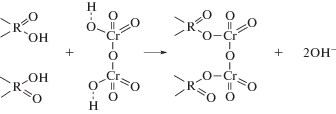
Сорбционная способность углеродного адсорбента объясняется тем, что на поверхности пор существуют активные центры – карбоксильные и фенольные группы, усиливающие ионообменные свойства адсорбента. Сорбционное извлечение ионов хрома из растворов по Фрумкину определяется действием электростатических и дисперсионных сил, обуславливающих электрохимический и молекулярный механизм сорции [8, 9]. Для ионов хрома(VI) в растворах возможно образование комплексных изополикислот состава H2(CrOn(CrO4)m), где n = 1–4; m = 0–3; n + m = 4. В сильно кислой среде ионы хрома(VI) находятся, как правило, в виде димера ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{7}^{{2 - }}$ [10]. В сорбционном процессе может участвовать каждая из этих частиц, однако сорбируемым ионом является анион ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{7}^{{2 - }}$. Процесс сорбции осуществляется за счет химической реакции анионного обмена, в котором участвуют карбоксильные и гидроксильные функциональные группы адсорбента. Происходит процесс замещения в функциональных группах, закрепленных на углеродной поверхности с выделением гидроксильных групп. Частный случай ионного обмена можно представить в виде следующей схемы:
Схема 1.
Закрепление ионов металла на поверхности адсорбента подтверждено результатами энергодисперсионной рентгеновской спектроскопии (прибор JeolJIB – Z4500), представленными на рис. 1.
Рис. 1.
Энергодисперсионный рентгеновский спектр адсорбента АД-05-2 до процесса сорбции ионов хрома(VI) (а) и после него (б).
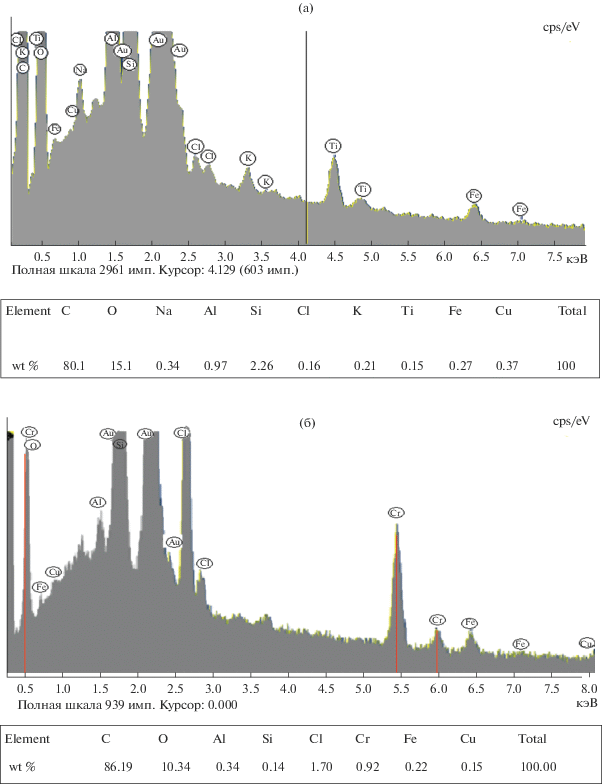
Как видно из спектров, исходный адсорбент содержит элементы C, O, Si, Al, Cl, Fe, однако на нем отсутствуют полосы, соответствующие хрому (рис. 1а). В спектре, полученном после процесса сорбции ионов хрома, помимо полос основных элементов наблюдается образование дополнительных, относящихся к хрому (рис. 1б).
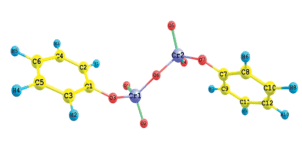
В водном растворе бихромат-ион в кислой среде находится в виде устойчивого аквакомплекса. Молекулярная структура аквакомплекса хрома показана на рис. 2. Для его разрушение перед закреплением на поверхности адсорбента требуется некоторая дополнительная энергия, которую можно получить повышением температуры. Этим объясняется необычный для аадсорбционных процессов факт возрастания велечины адсорбции ионов хрома(VI) при повышении температуры.
Рис. 2.
Молекулярная структура аквакомплекса хрома(VI), оптимизированная с использованием программы Firefly801.
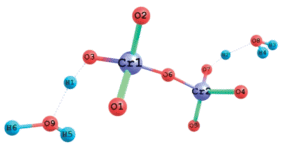
После разрушения аквакомплекса ионы хрома диффундируют к поверхности, а затем в поры адсорбента. Далее происходит закрепление хрома на поверхности адсорбента (рис. 3).
Анализируя ИК-спектры, полученные нами для адсорбентов до и после процесса сорбции, выявлены следующие изменения. Спектры характеризуются наличием интенсивных полос поглощения в областях валентных колебаний (3200–4000, 1300–2000, 500–1000 см–1) гидроксильных, карбоксильных, фенольных и азотосодержащих группировок соединений, присутствующих в исследуемых образцах.
Совпадение положения полос поглощения на разных спектрах свидетельствует об идентичности анализируемых образцов. Наиболее существенные изменения наблюдаются в области поглощения (500–1000 см–1) деформационных колебаний указанных группировок, а также соединений, соответствующих ионам сорбированного металла.
В ИК-спектре исходного адсорбента (рис. 4) полосы поглощения 878, 742 и 669 см–1 могут быть отнесены к деформационным колебаниям двойных связей –С=С– ароматических фрагментов, обертонов связей =СН2, =С–ОН и =С–NH2 [11, 12 ] . В спектрах адсорбента после сорбции эти полосы не наблюдаются. Кроме того, в результате сорбции сместились в коротковолновую область на 4–8 см–1 характеристические колебания, соответствующие деформационным колебаниям сопряженных фрагментов связей –С=С–С=С– и R–С=О, R–ОН [11, 12 ] . Данный факт подтверждает донорно-акцепторный характер взаимодействия ионов металла с поверхностью адсорбента. Появление полос (рис. 4 и 5) в спектре адсорбента после сорбции ионов металла при 574, 604, 836 см–1 [13], однозначно соотносимых с характеристическими полосами деформационных колебаний связей Cr–O–C и Cr–O–Cr, свидетельствует о наличии соответствующих связей в исследуемых соединениях.
Рис. 4.
ИК-спектры адсорбента исходного (а) и после процесса сорбции (б) в диапазоне частот от 900 до 700 см–1.
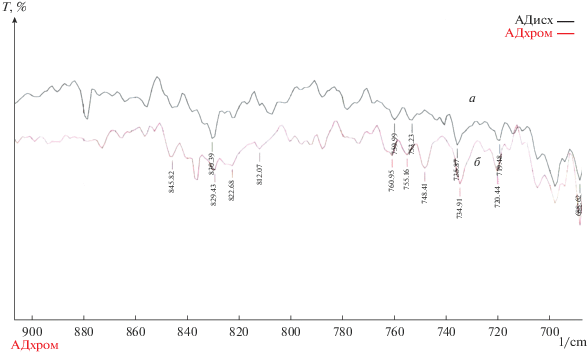
Рис. 5.
ИК-спектры адсорбента исходного (а) и после процесса сорбции (б) в диапазоне частот от 700 до 550 см–1.
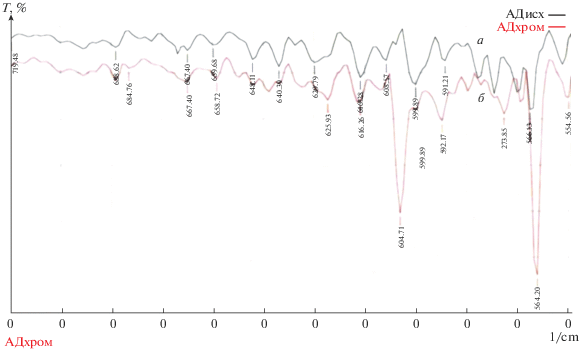
О наличии ионообменного взаимодействия при сорбции ионов хрома может свидетельствовать и изменение в большую сторону показателя кислотности среды на 0.1–0.5 единиц, наблюдаемое в результате сорбционного процесса. Помимо ионообменного взаимодействия закрепление ионов хрома(VI) на углеродной поверхности осуществляется за счет образования координационных связей с поверхностью адсорбента (π–d взаимодействие). Акцепторами выступают свободные d-орбитали сорбируемого металла, а донорами – π-электроны, расположенные на поверхности адсорбента.
Фундаментальные исследования углеродного адсорбента показали, что молекулярная структура определяется наличием в его составе конденсированных ароматических фрагментов разного размера, π-электроны в них делокализованы по единой полисопряженной системе (ПСС) [14]. Наличие электроноакцепторных участков ПСС должно способствовать делокализации на них неспаренных электронов, тогда как электронодонорные участки будут содержать в этом случае локализованные “дырки”. Поэтому указанные фрагменты ПСС можно характеризовать как квазианион- и квазикатион-радикалы. В водной среде они трансформируются в карбокатионы, которые вместо неспаренного электрона у атома углерода несут положительный заряд [14]. При этом в зависимости от размеров ПСС и наличия гетероатомов заряд распределяется по всему объему ПСС. Поэтому важно учитывать возможность взаимодействия ПСС адсорбента и системы сопряжения комплексного иона металла. Взаимодействие систем сопряжения углеродного адсорбента и металла может протекать через связь С+-комплекс–.
ЗАКЛЮЧЕНИЕ
На основании результатов исследования сорбции ионов хрома(VI) углеродными адсорбентами физико-химическими методами энергодисперсионной рентгеновской спектроскопии, ИК-спектроскопии и моделирования с помощью программы Firefly801 можно заключить следующее. В целом, механизм сорбционного взаимодействия ионов хрома(VI) с углеродными адсорбентами можно рассматривать как сумму процессов, протекающих по схеме:
– внешняя диффузия ионов металла к поверхности гранул адсорбента;
– электростатическое взаимодействие поверхности адсорбента и иона металла;
– внутренняя диффузия ионов металла в поры адсорбента;
– закрепление ионов хрома(VI) за счет взаимодействия π-электронов полисопряженной системы углеродного адсорбента и d-орбиталей ионов хрома (частный случай донорно-акцепторного взаимодействия);
– химическая реакция ионного обмена на углеродной поверхности с участием аниона ${\text{C}}{{{\text{r}}}_{{\text{2}}}}{\text{O}}_{7}^{{2 - }}$ и функциональных групп, закрепленных на углеродной поверхности с выделением гидроксильных групп.
Список литературы
Novotnik B., Zuliani T., Scancar J. // J. Analytical Atomic Spectrometry. 2012. V. 27. № 9. P. 1484–1493.
Usui T., Iwata T., Miyake S. // J. Dental Science. 2018. V. 13. № 2. P. 151–159.
Виноградов С.С. Экологически безопасное гальваническое производство. М.: Глобус, 2002. 352 с.
Basha C.A., Ramanathan K., Rajkumar R. // Industrial and Engineering chemistry research. 2008. V. 47. № 7. P. 2279–2286.
Дударев В.И., Филатова Е.Г., Дударева Г.Н. и др. // Заводская лаборатория. Диагностика материалов. 2015. № 1(81). С. 16–23.
Патент на изобретение РФ № 2547756 от 13.11.2013, МПК C 02 F 1/28, B 01 J 20/20. Способ очистки сточных вод от ионов хрома(VI) / Климова О.В., Дударев В.И., Филатова Е.Г.
Патент РФ 2064335, 1996, МПК C 01 B 31/08, B 01 J 20/20. Способ получения сорбента / С.Б. Леонов, В.В. Елшин, В.И. Дударев и др.
Леонов С.Б., Елшин В.В., Дударев В.И. и др. Получение и применение синтетических углеродных сорбентов для извлечения благородных металлов. Иркутск: Изд-во ИрГТУ, 1997. 119 с.
Леонов С.Б., Елшин В.В., Дударев В.И. и др. Углеродные сорбенты на основе ископаемых углей. Иркутск: Изд-во ИрГТУ, 2000. 268 с.
Лаврухина А.К., Юкина Л.В. Аналитическая химия хрома. М.: Наука, 1979. 218 с. 11.
Nakamoto K. Infrared and Raman Spectra of Inorganic and Coordination Compounds: Part A: Theory and Applications in Inorganic Chemistry, Sixth Edition. Published by John Wiley & Sons, Inc., Hoboken, New Jersey. 2009. 415 p.
Silverstain R.M., Bassler G.C., Morrill T.C. Spectrometric identification of organic compounds. Fifth Edition. Wiley, New York, 1991. 430 p.
Рябин В.А. Неорганические соединения хрома Л.: Химия, 1981. 208 с.
Дударева Г.Н., Рандин О.И., Петухова Г.А. и др. // Физикохимия поверхности и защита материалов. 2015. Т. 51. № 6. С. 582–586.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов