Физикохимия поверхности и защита материалов, 2022, T. 58, № 4, стр. 380-387
Адсорбционно-структурные характеристики порошка алюминия, модифицированного формиатом марганца
А. В. Рябина 1, *, В. Г. Шевченко 1, В. Н. Красильников 1
1 ФГБУН Институт химии твердого тела УрО РАН,
ГСП-145
620219 Екатеринбург, Первомайская, 91, Россия
* E-mail: anna-ryabina@yandex.ru
Поступила в редакцию 25.10.2021
После доработки 28.02.2022
Принята к публикации 10.03.2022
- EDN: NUCNBQ
- DOI: 10.31857/S0044185622040180
Аннотация
Экспериментально, при температуре 78 К, изучена адсорбция азота на порошке алюминия марки АСД-4, а также на синтезированном порошке: АСД-4–2% Mn. Представлены результаты исследования адсорбционно-структурных особенностей взаимодействия ультрадисперсного порошка алюминия с формиатом марганца в частности морфология и фазовый состав продуктов взаимодействия, рассчитана удельная поверхность и пористость порошков. Обсуждаются особенности изотерм адсорбции исследуемых образцов до и после модификации с точки зрения соответствия их определенному типу согласно рекомендациям Международного союза по теоретической и прикладной химии (IUPAC), а также определенному виду пористости, что необходимо для понимания области их дальнейшего применения. Изотерма адсорбции модифицированного порошка соответствует мезопористой системе. Показано, что структура адсорбента, его агрегатное состояние определяют вид изотерм адсорбции и принадлежность к определенному типу. Введение модификатора увеличило адсорбционную активность порошка алюминия. Удельная поверхность модифицированного образца выросла до 20 м2/г, тогда как удельная поверхность порошка АСД-4 до модификации формиатом марганца составляла 0.7 м2/г.
ВВЕДЕНИЕ
Известно, что одним из наиболее распространенных легирующих компонентов в сплавах алюминия является марганец. Являясь переходным металлом, марганец имеет определенные особенности в строении – недостроенность d-оболочки. Электронное строение атомов характеризуется наличием двух s-электронов и пяти d-электронов, в связи с чем, максимальная степень окисления атомов может достигать +7. Марганец наиболее активный окислитель в высшей степени окисления. Это и определяет многие свойства и влияет на характер взаимодействия с другими металлами, в частности с алюминием [1].
Согласно диаграмме состояния, взаимодействие марганца с алюминием происходит по эвтектическому типу. Максимальная растворимость марганца в алюминиевой матрице равна 1.95% при температуре эвтектики [2–13]. Марганец, имея меньший атомный радиус, чем алюминий, растворяясь в алюминии, сжимает его решетку. Марганцевые интерметаллиды образующиеся в результате распада твердого раствора марганца в алюминии, более мелки и благодаря этому имеют более развитую поверхность, а наличие свободных валентностей на поверхности электронных катализаторов определяет, прежде всего, его адсорбционные свойства. Вероятной причиной такого расслоения является склонность к сегрегации катионов Mn3+, что следует из различий энергий связи между атомами алюминия и марганца и энергий связи между чистыми компонентами. Предполагается, что это происходит за счет кооперативного эффекта Яна−Теллера [14, 15]. Эффект Яна–Теллера чаще всего встречается в октаэдрических комплексах переходных металлов. Основная причина эффекта Яна–Теллера – это наличие молекулярных орбиталей, которые являются как вырожденными, так и не полностью занятыми.
Присутствие марганца в количестве десятых долей % (0.2–1%) во многих деформируемых сплавах, приводя к образованию дисперсных включений марганцевых интерметаллидов и изменяя величину и форму рекристаллизованных зерен, обуславливает повышение прочностных характеристик на 61 кгс/мм2. Марганец в сплаве образует с алюминием твердый раствор, что изменяет энергетическое состояние элементарной ячейки кристаллической решетки металла, повышает его химическую и термодинамическую устойчивость [1, 16, 17]. Марганец, являясь переходным металлом, способствует увеличению сил межатомной связи. Поскольку в межатомных связях принимают участие не только внешние s-электроны, но и более связанные электроны внутренних уровней. Величина межатомных сил связи может быть оценена по многим физическим свойствам, в том числе и температуре плавления. Температура плавления марганца 1245°C, для алюминия 660°C. Марганец, упрочняя сплавы с алюминием, способствует устойчивости зон Гринье–Престона что отражено на диаграмме состояния. В работе [18] показано, что катализаторы на основе оксидов марганца проявляют различные термическую стойкость и сродство к кислороду при высоких температурах. Например, оксид марганца(II) плавится при 1840°C, оксид марганца(II, III) Mn3O4 – при 1564°C, а марганцевый ангидрид Mn2O7 – при 5–9°C. Соединения марганца высоко активны в окислительно-восстановительных реакциях, и, в частности, в процессах дожигания [19, 20]. Благодаря чему оксиды Al−Mn используются как катализаторы полного окисления CO и углеводородов [21–24].
Придание определенных свойств материалу путем его модифицирования является актуальной задачей. Известно, что модификатор может находиться на поверхности, в приповерхностном слое или в объеме [25]. Особый интерес представляет модифицирование поверхности порошков алюминия с использованием добавок оксидов переходных металлов. Так модифицирование порошка алюминия формиатами переходных металлов представлено в работе [26]. В работе исследовано влияние малых добавок оксидов марганца, железа, кобальта и никеля на окисление порошка алюминия марки АСД-4 при нагревании в воздушной среде. Показано что оксиды, образовавшиеся на поверхности порошка алюминия, при модификации порошка формиатами Mn, Fe, Co, Ni влияют на интенсивность его окисления. Так, при модификации поверхности оксидом железа наблюдается значительное ускорение окисления алюминия, что связано с образованием в процессе нагрева частиц алюминия жидкой фазы двойного оксида FeAlO3. Для взаимодействия оксида алюминия с оксидом марганца характерно образование шпинели имеющей более высокую температуру плавления (выше 1900°С).
Удельная поверхность, являясь величиной обратно пропорциональной размеру частиц, составляющих твердое тело, и структура адсорбента дают возможность понять механизм адсорбции газа на металле и реакции, протекающие на поверхности и в объеме адсорбента. В настоящей работе приведены результаты изучения морфологии частиц исходного порошка АСД-4 и модифицированного формиатом марганца, а также адсорбционные характеристики этих порошков.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В эксперименте использовали модифицированный порошок алюминия марки АСД-4 с содержанием активного металла 98.7 ± 0.5%, полученный методом распыления расплавленного металла азотом. Способ модификации подробно описан в работе [26]. Порошок АСД-4 в количестве 9.8 г смешивали с 20 мл горячего (80°С) водно-глицеринового раствора, содержащего 0.655 г модификатора Mn(HCOO)2·2H2O. Полученную смесь сначала нагревали на электроплите для удаления компонентов растворителя, а затем отжигали в муфельной печи при температуре 350°C, необходимой для полного разложения формиата марганца с образованием оксидов [26]. Концентрация марганца в покрытии при пересчете на металл составляла 2 мас. %.
Адсорбционные измерения проводили на адсорбционном анализаторе Gemini VII 2390 (США) принцип действия которого основан на адсорбции и десорбции газа на внешней и внутренней поверхностях (в порах) исследуемых образцов дисперсных и пористых веществ и материалов при температуре жидкого азота. Азот является наиболее широко распространенным газом, который используют для определения площади поверхности: он химически инертен к поверхности твердого тела, форма его молекулы близка к сферической, он показывает точные результаты в области значений относительного давления Р/Рs = = 10–3–0.999. Диапазон измерения этим методом удельной поверхности от 0.01 до 4000 м2/г, погрешность измерения не более 5%. Удельную поверхность, определяли методом БЭТ, площадь поверхности микропор и площадь внешней поверхности – сравнительным методом t-графика. Адсорбционный и десорбционный кумулятивный объем пор, средние адсорбционный и десорбционный диаметры пор, дифференциальное распределение объема мезопор по диаметрам рассчитывали методом Барретта–Джойнер–Халенды (BJH).
Морфологию частиц анализировали на растровом электронном микроскопе JEOL JSM-6390LA с энергодисперсионным рентгеновским анализатором (EDS). Фазовый состав исследуемых образцов до и после эксперимента определяли методом рентгенофазового анализа (РФА) на дифрактометре Shimadzu XRD-6000 (CuKα-излучение (λ = 1.5418 Å)) с использованием банка картотеки стандартов JCPDS. Диапазон углов сканирования от 1° до 100° и скоростью сканирования 1 град/мин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Электронно-микроскопическое исследование порошка АСД-4 и АСД-4 + 2% Mn показало, что порошки в основном состоят из сферических частиц правильной формы (рис. 1) с примерно одинаковым средним размером частиц около 5–7 мкм.
Порошок АСД-4 + 2% Mn (рис. 1б) представляет собой сферические частицы, имеющие на поверхности небольшие частицы металлического порошка мелких фракций, состав которых, в пределах погрешности элементного анализа, практически совпадает с результатами анализа крупных частиц. На микрофотографиях порошков видны мелкие пушинки на частицах. Возможно электростатическое взаимодействие между частицами порошков, препятствующее более плотной усадке порошкообразных частиц.
Энергодисперсионным анализом установлено равномерное распределение формиата марганца по поверхности АСД-4. Количественное определение элементного состава в разных точках образца показало наличие, наряду с алюминием и марганцем, некоторого количества кислорода.
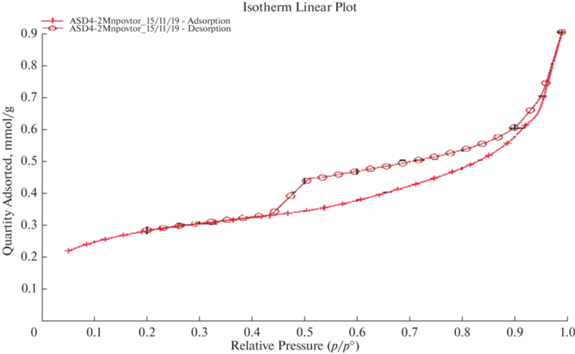
На рис. 2 представлены изотермы адсорбции образцов АСД-4 (а) и АСД-4 + 2% Mn (б). Сила адсорбционного взаимодействия поверхности адсорбента с парами адсорбата оценивалась по характеру начального участка экспериментальной изотермы адсорбции в мономолекулярной области.
Удельная поверхность образца АСД-4 составляет 0.7 м2/г, удельная поверхность АСД-4 модифицированного марганцем возросла до 20 (19.7907 ± 0.5565) м2/г. Образец Al–2% Mn, согласно рекомендациям Международного союза по теоретической и прикладной химии (IUPAC) [27–29] относится к мезопористому телу и соответствует 4 типу по классификации БДДТ, изотерма образца АСД-4 относится ко 2 типу. Образец АСД-4 обладает малой удельной поверхностью и небольшим объемом пор. Форма изотермы согласуется с представлением о системе рыхло упакованных непористых частиц с размерами порядка нескольких микрон. Изотермы адсорбции во всех наших случаях обратимы в мономолекулярной области. Адсорбционная связь азота с поверхностью у образца АСД-4 слабее, чем Al–2% Mn, что выражается уменьшением наклона изотермы в начальной области (рис. 2а). Адсорбционная ветвь образца Al–2% Mn выпуклая при малых относительных давлениях.
В том случае, когда о пористой структуре исследуемого образца ничего заранее неизвестно, то следует проводить полный анализ, включающий установление наличия различных типов пор, а также их характеристик. Согласно теории предложенной Л.В. Радушкевичем, А.П. Карнауховым [30] сферические частицы в адсорбентах упакованы в структуры с координационным числом 8, 6, 4 и т.п. Поры в таких адсорбентах и катализаторах представляют зазоры между частицами скелета и зависят от числа взаимных касаний, формы и размера частиц. Капиллярная конденсация проходит в зазорах этих упаковок. Однако в реальных телах в силу наличия взаимодействия между частицами не может быть строго правильной упаковки и наряду с возможной упорядоченной структурой с различными координационными числами имеются структуры полнейших упаковок. Узкая петля гистерезиса у образца АСД-4 связана с наличием некоторого количества более узких зазоров между частицами, способных вызвать капиллярную конденсацию, не только вокруг мест контакта частиц, но и в объеме горл или во всем объеме этих зазоров.
После образования монослоя, в образце Al–2% Mn начинаются одновременно процессы полимолекулярной адсорбции и капиллярной конденсации, а за пределами второго или третьего слоя процесс адсорбции протекает преимущественно по механизму капиллярной конденсации. Изотерма адсорбции в области больших относительных давлений круто поднимается вверх. Такой рост адсорбции, несомненно, вызван процессом необратимой капиллярной конденсации паров в широких порах адсорбента близких размеров. Гистерезис соответствует второму этапу капиллярной конденсации. Первый этап капиллярной конденсации связан с адсорбцией вокруг мест контакта частиц и протекает обратимо.
Согласно классификации предложенной Де Буром [31] образец АСД-4 имеет петлю гистерезиса типа Н1. Такая петля характерна для пористой структуры образованной сферическими частицами близкого размера с однородной упаковкой. Петля гистерезиса модифицированного образца соответствует типу Н4 [31] характеризуется вертикальной адсорбционной ветвью, расположенной вблизи давления насыщения, и крутой десорбционной ветвью в области промежуточных давлений (0.5–0.8). Этот тип гистерезиса может быть вызван открытыми с обоих концов капиллярами, имеющими трубчатую форму с различной конфигурацией поперечного сечения и небольшой разброс радиусов по величине. Также согласно классификации Де Бура петли гистерезиса такой формы могут указывать на наличие микропор. К развитию некоторого объема микропор привело, вероятно, удаление физически адсорбированной воды при термообработке образца АСД-4 + 2% Mn, что подтверждается также данными ДТА и ТГ [26], а также некоторой потерей массы после процесса дегазации. Согласно [27–29] уравнение БЭТ в упрощенном виде выглядит следующим образом:
где: $Pa$ – равновесное давление, мм рт. ст., $Po$ – давление насыщения адсорбируемого газа, над образцом при температуре охлаждающей бани, мм рт. ст., $Va$ – объем, адсорбированный при давлении $Pa$, см3, $C$ – константа, выражающая энергию адсорбции, $Vm$ – объем газа, соответствующий образованию мономолекулярного слоя, см3, $Pa$/$Po$ – относительное давление адсорбции. Энергетическая константа $C$ уравнения БЭТ также может характеризовать наличие микропористости в системе [27–29]. Согласно допущениям принятым авторами теории БЭТ: где Q–QL – чистая теплота адсорбции равная разности изостерической теплоты адсорбции и теплоты конденсации чистого адсорбата в жидкость.Значения константы $C$ уравнения БЭТ которая экспоненциально связана с энергией мономолекулярной адсорбции равна 50 для образца АСД-4, для АСД-4 + 2% Mn она составила 86. Согласно этим данным, в образце АСД-4 отсутствует микропористость, поскольку константа $C$ лежит в интервале 80 > $C$ > 50 [27]. Что также подтверждает слабое взаимодействие адсорбат–адсорбент в мономолекулярной части изотермы.
Оценим объем микропор для АСД-4 + 2% Mn с помощью метода t-Plot предложенного Де Буром [32]. Сравнительный метод Де Бура позволяет судить о наличии пор того или иного типа (микро, мезо, макро). Т-метод позволяет определить объем микропор и площадь микропор по изотерме адсорбции газа без необходимости измерения части изотермы, заполняющей микропоры при низком давлении, и применяется в диапазоне многослойной адсорбции. Толщина пленки рассчитывалась согласно уравнению Гаркинса–Юра: t = [13.99/(0.034 – lg(Р/Р0))]0.5. Так при относительном давлении Р/Р0 = 0.050 толщина пленки составила 3.2429 Å. Для Р/Р0 = 0.36 толщина пленки составила 5.44 Å. Площадь микропор составила 5.9638 м2/г, внешняя площадь поверхности 13.8269 м2/г. Для модифицированного образца содержащего некоторое количество микропор на ряду с мезопорами, описываемого изотермой 4 типа с петлей гистерезиса, предшествуют три процесса: заполнение мономолекулярного слоя, где наиболее активно взаимодействие адсорбат–адсорбент, затем идет заполнение пор большего размера и процесс капиллярной конденсации, описываемый модифицированным уравнением Томсона–Кельвина выражающим математическую зависимость между радиусом кривизны мениска жидкости в капиллярах и давлением пара адсорбата [33, 34]:
(3)
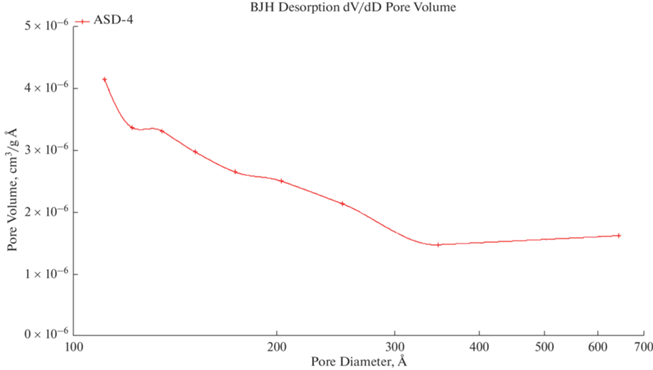
$d = \frac{{4\sigma {{V}_{m}}}}{{RT\ln ({{{{P}_{s}}} \mathord{\left/ {\vphantom {{{{P}_{s}}} P}} \right. \kern-0em} P})}},$Согласно графику АСД-4 адсорбент или вообще не имеет пористой структуры, или радиусы пор настолько велики, что адсорбция происходит как на “открытой” поверхности. Величина адсорбции незначительна, однако такие поры оказывают существенное влияние на скорость процесса, выполняя функцию транспортных каналов. Объем пор 0.002231 см3/г, средний диаметр пор 169.878 Å.
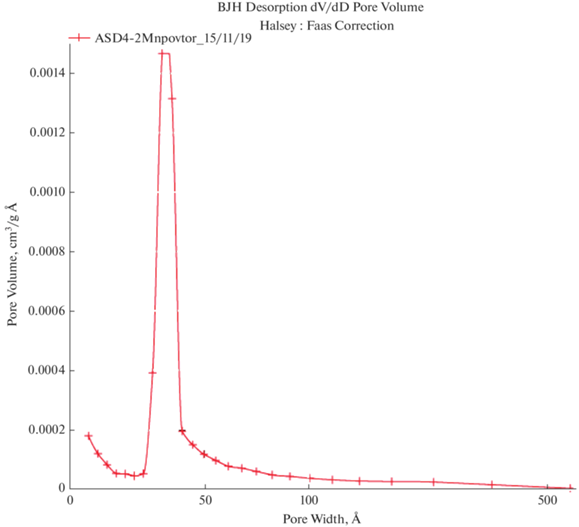
Для образца прошедшего модификацию характерно узкое распределение пор по размерам и большая удельная поверхность. Объем пор 0.028250 см3/г, средний диаметр пор: 75.835 Å. После модификации система является монодисперсной с одним четким пиком; в исходном образце АСД-4 полимодальное распределение.
Увеличение адсорбционной способности модифицированного порошка связно с характером разложения модификатора на поверхности частиц алюминия.
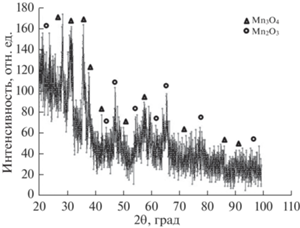
Согласно дифракционным данным термическое разложение формиата марагнца на воздухе сопровождается образованием двух фаз: основной Mn3O4 и примеси Mn2O3 [26] (рис. 5). При этом характер дифракционной кривой продуктов разложения свидетельствует об очень малом размере частиц, что хорошо видно на рис. 6.
Рис. 6.
Морфология частиц продукта термического разложения формиата марганца после нагревания при 350°С в воздушной среде.

Микроструктура исходного АСД-4 и модифицированного формиатом марганца, по данным рентгенофазового анализа, представлена лишь фазой металлического алюминия (рис. 7). Это связано с небольшим количеством модификатора, а также малым размером оксидных фаз образующих модифицированный слой на поверхности частиц. Однородность кристаллической структуры образцов дает мало отличающиеся по величинам межплоскостные расстояния и относительные интенсивности [35].
ВЫВОДЫ
Исследование структурных особенностей порошков до и после модификации показало, что в результате модификации порошка АСД-4 формиатом марганца в концентрации 2% произошло увеличение удельной поверхности. Поверхностное модифицирование формиатом позволило преобразовать поверхностный и приповерхностный слой носителя. В результате чего появились новые адсорбционные центры. Характер разложения модификатора на поверхности частиц алюминия повлиял на увеличение адсорбционной способности модифицированного порошка. Вычисление удельной поверхности модифицированного образца по методу БЭТ составило 20 м2/г и t-методом Де Бура 14 м2/г. Как видно полученные данные отличаются, что может говорить об адсорбции, как на внешней поверхности, так и в микропорах. Поскольку активность и селективность адсорбента влияет на динамику адсорбции, и на скорость протекания адсорбционных процессов, важно иметь не только информацию об удельной поверхности образца, но и о разновидности пор адсорбента, также важна природа поверхности, поскольку активирование порошка меняет адсорбционную способность, что имеет большое значение для дальнейшей области применения.
Список литературы
Елагин В.И. Легирование деформируемых алюминиевых сплавов переходными металлами. М.: Металлургия, 1975. 246 с.
Мондольфо Л.Ф. Структура и свойства алюминиевых сплавов / Перевод с английского. М.: Металлургия, 1979. 483 с.
Диаграммы состояния металлических систем. Под ред. Агеева Н.В. М.: ВИНИТИ, Вып. 1955–1995 гг.
Лякишев Н.П. Диаграммы состояния двойных металлических систем. М.: Машиностроение, 1996–2000 г.
Эллиот Р.П. Структуры двойных сплавов / Перевод с английского. М.: Металлургия, 1970. Т. 1. С. 448 . Т. 2 . С. 445.
Добаткин В.И., Елагин В.И., Федоров В.М. Быстро закристаллизованные алюминиевые сплавы. М.: ВИЛС, 1995. 341 с.
Lijun Zhang, Yong Dua, Ingo Steinbach et al. // Acta Mater. 2010. V. 58. P. 3664.
Воронцова Л.А. Алюминий и алюминиевые сплавы в электротехнических изделиях. М.: Энергия, 1971. 224 с.
Квасов Ф.И., Фридляндер И.Н. Промышленные алюминиевые сплавы / Справочник. М.: Металлургия, 1984. 527 с.
Хансен М., Андерко К. Структура двойных сплавов / Перевод с английского. М.: Металлургия, 1979. 637 с.
Toropova L.S., Eskin D.G., Kharakterova M.L., Dobatkina T.V. Advanced Aluminum Alloys Containing Scandium. Structure and Properties // Gordon and Breach Science Publishers, 1998. P. 175.
Phillips H.W.L. Annotated equilibrium diagrams of some aluminium alloys systems // Monograph and report series. The institute of metals. London. 1959. № 25. P. 121.
Yucel Birol // Scripta Mater. 2009. V. 60. P. 5.
Минкин В.И., Симкин Б.Я., Миняев Р.М. Теория строения молекул. Издательство Феникс. Ростов- на-Дону, 1997.
Bulavchenko O.A., Tsybulya S.V., Gerasimov E.Yu. et al. // Z. Kristallogr. Proc. 2011. V. 226. № 1. P. 325.
Алюминий. Свойства и химическое металловедение / Справочник. Под ред. Хэтча Ож. (пер. с англ.) М.: Металлурги, 1989. 423 с.
Ведь М.В., Сахненко Н.Д., Андрощук Д.С. и др. // Двигатели внутреннего сгорания 2014. № 2. С. 73.
Ведь M.B., Сахненко Н.Д. // Коррозия: материалы, защита. 2007. № 10. С. 36.
Каталитические свойства веществ / Справочник Под. ред. Ройтера В.А. Киев: Наукова думка, 1975. 1464 с.
Чагунава В.Т. Марганцевые катализаторы для некоторых реакций. Тбилиси: Мецниереба, 1969. 186 с.
Kapteijn F., Singoredjo L., Andreini A., Moulijn J.A. // Appl. Catal. 1994. B 3. P. 173.
de la Pena O’Shea V.A., Alvarez-Galvan M.C., Fierro J.L.G., Arias P.L. // Appl. Catal. 2005. B 57. P. 191.
Цырульников П.Г., Сальников В.С., Дроздов В.А. и др. // Кинетика и катализ. 1991. Т. 32. № 2. С. 439.
Carno J., Ferrandon M., Bjornbom E., Jaras S. // Appl. Catal. A. 1997. V. 155. № 2. P. 265.
Химия привитых поверхностных соединений / Под ред д. х. н. Лисичкина Г.В. Москва. Физматлит, 2003. 592 с.
Шевченко В.Г., Красильников В.Н., Еселевич Д.А. и др. // Физикохимия поверхности и защита материалов. 2019. Т. 55. № 1. С. 25.
Грег С., Синг К. Адсорбция. Удельная поверхность. Пористость / Пер. с англ. 2-е изд. М.: Мир, 1984. 306 с.
Sing K.S.W., Everett D.H., Hall R.A.W. et al. // Pure and Applied Chemistry. 1985. V. 57. № 4. P. 603. https://doi.org/10.1351/pac198254112201
Thommes M., Kaneko K., Neimark A.V. et al. // Pure Appl. Chem. 2015. V. 87. № 9–10. P. 1051.
Карнаухов А.П. Адсорбция. Текстура дисперсных и пористых материалов / Новосибирск: Наука. Сиб. предприятие РАН, 1999. 470 с.
Lippens B.C., de Boer J.H. // J. Catal. 1965. V. 4. № 3. P. 319.
deBoer J.H., Lippens B.C., Linsen B.G. et al. // J. Colloid Interface Sci. 1966. V. 21. № 4. P. 405.
Экспериментальные методы в адсорбции и молекулярной хроматографии. / Под ред. Киселева А.В. и Древинга В.П. М.: Издательство МГУ, 1973. 448 с.
Авгуль Н.Н., Джигит О.М., Киселев А.В. // ЖФХ. 1955. Т. 29. С. 316.
Ковба Л.М. Рентгенография в неорганической химии. Изд.-во МГУ, 1991. 254 с.
Ребиндер П.А. Поверхностные явления в дисперсных системах / Коллоидная химия. Избранные труды. М.: Наука, 1978. 368 с.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов