Физикохимия поверхности и защита материалов, 2022, T. 58, № 5, стр. 466-472
Синтез и исследование физико-химических свойств мезопористого углеродного сорбента, модифицированного аминокислотами
А. В. Седанова 1, *, Л. Г. Пьянова 1, М. С. Делягина 1, Н. В. Корниенко 1, Д. Н. Огурцова 1, С. Н. Несов 2, В. А. Дроздов 1, Н. Н. Леонтьева 1, А. В. Лавренов 1
1 Центр новых химических технологий Федерального государственного бюджетного учреждения науки
“Федеральный исследовательский центр “Институт катализа им. Г.К. Борескова
Сибирского отделения Российской академии наук” (Омский филиал) (ЦНХТ ИК СО РАН)
644040 Омск – 40, ул. Нефтезаводская, 54, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Омский государственный технический университет”
644050 Омск, ул. Мира, 11, Россия
* E-mail: medugli@ihcp.ru
Поступила в редакцию 25.05.2022
После доработки 02.06.2022
Принята к публикации 09.06.2022
- EDN: FUOAHY
- DOI: 10.31857/S0044185622050229
Аннотация
Проведена и изучена реакция конденсации глутаминовой кислоты с глицином в объеме. По установленным условиям объемного синтеза проведена конденсация аминокислот на поверхности мезопористого углеродного сорбента. В процессе поверхностного модифицирования варьировали соотношение сорбент/раствор и продолжительность синтеза. Смоделированы и изучены процессы десорбции нанесенных модификаторов с поверхности сорбента в водных растворах. Физико-химическими методами: низкотемпературной адсорбцией азота, термическим анализом, кислотно-основным титрованием по методу Boehm, рентгеновской фотоэлектронной спектроскопией – исследованы и сопоставлены свойства образцов сорбента до и после проведения модифицирования, а также после десорбции введенных модификаторов. Установлены закономерности реакции конденсации аминокислот на углеродном сорбенте. Определены оптимальные условия получения модифицированных углеродных материалов для целей сорбционной медицины. Установлено, что наиболее перспективным является образец, полученный при соотношении “сорбент : раствор аминокислот”, равном 1 : 5, при продолжительности термообработки 1.5 ч при 190°С.
ВВЕДЕНИЕ
Реакция конденсации биологически активных веществ на поверхности твердых тел достаточно широко применяется в химико-фармацевтической промышленности, так как она представляет большой практический интерес. Поликонденсация аминокислот используется при твердофазном синтезе белков [1–5], также при разработке медицинских тест-систем [6] и для получения эффективных биоспецифических сорбентов [7, 8].
Одним из перспективных функциональных направлений применения процессов конденсации на поверхности твердого тела является разработка медицинских сорбентов комплексного действия, проявляющих детоксикационные, антибактериальные, противогрибковые, иммунокорригирующие и др. свойства [9]. Основная задача при создании таких сорбентов – это сохранение биологической активности наносимых веществ (модификаторов) и свойств самого носителя.
В данной работе рассмотрен гетерогенный синтез сорбента, получаемого конденсацией аминокислот (глутаминовой кислоты и глицина) в расплаве без использования катализаторов на углеродном мезопористом носителе, исследованы его физико-химические свойства. Выбор модификаторов обоснован тем, что глицин, глутаминовая кислота и их производные являются лекарственными препаратами, которые широко применяются в косметологии, медицине, ветеринарии. Они обладают детоксикационными [8], антибактериальными [9–12], антиоксидантными [13–17], иммунокорригирующими [18, 19] и противовоспалительными [20–23] свойствами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы исследования
В качестве объекта исследования выбран мезопористый углеродный сорбент УС (ЦНХТ ИК СО РАН, г. Омск), характеризующийся удельной площадью поверхности по БЭТ 350 ± 30 м2/г, удельным объемом пор 0.365 ± 0.005 см3/г и гранулометрическим размером 0.50 ± 0.05 мм. Для модифицирования использовали глутаминовую кислоту (“Омскреактив”, Россия) и глицин (“Омскреактив”, Россия).
Перед проведением синтеза модифицированного углеродного сорбента проведена конденсация глутаминовой кислоты (0.005 моль) и глицина (0.005 моль) в расплаве без применения катализаторов при температуре 190°С в течение 1.5 ч. Продукты реакции конденсации глутаминовой кислоты с глицином идентифицировали методом хромато-масс спектрометрии (ГХ-МС) на приборе 5973N/6890N, “Agilent”.
Методика модифицирования углеродного сорбента включала приготовление раствора аминокислот, взятых в эквимолярном соотношении (0.005 моль), добавление навески сорбента для пропитки при различных объемных соотношениях сорбент/раствор (1/5, 1/10). Пропитывающие растворы аминокислот с углеродным сорбентом нагревали при 190°С в течении 1.5–4 ч при периодическом перемешивании. Далее растворы декантировали и образцы модифицированного углеродного носителя сушили при комнатной температуре в течение суток, а затем в сушильном шкафу при 105°С до постоянной массы.
Изучена возможность процесса десорбции олигомеров нанесенных аминокислот с поверхности модифицированных образцов в физиологическом водном растворе 0.9 мас. % NaCl в течение 120 ч при соотношении сорбент : NaCl = 1 : 6. Продукты в растворах после десорбции исследовали методами низкотемпературной адсорбции азота (Tадс = 77.4 К) на анализаторе Gemini-2380 (“Micromeritics”), рН-метрии (рН-метр “Sartorius”).
Образцы углеродного сорбента до модифицирования (образец УС), после модифицирования (образцы с шифром УСМ) и после десорбции (образец УСМД) исследованы комплексом физико-химических методов. Характеристики пористой структуры определяли методом низкотемпературной адсорбции азота. Термический анализ в воздушной среде проводили на термоанализаторе DTG-60H, “Shimadzu” для контроля процесса модифицирования углеродного носителя путем конденсации выбранных аминокислот и определения количества образуемого модификатора. Количественное определение функциональных кислородсодержащих групп на поверхности образцов исследуемого углеродного сорбента проводили методом титрования по Боэм (Boehm) [24]. Содержание общего азота в образцах определяли методом Къельдаля [25]. Состояние поверхности образцов углеродного сорбента изучали методом рентгеновской фотоэлектронной спектроскопии (РФЭС) (вакуумная установка Surface Science Center, “Riber” с использованием немонохроматического излучения AlKα (hν = 1486. 7 эВ)). Перед проведением измерений спектрометр был откалиброван по положению линий Au4f7/2 (84.0 эВ) и Cu2p3/2 (932.7 эВ) металлических золота и меди. Обзорные РФЭ-спектры образцов (в диапазоне энергий 1050–0 эВ) измерялись с шагом по энергии 1 эВ при энергии пропускания hν = 50 эВ. Спектры остовных линий углерода и кислорода (С 1s и O 1s) измерялись с шагом по энергии 0.1 эВ при энергии пропускания hν = 25 эВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате конденсации глутаминовой кислоты и глицина в расплаве получен продукт в виде твердой темно-коричневой массы. Результаты хромато-масс спектрометрии позволили установить, что в ходе реакции онденсации используемых аминокислот образуется смесь соединений: пироглутаминовая кислота, димер глутаминовой кислоты и глицина, димер глицина (табл. 1).
Таблица 1.
Соединения, идентифицированные в продукте синтеза методом ГХ-МС
| Номер пика | Время обнаружения, мин | Соединение | Содержание, % |
|---|---|---|---|
| 1 | 6.29 | Растворитель | 93.78 |
| 2 | 17.42 | Пироглутаминовая кислота | 3.23 |
| 3 | 18.81 | Димер глицина | 1.11 |
| 4 | 22.89 | Димер глутаминовой кислоты и глицина | 1.88 |
По результатам термического анализа (температурный интервал разложения продукта составил 150–250°С) можно предположить, что в результате протекания реакции конденсации аминокислот в раплаве образуется олигомер (рис. 1).
Рис. 1.
Результаты термического анализа продукта конденсации в расплаве (пунктирная линия) и образца УСМ-1/5-1.5 (сплошная линия): (а) кривые ТГА; (б) кривые ДТА.
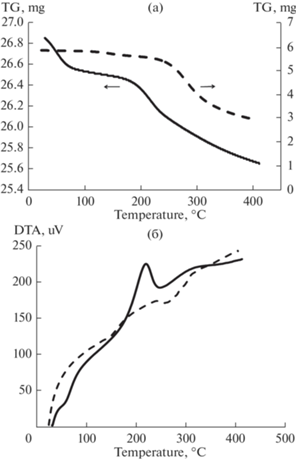
Параметры процесса конденсации аминокислот в расплаве были использованы при проведении конденсации модификаторов на исходном углеродном сорбенте. В ходе гетерогенного синтеза варьировали такие параметры, как соотношение “сорбент/раствор аминокислот” и время модифицирования. В работе получена серия из 6-ти модифицированных образцов углеродного сорбента, отличающихся параметрами синтеза (табл. 2). Изучены текстурные характеристики исследуемых образцов углеродных сорбентов и количество нанесенного модификатора по данным термического анализа (табл. 2, рис. 1).
Таблица 2.
Текстурные характеристики и количество нанесенного модификатора по данным термического анализа исследуемых образцов
| Образец* | Соотношение сорбент/раствор | Продолжительность синтеза, ч | Удельная площадь поверхности, по БЭТ, м2/г | Суммарный объем пор, V∑, см3/г |
Объем мезопор, Vмезо, см3/г |
Количество нанесенного модификатора, мас. % |
|---|---|---|---|---|---|---|
| УС | – | – | 345 | 0.366 | 0.350 | – |
| 1 серия | ||||||
| УСМ-1/5-1.5 | 1/5 | 1.5 | 142 | 0.157 | 0.149 | 1.69 |
| УСМ-1/5-2 | 1/5 | 2.0 | 186 | 0.191 | 0.184 | 0.77 |
| УСМ-1/5-4 | 1/5 | 4.0 | 237 | 0.243 | 0.237 | 0.66 |
| 2 серия | ||||||
| УС-1/10-1.5 | 1/10 | 1.5 | 253 | 0.263 | 0.254 | 0.67 |
| УСМ-1/10-2 | 1/10 | 2.0 | 194 | 0.202 | 0.196 | 1.07 |
| УСМ-1/10-4 | 1/10 | 4.0 | 230 | 0.238 | 0.230 | 0.70 |
С увеличением времени модифицирования аминокислот на углеродном сорбенте в интервале от 1.5 до 4 ч при соотношении “сорбент/раствор аминокислот” 1/5 масса нанесенных модификаторов уменьшается в 2–2.5 раза, в то время как значения удельной поверхности и объема пор монотонно увеличиваются в 1.7 и 1.5 раза соответственно. Характер временного изменения характеристик образцов, полученных при соотношении “сорбент/раствор аминокислот” равном 1/10, иной. Наибольший привес массы сорбента происходит при времени синтеза 2 ч, которое и было принято как оптимальное. Значения величин удельной поверхности и суммарного объема пор в этом образце соответственно несколько ниже (в ~1.2–1.3 раза и в ~1.1–1.2 раза) по сравнению с продолжительностями синтеза в течение 1.5 и 4 ч. Для двух серий образцов установлена обратная зависимость между содержанием модификаторов и объемом пор. Это означает, что при протекании реакции конденсации аминокислот в объеме пористого пространства углеродного сорбента образуются продукты синтеза. Скорее всего, что данная реакция протекает с частичным выходом и локализацией на отдельных участках поверхности. Установлено, что разложение нанесенных на углеродный сорбент модификаторов протекает в области 200–250°С и обусловлено окислительной деструкцией нанесенных олигомеров аминокислот (рис. 1).
Количественное содержание функциональных групп по методу H.P. Boehm на поверхности исследуемых образцов и содержание азота по Кьельдалю представлено в табл. 3.
Таблица 3.
Содержание функциональных групп и элементного азота на поверхности исследуемых образцов
| Образец | Общие группы, мг-экв/г |
Фенольные группы, мг-экв/г |
Карбоксильные группы, мг-экв/г |
Азот, мас. % |
|---|---|---|---|---|
| УС | 0.070 | 0.021 | 0.049 | – |
| 1 серия | ||||
| УС-1/5-1.5 | 0.390 | 0.079 | 0.311 | 0.29 |
| УС-1/5-2 | 0.296 | 0.082 | 0.214 | 0.27 |
| УС-1/5-4 | 0.207 | 0.027 | 0.180 | 0.21 |
| 2 серия | ||||
| УС-1/10-1.5 | 0.226 | 0.024 | 0.202 | 0.20 |
| УС-1/10-2 | 0.316 | 0.079 | 0.237 | 0.28 |
| УС-1/10-4 | 0.238 | 0.030 | 0.208 | 0.26 |
Видно, что по сравнению с исходным углеродным сорбентом УС для всех образцов модифицированного сорбента наблюдается увеличение содержания кислородсодержащих групп на поверхности. Сопоставление полученных показателей табл. 2 показало, что количественное содержание общих кислородсодержащих групп и карбоксильных групп в определяющей степени зависит от параметров синтеза. Максимальное увеличение количества функциональных групп на поверхности установлено для образца УС-1/5-1.5. Так, по сравнению с исходным образцом УС количество суммарных функциональных групп выше в ~5.5 раз. Содержание общего азота в этом образце также больше, чем для других сорбентов и составило 0.29 мас. %.
Таким образом, согласно данным физико-химических исследований модифицированных образцов, наиболее перспективным является образец УС-1/5-1.5, полученный при соотношении “сорбент/раствор аминокислот” – 1 : 5 при времени термообработки 1.5 ч при 190°С.
Для данного образца изучены процессы десорбции нанесенных аминокислот с углеродной поверхности в физиологическом водном растворе 0.9 мас. % NaCl (образец УСМД). В табл. 4 представлены значения рН растворов при контакте с образцом в течение 120 ч при соотношении сорбент : NaCl = 1 : 6.
Таблица 4.
Изменение рН исследуемого образца УСМД в процессе десорбции в физиологическом водном растворе
| Образец | Значение рН | ||||||
|---|---|---|---|---|---|---|---|
| исходное значение физиологического раствора NaCl | 1 ч | 2 ч | 6 ч | 24 ч | 48 ч | 120 ч | |
| УСМД | 6.53 | 3.07 | 3.06 | 3.09 | 3.17 | 3.22 | 3.26 |
Установлено, что уже в течение часа при контакте образца УС-1/5-1.5 с физиологическим раствором происходит снижение рН от 6.53 до 3.06.
Удельная площадь поверхности образца после десорбции в физиологическом растворе в течение 5 сут составила 254 м2/г, что в 1.8 раза больше по сравнению с модифицированным образцом до десорбции. Таким образом, равновесие в системе устанавливается в течение первого часа. Снижение рН исходного водного раствора можно объяснить десорбцией нанесенных олигомеров аминокислот и их гидролизом.
Проведены РФЭС исследования исходного (образец УС) и модифицированного углеродного сорбента до (образец УС-1/5-1.5) и после десорбции (образец УС-1/5-1.5Д).
На рис. 2 представлены обзорные РФЭ-спектры образцов, измеренные в диапазоне энергий связи 1050–0 эВ с шагом по энергии 1 эВ.
Рис. 2.
Обзорные РФЭ-спектры исследованных образцов углеродного сорбента: (1) УС; (2) УС-1/5-1.5; (3) УСМД.

На всех рентгенофотоэлектронных спектрах наблюдается высоко интенсивная спектральная линия в районе ~284 эВ, которая соответствует фотоэмиссии электронов с уровня С1s атомов углерода и низко интенсивная спектральная линия в районе ~532 эВ, связанная с фотоэмиссией электронов с уровня O1s, а также низко интенсивная спектральная линия оже-перехода кислорода OKLL (рис. 2). Полученные обзорные спектры РФЭС характерны для углеродных материалов, имеющих контакт с кислородом воздуха и содержащих кислородсодержащие группы на поверхности [26]. Также отметим, что в обзорном РФЭ-спектре модифицированного образца (рис. 3, кривая 2) наблюдается мало интенсивная спектральная линия с энергией связи ~400 эВ, связанная с фотоэмиссией электронов с уровня N1s атомов азота, характерная для спектров азотсодержащих углеродных материалов [27]. В РФЭ-спектре образца УС-1/5-1.5Д, прошедшего десорбцию, спектральная линия N1s с энергией связи ~400 эВ регистрируется крайне слабо, практически на уровне шумов (рис. 4, кривая 3), что позволяет предположить наличие элемента N в следовых количествах, как следствие наличия остаточных азотсодержащих групп после десорбции.
Анализ электронного состояния атомов углерода и кислорода проводили по данным полученных прецизионных РФЭ-спектров отдельных спектральных областей линий С1s, O1s (рис. 3, 4) с шагом 0.1 эВ при энергии пропускания анализатора hν = 25 эВ.
Спектры углерода были аппроксимированы с помощью нескольких компонентов, обозначенных С1-С5 в соответствии с работами [28, 29].
Наиболее интенсивный компонент пика (С1) с энергией связи 284.5 эВ (рис. 4) отвечает графитоподобному состоянию углерода (sp2-гибридизация атомов). Об этом же свидетельствует наличие выраженного π-π* – сателлита в районе 292.0 эВ (рис. 4). Компонент пика с энергией связи 285.5 эВ (С2) соответствует состоянию sp3-гибридизации атомов углерода в составе С–Н и C–C связей. Компонент пика с энергией связи 287.0 эВ (С3) относится к углероду (sp3-гибридизация атомов), связанному с кислородом в составе одинарных С–O связей (гидроксидные, эфирные, фенольные группы).
Пики с энергиями связи 288.0 и 289.5 эВ (компоненты С4 и С5 на рис. 3) отвечают состояниям атомов углерода в составе карбонильных (С=O) и карбоксильных (СOOH) групп соответственно.
Электронное состояние кислорода на углеродной поверхности всех исследуемых образцов представлено тремя формами, обозначенными О1–О3 (рис. 4). Пик О1s с энергией связи 534.0–533.5 эВ (форма О1) отвечает состоянию кислорода в составе одинарных C–O связей [29, 30]. Компонент пика O1s с энергией связи 532.0–531.5 эВ (форма О2) связан с присутствием карбонильных групп [29, 30]. Низкоэнергетический компонент пика O1s с энергией связи 530.0–529.5 эВ (форма О3) отвечает состояниям углерода в составе карбоксильных групп [30, 31].
На основе сопоставления аппроксимированных (разложенных на компоненты) РФЭ-спектров области углерода (рис. 3) и кислорода (рис. 4) можно заключить следующее. В образцах сорбента до и после модифицирования количество форм углерода и кислорода, отражающее конкретные электронные состояния атомов углеродной поверхности, не меняется, то есть качественный состав исходных кислородсодержащих функциональных групп сохраняется. Конечно, при модифицировании вероятны и, действительно, происходят относительные перераспределения между разными типами кислород-углеродных групп, обусловленные прежде всего образованием и закреплением модификатора из фрагментов взаимодействующих молекул аминокислот. Это, например, удаление OH–групп из состава поверхностных –СООН с образованием амидной группы О=С–N–, появление дополнительных групп –COOH в составе олигомеров аминокислот и т.д. Не случайно, при модифицировании по сравнению с исходным сорбентом по данным титриметрического анализа по Н.P. Boehm в 5–6 раз возрастает количество кислородсодержащих групп, причем в основном за счет увеличения карбоксильных.
ВЫВОДЫ
1. Проведена гетерогенная реакция конденсации глицина и глутаминовой кислоты на углеродном материале для получения модифицированного сорбента без использования катализаторов. Наибольшее количество нанесенного на сорбент модификатора 1.69 мас. % получено при времени синтеза 1.5 ч при соотношении “сорбент/раствор аминокислот” 1/5 и температуре 190°С. Значения удельной поверхности и объема пор при этом составляют 142 м2/г и 0.157 см3/г соответственно, количество кислородсодержащих групп по сравнению с исходным образцом повышается в 5.5 раз.
2. Установлено, что полученные олигомеры аминокислот десорбируются в водный раствор 0.9% NaCl. При этом происходит снижение рН в течение часа от 6.5 до 3.1, что обусловлено гидролизом нанесенных модификаторов.
3. По данным РФЭС в образцах сорбента до и после модифицирования количество форм углерода и кислорода не меняется. Этот факт отражает то, что идентифицированный состав кислородсодержащих функциональных поверхностных групп при модифицировании сохраняется, хотя их относительное содержание может перераспределяться.
Разработанный способ синтеза углеродного сорбента с нанесенными олигомерами аминокислот представляет интерес для получения материала медицинского назначения (энтеро-, вульнеросорбция). Наблюдаемый результат снижения рН раствора за счет гидролиза нанесенного модификатора позволяет предположить, что за счет подкисления биологической среды сорбент будет проявлять антибактериальное действие, так как рН среды 2–3 является губительной для жизнедеятельности и размножения патогенной микрофлоры.
Список литературы
Manilo M., Lytvynov G.S., Barany S. // Nanosystems, Nanomaterials, Nanotechnologies. 2016. V. 14. P. 123–135.
Uzhel A.S. et al. // J. Chromatogr. A. 2019a. V. 1589. P. 65–72.
Uzhel A.S. et al. // J. Chromatogr. A. 2019b. V. 1596. P. 117–123.
Mäde V., Els-Heindl S., Beck-Sickinger A.G. // Beilstein J. Org. Chem. 2014. V. 10. P. 1197–1212.
Shinbara K. et al. // Frontiers in Chemistry. 2020. V. 8. P. 447.
Wang C., Yang G., Jiang Y. // Physica E Low Dimensional Systems Nanostructures. 2017. V. 85. P. 7–12.
Thompson M., Scholz C. // Nanomaterials. 2021. V. 11. P. 1119.
Pérez-Torres I., Zuniga-Munoz A., Guarner-Lans V. // Mini Reviews in Medicinal Chemistry 2016. V. 17. Is. 1. P. 15–32.
Gillissen G., Schumacher M., Breuer-Werle M. // Zentralblatt für Bakteriologie. 1991. V. 275. P. 223–232.
Minami M. et al. // Antimicrob. Agents Ch. 2004. V. 48. Is. 10. P. 3782–3788.
Inbaraj B.S. et al. // Nanotechnology. 2011. V. 22. Is. 7. P. 75–101.
Lee N.R. et al. // Saudi J. Biol. Sci. 2014. V. 21. Is. 2. P. 153–158.
Ponnusha B.S. et al. // Int. J. Cur. Biol. Med. Sci. 2011. V. 1. Is. 2. P. 49–62.
Najar I.N., Das S. // Int. J. Pharm. Sci. Res. 2015. V. 6. Is. 6. P. 2258–2280.
Pagire S.H. et al. // Bioorg Med Chem Lett. 2018. V. 28. Is. 3. P. 529–532.
Lee J.M. et al. // Int. J. Biol. Macromol. 2018. V. 108. P. 598–607.
Demir E. et al. // Curr. Anal. Chem. 2020. V. 16. P. 176–183.
Schaumann T. et al. // Clin. Dev. Immunol. 2013. P. 808367–808376.
Belokrylov G.A., Popova O.Y., Sorochinskaya E.I. // Int. J. Immunopharmacol. 1999. V. 21. Is. 12. P. 879–883.
Zhong Z. et al. // Curr. Opin. Clin. Nutr. Metab. Care. 2003. V. 6. P. 229–240.
Hasegawa S. et al. // Clin. Exp. Immunol. 2012. V. 167. Is. 2. P. 269–274.
Vargas M.H., Del-Razo-Rodríguez R., López-García A. // BMC Pulm. Med. 2017. V. 17. P. 206–218.
Ogunleye A. et al. // Microbiology. 2015. V. 161. P. 1–17.
Boehm H.P. // Carbon. 2002. V. 40. Is. 2. P. 145–149.
Zauer E.A., Ershov A.B. // Analitika i kontrol’ [Analytics and Control]. 2019. V. 23. Is. 2. P. 168–192.
Michio I. // Tsinghua University Press Limited. Elsevier Inc. 2016. 318 p.
Kryazhev Y.G. et al. // Solid Fuel Chem. 2015. V. 49. Is. 1. P. 1–6.
Kovtun A. et al. // Carbon. 2019. V. 143. P. 268–275.
N.G. Bobenko et al. // Carbon. 2019. V. 153. P. 40–51.
Sotoma S. et al. // RSC Adv. 2015. V. 5. P. 13818–13827.
Zhang L. et al. // RSC Adv. 2018. V. 8. P. 42280–42291.
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов




