Физикохимия поверхности и защита материалов, 2022, T. 58, № 5, стр. 473-479
Сорбционные свойства активированного угля БАУ-А по отношению к ионам никеля
О. Д. Линников 1, *, И. В. Родина 1, А. Ю. Сунцов 1
1 ФГБУН Институт химии твердого тела УрО РАН
620990 Екатеринбург, ул. Первомайская, 91, Россия
* E-mail: linnikov@mail.ru
Поступила в редакцию 07.09.2021
После доработки 30.05.2022
Принята к публикации 06.06.2022
- EDN: XZNLUV
- DOI: 10.31857/S004418562205014X
Аннотация
Изучены сорбционные свойства активированного угля БАУ-А по отношению к ионам никеля. Исследования проведены при комнатной температуре на модельном растворе в диапазоне рН 5–8. Показано, что изотермы адсорбции ионов никеля активированным углем БАУ-А при различных рН раствора могут быть с одинаковой точностью описаны двумя классическими уравнениями: Фрейндлиха и Ленгмюра. Обнаружено отсутствие корреляции параметров уравнения Фрейндлиха с изменением рН раствора, что указывает на эмпирический характер описания экспериментальных данных этим уравнением. Параметры уравнения Ленгмюра закономерно меняются при изменении рН раствора. При росте рН раствора адсорбционная емкость БАУ-А по отношению к ионам никеля снижается, а константа адсорбционного равновесия напротив возрастает. Оценка свободной энергии адсорбции по уравнению Дубинина–Радушкевича показала, что она не превышает 1 кДж/моль, что исключает ионообменное взаимодействие ионов никеля с БАУ-А. Сопоставление параметров уравнения Ленгмюра по сорбции ионов никеля с аналогичными данными для ионов меди(II) показывает, что адсорбционная емкость БАУ-А по ионам никеля примерно на порядок выше, чем по ионам меди(II). Это позволяет рекомендовать данный сорбент для селективного извлечения ионов никеля и меди из смешанных растворов.
ВВЕДЕНИЕ
Активированные угли и другие углеродные сорбенты давно и широко используются для очистки газов, природных и сточных вод от органических и неорганических примесей. Наибольшее применение они нашли для очистки растворов от нефтепродуктов и других нежелательных органических соединений [1]. Также данные сорбенты используются для удаления из загрязненных вод ионов тяжелых металлов [1–3]. Однако их промышленное применение нередко носит эмпирический характер, так как свойства этих сорбентов изучены еще недостаточно, а имеющиеся сведения часто противоречивы. Все это затрудняет проведение корректных технологических расчетов при проектировании схем и оборудования для очистки загрязненных вод.
Ионы двухвалентного никеля обладают высокой токсичностью. Они способны накапливаться в организме человека и вызывать онкологические заболевания. Поэтому они имеют достаточно низкую ПДК для питьевой воды (0.1 мг/л), а также для вод рыбохозяйственного назначения (0.01 мг/л). Их глубокое осаждение из водных растворов в виде гидроксида возможно только при рН > 8–9. Однако вода с такой высокой щелочностью не может быть использована в коммунальном хозяйстве или сброшена в природные водоемы. Одним из способов решения данной проблемы может быть сорбционная очистка загрязненных никелем вод. В связи с этим поиск эффективных сорбентов для ионов двухвалентного никеля является важной научно-технической задачей.
Активированный уголь БАУ-А давно используется для очистки загрязненных вод от нежелательных примесей, в том числе и от ионов никеля [1–5]. Однако детальных исследований закономерностей сорбции ионов никеля БАУ-А в широком диапазоне рН очищаемого раствора практически не было проведено. Данной работой мы пытаемся заполнить этот пробел. Ранее было установлено, что сорбция ионов меди(II) активированным углем БАУ-А хорошо описывается уравнением Ленгмюра для простой мономолекулярной адсорбции [6]. Были определены параметры этого уравнения в зависимости от рН очищаемого раствора. Можно предположить, что сорбция ионов никеля БАУ-А будет протекать по такому же механизму.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследований был взят технический активированный уголь БАУ-А (ГОСТ 6217-74). Все эксперименты проводили при комнатной температуре (25 ± 2°С) на модельном растворе, имитирующем природные и сточные воды, который готовили путем растворения в дистиллированной воде сульфатов натрия и никеля (Na2SO4 и NiSO4). Концентрация сульфата натрия в модельном растворе составляла 400 мг/л, а ионов никеля меняли от 10 до 80 мг/л. Использованный для приготовления растворов Na2SO4 имел квалификацию “ч.”, а NiSO4 – “ч. д. а.”.
Сорбцию ионов никеля активированным углем БАУ-А изучали при разных значениях рН модельного раствора. В этих экспериментах в модельный раствор при непрерывном его перемешивании на магнитной мешалке добавляли разное количество сорбента, а затем с помощью 0.1 N растворов серной кислоты (квалификация – “ОС. Ч.”) и NaOH (квалификация – “Х. Ч.”) проводили корректировку его рН до требуемого значения, которое контролировали в течение всего опыта с помощью рН-метра АНИОН 4100. При этом электроды рН-метра были постоянно погружены в модельный раствор с сорбентом. Длительность сорбционных экспериментов составляла 60 мин. Как показали предварительные опыты, этого времени было достаточно для установления сорбционного равновесия в растворе.
Величина сорбции рассчитывалась по формулам:
где q – величина сорбции, мг/г (расчет по формуле (1)) или мг/м2 (вычисление по формуле (2)); v – объем раствора, л; m – масса сорбента, г; Cin – начальная (до сорбции) концентрация ионов никеля в растворе, мг/л; C – остаточная (после сорбции) концентрация ионов никеля в растворе, мг/л; Ss – удельная поверхность сорбента, м2/г.Значение водородного показателя (pHZPC), при котором поверхность БАУ-А имеет нулевой заряд (рН точки нулевого заряда) определяли потенциометрическим методом. Для этого одна проба раствора Na2SO4 (400 мг/л), объемом 50 мл, была оттитрована 0.0105 N раствором H2SO4, а другая, такая же, – 0.01017 N раствором NaOH. Затем аналогичное титрование провели для двух проб суспензии 0.5 г/л БАУ-А в таком же растворе сульфата натрия. Точка пересечения этих кривых титрования дает значение pHZPC данного сорбента. Отметим, ранее было обнаружено, что исследуемый образец активированного угля БАУ-А содержит небольшое количество примесей (CaCO3, MgCO3 и т.п.), повышающих рН его суспензии [6]. Поэтому перед определением pHZPC сорбент был тщательно отмыт дистиллированной водой от этих примесей, до постоянного значения рН его суспензии.
В конце всех экспериментов при определении концентрации ионов никеля в растворе, чтобы исключить возможное искажение результатов анализа из-за сорбции части ионов никеля на бумажном фильтре при фильтровании, первые порции отфильтрованных растворов объемом 100 мл отбрасывали и для анализа брали оставшиеся объемы фильтратов. Процесс фильтрации занимал 20–30 мин. Таким образом, общее время контакта раствора с сорбентом составляло 80–90 мин.
Определение концентрации ионов никеля в растворе проводили фотоколориметрическим методом с диметилглиоксимом [7].
Морфологию и структуру частиц сорбента изучали с помощью сканирующего электронного микроскопа JSM JEOL 6390LA.
Удельная поверхность БАУ-А была определена методом БЭТ по низкотемпературной адсорбции азота на установке Gemini VII 2390 V1.03.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Физико-химические свойства БАУ-А
Микрофотография поверхности БАУ-А приведена на рис. 1. Видно, что БАУ-А имеет ярко выраженную пористую структуру. Измерение удельной поверхности БАУ-А показало, что она составляет 984.9 м2/г. При этом поверхность пор равна 674.6 м2/г. Таким образом, доля поверхности пор составляет около 69% от общей удельной поверхности угля. Это подтверждает литературные данные о том, что активированные угли обладают большой удельной поверхностью именно благодаря наличию у них пор.
На рис. 2 показаны кривые потенциометрического титрования раствора сульфата натрия (400 мг/л) и суспензии БАУ-А в нем. Точка нулевого заряда поверхности активированного угля БАУ-А соответствует рН 7.3 (pHZPC = 7.3, рис. 2).
Рис. 2.
Кривые потенциометрического титрования: 1 – титрование раствора Na2SO4; 2 – титрование суспензии БАУ-А в растворе Na2SO4 (V – объем титранта).
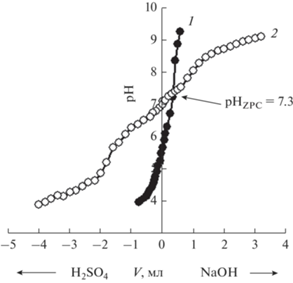
Из рис. 2 следует, что БАУ-А хорошо адсорбирует на своей поверхности гидроксид-ионы (ОН–). На это указывает значительное различие между кривыми титрования 1 и 2 при V(NaOH) > 0. Кроме того, при добавлении щелочи в чистый раствор сульфата натрия рН последнего резко увеличивается, в то время как при подщелачивании суспензии БАУ-А рост рН идет не так сильно.
При подкислении наблюдается аналогичная картина: введение серной кислоты в чистый раствор сульфата натрия приводит к резкому падению его рН, а при подкислении суспензии БАУ-А сдвиг рН происходит в меньшей степени. Это свидетельствует о том, что ионы водорода Н+ также хорошо адсорбируются на поверхности сорбента. Однако с учетом того, что при введении БАУ-А в чистый раствор сульфата натрия наблюдается сдвиг рН последнего в щелочную область от рН ≈ 5.5 до рН ≈ 7 (см. рис. 2), можно сделать вывод, что ионы ОН– адсорбируются на поверхности сорбента в меньших количествах по сравнению с ионами Н+.
КР-спектр активированного угля, снятый нами ранее в [6], приведен на рис. 3. Съемка производилась в диапазоне волновых чисел 50–4000 см–1 при комнатной температуре на спектрофотометре RENISHAW-1000 (λ = 532 нм, P = 25 мВт) [6].
Как видно, в КР-спектре присутствуют всего две линии, которые характерны для аморфного углерода (рис. 3). Это D-линия при ~1332 см–1 и G-линия при 1593 см–1. Линия G отвечает колебаниям атомов с sp2-типом гибридизации, находящихся в хорошо упорядоченных графитовых плоскостях. Линия D при 1332 см–1 обусловлена связями С–С с sp3-типом гибридизации [6]. Эта линия также характеризует структурное разупорядочение и служит характеристикой степени дефектности фазы углерода, ее значительное уширение и высокая интенсивность свидетельствуют об аморфном состоянии углерода в БАУ-А. Малые по интенсивности линии около 2600–3000 см–1 являются обертонами линий D и G [6]. Отношение общих интенсивностей линий G и D (т.е. G/D), как известно, является показателем степени кристалличности. Вычисление по данным рис. 3 дает G/D = 0.70.
Сорбционные свойства по отношению к ионам никеля
Пример изотермы сорбции ионов никеля активированным углем БАУ-А при рН 8 представлен на рис. 4. Остальные зависимости для другой кислотности модельного раствора имели аналогичный вид.
Форма изотермы на рис. 4 свидетельствует о том, что она относится к L-типу. Такой вид изотерм чаще всего описывается эмпирическим уравнением Фрейндлиха:
или классическим уравнением Ленгмюра для мономолекулярной адсорбции: где KF – коэффициент пропорциональности; n – показатель степени (n > 1); q∞ – емкость адсорбционного монослоя сорбента, мг/г или мг/м2; KL – константа адсорбционного равновесия, л/мг.Линейные формы уравнений (3) и (4) имеют, соответственно, следующий вид:
Типичные результаты обработки экспериментальных данных в координатах уравнений (5) и (6) показаны на рис. 5 и 6.
Рис. 5.
Экспериментальные данные по сорбции ионов никеля активированным углем БАУ-А при рН 8 в координатах уравнения (5).

Рис. 6.
Экспериментальные данные по сорбции ионов никеля активированным углем БАУ-А при рН 8 в координатах уравнения (6).

Как видно, оба уравнения, и Фрейндлиха и Ленгмюра, с удовлетворительной точностью описывают полученные экспериментальные данные (рис. 5 и 6), что, в частности, подтверждают высокие коэффициенты корреляции (табл. 1).
Таблица 1.
Параметры уравнений Фрейндлиха, Ленгмюра и Дубинина–Радушкевича для сорбции ионов никеля активированным углем БАУ-А в зависимости от рН модельного раствора (R – коэффициент корреляции)
| Уравнение Фрейндлиха | рН 5 | рН 6 | рН 7 | рН 8 |
|---|---|---|---|---|
| KF | 0.31 | 0.24 | 0.22 | 0.40 |
| n | 1.43 | 1.32 | 1,18 | 1.41 |
| R | 0.977 | 0.987 | 0.974 | 0.955 |
| Уравнение Ленгмюра | ||||
| q∞, мг/г | 13.1 | 12.8 | 9.9 | 5.3 |
| q∞, мг/м2 | 0.0133 | 0.0130 | 0.0100 | 0.0053 |
| KL, л/мг | 0.012 | 0.013 | 0.020 | 0.066 |
| R | 0.965 | 0.995 | 0.962 | 0.991 |
| Уравнение Дубинина–Радушкевича | ||||
| q∞, мг/г | 5.1 | 3.5 | 2.8 | 2.0 |
| k × 106 | 43.6 | 4.91 | 2.66 | 0.946 |
| E, кДж/моль | 0.11 | 0.32 | 0.43 | 0.73 |
| R | 0.976 | 0.920 | 0.803 | 0.919 |
Принято считать, что уравнение Фрейнлиха для n > 1 соответствует адсорбции на неоднородной поверхности. При n = 1 оно переходит в классическую изотерму Генри. Однако найденные значения параметров уравнения (3) не обнаруживают никакой корреляции с изменением рН модельного раствора. Поэтому в данном случае можно сделать вывод об эмпирическом описании опытных данных этой изотермой.
В отличие от уравнения Фрейндлиха, при описании результатов эксперимента изотермой Ленгмюра обнаруживается четкая взаимосвязь между рН раствора и значениями параметров этого уравнения. Так, с увеличением рН раствора адсорбционная емкость монослоя (q∞) БАУ-А по отношению к ионам никеля снижается, а константа адсорбционного равновесия (KL) напротив возрастает (табл. 1). Можно выделить две области изменения адсорбционной емкости монослоя БАУ-А. При 5 ≤ pH ≤ 6 наблюдается ее небольшое уменьшение, а при приближении к точке нулевого заряда поверхности БАУ-А (pHZPC = 7.3), т.е. при рН > 6, имеет место резкое падение. Для константы адсорбционного равновесия наблюдается обратная зависимость: при приближении к точке нулевого заряда поверхности сорбента происходит ее экспоненциальный рост.
Как правило, с ростом рН раствора адсорбционная емкость большинства сорбентов по отношению к ионам тяжелых металлов возрастает. В данном случае имеет место обратная картина, которую нельзя объяснить, например, изменением форм состояния ионов никеля, так как во всем изученном диапазоне рН он находится в растворе в виде ионов Ni2+ [8]. Обнаруженную зависимость можно объяснить влиянием конкурентной адсорбции гидроксид-ионов, которые при повышении рН раствора, по-видимому, вытесняют ионы никеля с поверхности БАУ-А. Это, видимо, и приводит к наблюдаемому снижению адсорбционной емкости БАУ-А по отношению к этим ионам. Другими словами, ионы ОН– занимают (или перекрывают) на поверхности сорбента те места, куда могли бы адсорбироваться ионы никеля. При этом адсорбционное взаимодействие гидроксид-ионов с поверхностью БАУ-А, по-видимому, превышает аналогичное взаимодействие ионов никеля. Поэтому последние не могут их вытеснить с поверхности сорбента. В связи с этим представляет интерес оценка свободной энергии адсорбции ионов никеля на поверхности БАУ-А, которую можно сделать с помощью изотермы Дубинина–Радушкевича [8, 9]:
или (после логарифмирования) в линейной форме: где k – константа, относящаяся к средней энергии адсорбции; ε – потенциал Поляни, равныйСвободная энергии адсорбции (E) рассчитывается по формуле:
Известно, что если E лежит в диапазоне 8–16 кДж/моль, то процесс адсорбции протекает путем ионного обмена. При E < 8 кДж/моль имеет место физическая адсорбция [8, 9].
Типичный пример обработки экспериментальных данных в координатах уравнения (8) показан на рис. 7. Видно, что изотерма Дубинина–Радушкевича несколько хуже описывает сорбцию ионов никеля активированным углем БАУ-А, чем теория Ленгмюра и эмпирическая формула Фрейнлиха. На это также указывают более низкие коэффициенты корреляции (табл. 1).
Рис. 7.
Экспериментальные данные по сорбции ионов никеля активированным углем БАУ-А при рН 8 в координатах уравнения (8).

Оценка адсорбционной емкости БАУ-А по ионам никеля по уравнению (7) дает значения примерно в 2 раза ниже, чем при расчете по изотерме Ленгмюра. Однако тенденция снижения q∞ с повышением рН раствора сохраняется. При этом наблюдается некоторое возрастание величины свободной энергии адсорбции (E) с ростом рН раствора, но даже при рН 8 ее величина не превышает 1 кДж/моль (см. табл. 1), что указывает на физическую природу адсорбции и исключает ионообменное взаимодействие ионов никеля с БАУ-А. Этот результат хорошо согласуется с данными по ИК и КР спектроскопии сорбента [6]. Так, на ИК-спектре БАУ-А не было зафиксировано характеристических линий и полос, принадлежащим различным функциональным группам (ОН, С–Н и т.п.), а КР-спектр указывает на аморфное состояние углерода в данном сорбенте (рис. 3).
Сравнение коэффициентов корреляции уравнений (3) и (4) (табл. 1) показывает, что они примерно с одинаковой точностью описывают экспериментальные результаты по сорбции ионов никеля активированным углем БАУ-А. Ни одному из них нельзя отдать предпочтение. Это довольно типичная ситуация [8–17]. Однако в отличие от эмпирического выражения (3) уравнение (4) хорошо теоретически обосновано, и его параметры можно сопоставить с опубликованными литературными данными по сорбции ионов никеля другими углеродными и угольными сорбентами (см. табл. 2).
Таблица 2.
Параметры уравнения Ленгмюра при сорбции ионов никеля(II) различными углеродными и угольными сорбентами
| Сорбент | рН | q∞, мг/г | q∞, мг/м2 | KL, л/мг | Источник |
|---|---|---|---|---|---|
| БАУ | – | 2.4 | 0.003 | – | [3] |
| АУВ | – | 5.4 | 0.004 | – | [3] |
| УНЧ | 4 | 59.8 | 0.033 | 0.0167 | [4] |
| АД-05-2 | – | 5.93 | 0.0108 | 0.0067 | [5] |
| Сибунит | – | 1.12 | 0.0025 | 0.0021 | [5] |
| MWCNTs | 5.4 | 3.73 | 0.019 | 0.197 | [8] |
| DHHC | 6 | 29.7 | 0.833 | 0.135 | [10] |
| SWCNT | – | 9.22 | 0.016 | 0.021 | [16] |
| MWCNT | – | 7.33 | 0.016 | 0.012 | [16] |
| GAC | – | 14.53 | 0.015 | 0.044 | [16] |
| Zn formate glycolate | 6 | 11.79 | 0.0073 | 0.0532 | [17] |
| Zn glycerolate | 6 | 8.388 | 0.0073 | 0.0929 | [17] |
| МИУ-С | 6 | 1.44 | 0.065 | 0.107 | [18] |
Сравнение данных табл. 1 и 2 показывает, что адсорбционная емкость изученного нами образца БАУ-А сопоставима с аналогичной величиной для других углеродных и угольных сорбентов.
Представляет интерес также сравнение сорбционных свойств БАУ-А по отношению к ионам никеля и меди(II), которые имеют близкие ионные радиусы и атомные массы. При этом обнаруживаются значительные отличия в протекании процесса адсорбции этих двух ионов на данном сорбенте при изменении рН раствора. Так, сорбция ионов меди(II) на БАУ-А тоже описывается уравнением Ленгмюра [6]. Однако с увеличением рН раствора емкость адсорбционного монослоя сорбента по отношению к ионам меди(II), в отличие от ионов никеля, не падает, а возрастает [6]. Константа же адсорбционного равновесия напротив несколько снижается. При рН 5 емкость адсорбционного монослоя БАУ-А по ионам меди(II) составляет 0.0016 мг/м2, а при рН 6 – 0.0026 мг/м2 соответственно [6]. Это на порядок ниже, чем по ионам никеля (см. табл. 1). Полученный результат мы пока не можем объяснить. Можно лишь предположить, что данные различия обусловлены отличием в строение электронных оболочек ионов меди(II) и никеля. Однако в практическом плане он может быть использован для селективного извлечения этих ионов из смешанных растворов с помощью БАУ-А.
ЗАКЛЮЧЕНИЕ
Таким образом, изотермы сорбции ионов никеля активированным углем БАУ-А при различных значениях рН раствора могут быть с одинаковой точностью описаны двумя классическими уравнениями: Фрейндлиха и Ленгмюра. Отсутствие корреляции параметров уравнения Фрейндлиха с рН раствора свидетельствует об эмпирическом характере описания им полученных экспериментальных данных. Параметры же уравнения Ленгмюра закономерно меняются при изменении рН раствора. Так, при росте рН раствора адсорбционная емкость монослоя БАУ-А по отношению к ионам никеля снижается, а константа адсорбционного равновесия напротив возрастает. Наиболее существенное снижение адсорбционной емкости монослоя БАУ-А и рост константы адсорбционного равновесия происходит при рН > 6, с приближением к точке нулевого заряда поверхности БАУ-А (pHZPC = 7.3). Оценка свободной энергии адсорбции по уравнению Дубинина–Радушкевича показала, что она не превышает 1 кДж/моль, что исключает ионообменное взаимодействие ионов никеля с БАУ-А. Сопоставление параметров уравнения Ленгмюра по сорбции ионов никеля с ранее полученными аналогичными данными для ионов меди(II) показывает, что адсорбционная емкость БАУ-А по ионам меди примерно на порядок ниже, чем по ионам никеля, что позволяет рекомендовать данный сорбент для селективного извлечения ионов никеля и меди из смешанных растворов.
Работа выполнена в соответствии с государственным заданием и планами НИР ИХТТ УрО РАН.
Список литературы
Смирнов А.Д. Сорбционная очистка воды. Л.: Химия, 1982. 168 с.
Зорина Е.И. // Сборник докладов III межотраслевой конференции “Вода в промышленности-2012”. Москва. 2012. С. 122–124.
Гимаева А.Р., Валинурова Э.Р., Игдавлетова Д.К., Кудашева Ф.Х. // Сорбционные и хроматографические процессы. 2011. Т. 11. № 3. С. 350–356.
Милютина А.Д., Колесников В.А., Колесников А.В. // Успехи в химии и химической технологии. 2016. Т. 30. № 1. С. 42–43.
Дударева Г.Н., Петухова Г.А., Нгуен А.Т.Н., Сырых Ю.С. // Физикохимия поверхности и защита материалов. 2013. Т. 49. № 4. С. 389–396. https://doi.org/10.7868/S0044185613040025
Линников О.Д., Родина И.В., Бакланова И.В., Сунцов А.Ю. // Сорбционные и хроматографические процессы. 2018. Т. 18. № 4. С. 554–562. https://doi.org/10.17308/sorpehrom.2018.18/563
Новиков Ю.В., Ласточкин К.О., Болдина З.Н. Методы исследования качества воды водоемов. Изд. 2-е, дополненное и переработанное. М.: Медицина, 1990. 400 с.
Yang S., Li J., Shao D., Hu J., Wang X. // J. Hazard. Mater. 2009. V. 166. P. 109–116. https://doi.org/10.1016/j.jhazmat.2008.11.003
Donat R., Akdogan A., Erdem E., Cetisli H. // J. Colloid Interface Sci. 2005. V. 286. P. 43–52. https://doi.org/10.1016/j.jcis.2005.01.045
Sivrikaya S., Albayrak S., Imamoglu M., Gundogdu A., Duran C., Yildiz H. // Desalination and water treatment. 2012. V. 50. P. 2–13. https://doi.org/10.1080/19443994.2012.708234
Kalkan E., Nadarogly H., Demir N. // Desalination and water treatment. 2012. V. 44. P. 180–189. https://doi.org/10.1080/19443994.2012.691704
Jiang Y., Pang H., Liao B. // J. Hazard. Mater. 2009. V. 164. P. 1–9. https://doi.org/10.1016/j.jhazmat.2008.07.107
Li Y.H., Wang S., Wei J., Zhang X., Xu C., Luan Z., Wu D., Wei B. // Chem. Phys. Lett. 2002. V. 357. P. 263–266. https://doi.org/10.1016/S0009-2614(02)00502-X
Basar C.A. // J. Hazard. Mater. 2006. V. B135. P. 232–241. https://doi.org/10.1016/j.jhazmat.2005.11.055
Di Z.C., Ding J., Peng X.J., Li Y.H., Luan Z.K., Liang J. // Chemosphere. 2006. V. 62. P. 861–865. https://doi.org/10.1016/j.chemosphere.2004.06.044
Lu C., Liu C. // J. Chem. Technol. Biotechnol. 2006. V. 81. P. 1932–1940. https://doi.org/10.1002/jctb.1626
Krasil’nikov V.N., Linnikov O.D., Gyrdasova O.I., Rodina I.V., Tyutyunnik A.P., Baklanova I.V., Polyakov E.V., Khlebnikov N.A., Tarakina N.V. // Solid state Sciences. 2020. V. 108. P. 106429. https://doi.org/10.1016/j.solidstatesciences.2020.106429
Линников О.Д., Родина И.В., Бакланова И.В., Сунцов А.Ю. // Физикохимия поверхности и защита материалов. 2021. Т. 57. № 3. С. 255–261. https://doi.org/10.31857/S0044185621030165
Дополнительные материалы отсутствуют.
Инструменты
Физикохимия поверхности и защита материалов





