Зоологический журнал, 2019, T. 98, № 1, стр. 48-55
Воздействие нереста лососей на зообентос: имитационный подход к оценке
М. В. Астахов *
Федеральный научный центр биоразнообразия наземной биоты Восточной Азии ДВО РАН
690022 Владивосток, Россия
* E-mail: mvastakhov@mail.ru
Поступила в редакцию 29.09.2017
После доработки 22.07.2018
Принята к публикации 2.06.2018
Аннотация
Традиционные методы изучения воздействия нерестующих лососей на донные сообщества позволяют, как правило, лишь регистрировать постнерестовое снижение количественных показателей зообентоса нерестилищ. Подход, предлагаемый в данной работе, расширяет спектр получаемой информации. Показано, что в ответ на травмоопасное смещение элементов грунта лососями донные беспозвоночные не только переходят в дрифт, но и могут мигрировать глубже в гипорейную зону. Проведен вероятностный расчет потерь популяций некоторых беспозвоночных вследствие смещения донных субстратов.
В последние два десятилетия жизнедеятельность животных, преобразующих среду обитания, обсуждается в рамках концепции “экосистемного инженеринга” (Jones et al., 1994; Albertson, Allen, 2015). Суть концепции сводится к рассмотрению отдельных видов как агентов физического изменения, создания и поддержания местообитаний. Механически трансформируя окружающую среду в своих целях, “экосистемные инженеры” прямо или опосредованно контролируют доступность ресурсов для других видов (Jones et al., 1994). Характерно, что результаты такой трансформации могут существовать дольше самих “инженеров” (Hastings et al., 2007).
Самыми известными преобразователями среды водотоков являются бобры, лососи и сетеплетущие ручейники (Завьялов и др., 2016; Statzner, 2012). Первых и последних можно объединить в группу стабилизаторов среды (Albertson, Allen, 2015), поскольку создаваемые ими структуры замедляют движение воды, способствуют осаждению и накоплению взвешенных минеральных частиц и детрита. Активность же лососей, преобразующих среду в ходе сооружения нерестовых гнезд (бугров), напротив, дестабилизирует донные отложения, ведет к переходу мелкофракционных компонентов грунта во взвешенное состояние и сносу их вниз по течению. Выраженное в показателях донной эрозии и транспорта наносов воздействие лососей часто сопоставимо с воздействием дождевых паводков (Gottesfeld et al., 2004). Инициируемое лососями и поддерживаемое водным потоком перемещение элементов грунта сопровождается истиранием перифитона и катастрофическим дрифтом зообентоса. В результате появляются участки “свежевымытого”, “лишенного перифитона” дна (Hildebrand, 1971). При массовом заходе лососей такие участки в водотоке преобладают. Поэтому некоторые исследователи приходят к заключению о “негативной реакции” бентосных сообществ на средообразующую деятельность этих рыб (Honea, Gara, 2009). С другой стороны, такая деятельность способствует выведению илистых фракций из состава наносов, улучшает интерстициальный водообмен и кислородный режим в грунте (Смирнов, 1975), поддерживая тем самым биоту гипорейной зоны.
Значимость воздействия, оказываемого нерестующими лососями на бентос водотоков, обусловливает проведение многочисленных работ по данной тематике (DeVries, 2012). Обычно используют два плана отбора материала: “до/(во время)/ после” и/или “воздействие/контроль”. Первый план – сбор и сравнение бентоса на нерестилищах до захода производителей и после окончания нереста (в некоторых случаях ведутся сборы во время нерестового хода). Второй – сопоставление бентоса нерестовых участков с бентосом участков, пригодных для нереста лососей, но для мигрирующих рыб недоступных из-за физических барьеров (водопады, плотины). Реже такие барьеры создаются намеренно, путем отгораживания сеткой отдельных зон нерестилищ (Tiegs et al., 2009). В последнем случае места отбора сравниваемых выборок оказываются наиболее близкими по своим характеристикам, что облегчает интерпретацию получаемой информации. Главный результат подобных исследований – снижение количественных показателей и таксономического богатства зообентоса на нерестовых участках по сравнению с преднерестовыми сроками. Однако часто невозможно определить, произошло такое снижение по причине средообразующей активности лососей или связано с фенологией самих донных беспозвоночных. Например, если зообентос был представлен преимущественно амфибиотическими насекомыми, которые за время нереста могли вылететь (Campbell et al., 2012). Вследствие того, что промежутки между датами сборов составляют до нескольких месяцев, а также из-за сложности контроля всех источников естественных изменений донных сообществ выводы исследователей зачастую умозрительны. Поэтому прорыв в данном направлении должен быть связан с изолированием отдельных элементов воздействия, осуществляемого лососями (Tiegs et al., 2009; DeVries, 2012). В этом ключе важно получение материалов, собранных непосредственно в момент воздействия. Однако во время устройства гнезд самки лососей осторожны; при появлении человека могут отплывать прочь и затаиваться в укрытиях (Семенченко, 1989). Значит, актуальным становится искусственное манипулирование средой путем имитирования действий рыб при ее физическом изменении (DeVries, 2012). О целесообразности имитации средообразующих эффектов высказывались еще авторы концепции “экосистемного инженеринга” (Jones et al., 1994). Заметим, что имитационные манипуляции давно используют в исследованиях нарушений донных сообществ паводками (Reice, 1985; McCabe, Gotelli, 2000).
Достаточно простой имитационный подход к прямой оценке воздействия, оказываемого нерестующими лососями на зообентос, был разработан Монаганом и Милнером в 1998 г. (Monaghan, Milner, 2009). Авторы одновременно устанавливали две дрифтовые сетки в 0.75 м сбоку друг от друга. Одна из сеток была предназначена для улавливания фонового дрифта, а выше по течению от другой в выбранную целевую область порционно (с интервалами 1–2 мин) на протяжении получаса забрасывали сухой каменистый субстрат. Последний, погружаясь на дно и смещаясь под действием течения, играл роль наносов, высвобождаемых лососями при устройстве гнезд. Затем зоологический материал из сеток извлекали, и отбор дрифта продолжали еще 30 мин, уже без имитации нарушения. Описанное моделирование осаждения и истирающего воздействия наносов вызывало статистически значимое увеличение плотности дрифта зообентоса на изучаемом участке, по сравнению с фоновым участком, не подвергавшимся манипулированию. После прекращения имитационного нарушения статистически значимые различия между выборками из одновременно экспонировавшихся сеток не были выявлены.
Несмотря на актуальность внедрения методов, имитирующих механическое влияние лососей на бентосные сообщества, метод Монагана-Милнера остается единственным опубликованным. Недостаток его в том, что действует он, очевидно, лишь на беспозвоночных, находящихся на поверхности дна. При этом игнорируется вероятность того, что представители зообентоса в ответ на оказываемое лососями механическое воздействие могут не только переходить в дрифт, но и мигрировать глубже в грунт (в гипорейную зону). Также не учитывается возможность прямых потерь беспозвоночных из-за травмирования каменистыми субстратами, которые смещают нерестующие рыбы. Цель настоящего исследования – посредством специально разработанного нами имитационного подхода провести оценку этих двух эффектов механического воздействия лососей на зообентос.
МАТЕРИАЛ И МЕТОДЫ
Работы проводили на реке Кедровая (43°05′ с.ш., 131°35′ в.д.), впадающей в Амурский залив Японского моря. Протяженность реки 18 км, суммарная длина ее притоков 46 км, площадь водосборного бассейна 45 м2. Среди других лососевых рек Амурского залива р. Кедровая выделяется тем, что в ней размножается только один вид тихоокеанских лососей – сима (Oncorhynchus masou). Это обусловлено отсутствием здесь зон разгрузки грунтовых вод площадью, достаточной для нереста других представителей рода Oncorhynchus. В целом, по данным Семенченко (2001), в р. Кедровая обитает пятнадцать видов рыб. На участке нашего исследования, расположенном в среднем течении реки, обычна молодь симы, жилая мальма (Salvelinus malma), гольян Лаговского (Phoxinus lagowskii) и сибирский голец (Barbatula toni). Как правило, начало нерестовой миграции проходной симы в реки района совпадает с периодом тайфунов, обычно приуроченным к концу лета. Однако в многоводные годы первые производители могут заходить из моря уже в середине июня (Смирнов, 1975; наблюдения местных жителей). Нерест происходит в августе–октябре, точные сроки зависят от условий года.
Материал для настоящего исследования отбирали дважды: 12.09.2006 г. – во время нерестового хода симы (межень, через две недели после вызванного тайфуном паводка) и 12.06.2008 г. – еще до захода производителей в реку (межень, перед паводком). Скорость течения в обе даты достигала 0.7–0.9 м/с. Участок исследования находится в нижней части зоны нерестилищ. Ширина реки здесь около 11 м. Грунт на участке хорошо дренированный; в его составе преобладает галька, преимущественно мелкая <5 см.
В основе разработанного нами подхода – имитация движений нерестующей самки лосося. В качестве орудия имитации использовали упругие пластины из вспененного полиуретана размером 22 × 12 × 2 см. Расположив пластину у поверхности дна под углом ~45° к водному потоку, выполняли ею 6–7 интенсивных маховых движений, подобных тем, которые совершает своим хвостом и телом самка лосося при устройстве гнезда. Указанное положение пластины соответствует типичному положению самки в момент “копания” (Burner, 1951). Последовательно перемещая пластину в пределах выбранного участка, воздействовали на всю его площадь (см. ниже) и возвращали пластину в исходную точку. После небольшой паузы имитирующие движения возобновляли. Через ряд таких циклов ниже по течению от выбиваемого залповыми токами воды углубления в грунте (“нерестовой ямки”) начинал формироваться “бугор” из увлекаемых потоком донных субстратов. Животных, высвобождаемых в дрифт в процессе имитации, отлавливали дрифтовыми сачками (ячея 220 мкм), которые устанавливали ниже зоны воздействия таким образом, чтобы перекрыть поток по глубине. Размеры входных отверстий сачков, которые мы использовали, позволяли работать на глубинах до 0.25 м (2006 г.) и 0.3 м (2008 г.). Ширина облавливаемых сечений потока составляла 0.3 и 0.25 м соответственно. В процессе увеличения “бугра” в сачках оседала часть формировавших его компонентов, которые мы периодически удаляли. Площадь участков воздействия составляла 0.48 м2 – этот показатель является близким к средней величине (0.5 м2) площади основания нерестовых бугров симы в р. Кедровая (Семенченко, 1989).
Подход был реализован двумя способами: индивидуально (2006 г.) и при участии ассистента (2008 г.). Первый способ требует предварительного вбивания в грунт трех пар опорных колышков. Колышки вбивают поперек русла “в линию”, таким образом, чтобы между двумя колышками “средней” пары можно было плотно вставить прямоугольный разграничительный экран, а колышки двух “крайних” пар использовать для установки двух орудий лова. “Крайние” пары колышков вбивают с расчетом, чтобы расстояние от каждого облавливаемого сечения потока до разграничительного экрана составляло ~0.2 м. Важно, что к намеченной зоне отбора материала следует подходить исключительно снизу по течению. Процесс отбора начинали с того, что чуть ниже по течению от колышков “средней” пары сборщик ставил разграничительный экран (в 2006 г. использовали лист ДСП 0.5 × 1.1 м) на одно из его коротких ребер, ориентируя боковые грани экрана по вектору движения потока. Затем, установив сачки, сборщик, придерживая экран одной рукой, осторожно перемещался вверх по течению, обходя сбоку намеченную зону имитационного воздействия. Разграничительный экран при этом опускали по дуге между “средними” колышками на его длинное ребро и упирали в дно водотока. Продолжая придерживать экран рукой, сборщик приступал к имитации – согласно описанной выше процедуре. В результате в сачок, расположенный с той же стороны экрана, что и сборщик, попадали как животные, вовлекаемые в поток при “копании” грунта, так и дрейфовавшие в этот период суток согласно своим эндогенным ритмам (фоновые дрифтеры). Сачок, расположенный с другой стороны экрана, улавливал только фоновых дрифтеров.
Рис. 1.
Вариант отбора материала, дрейфующего из зоны воздействия: а – момент готовности к началу имитации, б – имитация; 1 – направление течения, 2 – зона воздействия, 3 – дрейфующий материал.
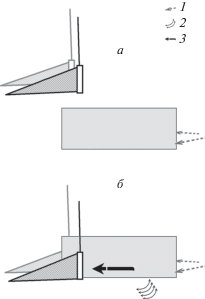
При реализации подхода вторым способом к выбранному участку нерестилища на вытянутых руках подносили разграничительный экран из плоского шифера (0.4 × 1.5 м) и осторожно упирали его длинным ребром в грунт. Край экрана, обращенный вниз по течению, зажимал между ног сборщик и, взяв в каждую руку по орудию лова, ожидал сигнала ассистента (рис. 1а). В момент, когда ассистент со своей стороны от экрана приступал к имитации, сборщик опускал орудия лова вертикально вниз по обе стороны от экрана (рис. 1б).
Как только глубина “нерестовой ямки” достигала 10 см, сачки убирали, а в образовавшемся углублении брали 2 пробы складным бентометром Богатова (1994): площадь захвата 1/16 м2, размер ячеи сетной части 220 мкм. Глубина отбора грунта в “нерестовой ямке” составляла тоже 10 см.
Для определения общего количества животных, попадавших в поток при каждой имитации, сначала вычисляли разницу между их количеством в сачке, отбиравшем дрифт ниже зоны воздействия, и их количеством в сачке, улавливавшем только фоновых дрифтеров. Полученный результат умножали на соответствующий поправочный коэффициент (2 в 2006 г.; 2.4 в 2008 г.), рассчитанный путем деления показателя ширины “нерестовой ямки” (0.6 м) на показатель ширины облавливаемого сачками сечения потока. Итоговую величину принимали за показатель количества беспозвоночных, которые до начала имитационного воздействия населяли слой грунта 0–10 см в пределах площади закладываемой “нерестовой ямки”. Беспозвоночных, отобранных в “нерестовых ямках” посредством бентометра, считали не покинувшими горизонт 10–20 см за время имитации. Количество их также пересчитывали на площадь зоны воздействия (0.48 м2).
Результаты этих расчетов использовали с целью проверки предположения о миграции донных животных в глубь гипорейной зоны в ответ на воздействие, имитировавшее средообразующую деятельность самки лосося. Для каждого случая на основе этих результатов выявляли отношение количества беспозвоночных из горизонта 0–10 см к их количеству в слое 10–20 см. Это соотношение затем сопоставляли с диапазоном аналогичных фоновых соотношений, которые мы рассчитали по представленным в литературе данным из водотоков Европы, Азии, Северной Америки и Новой Зеландии (всего 14 источников: Williams, Hynes, 1974; Bretschko, 1992; Olsen, Townsend, 2005; другие). Важно, что свой материал зарубежные коллеги отбирали специальными устройствами (например, пробоотборниками-намораживателями – freeze-corers), что позволяло им получить моментальную картину естественного вертикального распределения беспозвоночных сразу в нескольких горизонтах грунта. Именно поэтому соотношения, рассчитанные нами по данным этих коллег, мы называем фоновыми.
Гипотезу о вероятности прямых потерь беспозвоночных из-за подвижек каменистых субстратов мы проверяли на основе статистического анализа, который включал определение 95%-ных доверительных интервалов для частоты встречаемости летально повреждаемых животных. Летальными считали механические травмы тела; утрату жабр и придатков тела не учитывали. Расчет доверительных интервалов осуществляли методом Уилсона (Brown et al., 2001). Соответствующие вычисления проводили по первичным данным и только в случаях, когда летальные повреждения были выявлены не менее чем у 3 представителей таксона в расчете на одно имитационное воздействие.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Целью разработки и применения нашего подхода была оценка двух непосредственных эффектов механического воздействия производителей на зообентос. Во-первых, учитывая, что нерест лососей – это ежегодное событие, и у зообентоса могла эволюционно выработаться реакция избегания донных наносов, высвобождаемых этими рыбами, мы ожидали, что в ответ на “сигналы” аналогичного воздействия беспозвоночные станут не только дрейфовать, но и перемещаться в глубь гипорейной зоны. Известно, например, что личинки амфибиотических насекомых встречаются в гипорейной зоне водотоков глубже 30–40 см, а глубина проникновения олигохет достигает 70 см (Williams, Hynes, 1974). В отсутствие экстремальных событий (например, пересыхание русла, паводок) плотность вертикального распределения беспозвоночных максимальна в слое грунта 0–20 см, а с ростом глубины закономерно уменьшается. Поэтому глубина наших “нерестовых ямок” не превышала 10 см, т.е. была меньше той, на которой фоновая плотность распределения зообентоса остается достаточно высокой (Bretschko, 1992). Мы полагали, что за время наших манипуляций беспозвоночные переместятся еще дальше в глубь наносов. Таким образом, первая гипотеза допускала, что после процедуры имитации, в слое грунта, прилегавшем к “нерестовой ямке”, не должны были остаться высокомобильные представители зообентоса.
Проведенные нами по литературным данным расчеты показали, что фоновые соотношения численностей донных беспозвоночных в горизонтах грунта 0–10 и 10–20 см укладываются в диапазон 0.7: 1–5.3: 1. Поскольку эти соотношения были рассчитаны на основе данных из разных мест земного шара, то в грубом приближении этот диапазон можно рассматривать как интервал, отражающий “норму” фонового соотношения беспозвоночных в горизонтах 0–10 и 10–20 см. В то же время, диапазон соотношений, аналогично рассчитанных по результатам наших имитационных воздействий, составил 24: 1–35: 1. То есть после наших манипуляций соотношения между количественными показателями в рассматриваемых горизонтах грунта оказывались многократно выше “нормы”. Это может свидетельствовать о том, что большая часть животных, до начала воздействия находившихся в горизонте 10–20 см, во время имитации мигрировала еще глубже в гипорейную зону. В пробах из данного горизонта, взятых сразу после устройства “нерестовых ямок”, наиболее подвижные обитатели грунта – личинки веснянок (Plecoptera) и поденок (Ephemeroptera) – обнаруживались единично, а численность менее мобильных олигохет (Oligochaeta) и личинок двукрылых (Diptera) была на порядок выше (табл. 1). Это согласуется с нашей первой гипотезой.
Таблица 1.
Результаты апробации подхода
| Класс, Отряд, Семейство |
Улов дрифтовых сачков за время опыта, экз. | Плотность зообентоса в горизонте грунта 10–20 см после опыта, экз./два бентометра |
||||
|---|---|---|---|---|---|---|
| без имитации | с имитацией | |||||
| 2006 г. | 2008 г. | 2006 г. | 2008 г. | 2006 г. | 2008 г. | |
| Oligochaeta | ||||||
| Haplotaxida | ||||||
| Haplotaxidae | 0 | 0 | 0 | 5 | 0 | 0 |
| Naididae | 8 | 10 | 380** | 459** | 23 | 10 |
| Malacostraca | ||||||
| Amphipoda | ||||||
| Gammaridae | 0 | 0 | 77 | 19 | 0 | 0 |
| Arachnida | ||||||
| Trombidiformes | ||||||
| Aturidae | 0 | 0 | 4 | 27 | 0 | 1 |
| Feltriidae | 2 | 0 | 13 | 2 | 0 | 0 |
| Hydryphantidae | 0 | 0 | 0 | 4 | 0 | 0 |
| Hygrobatidae | 0 | 0 | 0 | 1 | 0 | 0 |
| Lebertiidae | 0 | 0 | 18 | 11 | 0 | 0 |
| Sperchontidae | 5 | 1 | 26 | 30 | 0 | 0 |
| Torrenticolidae | 5 | 0 | 69 | 91 | 0 | 0 |
| Insecta | ||||||
| Ephemeroptera | ||||||
| Baetidae | 9 | 0 | 126 | 99 | 0 | 1 |
| Ephemerellidae | 0 | 19 | 39* | 727 | 0 | 1 |
| Heptageniidae | 0 | 10 | 277** | 99* | 1 | 1 |
| Leptophlebiidae | 0 | 0 | 31* | 7 | 1 | 0 |
| Plecoptera | ||||||
| Capniidae | 0 | 0 | 4 | 0 | 0 | 0 |
| Cloroperlidae | 0 | 0 | 7* | 1* | 1 | 0 |
| Perlidae | 0 | 0 | 2 | 86* | 0 | 0 |
| Perlodidae | 0 | 0 | 18 | 0 | 0 | 0 |
| Pteronarcyidae | 0 | 0 | 0 | 1 | 0 | 0 |
| Coleoptera | ||||||
| Elmidae | 0 | 0 | 11 | 7 | 0 | 0 |
| Trichoptera | ||||||
| Arctopsychidae | 4 | 0 | 15* | 9 | 0 | 0 |
| Glossosomatidae | 2 | 0 | 2 | 28 | 0 | 0 |
| Hydrobiosidae | 0 | 0 | 4* | 0 | 0 | 0 |
| Hydropsychidae | 6 | 4 | 57** | 318** | 0 | 2* |
| Lepidostomatidae | 0 | 0 | 20 | 2 | 0 | 0 |
| Rhyacophilidae | 1 | 0 | 0 | 22 | 0 | 1 |
| Stenopsychidae | 17 | 0 | 214** | 71** | 0 | 0 |
| Uenoidae | 0 | 0 | 1 | 3* | 0 | 0 |
| Diptera | ||||||
| Athericidae | 2 | 2 | 124** | 82** | 1 | 1 |
| Ceratopogonidae | 0 | 0 | 0 | 14 | 0 | 1 |
| Chironomidae | 52 | 12 | 661** | 447** | 22 | 17 |
| (pupae) | 21 | 11 | 105* | 47 | 0 | 1 |
| Limoniidae | 0 | 2 | 81* | 44 | 1 | 0 |
| Nymphomyiidae | 0 | 2 | 0 | 34 | 0 | 0 |
| Simuliidae | 9 | 3 | 9* | 21 | 0 | 1 |
| (pupae) | 0 | 0 | 0 | 3* | 0 | 0 |
Вторая гипотеза допускала, что часть беспозвоночных, прежде всего с тонкой кутикулой и червеобразной формой тела (например, личинок Chironomidae (Diptera)), получит летальные механические повреждения перемещаемым обломочным материалом. Такое развитие событий свидетельствовало бы о прямой потере таких животных для соответствующих популяций, могло бы подтвердить мнение (Honea, Gara, 2009) о негативном влиянии средообразующей активности лососей на донные сообщества. Эта гипотеза была подтверждена отчасти. Вопреки нашим ожиданиям, личинок Chironomidae с механическими повреждениями тела было сравнительно мало (табл. 2). Еще реже встречались раненные представители других семейств отряда двукрылых. Так, помимо хирономид, уровень травматизма ≥ 3 экз./воздействие – принятый нами как достаточный для расчета 95%-ных доверительных интервалов в данном исследовании, наблюдался только у личинок Suragina satsumana Mats. (Athericidae). Из других беспозвоночных, характеризующихся отсутствием настоящих ног и червеобразным телом, жертвами перемещаемого донного материала гораздо чаще становились олигохеты (преимущественно Naididae). Однако мы не использовали данные по этим животным, поскольку олигохетам свойственна высокая способность к регенерации, существенно снижающая вероятность их гибели от ран, смертельных для большинства других беспозвоночных. Повреждения личинок веснянок и поденок, как правило, представляли собой не смертельную утрату отдельных жабр или придатков тела. В то же время, среди поденок вида Epeorus gornostajevi Tshern. (Heptageniidae) особи с летальными ранениями тела встречались в количестве, достаточном для расчета доверительных интервалов (табл. 2). Совершенно неожиданным для нас стало то, что чаще других водных насекомых страдали сетеплетущие личинки некоторых ручейников (Trichoptera). А именно Hydropsyche orientalis Mart. (Hydropsychidae) и Stenopsyche marmorata Navas (Stenopsychidae) (табл. 2). Однако их травмы ограничивались давлеными разрывами абдомена, кутикула которого у личинок названных видов фактически не склеротизирована. То есть низкая устойчивость этих животных к механическому воздействию должна быть очевидной. Повышенная вероятность получения личинками сетеплетущих ручейников летальных травм может быть связана с блокированием этих беспозвоночных в собственных убежищах из-за внезапного смещения субстратов, которое инициируют лососи во время нереста.
Таблица 2.
Границы 95%-ных доверительных интервалов для доли летальных повреждений
| Отряд, Семейство, Вид |
2006 | 2008 | ||
|---|---|---|---|---|
| доля поврежденных, % (n от N) |
95% доверительный интервал |
доля поврежденных, % (n от N) |
95% доверительный интервал |
|
| Ephemeroptera | ||||
| Heptageniidae | ||||
| E. gornostajevi | 1.3 (3 от 228) | 0.5–3.8 | – | – |
| Trichoptera | ||||
| Stenopsychidae | ||||
| S. marmorata | 8.9 (19 от 214) | 5.8–13.4 | 8.5 (6 от 71) | 3.9–17.2 |
| Hydropsychidae | ||||
| H. orientalis | 7.0 (4 от 57) | 2.8–16.7 | 10.1 (32 от 318) | 7.2–13.9 |
| Diptera | ||||
| Chironomidae | 1.4 (9 от 661) | 0.7–2.6 | 1.8 (8 от 447) | 0.9–3.5 |
| Athericidae | ||||
| S. satsumana | 2.4 (3 от 124) | 0.8–6.9 | 3.7 (3 от 82) | 1.3–10.2 |
Как известно, личинки сетеплетущих ручейников используют прочные шелковые нити при строительстве логовищ, куколочных домиков, страховочных оттяжек и ловчих сетей в пространствах между элементами донного материала, сцепляя эти элементы друг с другом (Cardinale et al., 2004; Takao et al., 2006). Чем крупнее личинка, тем значительнее связующая сила ее сооружений. Например, логовище одной крупной особи S. marmorata (длина личинок достигает 50 мм) способно удерживать на весу сцепленные с ним камни общей массой до 1.6 кг (Nunokawa et al., 2008). Сила сцепления элементов донного субстрата за счет сооружений в несколько раз меньших по своим размерам личинок гидропсихид намного ниже. Благодаря тому, что плотность распределения личинок обоих видов может достигать нескольких тысяч экземпляров на 1 м2 дна, совокупность их построек создает обширные участки связанного грунта. Такие участки уменьшают вероятность размыва русла во время паводков и поддерживают существование гидробионтов, предпочитающих условия медленного течения при хорошей обеспеченности пищевыми частицами и кислородом (Nakano et al., 2005; Statzner, 2012). Значит, если средообразующая активность лососей повышает уровень смертности среди сетеплетущих ручейников, то косвенным следствием этого может стать сокращение площади участков, пригодных для обитания некоторых других донных организмов.
Очевидно, что обе наши гипотезы нельзя было проверить на основе традиционных подходов к изучению воздействия нереста лососей на зообентос (Hildebrand, 1971; Campbell et al., 2012; другие). Первую – потому что соответствующие планы отбора материала не направлены на выявление характера вертикального распределения зообентоса в грунте, на который воздействуют лососи. А вторую – по причине неизменного присутствия близ нерестующих лососей резидентных рыб, которые активно поедают донных беспозвоночных, высвобождаемых в дрифт в процессе нереста. При реализации же нашего подхода пробы отбирают из разных горизонтов грунта, а дрифтоядных хищников отпугивает присутствие человека.
Выше было отмечено, что эффекты средообразующей деятельности лососей часто сопоставимы с результатами воздействия дождевых паводков (Gottesfeld et al., 2004). Однако если в ходе развития паводка донные беспозвоночные получают сигналы о приближающейся опасности (увеличение расхода и мутности воды) и имеют возможность мигрировать в гипорейную зону еще до начала травмоопасных подвижек каменистых субстратов, то при устройстве гнезд лососями давящее воздействие грубообломочных элементов грунта может проявляться сразу. Последнее обстоятельство предлагаемый подход позволяет учесть и провести вероятностную оценку потерь конкретной популяции (табл. 2). Заметим, что прежде потери зообентоса из-за летальных повреждений перемещаемыми субстратами специально не оценивались. Хотя, например, потерю 10% личинок H. orientalis, при данных абсолютных значениях дающую для генеральной доли верхнюю доверительную границу 14% (табл. 2), нельзя считать несущественной.
ЗАКЛЮЧЕНИЕ
Итоги нашего исследования поддерживают мнение о необходимости изучать воздействие нерестующих лососей на донные сообщества посредством изолирования отдельных его механизмов. Очевидно, что само по себе накопление информации о снижении количественных показателей бентоса из-за средообразующей активности этих рыб не углубляет понимание роли лососей как “экосистемных инженеров”. Мы предприняли попытку рассмотреть эффекты нерестовой деятельности лососей путем ее имитации. Разработанный для этого подход позволил получить прямые результаты с конкретной площади воздействия, что в достаточной мере компенсирует его имитативность.
Подход допускает учет непосредственного ущерба, наносимого бентосным популяциям при сооружении лососями нерестовых гнезд. Степень такого ущерба может зависеть от свойственного особям данного вида беспозвоночных характера вертикального распределения в грунте, от мобильности этих животных, от стадии их жизненного цикла. Вероятно, что представители зообентоса, находящиеся ближе к поверхности грунта, могут высвобождаться в дрифт быстрее особей, находящихся в глубине осадков. В то же время, беспозвоночные могут мигрировать еще глубже, чтобы не подвергаться травмирующему воздействию перемещающихся элементов субстрата.
Выявленные факты травмирования личинок сетеплетущих ручейников дают основание полагать, что выживаемость данных “экосистемных инженеров”, стабилизирующих среду обитания своими постройками, может напрямую зависеть от действий “экосистемных инженеров”, которые, напротив, среду дестабилизируют (нерестующие лососи).
Важно, что нерестовые участки любого водотока могут характеризоваться уникальным гранулометрическим составом и плотностью наносов, а также спецификой соотношений донных организмов, различающихся по своей мобильности и устойчивости к повреждениям. Поэтому результаты, полученные с помощью предложенного подхода, могут варьировать. Дальнейшее накопление такой информации позволит расширить понимание роли лососей как “экосистемных инженеров”.
Список литературы
Богатов В.В., 1994. Экология речных сообществ российского Дальнего Востока. Владивосток: Дальнаука. 218 с.
Завьялов Н.А., Альбов С.А., Хляп Л.А., 2016. Мобильность поселений и элементов сигнального поля бобров (Castor fiber) на рeкe Таденка (Приокско-Террасный заповедник) // Зоологический журнал. Т. 95. № 5. С. 584–596.
Семенченко А.Ю., 1989. Приморская сима. Владивосток: ДВО АН СССР. 192 с.
Семенченко А.Ю., 2001. Фауна и структура рыбных сообществ в ритрали рек Приморья // Чтения памяти В.Я. Леванидова. Владивосток: Дальнаука. Вып. 1. С. 217–228.
Смирнов А.И., 1975. Биология, размножение и развитие тихоокеанских лососей. М.: МГУ. 336 с.
Albertson L.K., Allen D.C., 2015. Meta-analysis: abundance, behavior, and hydraulic energy shape biotic effects on sediment transport in streams // Ecology. V. 96. P. 1329– 1339.
Bretschko G. 1992. Differentiation between epigeic and hypogeic fauna in gravel streams // Regulated Rivers: Research and Management. V. 7. P. 17–22.
Brown L.D., Cai T.T., DasGupta A., 2001. Interval estimation for a binomial proportion // Statistical Science. V. 16. № 2. P. 101–117.
Burner C.J., 1951. Characteristics of spawning nests of Columbia River salmon // Fishery Bulletin. V. 52. P. 97–110.
Campbell E.Y., Merritt R.W., Cummins K.W., Benbow M.E., 2012. Spatial and temporal variability of macroinvertebrates in spawning and non-spawning habitats during a salmon run in Southeast Alaska // PLoS ONE. V. 7. № 6.
Cardinale B.J., Gelmann R.E., Palmer M.A., 2004. Net spinning caddisflies as stream ecosystem engineers: the influence of Hydropsyche on benthic substrate stability // Functional Ecology. V. 18. № 3. P. 381–387.
DeVries P., 2012. Salmonid influences on rivers: a geomorphic fish tail // Geomorphology. V. 157–158. P. 66–74.
Gottesfeld A.S., Hassan M.A., Tunnicliffe J.F., Poirier R.W., 2004. Sediment dispersion in salmon spawning streams: the influence of floods and salmon redd construction // Journal of the American Water Resources Association. V. 40. № 4. P. 1071–1086.
Hastings A., Byers J.E., Crooks J.A., Cuddington K., Jones C.G., et al., 2007. Ecosystem engineering in space and time // Ecology Letters. V. 10. № 2. P. 153–164.
Hildebrand S.G., 1971. The effect of coho spawning on the benthic invertebrates of the Platte River, Benzie County, Michigan // Transactions of the American Fisheries Society. V. 100. № 1. P. 61–68.
Honea J.M., Gara R.I., 2009. Macroinvertebrate community dynamics: strong negative response to salmon redd construction and weak response to salmon-derived nutrient uptake // Journal of the North American Benthological Society. V. 28. P. 207–219.
Jones C.G., Lawton J.H., Shachak M., 1994. Organisms as ecosystem engineers // Oikos. V. 69. № 3. P. 373–386.
McCabe D.J., Gotelli N.J., 2000. Effects of disturbance frequency, intensity, and area on assemblages of stream macroinvertebrates // Oecologia. V. 124. P. 270–279.
Monaghan K.A., Milner A.M., 2009. Effect of anadromous salmon redd construction on macroinvertebrate communities in a recently formed stream in coastal Alaska // Journal of the North American Benthological Society. V. 28. P. 153–166.
Nakano D., Yamamoto M., Okino T., 2005. Ecosystem engineering by larvae of net-spinning caddisflies creates a habitat on the upper surface of stones for mayfly nymphs with a low resistance to flows // Freshwater Biology. V. 50. P. 1492–1498.
Nunokawa M., Gomi T., Negishi J.N., Nakahara O., 2008. A new method to measure substrate coherent strength of Stenopsyche marmorata // Landscape and Ecological Engineering. V. 4. P. 125–131.
Olsen D.A., Townsend C.R., 2005. Flood effects on invertebrates, sediments and particulate organic matter in the hyporheic zone of a gravel-bed stream // Freshwater Biology. V. 50. P. 839–853.
Reice S.R., 1985. Experimental disturbance and the maintenance of species diversity in a stream community // Oecologia. V. 67. P. 90–97.
Statzner B., 2012. Geomorphological implications of engineering bed sediments by lotic animals // Geomorphology. V. 157–158. P. 49–65.
Takao A., Negishi J.N., Nunokawa M., Gomi T., Nakahara O., 2006. Potential influences of a net-spinning caddisfly (Trichoptera: Stenopsyche marmorata) on stream substratum stability in heterogeneous field environments // Journal of the North American Benthological Society. V. 25. P. 545–555.
Tiegs S.D., Campbell E.Y., Levi P.S., Rüegg J., Benbow M.E., et al., 2009. Separating physical disturbance and nutrient enrichment caused by Pacific salmon in stream ecosystems // Freshwater Biology. V. 54. P. 1864–1875.
Williams D.D., Hynes H.B.N., 1974. The occurrence of benthos deep in the substratum of a stream // Freshwater Biology. V. 4. P. 233–256.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


