Зоологический журнал, 2019, T. 98, № 11, стр. 1304-1322
Млекопитающие горной части южного Урала в последнее межледниковье
Т. В. Фадеева a, b, *, П. А. Косинцев c, d, **, Д. О. Гимранов c, d, ***
a Пермский федеральный исследовательский центр УрО РАН, Горный институт
614007 Пермь, Россия
b Пермский государственный национальный исследовательский университет
614990 Пермь, Россия
c Институт экологии растений и животных УрО РАН
620144 Екатеринбург, Россия
d Уральский федеральный университет
620002 Екатеринбург, Россия
* E-mail: fadeeva.tatyana@mail.ru
** E-mail: kpa@ipae.uran.ru
*** E-mail: djulfa250@rambler.ru
Поступила в редакцию 15.03.2019
После доработки 03.04.2019
Принята к публикации 15.04.2019
Аннотация
Описана фауна млекопитающих из слоя 10 раскопа V Игнатиевской пещеры на Южном Урале (54°53′ с.ш., 57°46′ в.д.). Приведены данные о видовом составе фаун из разных горизонтов, данные о морфологии и размерах зубов и костей летучих мышей, насекомоядных, зайцеобразных и грызунов. Видовые комплексы млекопитающих свидетельствуют о лесостепных (верхняя половина исследованных отложений) и степных (нижняя половина отложений) ландшафтах. Видовой состав и морфологические особенности зубов млекопитающих позволяют определить временны́е рамки существования изученной фауны периодом от конца днепровского оледенения (конец изотопной кислородной стадии 6) до начала Микулинского (эемского) межледниковья (начало изотопной кислородной стадии 5e).
Фауна млекопитающих последнего межледниковья (микулинское, казанцевское, эемское, изотопная кислородная стадия (ИКС) 5е), по сравнению с фаунами последнего ледникового этапа (валдайский надгоризонт, зырянский надгоризонт, ИКС 5 a–d, 4, 3, 2), изучена слабо. Это связано, прежде всего, с малочисленностью местонахождений межледниковых фаун на территории Восточной Европы и Северной Азии. В последнем обзоре териофаун Европы последнего межледниковья, для территории Восточной Европы указано 15 местонахождений (Markova, Puzachenko, 2018). Для Северной Азии известно 4 местонахождения этого времени (Агаджанян, 2009). В то же время обнаружены десятки местонахождений ледникового этапа, как в Восточной Европе, так и в Северной Азии (Агаджанян, 2001; Маркова и др., 2008; Смирнов, 2001; Шер, 1971; Kahlke, 1994; Smirnov et al., 2014).
На Урале известно несколько фаун, датируемых последним межледниковьем или близким к нему временем. Предположительно к последнему межледниковью была отнесена фауна из нижних слоев грота Бобылек на Среднем Урале (Markova, Puzachenko, 2018), но автор исследований этого местонахождения при описании фауны датировал ее широко (поздний плейстоцен (Смирнов, 1993)). Концом межледниковья–началом стадиала (переход от МИС 5 к МИС 4) были датированы фауны из нижнего слоя раскопа V Игнатиевской пещеры и из слоя 3 Серпиевской 1 (Майской) пещеры на Южном Урале (Смирнов и др., 1990). На остальной территории Северной Евразии межледниковых или близких им фаун в пещерных местонахождениях до настоящего времени достоверно не было известно.
Отложения раскопа V Игнатиевской пещеры (54°53′55 с.ш., 57°46′48 в.д.) на Южном Урале (рис. 1) ранее были изучены в 1985 г. Раскоп V размером 3 × 1.5 м был заложен у восточной стенки входного грота пещеры (Петрин, 1992). В разрезе выделено 11 слоев (Стефановский, 2002; Smirnov et al., 2014):
Рис. 1.
Игнатиевская пещера (Южный Урал, Россия): a − местонахождение пещеры, b − стратиграфическая схема раскопа V (1985 г. (по: Стефановский, 2002) (1 – глины, 2 − глины алевритистые, 3 − глины песчано–алевритистые, 4 − глины песчаные, 5 − песок глинистый, 6 – пески, 7 – пелиты, 8 – гипс, 9 – щебень и глыбы известняков, 10 – известняки, 11 − остатки фауны крупных и мелких млекопитающих, 12 − известкование и ожелезнение, 13 − места отбора проб на радиоуглеродный анализ, 14 − номера слоев).
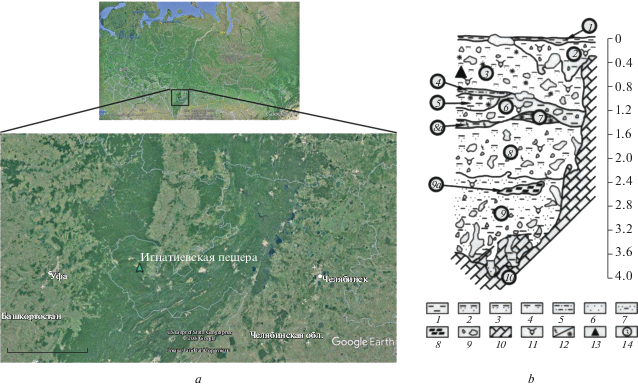
1 – глина песчаная, темно-серая, с зернами известняков, культурный слой. Мощность 0.02−0.12 м.
2 – глина гидрослюдистая, с мелкой и крупной щебенкой. Мощность от 0.1−0.3 до 0.65 м.
3 − глина каолинитовая, переполнена зернами, щебенкой и глыбами известняка. Мощность 0.9−1.1 м.
4 − линза охристо-бурых глинистых алевритистых песков. Мощность до 0.1 м.
5 − линза темно-коричневато-охристых песчаных глин. Мощность 0.2 м.
6 − глина охристо-бурая, песчано-алевритистая переполнена щебенкой и глыбами известняка. Мощность 0.2−0.3 м.
7 − линза темно-коричнево-охристых глин с мелкой щебенкой известняка. Мощность 0.1–0.25 м.
8 − глина темно-бурая, каолинитовая, алевритистая с щебнем кремней и известняков. Мощность 0.7−0.9 м.
8а − линза глины светло-коричневой с белыми пятнами с мелкой щебенкой известняка. Мощность до 0.15 м.
9 − пелит полимиктовый бурого и темно-бурого цвета, с щебнем и глыбами известняка. Мощность 1.2−1.4 м.
9а – линза светло-серого гипса на глубине 2.4−2.6 м. Мощность 1.2−1.4 м.
10 − глина светло-коричневая, алевритистая, с зернами и мелкой щебенкой известняка, заполняет трещины в известняковом ложе на дне. Мощность до 0.4 м.
11 − известняк серый, расколот на крупные блоки вертикальными трещинами.
Раскопки отложений раскопа V в 1985 г. производились условными горизонтами. Мощность условных горизонтов до глубины 1.6 м составляла 0.1 м; с глубины 1.6 до глубины 3.15−0.2 м. Последний слой 10 выбран из трещин известнякового ложа одним горизонтом. До глубины 2.35 м горизонты снимались со всей площади раскопа, а с глубины 2.35 м раскапываемую площадь сократили до 1.8 × 1.5 м. И на этой площади раскоп доведен до скального дна. Следует отметить, что в публикации 1990 г. слой 10 имел номер “9” (Смирнов и др., 1990).
В 2014 г. работы в раскопе V были продолжены и были раскопаны отложения площадью 1.2 × 1.5 м, оставленные в 1985 г.. Были доисследованы слой 9 (от 2.35 до 3.10 м) и слой 10 (от 3.10 до 5.20 м). Слой 10 в этой части раскопа представлял собой сильно расслоившийся известняк, заполненный глиной светло-коричневого цвета, мощностью до 2.1 м. Таким образом, слой 10 в раскопе 1985 и 2014 годов литологически был одинаковым. Различались эти участки только мощностью слоя. Это, вероятно, связано с тем, что участок 2014 г. примыкает к скальной стенке и скальное дно пещеры в этом месте расслоилось в большей степени.
Для отложений по материалам из раскопа 1985 г. получено несколько радиоуглеродных дат. По костям мелких млекопитающих из слоя 3 и по костям пещерного медведя из слоя 8 получены запредельные даты >27620 л. н., ИЭРЖ-59 и >27 500 л. н. ИЭРЖ-21. Из слоя 3 по метаподии пещерного льва получена дата 41 900 ± 1200 л.н., OxA-10 887 (Stuart, Lister, 2011).
По результатам раскопок 1985 г. (по костным остаткам грызунов) из слоя 10 (ранее слой 9) и из слоя 3 пещеры Серпиевская 1 была описана “Серпиевская” фауна. Эта фауна считалась самой древней из изученных фаун на момент исследования в пределах горной части Южного Урала. В слое 10 (9) были найдены остатки насекомоядных, зайцеобразных, грызунов, хищных и копытных (Смирнов и др., 1990). По морфологическим характеристикам и размерам зубов представителей родов Dicrostonyx, Lagurus, Arvicola и Microtus “Серпиевская” фауна была датирована переходом от финала микулинского межледниковья (ИКС 5 a-d) к началу валдайского надгоризонта (ИКС 4) (Смирнов и др., 1990).
В данной работе представлены результаты описания и анализа материалов из слоя 10, полученных в процессе новых исследований в 2014 г.
МАТЕРИАЛЫ И МЕТОДЫ
Отложения слоя 10 (глубина 3.1–5.2 м) были вскрыты 20 условными горизонтами мощностью от 5 до 20 см и промыты на ситах (1.0 мм). Мощность условных горизонтов определялась количеством гальки и гравия: она уменьшалась при уменьшении их доли и увеличивалась при увеличении. Из полученного концентрата был выбран весь костный материал (39 133 зубов, челюстей и сильно фрагментированных костей млекопитающих) и дополнительно очищен с помощью ультразвуковой ванны “GB-10 LB”. Материалы исследованы с помощью оптических (бинокуляр МБС-10, стереомикроскоп Leica MZ16) и электроннозондовых (сканирующий электронный микроскоп VEGA 3 LMH с системой рентгеновского энергодисперсионного микроанализа Oxford Instruments INCA Energy 250/X-max 20) методов в лаборатории ГМПИ Горного института УрО РАН. Фотографии обработаны в программе “Adobe Photoshop 11.0”. Статистическая обработка данных проводилась с использованием программ “Microsoft Excel 2007” и “STATISTICA 6”.
Для идентификации таксономической принадлежности ископаемых костных остатков млекопитающих были использованы следующие элементы краниального и посткраниального скелетов:
отряд Eulipotyphla: в пределах семейств Soricidae, Talpidae – фрагменты черепов, нижние челюсти и зубы;
отряд Chiroptera: фрагменты черепов, нижние челюсти и зубы;
отряд Rodentia: семейство Cricetidae, род Lasiopodomys (L. gregalis), род Microtus (M. oeconomus, M. agrestis) – первые нижние моляры (m1); M. agrestis, род Clethrionomys (Cl. rutilus, Cl. rufocanus, Cl. glareolus) – вторые верхние моляры (M2); рода Arvicola, Dicrostonyx, Lagurus, Eolagurus, Clethrionomys, Cricetus, Cricetulus, Allocricetulus, триба Lemmini – все моляры; семейство Muridae, род Sylvaemus (Apodemus) – m1, m2, m3 M2, M3, семейство Gliridae, род Dryomys – m2, M2, семейство Sminthidae, род Sicista – M1, семейство Sciuridae, рода Sciurus – m1, m3, P4 (моляры, обнаруженные в исследованных отложениях); рода Spermophilus и Marmota – нижние и верхние щечные зубы без дифференциации порядкового номера; род Marmota – все элементы краниального и посткраниального скелетов.
отряд Lagomorpha: семейство Ochotonidae – премоляры p3, P3, нижние и верхние зубы без дифференциации порядкового номера; семейство Leporidae – все элементы краниального и посткраниального скелетов.
отряд Carnivora, superorder Ungulata – все элементы краниального и посткраниального скелетов.
Всего до вида и рода идентифицировано 15 439 ископаемых костных остатков (табл. 1).
Таблица 1.
Таксономический состав и количество костных остатков млекопитающих из слоя 10 (Игнатиевская пещера, раскоп V, 2014)
| Вид/глубина (м) | 5.00–5.20 | 4.90–5.00 | 4.80–4.90 | 4.70–4.80 | 4.60–4.70 | 4.50–4.60 | 4.40–4.50 | 4.30–4.40 | 4.20–4.30 | 4.10–4.20 | 4.00–4.10 | 3.90–4.00 | 3.75–3.90 | 3.65–3.75 | 3.55–3.65 | 3.45–3.55 | 3.35–3.45 | 3.25–3.35 | 3.20–3.25 | 3.10–3.20 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Talpa sp. | – | – | – | – | – | – | – | – | – | – | 1 | – | 3 | 4 | 2 | 4 | 4 | 9 | 3 | 1 |
| Crocidura leucodon Hermann 1780 |
– | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 2 | 1 | 1 | – | – |
| Crocidura sp. | – | – | – | – | – | – | – | 1 | – | – | 1 | – | 5 | – | – | 2 | 2 | – | – | 1 |
| Sorex araneus Linnaeus 1758 |
– | – | – | – | – | – | – | 1 | – | – | – | – | 4 | 4 | 7 | 10 | 10 | 14 | – | 3 |
| Sorex tundrensis Merriam 1900 |
– | – | 1 | – | – | – | – | – | – | – | 2 | 3 | 6 | – | 3 | – | – | – | – | – |
| Sorex caecutiens Laxmann 1788 |
– | – | – | – | – | – | – | – | – | – | – | – | – | – | 2 | – | – | 3 | – | – |
| Sorex isodon Turov 1924 |
– | – | – | – | – | – | – | – | – | – | – | – | – | 2 | 4 | 3 | 2 | 3 | 3 | 3 |
| Sorex minutissimus Zimmermann 1780 |
– | – | – | – | – | – | – | – | – | – | – | – | 4 | 1 | 9 | 4 | 2 | 1 | – | – |
| Sorex minutus Linnaeus1766 |
– | – | – | – | – | – | – | – | – | – | – | – | – | 2 | 3 | 6 | 4 | 3 | – | – |
| Sorex ex gr. minutissimus–minutus | – | – | – | – | – | – | – | – | – | – | 2 | 1 | – | – | 3 | 1 | 4 | 1 | – | 1 |
| Sorex sp. | – | – | 1 | 2 | 1 | – | – | 3 | – | – | 1 | 22 | 50 | 43 | 84 | 52 | 56 | 61 | 12 | 22 |
| Myotis dasycneme Boie 1825 |
– | – | – | – | – | – | – | – | – | – | 2 | – | 2 | 1 | – | – | 1 | – | – | 1 |
| Myotis sp. | – | – | – | – | – | – | – | – | – | – | – | – | 4 | 2 | – | – | 2 | 3 | 1 | 2 |
| Plecotus auritus Linnaeus 1758 |
– | – | – | – | – | – | – | 1 | – | – | – | 3 | 3 | 5 | 1 | 2 | 3 | 3 | 1 | 3 |
| Eptesicus nilssoni Keyserling et Blasius 1839 |
1 | 1 | 4 | 7 | 2 | 7 | 3 | 7 | 2 | 6 | 12 | 31 | 48 | 25 | 25 | 20 | 61 | 37 | 33 | 29 |
| Chiroptera | 4 | 30 | 50 | 78 | 24 | 25 | 8 | 32 | 16 | 24 | 100 | 272 | 591 | 376 | 297 | 186 | 365 | 459 | 196 | 255 |
| Ochotona cf. hyperborea Pallas 1811 | – | – | – | – | – | – | – | 1 | 1 | – | – | – | 5 | 2 | – | – | – | – | – | – |
| Ochotona cf. pusilla Pallas 1769 |
1 | – | – | – | – | – | – | 2 | 1 | – | 1 | 3 | 2 | 2 | 3 | 3 | 1 | 1 | – | 1 |
| Ochotona sp. | 7 | 7 | 2 | 4 | 1 | – | 4 | 3 | 6 | 32 | 35 | 62 | 61 | 73 | 27 | 21 | 22 | 9 | 1 | – |
| Lepus sp. | 3 | – | 1 | – | 1 | 3 | 3 | 9 | 19 | 29 | 36 | 30 | 49 | 16 | 12 | 10 | 30 | 35 | 2 | 10 |
| Sciurus vulgaris Linnaeus 1758 |
– | – | – | 2 | – | – | – | – | – | – | – | – | 2 | – | – | – | – | – | – | – |
| Spermophilus sp. | – | 1 | 1 | 1 | – | – | – | 8 | 2 | 12 | 11 | 14 | 14 | 6 | 2 | 1 | 4 | 2 | 2 | 3 |
| Marmota sp. | – | 1 | – | – | – | – | 1 | 1 | – | 11 | 12 | 8 | 7 | 3 | 2 | 2 | – | 1 | 2 | – |
| Dryomys nitedula Pallas 1778 |
– | – | – | – | – | – | – | – | – | – | – | – | – | 2 | – | 1 | – | – | – | – |
| Sicista subtilis Pallas 1773 |
– | – | – | – | – | – | – | – | – | – | – | – | – | – | 1 | – | – | – | – | – |
| Cricetus cricetus Linnaeus 1758 |
– | – | – | – | – | – | – | – | – | 2 | 7 | 3 | 7 | 4 | 3 | 1 | – | – | – | – |
| Allocricetulus eversmanni Brandt 1859 | – | – | – | – | – | – | 1 | 3 | 2 | 1 | 3 | 4 | 8 | 19 | 13 | 21 | 9 | 15 | 5 | 5 |
| Cricetulus migratorius Pallas 1773 | 1 | 2 | 2 | 1 | – | – | – | 3 | 9 | 17 | 30 | 45 | 49 | 22 | 35 | 37 | 43 | 43 | 9 | 13 |
| Lemmus sibiricus Kerr 1792 |
– | – | – | – | – | – | – | – | – | 1 | 1 | 1 | – | 4 | – | – | 1 | 1 | – | 1 |
| Lemmini gen. | 1 | – | – | 2 | – | – | – | 2 | – | – | 1 | 4 | 9 | 19 | 4 | 8 | 10 | 5 | 14 | 4 |
| Dicrostonyx sp. | 3 | – | 2 | – | – | – | – | 2 | 1 | 4 | 6 | 9 | 11 | 8 | 10 | 21 | 25 | 27 | 5 | 9 |
| Clethrionomys rufocanus Sundevall 1846 | – | – | – | – | – | – | – | – | – | – | – | – | – | 1 | – | 1 | 2 | – | – | – |
| Clethrionomys glareolus Schreber 1780 | – | 2 | 2 | 1 | – | 1 | 3 | – | 2 | 1 | – | 8 | 14 | 9 | 6 | 7 | 7 | 4 | 1 | 1 |
| Clethrionomys rutilus Pallas 1779 | – | – | – | – | – | – | – | 2 | – | 4 | 7 | 7 | 4 | 5 | 2 | – | – | 2 | 1 | – |
| Clethrionomys sp. | 4 | 4 | 6 | 11 | 4 | 2 | 9 | 17 | 19 | 24 | 33 | 62 | 133 | 95 | 56 | 44 | 54 | 49 | 10 | 15 |
| Lagurus lagurus Pallas 1773 |
2 | – | – | 4 | 2 | 1 | 1 | 7 | 27 | 17 | 33 | 71 | 134 | 87 | 70 | 34 | 39 | 26 | 9 | 14 |
| Eolagurus luteus Eversmann 1840 | – | – | – | – | – | – | – | 1 | – | – | – | – | – | 1 | 4 | 8 | 5 | – | – | – |
| Arvicola terrestris Linnaeus 1758 | – | – | – | – | – | 1 | – | – | – | 4 | 3 | 6 | 11 | 17 | 5 | 5 | 12 | 17 | 8 | 8 |
| Lasiopodomys gregalis Pallas 1779 | 12 | 8 | 8 | 10 | 2 | 7 | 9 | 37 | 39 | 78 | 101 | 113 | 119 | 61 | 71 | 64 | 66 | 65 | 14 | 21 |
| Microtus oeconomus Pallas 1776 | 2 | 2 | – | 6 | – | 3 | 1 | 7 | 5 | 7 | 24 | 9 | 22 | 21 | 13 | 13 | 11 | 18 | 5 | 9 |
| Microtus agrestis Linnaeus 1761 | 5 | 2 | 5 | 2 | 1 | – | 1 | – | 2 | 10 | 12 | 20 | 22 | 20 | 16 | 12 | 18 | 23 | 6 | 9 |
| Microtus sp. | 83 | 38 | 71 | 103 | 20 | 34 | 73 | 204 | 248 | 395 | 727 | 762 | 696 | 436 | 503 | 373 | 476 | 456 | 112 | 180 |
| Sylvaemus flavicollis Melchior 1834 | – | – | – | – | – | – | – | – | – | – | – | – | 5 | 4 | 4 | 5 | 3 | 1 | – | – |
| Sylvaemus ex gr. uralensis–sylvaticus | – | – | – | – | – | – | – | – | – | – | – | – | 6 | 8 | 19 | 9 | 13 | 8 | 2 | – |
| Canis lupus Linnaeus 1758 |
– | – | – | – | – | – | 1 | 1 | 1 | 4 | 2 | – | 7 | 16 | 26 | 78 | 96 | 34 | 32 | |
| Vulpes lagopus Linnaeus 1758 |
– | – | – | – | – | – | – | 2 | 2 | 4 | 2 | 2 | 5 | 2 | 8 | 11 | 24 | 35 | 10 | 19 |
| Vulpes vulpes Linnaeus 1758 |
– | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 1 | – | – | – | 2 |
| Ursus savini Andrews 1922 |
– | – | – | – | – | – | – | – | – | – | 1 | – | – | – | – | – | 3 | – | ||
| Ursus sp. | 3 | – | 1 | 4 | 2 | 6 | 1 | 12 | 4 | 13 | 18 | 18 | 10 | 13 | 8 | 3 | 10 | 6 | 3 | 3 |
| Martes sp. | – | – | – | – | – | – | 1 | – | – | 1 | – | – | – | 2 | – | – | 1 | 2 | – | 1 |
| Gulo gulo Linnaeus 1758 |
– | – | – | – | – | – | – | – | – | 1 | – | – | – | 1 | 1 | 2 | 18 | 13 | 4 | 8 |
| Mustela nivalis Linnaeus 1766 |
– | – | – | 1 | – | – | – | 1 | – | – | 2 | 4 | 2 | 2 | 1 | 1 | 3 | 4 | – | 2 |
| Mustela erminea Linnaeus 1758 |
– | – | – | – | – | – | – | – | – | 1 | – | – | – | 3 | 1 | 1 | – | – | – | – |
| Mustela sp. | – | – | – | – | – | – | – | – | 1 | – | – | – | 1 | – | 1 | – | – | 1 | – | – |
| Panthera leo spelaea Goldfuss 1810 |
– | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 1 | – | – |
| Ovis ommon Linnaeus 1758 |
– | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 1 | – | – | – |
| Ungulates | 1 | – | – | – | – | – | – | 1 | 1 | – | – | – | – | – | – | 1 | – | 2 | – | – |
| Mammalia indet. | 141 | 157 | 72 | 154 | 15 | 90 | 297 | 577 | 906 | 1254 | 1486 | 1319 | 2715 | 1189 | 2388 | 1673 | 3139 | 4070 | 622 | 1430 |
| ∑ (количество остатков) | 274 | 255 | 229 | 393 | 75 | 180 | 416 | 948 | 1315 | 1954 | 2716 | 2919 | 4843 | 2629 | 3745 | 2711 | 4641 | 5636 | 1133 | 2121 |
| N (количество таксонов) | 13 | 9 | 11 | 14 | 9 | 8 | 12 | 23 | 18 | 23 | 26 | 25 | 32 | 38 | 35 | 36 | 34 | 35 | 26 | 29 |
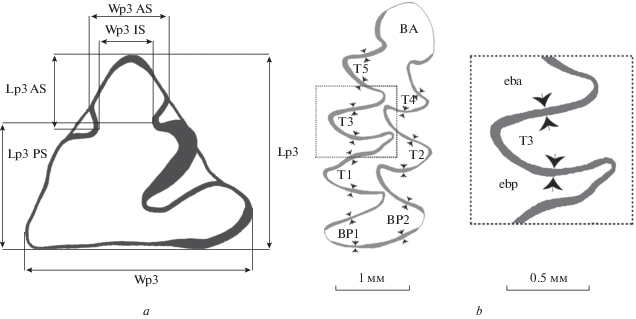
Для видового определения ископаемых черепов и нижних челюстей летучих мышей использовалась эталонная коллекция Горного института УрО РАН. Идентификация нижних челюстей землеройковых (Soricidae) проводилась по методикам (Zaitsev, 1998; Fadeeva, 2016). Для видовой идентификации ископаемых пищух использовались морфометрические показатели и индексы третьего нижнего премоляра (р3) по методике Тетериной (2001, 2003), схема промеров показана в данной статье на рис. 2a. Видовая принадлежность мышей (род Sylvaemus (Apodemus)) определялась с использованием коэффициентов классификационных функций по соответствующей методике (Лашкова, Дзеверин, 2002). Терминология элементов жевательной поверхности коренных зубов полевок дана по схеме А. ван дер Мойлена (Meulen van der, 1973). При измерениях первых нижнекоренных зубов полевок использовалась методика Рековца и Надаховски (Rekovets, Nadachowski, 1995). Видовую принадлежность изолированных зубов лесных полевок (род Clethrionomys) определяли на основании размерных характеристик второго верхнего моляра (М2), для которого возможна наиболее точная диагностика (Бородин и др., 2005; Бородин, 2009). Первые и вторые верхние моляры (M1, M2) копытных леммингов (Dicrostonyx sp.) отнесены к морфотипам “simplicior”, “henseli”, “torquatus”; отличия которых выражены разной степенью развития эмалевой режущей грани на проксимальной части шестого (у М1) и пятого (у М2) дентиновых треугольников (Смирнов и др., 1997). Видовая идентификация зубов ископаемых настоящих леммингов (Lemmini gen.) была проведена на основе размерных и морфологических особенностей третьих верхних коренных зубов (Смирнов и др., 1997; Пономарев и др., 2011; Ponomarev et al., 2015). Для установления стратиграфического положения вмещающих отложений вычислялся SDQ (Schmelzband-Differenzierung-Quotient) − коэффициент дифференциации эмали 7 треугольных полей первого нижнекоренного зуба водяной полевки (Arvicola terrestris) (Heinrich, 1978) по формуле SDQTn = ebp/eba × 100. Схема промеров представлена на рис. 2b. Все первые нижние моляры степной пеструшки (Lagurus lagurus) дифференцированы по морфотипам параконидного отдела по методике А.Г. Яковлева (2015) (I, II морфотипы – “транзиенсные”, III морфотип – “переходный” и IV, V морфотипы – “лагурусные”). Все первые нижнекоренные зубы узкочерепной полевки (Lasiopodomys gregalis) по комбинации входящих углов с обеих сторон параконидной головки были разделены на три морфотипа “грегалоидный”, “грегалоидно-микротидный” и “микротидный” (Большаков и др., 1980).
Рис. 2.
Схемы промеров зубов пищух и водяных полевок: а − промеры третьего нижнего премоляра (р3) пищух (по: Тетерина, 2003), описание промеров в табл. 2; b − cхема промеров толщины эмали первого нижнекоренного зуба водяных полевок (по: Escude et al., 2008). T 1–5 – элементы m1. Bp 1−2 – углы задней петли m1. ebp (enamel breadth posterior) – ширина нижней эмали, eba (enamel breadth anterior) − ширина верхней эмали.
Ископаемые остатки сравнивались с соответствующими таксонами из коллекций музея Института экологии растений и животных УрО РАН и Горного института УрО РАН. Коллекция ископаемых остатков хранится в музее ИЭРЖ УрО РАН № 253.
РЕЗУЛЬТАТЫ
Тафономические особенности. Кости черепа и посткраниального скелета крупных млекопитающих (размер от зайца и крупнее) из всех горизонтов сильно фрагментированы и многие имеют следы пищеварительной коррозии. Доля неопределимых костей крупных млекопитающих (Mammalia indet., табл. 1) очень высока и в разных горизонтах составляет от 92.1 (горизонт 3.2–3.25 м) до 99.9% (горизонт 4.9–5.0 м). Пригодными для видового и родового определения костных остатков крупных млекопитающих были только изолированные зубы, фрагменты нижних челюстей, карпальные, тарзальные и сесамоидные кости. Такой характер фрагментации костных остатков указывает на их накопление в результате деятельности хищных млекопитающих, которые использовали пещеру в качестве логова.
Ископаемые остатки мелких млекопитающих (летучие мыши, насекомоядные, пищухи и грызуны) во всех горизонтах в большинстве случаев представлены фрагментами нижней челюсти и изолированными зубами. Фрагменты черепа и трубчатые кости встречаются очень редко. Плохая сохранность материала, подавляющее большинство которого составляют изолированные зубы, указывает на его “экскрементное” происхождение. Летучие мыши часто попадают в зоогенные отложения карстовых полостей вследствие естественной гибели во время зимовки, но хищники так же могут играть значительную роль в накоплении остатков этих животных (Kowalski, 1995), особенно в периоды массовых скоплений мышей в пещерах (Тиунов, 1997). Практически полное отсутствие целых черепов и костей посткраниального скелета указывает на то, что накопление остатков летучих мышей происходило по этой причине.
С глубиной уменьшается количество костных остатков, но сохраняется соотношение основных таксонов (табл. 1). Во всех горизонтах найдены остатки наиболее многочисленных таксонов: Chiroptera, Ochotona, Lasiopodomys, Clethrionomys, Ursus. Менее многочисленные (Sorex, Lagurus, Microtus, Cricetulus) представлены почти во всех горизонтах. Во всех горизонтах сохраняется сильная степень раздробленности и высокая доля неопределимых костей. Все это свидетельствует о том, что на протяжении всего времени формирования слоя 10, накопление в нем костных остатков происходило в результате действий одних и тех же факторов. Ведущим среди них была деятельность хищных млекопитающих, которые устраивали логово во входном гроте.
На части зубов землероек наблюдаются депигментация и деструкция непигментированной части эмали, которые вероятнее всего являются результатом агрессивного химического воздействия подземных вод пещеры.
По соотношению видов грызунов выборки 1985 г. (Смирнов и др., 1990) и 2014 г. заметно различаются. В выборке 1985 г. заметно больше доля сибирского лемминга (Lemmus sibiricus). Различаются частоты морфотипов у представителей рода Dicrostonyx из раскопов разных лет. В небольшой выборке зубов копытных леммингов из раскопа 2014 г. часть имеет прогрессивные морфотипы (“henseli” и “torquatus”), а в выборке 1985 г. на верхних молярах представлен только один примитивный морфотип “simplicior” (Смирнов и др., 1990). Причины этих различий не вполне ясны. Мы предполагаем хронологическое различие выборок в разных частях раскопа.
Летучие мыши. Ископаемые остатки летучих мышей (3795 изолированных зубов, нижних челюстей и фрагментов верхних челюстей) были обнаружены в отложениях всех исследованных условных горизонтов пещеры Игнатиевская (табл. 1). Следующие виды были идентифицированы – северный кожанок (Eptesicus nilssonii), обыкновенный ушан (Plecotus auritus), прудовая ночница (Myotis dasycneme) и Myotis sp. (мелкие ночницы). Преобладают остатки северного кожанка. Для всех черепов зафиксирована плохая степень сохранности. Зубы отсутствуют в большинстве нижних челюстей. Большинство восходящих ветвей нижних челюстей сломаны.
Нижние челюсти E. nilssonii имеют три альвеолы премоляров – однокорневого p3 и двухкорневого p4. Подбородочное отверстие расположено под промежутком между альвеолами клыка и p3.
Несколько фрагментов нижних челюстей принадлежат мелким видам ночниц. Пять видов Myotis, обитающих в пещерах (M. brandtii, M. mystacinus, M. daubentonii, M. dasycneme, M. nattereri) зарегистрированы в современной фауне Южного Урала (Большаков и др., 2005; Снитько, 2005). Видовая идентификация мелких ночниц по фрагментам нижней челюсти без зубов и восходящей ветви затруднена. Нижние челюсти Myotis sp. характеризуются четырьмя премолярными альвеолами – однокорневыми p2, p3 и двухкорневыми p4 и аналогичны по расположению подбородочного отверстия с челюстями E. nilssonii.
Нижние челюсти P. auritus отличаются от других рассматриваемых видов расположением подбородочного отверстия – под альвеолой p2 или под промежутком между альвеолами p2 и p3. В нижней челюсти этого вида четыре премолярные альвеолы. Одна нижняя челюсть ушана с редукцией р2 обнаружена в отложениях с глубины 3.35–3.45 м.
Насекомоядные. Ископаемые остатки насекомоядных млекопитающих, найденные в Игнатиевской пещере, фрагментарны (602 фрагмента нижней челюсти и верхней челюсти, изолированные зубы) (табл. 1). Определены восемь таксонов: крот (Talpa sp.), белобрюхая белозубка (Crocidura leucodon), обыкновенная бурозубка (Sorex araneus), равнозубая бурозубка (S. isodon), тундряная бурозубка (S. tundrensis), средняя бурозубка (S. caecutiens), малая бурозубка (S. minutus), крошечная бурозубка (S. minutissimus). Таким образом, по составу видов наши результаты частично подтверждают более ранние выводы (Зайцев, 1992; Zaitsev, 1998) с дополнением еще четырех видов насекомоядных (S. isodon, S. caecutiens, S. minutissimus, C. leucodon).
Видовая принадлежность представителей Soricidae была определена по нижним челюстям. Обычно сохранность позднеплейстоценовых костных остатков насекомоядных млекопитающих очень плохая. Наличие пигментации в зубах Sorex является важным диагностическим критерием, однако у некоторых ископаемых зубов пигментация отсутствует. Такие зубы были обнаружены практически во всех условных горизонтах исследованных отложений, также были зафиксированы зубы с деструкцией непигментированной части. Видовое определение таких ископаемых остатков основано главным образом на структуре зубов и строении нижней челюсти. Сочленовные отростки разных видов бурозубок относительно хорошо сохраняются в отложениях и являются хорошим материалом для идентификации видов. Они хорошо различаются в мелкоразмерных и крупноразмерных группах бурозубок. Сочленовные отростки S. minutus (мелкоразмерная группа) и S. isodon (крупноразмерная группа) высокие. Верхняя и нижняя фасетки параллельны. Щечная сторона отростка прямая или слегка вогнутая. Ширина межсуставной области немного меньше длины верхней фасетки или равна ей. Суставные отростки S. minutissimus (мелкоразмерная группа) и S. araneus (крупноразмерная группа) низкие. Верхняя и нижняя фасетки не параллельны. Буккальная сторона отростка S. minutissimus слегка вогнутая, а у S. araneus сильно вогнутая.
Все обнаруженные нижние челюсти белозубок принадлежат C. leucodon. Видовая принадлежность изолированных зубов белозубок из исследованных отложений не определялась.
Немногочисленные изолированные зубы, принадлежавшие взрослым кротам (Talpa sp.), а также единичные фрагменты их нижних челюстей без зубов обнаружены только в верхней половине отложений до глубины 4.10 м.
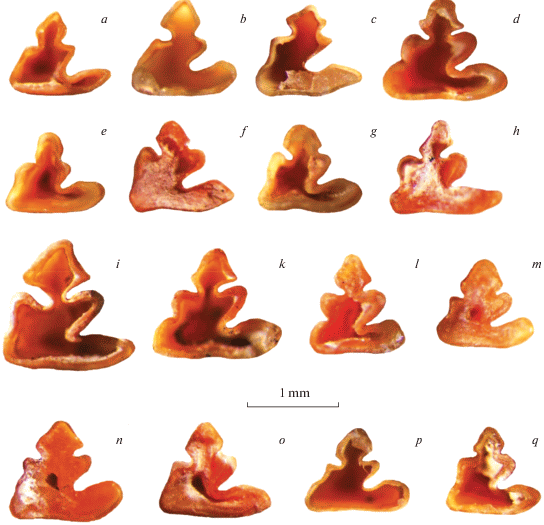
Зайцеобразные. Зубы и кости пищух и зайцев (705 экземпляров) присутствуют в небольших количествах практически во всех условных горизонтах (табл. 1). Как известно, в настоящее время на Урале обитают два вида пищух – степная пищуха (Ochotona pusilla Pall.) на Южном Урале и северная пищуха (Ochotona hyperborea Pall.) на Полярном Урале (Большаков, 1997). Ископаемые остатки этих видов дифференцируются по нижним челюстям и нижним третьим премолярам (p3) (Кузьмина, 1971; Ербаева, 1988; Громов, Ербаева, 1995). Премоляр O. pusilla имеет небольшой передний сегмент, который соединен с задним сегментом широким пространством, внутренний край заднего сегмента наклонен к продольной оси зуба. Премоляр O. hyperborea имеет более крупный передний сегмент, который соединен с задним сегментом пространством различной ширины, внутренний край заднего сегмента параллелен продольной оси зуба. Однако для обоих видов установлены широкие пределы морфологической изменчивости структуры этого зуба (Ербаева, 1988), и применение этих критериев для видовой идентификации ископаемого материала затруднено.
Значения размеров и пропорций p3 у обоих видов перекрываются (Тетерина, 2001, 2003). Самая небольшая степень перекрытия наблюдается у индекса “ширина p3 переднего сегмента/ширина p3” (W p3 AS/W p3). У современной северной пищухи он более 0.320, а у степной пищухи он имеет значения от 0.226 до 0.395 (Тетерина, 2001; табл. 2). На основании этого, ископаемые зубы с индексом менее 0.320 были отнесены к степной пищухе, а зубы со значениями более 0.395 – к северной пищухе (табл. 2, рис. 3). Результаты анализа предварительно свидетельствуют о наличии обоих видов пищух в составе фауны.
Таблица 2.
Промеры (мм) третьего нижнего премоляра (p3) представителей рода Ochotona
| Выборки | Промеры | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| L p3 | L p3 AS | L p3 PS | W p3 AS | W p3 | W p3 IS | L p3 AS/ W p3 AS |
W p3 IS/ W p3 AS |
W p3 AS/ W p3 |
|
| Ochotona cf. hyperborea1 [9 ] | 0.850–1.200 | 0.275–0.500 | 0.575–0.750 | 0.225–0.525 | 1.000–1.400 | 0.150–0.300 | 0.905–1.333 | 0.381–0.750 | 0.397–0.491 |
| Ochotona hyperborea [47]2 | 0.857–1.243 | 0.271–0.557 | 0.571–0.843 | 0.343–0.671 | 1.014–1.329 | 0.029–0.329 | 0.659–1.038 | 0.079–0.885 | 0.320–0.538 |
| Ochotona cf. pusilla1 [19 ] | 0.900–1.250 | 0.300–0.500 | 0.575–0.750 | 0.200–0.575 | 0.975–1.450 | 0.125–0.325 | 0.750–1.750 | 0.294–0.769 | 0.174–0.319 |
| Ochotona pusilla [19 ]3 | 0.750–1.125 | 0.225–0.525 | 0.525–0.750 | 0.275–0.425 | 0.875–1.425 | 0.05–0.250 | 0.688–1.455 | 0.133–0.636 | 0.226–0.395 |
Примечания. Выборки: 1 Игнатиевская пещера, раскоп V, 2014, слой 10; 2 современные, Полярный Урал (по: Тетерина, 2001); 3 современные, Южный Урал (по: Тетерина, 2001). Промеры: L p3 – длина p3, W p3 − ширина p3, L p3 AS − длина переднего сегмента p3, W p3 AS – ширина переднего сегмента p3, L p3 PS − длина заднего сегмента p3, W p3 IS – ширина промежутка между сегментами.
Рис. 3.
Ископаемые зубы (p3) пищух (альвеолярная сторона). b, c, i, k, m, n – Ochotona cf. hyperborea; h, o − Ochotona cf. pusilla; a, d, e, f, g, l, p, q – Ochotona sp. Глубина 3.65–4.00 м. Игнатиевская пещера (V, 2014).
Грызуны. Зубы млекопитающих этого отряда являются самыми многочисленными (9 674 экземпляров) в отложениях (табл. 1). Большинство этих зубов (~80%) были обнаружены в верхних горизонтах (3.10–4.10 м).
Зубы мышей (род Sylvaemus) встречаются только на глубине 3.20–3.90 м (0.9–4.5% от общего количества зубов грызунов). Зубы желтогорлой мыши (S. flavicollis) редки (0.7–1.4%), характеризуются крупными размерами. Мы условно объединили более мелкие зубы лесных мышей в группу S. ex gr. uralensis – sylvaticus. Систематический статус обладателей ископаемых изолированных зубов трудно определить на основе морфологических данных, поскольку четкие дискретные признаки зубов малой уральской мыши (S. uralensis) и европейской лесной мыши (S. sylvaticus) отсутствуют, морфометрические параметры перекрываются (Колчева, 2006). Данные о границах современных ареалов S. uralensis и S. sylvaticus и распространении их на территории Урала до сих пор противоречивы (Башенина, 2003; Колчева, 2006).
Единственный зуб степной мышовки (Sicista subtilis) был найден на глубине 3.55−3.65 м. Это первый верхний моляр (длина 1.10, ширина 1.08 мм), умеренно стертый (возраст ~ 1 год), без дополнительных шпор на окклюзионной поверхности.
Зубы лесной сони (Dryomys nitedula) были извлечены из отложений двух условных горизонтов – M2 sin (3.45–3.55 м) и M2 sin, м2 dex (3.65–3.75 м). Размеры (мм) этих зубов (трехкорневые LM2 (A): 1.00, WM2 (A): 1.25; LM2 (B): 1.08; WM2 (B): 1.32; двухкорневой Lm2 (C): 1.20, Wm2: 1.23) находятся в пределах размерной изменчивости зубов современных лесных соней из Польши и лесных соней из среднего плейстоцена, местонахождения Kozi Grzbiet (Daoud, 1993).
Зубы обыкновенной белки (Sciurus vulgaris) обнаружены в двух горизонтах (P4 sin и m3 sin на глубине 3.75–3.90 м; P4 sin и m1 sin – 4.70–4.80 м). Зубы принадлежали взрослым особям. Они не отличаются от современных зубов вида по строению коронки и размеру.
Редкие кости и зубы сурков Marmota и сусликов Spermophilus встречаются практически во всех условных горизонтах. Конкретная идентификация ископаемого материала невозможна из-за отсутствия четких критериев видовой идентификации зубов.
Зубы серого хомяка (Cricetulus migratorius) (в среднем около 6% от общего количества зубов грызунов) были обнаружены практически во всех горизонтах, за небольшим исключением (отсутствующим на глубине 4.40–4.70 м). Зубы хомячка Эверсмана (Allocricetulus evesmanni) представлены в меньших количествах (в среднем ~ 3%) во всех горизонтах, за исключением самых нижних (глубже 4.50 м). Единичные зубы обыкновенного хомяка (Cricetus cricetus) (~1%) извлечены из средней части отложений (3.45–4.10 м).
Зубы рыжей полевки (Clethrionomys glareolus) обнаружены практически на всех горизонтах (0.9–17.6%). Зубы красной полевки (Cl. rutilus) встречаются в меньших количествах (1.3–4.0%) и отсутствуют только в самых нижних отложениях (глубже 4,40 метра). Зубы красно-серой полевки (Cl. rufocanus) единичны (0.6–1.4%) и найдены только в трех условных горизонтах верхней половины отложений.
Немногочисленные зубы копытных леммингов (Dicrostonyx sp.) обнаружены во всех условных горизонтах, кроме нижней части отложений (отсутствуют на глубине 4.40–5.00 м). Сохранность этих зубов плохая, и среди M 1 [n = 27] морфотипы установлены только для ~40% зубов, среди M2 [n = 13] – ~23%. У 5 экземпляров первых верхнекоренных моляров (M1) установлен морфотип “simplicior”, у 2 − “henseli” и у 4 − “torquatus”. Среди вторых верхнекоренных моляров (M2) выявлен 1 экземпляр с морфотипом “simplicior” и 2 − с морфотипом “torquatus”. Малое количество зубов не позволяет достоверно установить морфологическую стадию эволюционного развития и определить их таксономическую принадлежность в пределах рода.
Доля зубов леммингов трибы Lemmini в отложениях значительно ниже (0.5–1.9%), чем доля зубов копытных леммингов. Все целые третьи верхнекоренные зубы M3 [n = 10] по морфометрическим характеристикам (LM3: 2.20–2.78 мм; WM3: 1.15–1.38 мм; WM3/LM3%: 48.11–52.27) принадлежат сибирскому леммингу Lemmus sibiricus. По строению заднего лингвального угла M3 (n = 12) относятся к морфотипу “M3/–1”. Этот морфотип характерен для подавляющего большинства зубов современных L. sibiricus (95.4%, 97.1%) и для большей части зубов современных лесных леммингов Myopus schisticolor (Ponomarev et al., 2015). По строению задней петли фрагменты трех зубов относятся к морфотипу “M3/−7”. Фрагмент одного зуба отнесен к морфотипу “M3/–8”. Оба последних морфотипа были установлены только для зубов M. schisticolor (Ponomarev et al., 2015). Учитывая эти данные, мы не исключаем наличия зубов, принадлежащих лесному леммингу, в выборках фрагментированных М3.
Зубов водяных полевок (Arvicola terrestris) (рис. 4) в отложениях (3.10–4.20 м) также обнаружено немного (0.5–5.6%). Средние значения SDQ первых нижнекоренных зубов (m1) установлены в пределах от 83.0 до 111.3, размеры относительно мелкие (табл. 3).
Рис. 4.
Первые нижние зубы (m1) Arvicola terrestris. 3.10−4.20 м. Буквенные обозначения как в табл. 3. Игнатиевская пещера (V, 2014).
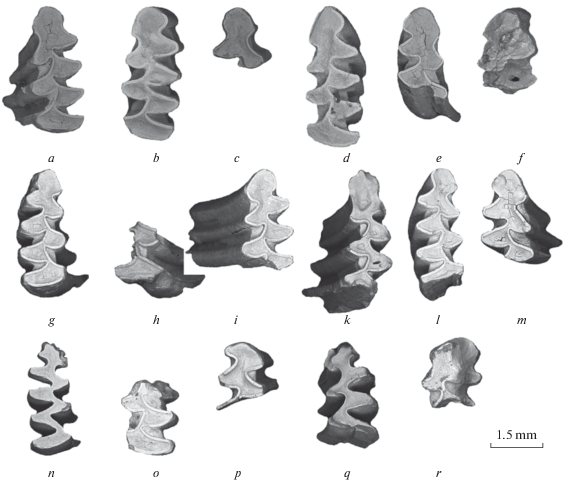
Таблица 3.
Промеры (мм) первого нижнекоренного зуба (m1) и толщины эмали зуба. Arvicola terrestris. Игнатиевская пещера (V. 2014). Южный Урал. 3.10−4.00 м
| Зуб | Глубина [количество] | Промеры и показатели | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| L m1 | W m1 | SDQ T1 |
SDQ T2 |
SDQ T3 |
SDQ T4 |
SDQ T5 |
SDQ Bp1 |
SDQ Bp2 |
SDQ m1 (среднее) | ||
| a | 3.10–3.20 [1 ] | 3.65 | 1.5 | 96.2 | 96.5 | 95.2 | 104.5 | 99.6 | 98.4 | ||
| b | 3.10–3.20 [2 ] | 3.95 | 1.65 | 91.5 | 78.6 | 77.9 | 70.3 | 85.9 | 93.9 | 83.0 | |
| c | 3.1–3.2 [3 ] | 83.1 | 83.1 | ||||||||
| d | 3.25–3.35 [1 ] | 3.9 | 1.6 | 95.2 | 89.0 | 88.8 | 89.8 | 80.2 | 97.8 | 90.1 | |
| e | 3.25–3.35(2) [2 ] | 1.35 | 80.6 | 91.0 | 91.0 | 87.5 | |||||
| f | 3.25–3.35 [3 ] | 89.4 | 108.6 | 99.0 | |||||||
| g | 3.55–3.65 [1 ] | 3.7 | 1.4 | 104.9 | 101.7 | 108.8 | 113.6 | 115.3 | 107.1 | 108.6 | |
| h | 3.55–3.65 [2 ] | 99.1 | 99.1 | ||||||||
| i | 3.65–3.75 [1 ] | 1.5 | 106.2 | 111.8 | 121.0 | 113.2 | 104.5 | 111.3 | |||
| k | 3.65–3.75 [2 ] | 113.0 | 107.9 | 110.4 | |||||||
| l | 3.65–3.75 [3 ] | 1.45 | 93.6 | 115.3 | 97.2 | 101.9 | 103.1 | 102.2 | |||
| m | 3.65–3.75 [4 ] | 1.55 | 82.3 | 81.4 | 88.2 | 85.2 | 84.3 | ||||
| n | 3.65–3.75 [5 ] | Ювенильный | |||||||||
| o | 3.65–3.75 [6 ] | 103.0 | 103.0 | 115.2 | 107.1 | ||||||
| p | 3.75–3.90 [1 ] | 90.9 | 82.2 | 89.6 | |||||||
| q | 3.75–3.90 [2 ] | Ювенильный | |||||||||
| r | 3.90–4.00 [1 ] | Сломан, окатан | |||||||||
Примечания. Обозначения зубов (m1) как на рис. 4. Показатели: SDQ = ebp/eba × 100 (enamel breadth posterior (ширина нижней эмали)/enamel breadth anterior (ширина верхней эмали)). T 1–5 – элементы m1. Bp 1–2 – углы задней петли m1.
Зубы степных пеструшек Lagurus lagurus встречены практически во всех условных горизонтах (1.7–16.7%), за исключением нескольких нижних. “Транзиенсные” морфотипы (I, II) составляют около 30% в общей выборке m1, а в совокупности с переходными (III) морфотипами составляют более половины от общего количества m1 вида в исследованных отложениях (табл. 4). Значимых отличий средней длины m1 (табл. 5) с разных глубин отложений не обнаружено (Шеффе тест). Зубы желтых пеструшек Eolagurus luteus (L m1: 3.15 [3 ] ; W m1: 1.2–1.35 [n = 3]) редки в исследованных отложениях (0.6–2.8%).
Таблица 4.
Морфотипы параконидного отдела первого нижнекоренного зуба (m1) Lagurus lagurus. Игнатиевская пещера (V, 2014). Южный Урал. 3.10−4.70 м
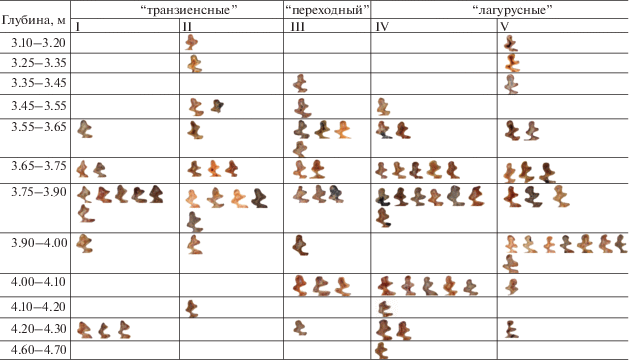
Таблица 5.
Промеры (мм) и доля “транзиенсных” морфотипов первых нижнекоренных зубов (m1) Lagurus lagurus
| Выборка | Промеры | Доля морфотипов I–II, % | |
|---|---|---|---|
| L m1 | W m1 | ||
| Lagurus lagurus1 | 2.52 ± 0.03 (2.25–2.90) [36] | 0.94 ± 0.01 (0.85–1.05) [34] | 34.3 |
| Lagurus lagurus2 | 2.54 ± 0.04 (2.45–2.70) [6 ] | 0.96 ± 0.03 (0.85–1.05) [6 ] | 21.1 |
| Lagurus lagurus3 | 2.61 ± 0.01 (2.20–3.02) [100]) | 0.89 ± 0.03 (0.72–1.02) [100] | 18 |
| Lagurus lagurus4 | 2.55 ± 0.06 (2.27–2.78) [9 ] | 0.92 ± 0.02 (0.85–1.00) [9 ] | 16.7 |
| Lagurus lagurus5 | 2.56 ± 0.02 (2.35–2.75) [25 ] | 0.91 ± 0.01 (0.82–1.02) [6 ] | 2.6 |
| Lagurus lagurus6 | 2.53 ± 0.01 [114] | – | 21.7 |
| Lagurus lagurus7 | 2.57 ± 0.01 [165] | – | 18.5 |
| Lagurus lagurus8 | 2.58 ± 0.01 [126] | – | 16.8 |
Примечания. Выборки: 1 Игнатиевская, раскоп V, 2014, слой 10 (глубина 3.25–4.00 м); 2 Игнатиевская раскоп V, 2014, слой 10 (глубина 4.00–4.30 м); 3 Первая половина среднего плейстоцена, Красный Яр, Южное Предуралье (по: Яковлев, 2015); 4 Вторая половина среднего плейстоцена, Груздевка, Южное Предуралье (по: Яковлев, 2015); 5 Поздний плейстоцен, Горнова, Южное Предуралье (по: Яковлев, 2015); 6 Конец среднего плейстоцена, Ница, Среднее Зауралье (по: Струкова, 2003); 7 Начало позднего плейстоцена, Мальково 1, Среднее Зауралье (по: Струкова, 2003); 8 Вторая половина позднего плейстоцена, Мальково 2, Среднее Зауралье (по: Струкова, 2003).
Зубы трех видов серых полевок были обнаружены по всей глубине отложений, и они являются самыми многочисленными среди зубов грызунов. Зубы узкочерепной полевки (Lasiopodomys gregalis) наиболее многочисленны среди идентифицированных остатков, доминируют во всех слоях (33.8–68.4%) и составляют более половины от количества всех зубов грызунов на глубине от 3.75 до 4.60 м. В выборках первых нижнекоренных зубов (m1) обнаружены зубы всех трех морфотипов: грегалоидного, грегалоидно-микротидного и микротидного (Ponomarev, Puzachenko, 2017). Грегалоидный морфотип преобладает среди m1 [n = 905 зубов] L. gregalis (рис. 5). Среднее значение длины m1 вида из верхней половины отложений достоверно больше (Шеффе тест) такового из нижней половины отложений (табл. 6). Зубы полевки-экономки (Microtus oeconomus) также относительно многочисленны в отложениях (4.7–26.1%). Этот вид и степная пеструшка занимают второе место после узкочерепной полевки по количеству зубов в отложениях. Так же как и в случае с зубами узкочерепной полевки тенденция к увеличению размера m1 со временем наблюдается и в зубах этого вида (табл. 6). Зубы темной полевки (Microtus agrestis) были обнаружены в отложениях в несколько меньших количествах (1.2–16.7%). Значения длин m1 (мм) с различной глубины не отличаются (табл. 6).
Рис. 5.
Соотношение морфотипов m1 Lasiopodomys gregalis. 3.10−5.20 м. Игнатиевская пещера (V, 2014).
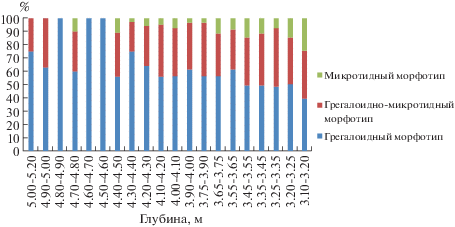
Таблица 6.
Длина (мм) первых нижних коренных зубов (m1) серых полевок из слоя 10 (Игнатиевская, раскоп V, 2014)
| Выборка | L m1 |
|---|---|
| Lasiopodomys gregalis1 | 2.64 ± 0.01 (2.30–3.30) [254] |
| Lasiopodomys gregalis2 | 2.58 ± 0.01 (2.20–2.90) [105] |
| Microtus oeconomus1 | 2.65 ± 0.02 (2.30–2.95) [63] |
| Microtus oeconomus2 | 2.60 ± 0.03 (2.35–2.85) [22 ] |
| Microtus agrestis1 | 2.83 ± 0.03 (2.50–3.20) [47] |
| Microtus agrestis2 | 2.90 ± 0.04 (2.70–3.15) [10 ] |
Хищные, копытные. Крупные млекопитающие представлены изолированными зубами и фрагментированными костями. Почти все они найдены в верхней половине отложений (табл. 1). Доминируют остатки хищных млекопитающих (659 экз.), из которых из-за сильной раздробленности многие определены только до рода. Наиболее многочислен волк (Canis lupus), значительно меньше песца (Vulpes lagopus), росомахи (Gulo gulo) и ласки (Mustela nivalis). Единичными остатками представлены горностай (Mustela erminea), малый пещерный медведь (Ursus svini), лисица (Vulpes vulpes) и пещерный лев (Panthera leo spelaea). Значительное количество костей медведей (Ursus sp.) и часть костей куньих (Mustela sp., Martes sp.) не определены до вида (табл. 1). Остатки копытных единичны – 7 экз., из которых до вида определена 1 кость архара (Ovis ammon). Остальные принадлежат животным не крупнее благородного оленя.
ОБСУЖДЕНИЕ
Наибольшее количество идентифицированных костных остатков было обнаружено на глубине от 3.25 до 4.10 м. Наибольшее видовое разнообразие (32–38 видов млекопитающих) отмечено в верхних изученных слоях (3.25–3.90 м) (табл. 1). Среди них преобладают зубы грызунов. Степные виды грызунов преобладают во всех горизонтах, но наибольшее их количество наблюдается на глубине 3.75–4.40 м. Остатки теплолюбивых видов млекопитающих (C. leucodon, D. nitedula, S. flavicollis) обнаружены в верхних горизонтах. В фауне землероек верхних условных горизонтов (3.10–3.75 м) доминируют S. araneus, S. minutissimis и S. minutus, а в нижних отложениях (3.75–4.90 м) видовой состав более бедный и доминирует S. tundrensis. Все эти данные позволяют сделать вывод, что верхние и нижние горизонты образовались при различных климатических условиях. Предположительно нижние горизонты сформировались в условиях более сухого климата с преобладанием открытых степных ландшафтов, а во время формирования верхних горизонтов (условно выше 4 м) климат, скорее всего, был более влажным и преобладали открытые ландшафты с примесью леса.
Доминирование среди костных остатков L. gregalis и L. lagurus не характерно для известных фаун Микулинского (Эемского) межледниковья с территории Урала, Восточно-Европейской равнины, Центральной – Западной Европы (Markova, Puzachenko, 2018). Однако видовой состав грызунов с преобладанием узкочерепных полевок и наличием D. nitedula, S. flavicollis/sylvaticus, леммингов зафиксирован в отложениях слоя 14 (пещера Бисник, Польша), отнесенных к границе между средним плейстоценом и поздним плейстоценом (Socha, 2014). В предыдущем исследовании (Смирнов и др., 1990) фаунистический комплекс отложений с глубин 3.10–4.0 м Игнатиевской пещеры был отнесен к заключительным этапам Микулинского межледниковья. Наши данные по составу фауны более глубоких слоев (4.0–5.20 м) доказывают, что климат во время их формирования был более сухим и холодным.
Степная пищуха обнаружена в составе фаун Северного, Среднего и Южного Урала в позднем плейстоцене – среднем голоцене, ископаемые останки северной пищухи были обнаружены только на Среднем Урале (Тетерина, 2001). Согласно нашему исследованию, мы не исключаем присутствие обоих видов в плейстоцене Южного Урала. Возможно, северная пищуха населяла Южный Урал в период, предшествующий позднему плейстоцену или в его начале. Однако временная изменчивость зубов степной пищухи до сих пор не изучена. Наши материалы могут стать дополнением к дальнейшим исследованиям истории распространения рода Ochotona в позднем плейстоцене.
Единичные зубы S. vulgaris (вида, связанного с лесными местами обитания) и D. nitedula (широколиственные леса) найдены в отложениях Игнатиевской пещеры. Костные остатки этих видов были обнаружены в местонахождениях Восточно-Европейской равнины и на Урале, которые датируются последним межледниковым периодом или близким к нему временем (Яхимович и др., 1988; Смирнов, 1993; Мотузко, 2007).
Значения SDQ m1 водяной полевки от 83.0 до 111.3 (среднее для всей выборки 96.7) соответствуют таковым из различных позднеплейстоценовых выборок A. terrestris из отложений местонахождений Европы (Kolfschoten, 1990). Среднее значение SDQ близко к таковым в выборках зубов водяных полевок из восточноевропейских микулинских местонахождений Красный Бор (Fadeeva et al., 2018) и Малютино, Чернянка, Новонекрасовка ((Markova, 2000). Считается, что значения SDQ около 100 характерны для эемских и самых ранних вислинских местонахождений (Koenigswald, Heinrich, 1999). По мнению Марковой (2006), тенденция к снижению значения SDQ от среднего к позднему плейстоцену очевидна, однако этот коэффициент не может быть единственным решающим аргументом в поддержку определенного возраста фауны позднего плейстоцена из-за значительного варьирования в пределах одной локальной территории. Эскуде (Escude et al., 2008) также не считает коэффициент SDQ надежным показателем для стратиграфической интерпретации. Размеры зубов вида ниже минимальных значений, указанных для современных полевок Южного Урала (Lm1 4.0−4.9 мм, Wm1 1.62−1.92 мм) и полевок из местонахождения Красный Бор (Lm1 4.0−4.7 мм, Wm1 1.60−2.02 мм) (Яковлев, 1992).
Доля зубов (m1) L. lagurus “транзиенсных” морфотипов в выборках из исследованных отложений Игнатиевской пещеры сравнительно высокая, превышает долю зубов вида с такими же морфотипами из местонахождения конца среднего плейстоцена Среднего Зауралья. Уменьшение числа примитивного морфотипа с 21.7 до 14.3% показано для зубов m1 вида с территории Среднего Зауралья с конца среднего плейстоцена до настоящего времени (Струкова, 2003). Размеры m1 пеструшек из отложений Игнатиевской пещеры мелкие, не изменяются в выборках с различных глубин. Эти размеры аналогичны таковым у m1 степных пеструшек из местонахождений второй половины среднего плейстоцена и позднего плейстоцена Южного Предуралья и Среднего Зауралья, но меньше, чем размеры m1 вида из южноуральского местонахождения “Красный Яр”, отнесенного к первой половине среднего плейстоцена (Яковлев, 2015).
Зубы (m1) L. gregalis с примитивным (“грегалоидным”) морфотипом преобладают в выборках из всех горизонтов. Доля зубов этого морфотипа увеличивается с глубиной. Длина первого нижнего моляра (m1) из нижних горизонтов (глубина 4.00–5.20 м) по t-критерию достоверно меньше, чем из верхних горизонтов (глубина 3.10–4.00 м). Частота “грегалоидного” морфотипа m1 L. gregalis в ископаемых выборках из местонахождений северо-востока европейской части России снижается (> 50 → ~ 20%) в период между 90–50 тыс. лет назад (MIS5b – MIS4) (Ponomarev, Puzachenko, 2017). Количество зубов с “грегалоидным” морфотипом преобладает и в выборках зубов из местонахождений Южного Зауралья в конце среднего – начале позднего плейстоцена (в местонахождении “Ница” (конец среднего плейстоцена) доля этого морфотипа составляет более 50%, в местонахождении “Мальково 1” (начало позднего плейстоцена) − около 50% (Струкова, 2003)). Тенденция увеличения длины жевательной поверхности первого нижнего моляра от конца среднего плейстоцена к первой половине позднего плейстоцена отмечена для m1 узкочерепных полевок Южного Зауралья (Струкова, 2003). Наши данные по динамике размерных показателей первого нижнекоренного зуба узкочерепной полевки из отложений Игнатиевской пещеры также иллюстрируют эту тенденцию.
Среди крупных млекопитающих наиболее многочисленны остатки интразональных видов (73%): C. lupus, V. vulpes, M. nivalis, M. erminea и G. gulo. Кости видов открытых и полуоткрытых ландшафтов: V. lagopus, U. savini, P. leo spelaea и O. ammon составляют 25%. Видам закрытых ландшафтов (Martes sp.) принадлежит 2% остатков. Такая структура согласуется с результатами анализа ландшафтно-биотопической приуроченности мелких млекопитающих.
ЗАКЛЮЧЕНИЕ
По результатам изучения костных остатков млекопитающих из двадцати условных горизонтов слоя 10 (Игнатиевская пещера, раскоп V, глубина от 3.10 до 5.20 м) были идентифицированы 21 вид грызунов, 3 – зайцеобразных, 4 – летучих мышей, 8 – насекомоядных млекопитающих, 8 хищных и 1 вид парнокопытного.
Анализ состава фауны мелких и крупных млекопитающих позволяет сделать вывод о том, что открытые и полуоткрытые ландшафты преобладали в окрестностях Игнатиевской пещеры в периоды формирования изученных отложений. Наибольшее видовое разнообразие млекопитающих, в числе которых имеются теплолюбивые виды – C. leucodon, D. nitedula, S. flavicollis, зафиксировано на глубинах 3.25–3.90 метра. В более глубоких слоях видовое разнообразие грызунов ниже, доля видов открытых пространств выше, кости лесных видов редки, количество костей насекомоядных млекопитающих очень мало. Среди костных остатков хищных млекопитающих нижних слоев преобладают кости медведей (в верхних слоях преобладают кости волка).
Геологический возраст фауны определяется морфологией зубов некоторых видов-индикаторов. Среди первых нижнекоренных зубов L. gregalis “грегалоидный” морфотип преобладает, и доля зубов с этим морфотипом очень высока в более глубоких слоях. Известно, что “грегалоидный” морфотип зубов составляет более 50% в ископаемых популяциях вида из местонахождений северо-востока (Северный Урал) в начале позднего плейстоцена. Средняя длина первого нижнего моляра этого вида увеличивается со временем, самые мелкие зубы обнаружены в нижней половине отложений. Зубы L. lagurus с примитивным (“транзиенсным”) морфотипом составляют около 30% всех первых нижних моляров (относительно высокая доля такого морфотипа характерна для зубов L. lagurus из отложений среднего плейстоцена Среднего Зауралья). Коэффициент дифференциации эмали первых нижних коренных зубов (m1) водяной полёвки изменялся в пределах 83.0–111.3 и составил в среднем 96.7 (n = 14). Это значение SDQ соответствует таковому A. terrestris из местонахождений конца среднего (Днепровский, Saalian, ИКС 6) и всего позднего плейстоцена (Микулино, Валдай, Eemian, Weichseliann, ИКС 5–2) Европы (Kalthoff et al., 2007; Markova, 2000).
На основании морфологических характеристик зубов грызунов и видового состава ископаемой фауны млекопитающих из слоя 10 время ее существования предположительно может быть отнесено к периоду от конца днепровского оледенения (конец изотопной кислородной стадии 6) до начала Микулинского (эемского) межледниковья (начало изотопной кислородной стадии 5e).
Список литературы
Агаджанян А.К., 2001. Пространственная структура позднеплейстоценовой фауны млекопитающих Северной Евразии // Археология, этнография и антропология Евразии. Т. 2. № 6. С. 2−19.
Агаджанян А.К., 2009. Мелкие млекопитающие плиоцена-плейстоцена Русской равнины // Труды Палеонтологического института РАН. Т. 289. С. 1−676.
Башенина Н.В., 2003. Морфологическая характеристика лесных мышей двух географически разобщенных популяций // Териофауна России и сопредельных территорий. Материалы международного совещания. Москва. С. 35.
Большаков В.Н., Васильева И.А., Малеева А.Г., 1980. Морфотипическая изменчивость зубов полевок. М.: Наука. 140 с.
Большаков В.Н., 1997. Мир млекопитающих // Природа Урала. Екатеринбург: Банк культурной информации. Вып. 4. С. 5–54.
Большаков В.Н., Орлов О.Л., Снитько В.П., 2005. Летучие мыши Урала. Екатеринбург: Академкнига. 176 с.
Бородин А.В., 2009. Определитель зубов полевок Урала и Западной Сибири (поздний плейстоцен−современность). Екатеринбург: УрО РАН. 100 с.
Бородин А.В., Коурова Т.П., Маркова Е.А., 2005. Размерные характеристики щечных зубов лесных полевок Clethrionomys (Craseomys) rufocanus, Cl. (Clethrionomys) glareolus, Cl. (Cl.) rutilus (Arvicolinae, Rodentia) и их использование для видовой идентификации // Зоологический журнал. Т. 84. С. 236−244.
Ербаева М.А., 1988. Пищухи кайнозоя. М.: Наука. 224 с.
Громов И.М., Ербаева М.А., 1995. Млекопитающие фауны России и сопредельных территорий. Зайцеобразные и грызуны СПб.: ЗИН РАН. 522 с.
Зайцев М.В., 1992. Насекомоядные млекопитающие позднего антропогена Южного Урала // История современной фауны Южного Урала. Свердловск. С. 61−80.
Колчева Н.Е., 2006. Заметки по морфологии и систематике лесной мыши, обитающей на Урале // Вестник ОГУ. № 4(54). С. 67−69.
Кузьмина И.Е., 1971. Формирование териофауны Северного Урала в позднем антропогене // Труды Зоол. института АН СССР. Т. 49. С. 44−122.
Лашкова Е.И., Дзеверин И.И. 2002. Одонтометрическая изменчивость и идентификация видов лесных мышей, Sylvaemus (Muridae, Rodentia), фауны Украины // Vestnik zoologii. V. 36. P. 25−33.
Маркова А.К., Кольфсхотен Т. ван, Бохнкке Ш., Косинцев П.А., Мол И., Пузаченко А.Ю., Симакова А.Н., Смирнов Н.Г., Верпоорте А., Головачев И.Б., 2008. Эволюция экосистем Европы при переходе от плейстоцена к голоцену (24 – 8 тыс. л.н.). Отв. ред. Маркова А.К, Т. Ван Кольфсхотен. Москва: Товарищество научных изданий КМК. 556 с.
Мотузко А.Н., 2007. Ископаемые остатки семейства Muridae антропогеновых отложений Беларуси и Литвы // Литосфера. № 2. С. 37−49.
Петрин В.Т., 1992. Палеолитическое святилище в Игнатиевской пещере на Южном Урале. Новосибирск: Наука. 207 с.
Пономарев Д.В., Исайчев К.И., Бикбаева Г.В., Кряжева И.В., 2011. Материалы к родовой диагностике леммингов Lemmus и Myopus // Вестник института геологии Коми научного центра Уральского отделения РАН. Сыктывкар. № 11. С. 10−11.
Смирнов Н.Г., 1993. Мелкие млекопитающие Среднего Урала в позднем плейстоцене и голоцене. Екатеринбург: Наука. 64 с.
Смирнов Н.Г., 2001. Зональное распределение млекопитающих в позднем валдае на Урале // Мамонт и его окружение. Отв. ред. Розанов А.Ю. М.: ГЕОС. С. 209−219.
Смирнов Н.Г., Большаков В.Н., Косинцев П.А., Панова Н.К., Коробейников Ю.И., Ольшванг В.Н., Ерохин Н.Г., Быкова Г.В., 1990. Историческая экология животных гор Южного Урала. Отв. ред. Смирнов Н.Г. Свердловск: УрО АН СССР. 244 с.
Смирнов Н.Г., Головачев И.Б., Бачура О.П., Кузнецова И.A., Чепраков M.И., 1997. Сложные случаи определения зубов грызунов из отложений позднего плейстоцена и голоцена тундровых районов Северной Евразии // Материалы по истории и современному состоянию фауны севера Западной Сибири. Челябинск: Рифей. С. 60−90.
Стефановский В.В., 2002. Литология и возраст спелеогенных образований Южного Урала // Уральский геологический журнал. Т. 6. С. 3−16.
Снитько В.П. 2005. Летние местообитания оседлых видов рукокрылых на Южном Урале // Plecotus et al. № 8. С. 43–53.
Струкова Т.В., 2003. Степная пеструшка (Lagurus lagurus Pall.) и узкочерепная полевка (Microtus gregalis Pall.) в четвертичных фаунах Среднего и Южного Зауралья. Дис. … канд. биол. наук. Екатеринбург: ИЭРиЖ УрО РАН. 128 с.
Тетерина А.А., 2001. Использование морфологического строения рmЗ при определении ископаемых остатков пищух из уральских местонахождений // Современные проблемы популяционной, исторической и прикладной экологии: Материалы конф. молодых ученых. Екатеринбург: Екатеринбург: ИЭРиЖ УрО РАН. С. 239−242.
Тетерина А.А. 2003. История фаун мелких млекопитающих Северного Урала в позднем плейстоцене и голоцене. Дис. … канд. биол. наук. Екатеринбург: ИЭРиЖ УрО РАН. 168 с.
Тиунов М.П., 1997. Рукокрылые Дальнего Востока России. Владивосток: Дальнаука. 134 с.
Шер А.В., 1971. Млекопитающие и стратиграфия плейстоцена крайнего северо-востока СССР и Северной Америки. Москва: Наука. 310 с.
Яхимович В.Л., Немкова В.К., Яковлев А.Г., 1988. Региональные подразделения новой стратиграфической схемы плейстоцена Предуралья и некоторые опорные разрезы. Уфа: БНЦ УрО РАН СССР. 65 с.
Яковлев А.Г., 1992. Морфологическое описание костных остатков нескольких видов полевок из плейстоценовых местонахождений Башкирского Предуралья // Флора и фауна кайнозоя Предуралья и некоторые аспекты магнитостратиграфии. Уфа. С. 70−92.
Яковлев А.Г., 2015. Морфологическая характеристика моляров степных пеструшек (Lagurus lagurus Pallas, 1773) из неоплейстоценовых местонахождений Южного Предуралья // Геологический сборник. № 12. С. 56−61.
Daoud A., 1993. Evolution of Gliridae (Rodentia, Mammalia) in the Pliocene and Quaternary of Poland // Acta Zoologica Cracoviensia. V. 36. P. 199–231.
Escude E., Montuire S., Desclaux E., Quere J., Renvoise E., Jeannet M., 2008. Reappraisal of ‘chronospecies’ and the use of Arvicola (Rodentia, Mammalia) for biochronology // Journal of Archaeological Science. V. 35. P. 1867−1879.
Fadeeva T. V., 2016. Insectivorous mammals (Lipotyphla, Soricidae) of the Perm Pre-Ural in the Late Pleistocene and Holocene time // Quaternary International. V. 420. P. 156–170.
Fadeeva T.V., Kosintsev P.A., Gimranov D.O., Yakovlev A.G., Gasilin V.V., Plasteeva N.A., Smirnov N.G., 2018. A Finding of the Red Squirrel (Rodentia, Sciuridae, Sciurus vulgaris Linnaeus, 1758) and Forest Dormouse (Rodentia, Gliridae, Dryomys nitedula Linnaeus, 1778) in the Pleistocene of the Southern Urals // Doklady Biological Sciences. V. 481. P. 160–162.
Heinrich W.D., 1978. Zur biometrischen Erfassung eines Evolutionstrends bei. Arvicola (Rodentia, Mammalia) aus dem Pleistoziin Thtiringes // Siiugertierkund Information. V. 2. P. 3−21.
Kahlke R.-D., 1994. Die Entstehungs-, Entwicklungs- und Verbreitungsgeschichte des oberpleistozänen Mammuthus - Coelodonta- Faunenkomplexes in Eurasien (Grossäuger) // Abhandlungen der Senckenbergischen Naturforschenden Gesellschaft. Frankfurt am Main. V. 546. P. 1−164.
Kalthoff D.C., Mörs T., Tesakov A., 2007. Late Pleistocene small mammals from the Wannenköpfe volcanoes (Neuwied Basin, Germany) with remarks on the stratigraphic range of Arvicola terrestris // Geobios. V. 40. P. 609−623.
Koenigswald W., Heinrich W.-D., 1999. Mittelpleistozane Saugetierfaunen aus Mitteleuropa – der Versuch einer biostratigraphischen Zuordnung // Darmstadter Beitrage zur Naturgeschichte. V. 9. P. 53−112.
Kolfschoten T.v., 1990. The evolution of the mammal fauna in the Netherlands and the middle Rhine Area (Western Germany) during the late Middle Pleistocene // Mededelingen Rijks Geologische Dienst. V. 43. P. 1–69.
Kowalski K., 1995. Taphonomy of bats (Chiroptera) // Geobios. V. 18. P. 251−256.
Markova A., Puzachenko A., 2018. Preliminary Analysis of European Small Mammal Faunas of the Eemian Interglacial: Species Composition and Species Diversity at a Regional Scale // Quaternary. V. 1. P. 1−21.
Markova A.K., 2000. The Mikulino (Eemian) mammal faunas of the Russian Plain and Crimea // Geologie en Mijnbouw/ Netherlands Journal of Geosciences. V. 79. P. 293–301.
Markova A.K., 2006. Likhvin Interglacial small mammal faunas of Eastern Europe // Quaternary International. V. 149. P. 67−79.
Markova A., Puzachenko A., 2018. Preliminary analysis of european small mammal faunas of the eemian interglacial:species composition and species diversity at a regional scale // Quaternary. V. 1. № 2. P. 1−21.
Meulen A.J. van der, 1973. Middle Pleistocene smaller mammals from the Monte Pegalia (Orvieto, Italy) with special reference to the phylogeny of Microtus (Arvicolidae, Rodentia) // Quaternaria. V.17. P. 1−144.
Ponomarev D., Puzachenko A., Isaychev K., 2015. Morphotypic variability of masticatory surface pattern of molars in the recent and Pleistocene Lemmus and Myopus (Rodentia, Cricetidae) of Europe and Western Siberia // Acta Zoologica. V. 96. P. 14–29.
Ponomarev D., Puzachenko A., 2017. Changes in the morphology and morphological diversity of the first lower molar of narrow-headed voles (Microtus gregalis, Arvicolinae, Rodentia) from northeastern European Russia since the Late Pleistocene // Quaternary International. V. 436. P. 239–252.
Rekovets L., Nadachowski A., 1995. Pleistocene Voles (Arvicolidae) of the Ukraine // Paleontologia i evolutio. T. 28/29. P. 145−245.
Smirnov N.G., Kosintsev P.A., Stefanovsky V.V., 2014. Karst caves of the Southern Urals: Quaternary deposits, paleoenvironment, dating and archaeological heritage of Ignatievskaya Cave // The Quaternary of the Urals. Global trends and Pan-European Quaternary records: Fieldtrip Guide-book of the International INQUA-SEQS Conference (Ekaterinburg, September 10-16, 2014). Ekaterinburg: IPAE UrB RAS. P. 42–49.
Smirnov N.G., Kosintsev P.A., Kuzmina E.A., Izvarin E.P., Kropacheva Yu.E., 2014. The Ecology of Quaternary Mammals in the Urals // Russian Journal of Ecology. V. 45. № 6. P. 449−455.
Socha P., 2014. Rodent palaeofaunas from Biśnik Cave (Krakow-Częstochowa Upland, Poland): palaeoecological, palaeoclimatic and biostratigraphic reconstruction // Quaternary International. V. 326−327. P. 64–81.
Stuart A.J., Lister A.M., 2011. Extinction chronology of the cave lion Panthera spelaea. Quaternary Science Reviews. V. 30. P. 2329–2340.
Zaitsev M.V., 1998. Late Anthropogene Insectivora from the South Urals with a Special Reference to Diagnostics of Red-Toothed Shrews of the Genus Sorex // Quaternary Paleozoology in the Northern Hemisphere. V. 27. P. 145−158.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


