Зоологический журнал, 2020, T. 99, № 7, стр. 728-744
Тридцатилетняя динамика биомассы некоторых видов литоральных сообществ в двух небольших губах Кандалакшского залива (Белое море)
О. Н. Савченко a, *, А. Д. Наумов a, **
a Зоологический институт РАН
199034 Санкт-Петербург, Россия
* E-mail: olga_nks@mail.ru
** E-mail: andrewnmv@gmail.com
Поступила в редакцию 25.11.2019
После доработки 10.01.2020
Принята к публикации 09.03.2020
Аннотация
Исследования литорального бентоса в двух небольших губах Кандалакшского залива ведутся ежегодно с весны 1987 г. по настоящее время и охватывают все гидрологические сезоны: весну, лето, осень и зиму. Работы ведутся на фиксированных точках, организованных в виде разрезов от нижней до средней или верхней литорали. За все время наблюдений применялись единые стандартизованные методы сбора и обработки полученного материала. Изучена многолетняя динамика биомассы семи основных видов при помощи методов компонентной фильтрации и динамического фазового портрета. На протяжении времени наблюдений структура изученных сообществ изменялась, что выражалось в направленных тенденциях к росту основной временно́й переменной биомассы отдельных видов или же к ее снижению. Обнаружена зависимость между главными трендами биомасс некоторых видов и главным трендом температуры поверхностного слоя воды в губе Чупа. Кроме того, в одной из исследованных губ время от времени такие изменения были спровоцированы аномальными условиями схода льда. Анализ других выявленных временны́х переменных позволил обнаружить у всех видов квазициклические изменения биомассы. Продолжительность квазициклов в большинстве случаев близка к 4–6 годам, но может различаться у разных видов. Кроме того, даже для одного вида в разных губах и на разных уровнях литорали одной губы они асинхронны и не коррелируют с квазициклической динамикой температуры и солености поверхностных вод. Названные особенности рассматриваемой динамики позволяют предположить, что они не индуцируются внешними факторами, а представляют собой автоколебательные процессы.
В последние годы изучение временны́х изменений в морских сообществах становится все более актуальной задачей (Maximov, 2015; Beukema et al., 1996, 2001; Poggiale, Dauvin; 2001; Clare et al., 2015; Rousi et al., 2013; Sukhotin et al., 2015; Максимов, 2018; и др.). Это хорошо заметно и по работам, которые проводятся на Белом море (Луканин и др., 1986; Бурковский, 2006; Наумов, 2006, 2007; Наумов и др., 2017; Naumov, 2013; Халаман, Наумов, 2009; Лайус и др., 2013; Усов, 2015; Козминский, 2017).
Исследования многолетней динамики позволяют приблизиться к пониманию природы надорганизменных систем и получить ответ о границах их устойчивости. Актуальность этих вопросов растет в связи с возрастающей антропогенной нагрузкой на природные системы, но подобные исследования пока еще не очень многочисленны, т. к. достаточно трудоемки и требуют регулярных длительных наблюдений. Проведенные к настоящему времени работы дают основания предполагать, что в природных сообществах идут сложные процессы, обусловленные как внешними, так и внутренними, аутогенными, причинами, а динамика этих процессов представляет собой сложное сочетание как направленных, так и квазициклических, а также стохастических изменений. Отмеченные особенности проявляются и на уровне целых сообществ, и на уровне отдельных видов, в них входящих.
Мониторинговые исследования в двух губах Кандалакшского залива ведутся сотрудниками Беломорской биостанции ЗИН РАН с целью изучения характера многолетней динамики литоральных сообществ, а также причин, его определяющих (Федяков, Шереметевский, 1991; Naumov, 2009; Varfolomeeva, Naumov, 2013; Naumov et al. 2014; Савченко, Наумов, 2017). Мониторинг был организован на строго фиксированных точках и в фиксированное время, что позволяет уменьшить дисперсию данных и более четко выявить процессы, идущие в сообществах и в популяциях отдельных видов. Применяющиеся нами методы пробоотбора наравне с другими аналогичными исследованиями послужили основой для разработки рекомендаций по организации мониторингов (Азовский, 2018).
Полученные нами регулярные ряды данных практически не имеют аналогов. Что же касается зимних наблюдений на литорали в морях со стабильным ледоставом, то авторам такие исследования не известны.
Необходимо отметить, что изучаемые нами сообщества не подвержены серьезному антропогенному прессу и могут рассматриваться как ненарушенные системы, имеющие естественную динамику. Это дает возможность считать их эталонными.
Основная задача настоящей работы состоит в изучении квазициклических аутогенных осцилляций биомассы, которые наблюдаются в поселениях ведущих видов, обитающих на беломорской илисто-песчаной литорали.
МАТЕРИАЛЫ И МЕТОДЫ
Материал для настоящего исследования был собран в двух губах в окрестностях Беломорской биологической станции мыс Картеш (ЗИН РАН). В процессе работы из семи требований, предъявляемых Азовским (2018, стр. 330) к “идеальной” модели пробоотбора с целью выявления многолетней динамики, не соблюдено только одно: “условия среды (и состояние объекта) между съемками неизменны”. Причины понятны: и условия среды, и состояние (биомасса) объектов постоянно менялись. Результирующая динамика обилия массовых видов как раз и послужила предметом настоящего исследования.
Работы были начаты в 1987 г. и продолжаются по настоящее время. В обеих губах были заложены стандартные фиксированные станции по четыре в каждой губе в виде разрезов, по одному на каждой (рис. 1, табл. 1), для точной привязки каждой станции на берегу были установлены створы.
Рис. 1.
Схема расположения разрезов. Основа – навигационная карта “Подходы к губам Чупа и Кереть. № 1110. 1970 г.” 1–4 – номера станций.
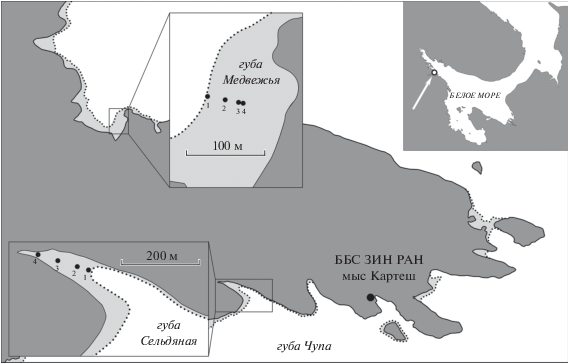
Таблица 1.
Координаты станций, расстояния, высоты и время осушения
| Губа | № станции | Широта (с.ш.) | Долгота (в.д.) | Расстояние от станции 1, м |
Уровень над гидрографическим нулем, м | Среднее время осушения (ч и мин) в течение одного приливного цикла (половина приливных суток) |
|---|---|---|---|---|---|---|
| Медвежья | 1 | 66°21.085′ | 33°35.782′ | 0 | 0.22 | 0 ч 00 мин |
| 2 | 66°21.082′ | 33°35.811′ | 23 | 0.46 | 2 ч 24 мин | |
| 3 | 66°21.081′ | 33°35.831′ | 40.5 | 0.65 | 3 ч 48 мин | |
| 4 | 66°21.081′ | 33°35.841′ | 46.5 | 0.79 | 4 ч 54 мин | |
| Сельдяная | 1 | 66°20.277′ | 33°37.311′ | 0 | 0.42 | 1 ч 54 мин |
| 2 | 66°20.285′ | 33°37.275′ | 30 | 0.73 | 4 ч 30 мин | |
| 3 | 66°20.293′ | 33°37.216′ | 82.2 | 0.98 | 6 ч 06 мин | |
| 4 | 66°20.304′ | 33°37.137′ | 135.2 | 1.13 | 7 ч 54 мин |
Разметка стандартных точек пробоотбора была проведена В.В. Федяковым глазомерно в мае 1987 г. В 2017 г. Е.А. Голиковой и Д.А. Аристовым их расположение было уточнено нивелирной съемкой. При проведении этих работ были измерены расстояния между стандартными станциями и была выполнена оценка их высот относительно нижнего уровня сизигийного прилива. Измерения были выполнены при помощи оптического нивелира с компенсатором RGK C–20. Точность нивелирной съемки составляла ±5 мм по высоте и ±0.5 м по расстоянию.
Привязка к гидрографическому нулю глубин в день проведения наблюдений была выполнена авторами с использованием свободно распространяемой программы WXTide32 4.7 (погрешность ресурса составляет ±0.1 м) и данных трехмесячных уровневых наблюдений с точностью 1 мм, полученных ранее А.Д. Наумовым и И.Н. Бахметом в Кривозерской губе, где расположена Беломорская биостанция ЗИН РАН, при помощи мареографов Solinst 3001, а также с опорой на поправки высот уровня стояния полных и малых вод относительно основного пункта Кемь–порт (Таблицы приливов, 1990). Учитывая, что реальный уровень воды в день наблюдений может отличаться от рассчитанного из-за сгонно-нагонных явлений, атмосферного давления и ряда других причин, а погрешность поправок по основному пункту равна приблизительно ±0.1 м, не следует считать полученные данные строгими в гидрографическом отношении, однако в сравнительном аспекте они вполне надежны, и различия между расположением стандартных станций в обеих губах можно считать достаточно точными.
Для изучения ежесуточных приливно-отливных движений был установлен указанный выше автоматический мареограф. При помощи полученных таким способом данных среднее время осушения с поправкой на сгонно-нагонные явления на различных уровнях литорали было рассчитано по усредненной за 3 месяца приливной волне с точностью до 6 мин. Более точное вычисление погрешности сроков осушения затруднено из-за наличия астрономических (суточных, полумесячных и параллактических) неравенств, которые в нашем случае не все были измерены со всей необходимой точностью из-за краткого времени наблюдений. Результаты приведены в табл. 1.
Топографическая характеристика полигонов
Губа Медвежья открыта на северо-северо-восток и представляет собой водоем почти прямоугольной формы размером около 300 м (ширина) и около 200 м (длина) (рис. 1). Берега губы сложены смешанным каменисто-песчаным и несколько заиленным грунтом (Федяков, Шереметьевский, 1991). Протяженность открытого водного пространства (расстояние от устьевой части губы до ближайших островов) около 700 м. Разрез из четырех станций расположен на песчаном грунте восточного берега губы. Длина разреза 46.5 м. Первая станция, самая нижняя, расположена вблизи устья ручья, вытекающего из близлежащего верхового болота. По данным 1988–1989 гг. (Федяков, Шереметьевский, 1991), наиболее удаленная от уреза воды в отлив четвертая станция была расположена в литоральной ванне, несколько ниже, чем третья. Нивелирная съемка 2017 г. показала, что четвертая станция находится на 14 см выше третьей и, таким образом, расположена наиболее высоко. Возможно, за время, прошедшее с начала мониторинга, произошли изменения профиля осушной полосы. Общий перепад уровня между крайними точками (первой и четвертой) составляет около 0.5 м (табл. 1). В соответствии с тем, на каком уровне находится та или иная станция на литорали, изменяется и время осушения.
Губа Сельдяная расположена на северном берегу губы Чупа и представляет собой открытую в юго-восточном направлении, постепенно суживающуюся к куту, узкую бухту протяженностью около 400 м. На входе берега сложены валунной россыпью, ближе к куту сменяющейся илистым пляжем. Станции расположены вдоль русла небольшого ручья, впадающего в кутовую часть губы, где ширина илистой осушной зоны достигает 150 м. Русло ручья может год от года менять свое положение. Длина разреза составляет 136 м. Перепад уровня между крайними станциями около 0.7 м (табл. 1).
Состав грунта
Анализ грунта, проведенный в начале исследований в 1988 г. (Федяков, Шереметевский, 1991), показал, что в Медвежьей губе на литорали преобладают хорошо промытые слабообводненные осадки с преобладанием песчаных фракций, а в Сельдяной губе – насыщенные водой илистые алевритовые грунты, содержащие большое количество гниющих растительных остатков.
Гидрологические условия
По данным Федякова и Шереметевского (1991), соленость поверхностных вод в губе Медвежьей в летнее время зависит от стадии приливного цикла. Во время отлива за счет стока ручья прибрежные воды опресняются до 11‰. Во время дождя опреснение может быть еще больше – до 9‰. Во время прилива морские воды подпруживают пресный сток и соленость возрастает до 22–24‰.
В губе Сельдяной бóльшее влияние на соленость оказывают атмосферные осадки. В дождливую погоду соленость падает до 16‰ на прибылой воде. Во время отлива опреснение еще сильнее – до 10‰. В ясную погоду соленость повышается до 23 и 18‰ соответственно.
В зимнее время за счет аккумуляции пресной воды подо льдом соленость в обеих губах может снижаться до 5‰ и ниже (наши данные).
По нашим данным, летние температуры воды и в Медвежьей и в Сельдяной губах достигают 14–16°C, а зимой снижаются до –0.9°C. Время начала ледостава зависит от погодных условий и год от года сильно варьирует. По наблюдениям авторов, это может происходить довольно рано – в октябре, а может задерживаться и до февраля. В целом же, за счет более сильного пресного стока в губе Медвежьей лед встает примерно на неделю раньше.
Отсутствие валунного бара в обеих губах приводит к тому, что лед в зимнее время на малой воде ложится непосредственно на грунт. Это может приводить к вмораживанию верхних слоев донных осадков в толщу подвижной полосы припая. В губе Медвежьей это явление не отмечалось, тогда как в губе Сельдяной фиксировалось неоднократно. В марте 2013 г. на стандартных станциях 1 и 2 в губе Сельдяной нами были взяты ледовые керны площадью 1/154 м2. При толщине льда 55 см на первой станции слой вмерзшего грунта достигал 25 см. На второй станции при толщине льда около 54 см соответственно 18–20 см.
Во время схода льда при определенных условиях, например в ветреную погоду, вся масса льда может единовременно выноситься из губы вместе с верхним слоем грунта и всеми находящимися в нем организмами. Это явление по нашим визуальным наблюдениям имело место в губе Сельдяной в 1988, 1994, 1998, 1999, 2002, 2005, 2006 и 2007 гг. (Naumov, 2013). В последующие годы подобные эпизоды также происходили, что косвенно прослеживается по резкому уменьшению биомасс всех видов, но визуальные наблюдения проведены не были.
Методика пробоотбора
Отбор проб проводили четыре раза в год, охватывая все гидрологические сезоны: весну (конец мая–начало июня), лето (конец июля–начало августа), осень (конец октября–начало ноября) и зиму (конец марта–начало апреля). На каждой станции брали по три повторности. Каждую повторность отбирали с помощью трех вложенных один в другой пробоотборников с разной рабочей площадью (м2): 0.004, 0.0076, 0.0153. Пробоотборники заглубляли на глубину 10–15 см. Полученные образцы промывали на колонке почвенных сит с размерами ячеи 0.5, 1.0 и 3.0 мм. Животных размером 0.5–1 мм выбирали из первого пробоотборника, размером 1–3 мм из первых двух пробоотборников и размером крупнее 3 мм – из всех трех орудий. Организмы из каждой фракции определяли до вида, за исключением представителей родов Gammarus, Monoculodes, типа Nemertea и некоторых водорослей. Затем все организмы считали, подсушивали на фильтровальной бумаге до такой степени, когда они переставали оставлять влажный след [поверхностно-сухой вес, по терминологии Азовского (2018)], и взвешивали с точностью до 0.001 г. Моллюсков взвешивали с раковиной и мантийной жидкостью, полихет – без домиков. Для макрофитов определяли только вес. Данные всех трех фракций приводили к 1 м2, объединяли и обрабатывали как единую пробу.
Математические методы
Для анализа материала были использованы методы линейной статистики (нулевую гипотезу во всех случаях отвергали на доверительном уровне P1 = 0.95).
Анализ временны́х рядов среднегодовых значений биомасс был проведен методом компонентной фильтрации (Colebrook, 1978; Ibanez, Dauvin, 1988; Наумов, 2006), который можно считать аналогом сингулярного спектрального анализа. Для выравнивания дисперсии во всех случаях исходные ряды биомасс были прологарифмированы. Суть метода состоит в расчете матрицы автокорреляций, которую затем подвергают компонентному анализу. Результатом этих вычислений являются числовые последовательности значений факторов, представляющие собой различные тренды, или временны́е переменные. Для основной временно́й переменной (главного тренда) были рассмотрены: доля объясненной дисперсии полученного ряда и характер изменений на всем протяжении периода наблюдений. Обнаружены также относительно короткие квазициклы различной длины. Наиболее длинные из них чаще всего имеют продолжительность 4–6 лет. Основными характеристиками таких колебаний можно считать долю объясненной дисперсии и продолжительность цикла. То же самое относится и к коротким квазициклам длительностью обычно 2–3 года. В большинстве случаев этот квазицикл объясняет сравнительно небольшую долю общей дисперсии исходного ряда, но, в некоторых случаях, она может быть сравнима и даже превышать таковую длинного квазицикла. При этом и главный тренд иногда имеет циклический характер, хотя на имеющемся материале нет возможности достаточно точно определить период таких колебаний.
Для анализа общего характера динамики биомассы был использован метод динамического фазового портрета. Суть метода заключается в том, что состояние сколь угодно сложной системы изображают образующей точкой в фазовом пространстве или пространстве параметров, а эволюцию системы – перемещением этой точки, или ее траекторией. В случае динамического фазового портрета по оси абсцисс откладывают значения изменяющегося параметра, а по оси ординат скорость таких изменений (Айламазян, 1989; Терещенко, 2009). Существуют некоторые характерные паттерны, или виды фазовых портретов (Ризниченко, 2011). Наиболее часто встречаются устойчивый и неустойчивый фокусы и предельный цикл. Фокус представляет собой относительно регулярную спираль. Если траектория системы стремится к центральной точке – это устойчивый фокус, характерный для затухающих колебаний. Если же траектория системы, напротив, стремится от центральной точки – состояние неустойчивое, амплитуда колебаний нарастает. В случае предельного цикла образующая точка обращается в окрестности некоего воображаемого эллипса. На коротких временах она то приближается к нему, то удаляется, не выходя, однако, за границы определенной области в его окрестности. Предельный цикл – это устойчивое состояние, характерное для режима автоколебаний, т.е. таких осцилляций, параметры которых устанавливаются внутренними механизмами системы (Андронов и др., 1981). В данной работе рассматривается сложение главного тренда и длинного квазицикла, что позволяет охарактеризовать общую динамику системы за вычетом короткопериодических, в т.ч. стохастических флуктуаций.
Все полученные данные занесены в интегрированную информационную систему “Marine benthos”, которую разрабатывает группа специалистов, в т.ч. и авторы настоящей статьи (Зародов и др., 2017).
РЕЗУЛЬТАТЫ
За все время исследования в губе Медвежьей зафиксирована в целом 91 форма донных организмов, из которых до вида определены 73, а в Сельдяной, соответственно, – 87 и 69. В обеих губах при этом их количество уменьшается с удалением от гидрографического нуля глубин (табл. 2).
Таблица 2.
Количество видов и их встречаемость
| Губа | Станция | Общее число видов за все время исследования | Среднее число видов на станции за съемку | Число видов, встреченных | |
|---|---|---|---|---|---|
| менее чем в 10% съемок | приблизительно в 70−80% съемок | ||||
| Медвежья | М1 | 79 | 16 | 49 (62) | 7 (9) |
| М2 | 61 | 14 | 33 (54) | 4 (7) | |
| М3 | 56 | 11 | 36 (64) | 4 (7) | |
| М4 | 54 | 13 | 32 (59) | 5 (9) | |
| Сельдяная | С1 | 77 | 17 | 51 (65) | 8 (10) |
| С2 | 58 | 16 | 29 (49) | 7 (12) | |
| С3 | 55 | 14 | 26 (47) | 5 (9) | |
| С4 | 53 | 11 | 23 (44) | 4 (7) | |
Примечания. Здесь и далее М – станции в Медвежьей губе, С – станции в Сельдяной губе. Цифры соответствуют номерам избранных точек (рис. 1). В скобках – доля от общего числа обнаруженных форм, %.
Для рассмотрения многолетней динамики взяты виды, встречаемость которых на всех станциях не менее 70–80%. Число этих видов составляет менее 10% от общих видовых списков. В обеих губах это Hydrobia ulvae (Pennant 1777), Macoma balthica (Linnaeus 1758), Tubificoides benedeni (d’Udekem 1855). Динамика названных видов рассматривается на всех станциях. Кроме того, рассмотрена динамика характерного для Медвежьей губы вида Scoloplos armiger (Müller 1776) и обычного в губе Сельдяной Chironomus salinarius (Kieffer 1915).
Проанализирована также динамика обилия еще двух видов, играющих роль эдификаторов – Zostera marina (Linnaeus 1753) и Cladophora sericea (Hudson) (Kützing 1843). Их встречаемость на части станций не достигает 70%, однако, названные макрофиты оказывают значительное влияние на многолетнюю динамику сообщества всей осушной полосы обеих губ. Поэтому необходимо их рассматривать наравне с перечисленными ранее формами. При этом для компонентного разложения динамики названных макрофитов на тренды взяты только первые станции, где встречаемость этих видов отвечает выбранному критерию. На остальных станциях в обеих губах обилие зостеры и кладофоры крайне невелико (вплоть до полного их отсутствия в некоторых пробах), что неизбежно должно искажать результаты анализа и вынуждает отказаться от использования метода компонентной фильтрации.
Встречаемость и средние биомассы выбранных для рассмотрения видов приведены в табл. 3.
Таблица 3.
Встречаемость основных видов и их средние биомассы со статистической погрешностью в изученных губах
| Станция | Zostera marina | Cladophora sericea | Hydrobia ulvae | Macoma balthica | Tubificoides benedeni | Scoloplos armiger | Chironomus salinarius | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| P | W | P | W | P | W | P | W | P | W | P | W | P | W | |
| М1 | 81 | 272.24 ± 29.15 | 68 | 53.60 ± 12.95 | 100 | 50.57 ± 5.01 | 99 | 11.97 ± 0.93 | 91 | 4.04 ± 0.58 | 94 | 6.14 ± 0.56 | 20 | 0.07 ± 0.03 |
| М2 | 51 | 83.03 ± 7.26 | 61 | 19.67 ± 2.60 | 100 | 31.44 ± 6.45 | 98 | 12.84 ± 3.79 | 74 | 0.44 ± 0.57 | 97 | 6.15 ± 2.74 | 10 | 0.02 ± 0.07 |
| М3 | 9 | 2.50 ± 1.28 | 38 | 6.99 ± 2.58 | 100 | 27.83 ± 2.78 | 100 | 17.23 ± 1.07 | 78 | 0.54 ± 0.08 | 91 | 3.74 ± 0.47 | 5 | 0.01 ± 0.00 |
| М4 | 9 | 0.57 ± 0.34 | 45 | 10.85 ± 4.20 | 100 | 60.67 ± 3.55 | 100 | 33.27 ± 1.99 | 100 | 4.30 ± 0.45 | 86 | 6.04 ± 0.67 | 26 | 0.11 ± 0.03 |
| С1 | 92 | 767.98 ± 89.47 | 86 | 268.69 ± 32.44 | 99 | 148.34 ± 11.22 | 100 | 53.61 ± 4.19 | 100 | 23.16 ± 1.26 | 3 | 0.01 ± 0.01 | 98 | 6.24 ± 0.55 |
| С2 | 71 | 223.29 ± 31.50 | 54 | 64.77 ± 12.99 | 99 | 66.53 ± 4.14 | 97 | 40.48 ± 3.64 | 99 | 10.86 ± 0.99 | 2 | 0.01 ± 0.01 | 92 | 2.77 ± 0.34 |
| С3 | 36 | 15.94 ± 4.50 | 41 | 22.26 ± 5.96 | 97 | 42.59 ± 3.50 | 98 | 37.15 ± 2.40 | 96 | 4.21 ± 0.60 | 0 | – | 86 | 2.72 ± 0.46 |
| С4 | 13 | 1.29 ± 0.72 | 40 | 18.3 ± 5.04 | 97 | 30.02 ± 2.57 | 84 | 18.44 ± 2.00 | 51 | 0.22 ± 0.08 | 1 | 0.01 ± 0.01 | 76 | 3.74 ± 0.65 |
В течение всего периода исследований в структуре сообществ происходили изменения. В губе Медвежьей с начала 2000-х гг. наблюдается увеличение биомасс большинства видов. На самой нижней станции значительно возрастает биомасса Zostera marina, этот вид становится доминантом и его биомасса во многих случаях на порядок превышает суммарную биомассу остальных видов. В это же время зостера распространяется на вторую станцию, где до начала 2000-х гг. доминантом был вид Mytilus edulis (Linnaeus, 1758). С этого момента эти два вида становятся здесь содоминантами. На третьей и четвертой станциях четкое доминирование какого-либо вида не выражено. Тем не менее, здесь можно выделить преобладающие по биомассам формы. На третьей станции это Hydrobia ulvae, ювенильные экземпляры Arenicola marina (Linnaeus 1758) и M. edulis, которые затем сменяются комплексом H. ulvae, Macoma balthica и M. edulis. На четвертой станции в губе Медвежьей по биомассе преобладает H. ulvae, с середины 90-х гг. содоминантом становится Mac. balthica.
В губе Сельдяной на нижней станции доминирующее положение занимает Zostera marina. В качестве субдоминантов можно выделить Cladophora sericea и Hydrobia ulvae. Вторая станция испытывает периодические нарушения во время выноса льда (Naumov, 2013), при этом происходит частичная элиминация доминирующего вида, в качестве которого здесь также выступает Z. marina. Виды с наибольшими биомассами на второй станции – Z. marina, Mya arenaria (Linnaeus 1758), C. sericea, Macoma balthica, H. ulvae и Ruppia maritima (Linnaeus 1753). На третьей и четвертой станциях доминирование не выражено. Преобладающие по биомассе виды на третьей станции – Mya arenaria, Mac. balthica, H. ulvae. На четвертой – H. ulvae и C. sericea. С конца 90-х гг. к ним добавляется Mac. balthica и, с 2005 г., Alitta virens (M. Sars 1835). В некоторые годы к ним добавляется Ruppia maritima.
Многолетняя динамика основных видов
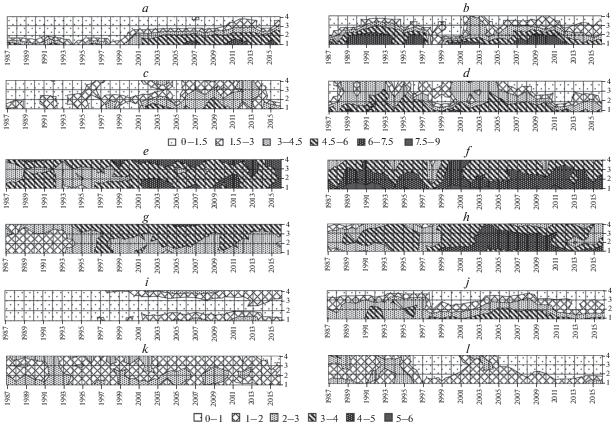
Zostera marina в губе Медвежьей постоянно встречается только на первой, самой нижней станции, где с начала 2000-х гг. ее биомасса существенно возрастает, и она становится доминантом. Если до 2000 г. среднегодовые биомассы в среднем составляли около 100 г/м2, то с 2000-х гг. эти значения уже достигают 400 г/м2. В это же время зостера распространяется на вторую станцию. На двух верхних станциях отмечены эпизодические находки с очень небольшими биомассами, возможно, представляющие собой занос. График динамики логарифма биомассы зостеры на четырех станциях представлен на рис. 2a.
Рис. 2.
График поверхности логарифма биомасс Zostera marina в губах Медвежьей (a) и Сельдяной (b), Cladophora sericea в губах Медвежьей (c) и Сельдяной (d), Hydrobia ulvae в губах Медвежьей (e) и Сельдяной (f), Macoma balthica в губах Медвежьей (g) и Сельдяной (h), Tubificoides benedeni в губах Медвежьей (i) и Сельдяной (j), Scoloplos armiger в губе Медвежьей (k) и Chironomus salinarius в губе Сельдяной (l). По осям абсцисс – время, годы; по осям ординат – номера станций. Разной заливкой обозначены диапазоны значений логарифмов биомасс, ln г/м2.
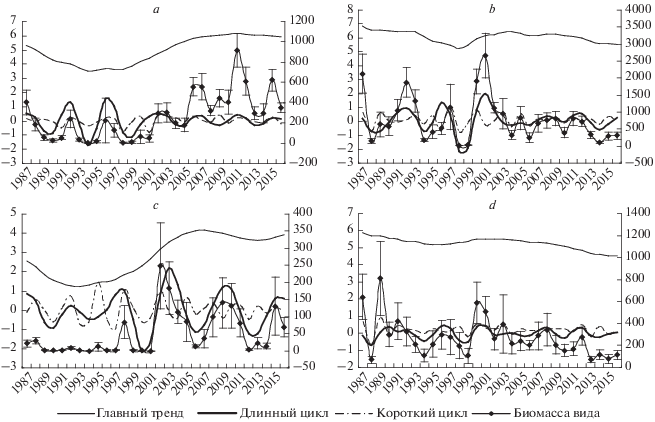
Результат компонентной фильтрации ряда логарифмов биомасс Zostera marina на станции 1 в губе Медвежьей представлен на рис. 3a. Главный тренд объясняет 50% дисперсии ряда и имеет характер длинной пологой волны с периодом около половины времени исследования, т.е. порядка 15 лет. Кроме того, выделяется циклическая составляющая продолжительностью 4–6 лет (в среднем около пяти), объясняющая 20.9% общей дисперсии ряда. Существенный рост биомассы зостеры с начала 2000-х гг. сопровождается заметным снижением амплитуды колебаний этой циклической составляющей. На короткопериодический цикл приходится 28.6% общей дисперсии ряда.
Рис. 3.
Результат фильтрации ряда логарифмов биомасс Zostera marina, губа Медвежья, станция 1 (a), губа Сельдяная, станция 1 (b) и Cladophora sericea, губа Медвежья, станция 1 (c), губа Сельдяная, станция 1 (d). По осям абсцисс – время, год; по осям ординат слева – разложение биомассы в отклонениях от предыдущей оси максимального варьирования, по осям ординат справа – исходная биомасса вида, г/м2.
В губе Сельдяной Zostera marina практически постоянно встречается на двух первых станциях, хотя ее биомасса существенно снижается в годы вмерзаний и весенних выносов льда (рис. 2b).
На первой станции основной тренд показывает медленное неравномерное снижение биомассы и объясняет всего 17% дисперсии (рис. 3b). При этом выражен 4–5-летний цикл (61% объясненной дисперсии), амплитуда которого имеет тенденцию уменьшаться с начала 2000-х гг. Короткопериодические тренды объясняют 22.1% дисперсии ряда.
Фазовые портреты сложения главного тренда и длинного квазицикла динамики Zostera marina на первых станциях в обеих губах представлены на рис. 4.
Рис. 4.
Динамические фазовые портреты суммы главного тренда и длинного (основного) цикла Zostera marina в губах Медвежьей, станция 1 (a) и Сельдяной, станция 1 (b) и Cladophora sericea в губах Медвежьей, станция 1 (c) и Сельдяной, станция 1 (d). По осям абсцисс – логарифм биомассы; по осям ординат – скорость ее изменения. Направление движения траектории – по часовой стрелке, начало обозначено жирной точкой.
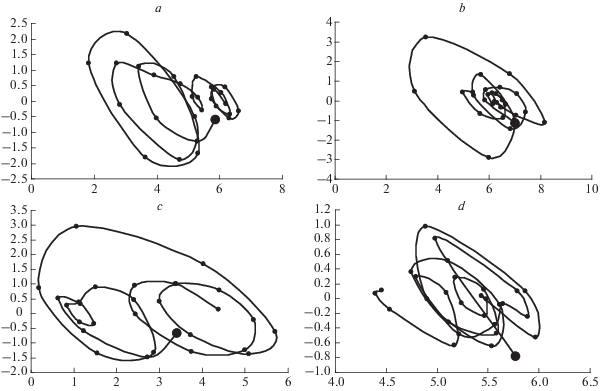
На первой станции в губе Медвежьей динамический фазовый портрет имеет характер неустойчивого фокуса, переходящего в предельный цикл с резким уменьшением амплитуды колебаний (рис. 4a). При этом смещение траектории соответствует общему росту биомассы, описываемому главным трендом.
В губе Сельдяной в целом фазовый портрет имеет характер предельного цикла, но с нарушениями (рис. 4b). Время от времени биомасса резко возрастает на короткое время, что приводит к увеличению радиуса витков фазовой траектории образующей точки. Это соответствует моментам потери системой устойчивости и ее восстановления после аномального выноса льда.
Cladophora sericea – нитчатая зеленая водоросль, обычный вид для беломорской литорали. По мнению некоторых авторов, это однолетняя форма. Например, Возжинская (1986) выделяет однолетнюю ассоциацию C. sericea + Pylaiella litoralis + Ectocarpus confervoides. В работе Володиной и Герб (2013) также указывается, что C. sericea − однолетний вид. Между тем, по нашим данным кладофора в живом виде в изобилии присутствует в конце марта, т.е. в самом разгаре зимнего гидрологического сезона, и ее обилие в целом не снижается даже в последних числах июня, в конце гидрологической весны. Возможно, это вид не однолетний.
В губе Медвежьей наблюдается рост биомассы кладофоры на всех станциях с начала 2000-х гг., хотя с 2014 г. наметилась тенденция к ее уменьшению. Наибольшее обилие зафиксировано на нижней станции. С увеличением высоты станции биомасса снижается. В Сельдяной губе она присутствует постоянно, хотя в годы аномального выноса льда ее обилие падает. Наибольшие биомассы этой нитчатой водоросли отмечены на нижней станции. С 2010 г. наблюдается снижение биомассы этого вида на всех станциях.
Результат фильтрации ряда логарифмов биомасс Cladophora sericea на первой станции в губе Медвежьей представлен на рис. 3c. Главный тренд объясняет 41% дисперсии ряда и имеет характер длинной пологой волны с периодом около 20 лет. Циклическая составляющая (24.4%) имеет период около 5–7 лет. Резкое увеличение биомассы сопровождается ростом амплитуды колебаний. На короткопериодические тренды приходится 34.4% общей дисперсии ряда.
В губе Сельдяной главный тренд (31%) описывает медленное пологое снижение биомассы (рис. 3d). Циклическая составляющая (30.9%) имеет период 4 года и практически постоянную амплитуду на протяжении времени исследования. Короткопериодические циклы в целом объясняют 38.3% дисперсии ряда.
На фазовом портрете в губе Медвежьей наблюдается смена предельного цикла через момент неустойчивости (рис. 4c). В губе Сельдяной фазовый портрет системы имеет характер сильно нарушенного предельного цикла, сдвигающегося в сторону уменьшения биомассы (рис. 4d).
Динамика видов Hydrobia ulvae, Macoma balthica и Tubificoides benedeni рассмотрена на всех восьми станциях. Помимо этого, исследована динамика характерного для губы Медвежьей вида Scoloplos armiger и для губы Сельдяной вида Chironomus salinarius.
Собирающий детритофаг Hydrobia ulvae – один из наиболее массовых видов брюхоногих моллюсков, характерных для илистой и илисто-песчаной литорали. Macoma balthica – массовый вид двустворчатых моллюсков, обитающий в верхнем слое грунта. По типу питания собирающий детритофаг, но при определенных условиях может становиться фильтратором. Tubificoides benedeni – представитель класса олигохет. Питается детритом. Scoloplos armiger – представитель класса многощетинковых червей, обычный вид для илисто-песчаной литорали и верхней сублиторали. Chironomus salinarius – характерная для опресненных участков литорали личинка комаров семейства Chironomidae.
В губе Медвежьей для видов Hydrobia ulvae, Macoma balthica и Tubificoides benedeni наблюдается рост биомассы с конца 90-х–начала 2000-х гг. (рис. 2e, 2g, 2i). Для H. ulvae и T. benedeni наибольшие значения зафиксированы на верхней и нижней станциях, биомасса Mac. balthica выше на третьей и четвертой станциях. В губе Сельдяной обилие всех трех видов выше на нижних станциях, но при этом происходит резкое снижение биомассы в годы аномального выноса льда с последующим ее восстановлением (рис. 2 f, 2h, 2j). Для Scoloplos armiger за время исследования наблюдается незначительное снижение биомассы (рис. 2l). В сообществе губы Сельдяной этот вид встречается единично. Chironomus salinarius характерен для губы Сельдяной, где на всех станциях, за исключением первой, наблюдается снижение биомассы (рис. 2k). Для губы Медвежьей этот вид не является массовым. Средние за все время исследования биомассы представлены в табл. 3.
Результаты разложения рядов логарифма биомассы указанных видов по методу компонентной фильтрации представлены для обеих губ в табл. 4. Динамические фазовые портреты суммы главного тренда и длинного квазицикла – на рис. 5.
Таблица 4.
Характеристики главного тренда, а также длинного и короткого квазициклов по станциям
| Тренд | Губа Медвежья | Губа Сельдяная | ||||||
|---|---|---|---|---|---|---|---|---|
| станция 1 | станция 2 | станция 3 | станция 4 | станция 1 | станция 2 | станция 3 | станция 4 | |
| Hydrobia ulvae | ||||||||
| ГТ | 53.0, б/вт, 1 ВМА (≈18) | 51.0, рост, 2 ВМА (≈10) | 52.0, рост | 31.0, б/вт | 23.0, б/вт, 2 ВМА (≈10) | 27.0, б/вт, 2 ВМА (≈15) | 12.0, б/вт | 31.2, б/вт, 2 ВМА (≈11) |
| ДКЦ | 33.5 (5−6 ) | 17.6 (5−8) | 15.2 (5−7) | 37.9 (3−5) | 25.4 (5−6) | 44.0 (3−4) | 57.8 (4−8) | 50.6 (5−6) |
| ККЦ | 10.6 | 31.7 | 32.6 | 29.2 | 51.8 | 29.3 | 30.2 | 18.0 |
| Macoma balthica | ||||||||
| ГТ | 68.0, рост, 2 ВМА (≈12) | 72.0, б/вт, 1 ВБА (≈30) | 80.0, рост, плато | 90.0, рост, 1 ВБА (≈30) | 86.0, рост, плато | 62.0, рост, 2 ВМА (≈12) | 59.0, б/вт, 2 ВМА (≈12) | 62.0, рост, 3 ВМА (≈10) |
| ДКЦ | 12.2 (4−5) | 22.1 (6−8) | 16.5 (5−6) | 6.5 (5−6) | 8.3 (7–8) | 22.3 (5–6) | 25.3 (5−7) | 25.8 (9–10) |
| ККЦ | 19.7 | 6.2 | 3.7 | 3.6 | 3.9 | 15.6 | 15.9 | 11.9 |
| Tubificoides benedeni | ||||||||
| ГТ | 73.0, рост, 1 ВБА (≈30) | 60.0, рост, 1 ВБА (≈30) | 73.0, рост | 96.0, рост, 1 ВБА (≈30) | 52.0, б/вт, 1 ВМА (≈20) | 88.0, б/вт, 2 ВБА (≈12) | 70.0, б/вт, 2 ВБА (≈12) | 47.0, рост, 2 ВМА (≈14) |
| ДКЦ | 11.3 (5−6) | 21.2 (5−7) | 12.3 (5) | 2.1 (4−5) | 27.7 (5) | 8.0 (3−4) | 8.1 (5−7) | 23.2 (5) |
| ККЦ | 15.4 | 18.3 | 14.5 | 1.7 | 20.3 | 4.0 | 21.4 | 30.0 |
| Scoloplos armiger | ||||||||
| ГТ | 46.0, спад, 1 ВМА (≈16) | 25.0, спад, ВМА (≈15) | 9.4, б/вт, 1 ВМА (3–4) | 46.0, спад, 2 ВМА (≈15) | – | – | – | – |
| ДКЦ | 38.2 (4–5) | 33.3 (5–6) | 54.7 (4–6) | 16.9 (5–6) | – | – | – | – |
| ККЦ | 15.3 | 41.6 | З5.9 | 36.8 | – | – | – | – |
| Chironomus salinarius | ||||||||
| ГТ | – | – | – | – | 34.0, б/вт | 55.0, спад, 2 ВБА (≈12) | 56.0, спад, 2 ВБА (≈11) | 67.0, спад, 2 ВБА (≈11) |
| ДКЦ | – | – | – | – | 25.0 (6–7) | 34.0 (6–8) | 37.7 (5) | 27.5 (6–7) |
| ККЦ | – | – | – | – | 40.6 | 11.0 | 6.0 | 5.6 |
Примечания. Для главного тренда (ГТ) указаны: доля объясненной дисперсии, %; общая тенденция – рост, спад или без выраженной тенденции (б/вт); количество и характер волн: ВМА – волна малой амплитуды, ВБА – волна большой амплитуды. Для длинного квазицикла (ДКЦ): доля объясненной дисперсии, %, и длина волны. Для короткого квазицикла (ККЦ) – доля объясненной дисперсии, %. Во всех случаях в скобках – период волны.
Рис. 5.
Динамические фазовые портреты суммы главного тренда и длинного квазицикла. По осям абсцисс – логарифм биомассы, по осям ординат – скорость его изменения. Направление движения траектории – по часовой стрелке, начало обозначено жирной точкой.
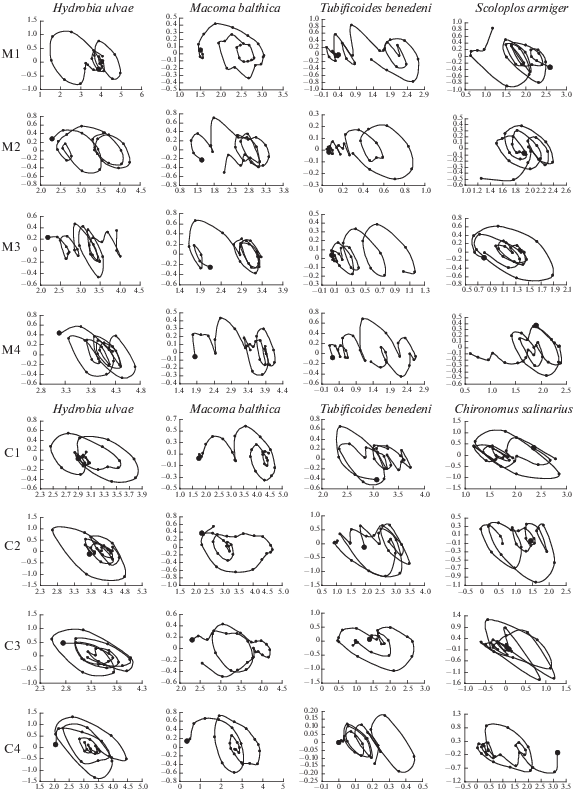
Hydrobia ulvae. В губе Медвежьей главный тренд на первой станции имеет характер длинного цикла с периодом около 18 лет, на второй этот цикл выражен слабее, а на третьей и четвертой станциях практически не выражен. Тенденция к общему росту биомассы прослеживается только на второй и третьей станциях. Длинный квазицикл имеет период около 5–6 лет, немного сокращаясь на четвертой станции. Вклад длинного квазицикла в суммарную дисперсию ряда снижается от первой к третьей, снова увеличиваясь на четвертой. Короткий цикл, напротив, с высотой станции становится более значимым (табл. 4). Динамический фазовый портрет суммы основного тренда и длинного квазицикла на первой, второй и четвертой станциях показывает переход от одного предельного цикла к другому (рис. 5).
В губе Сельдяной на первой, второй и третьей станциях главный тренд имеет две волны малой амплитуды. Длинный квазицикл имеет период около 5 лет, его вклад (как и вклад короткого квазицикла, значимость которого максимальна на нижних станциях) уменьшается с высотой станции (таб. 4). Фазовый портрет имеет характер нестабильного предельного цикла с периодически возникающими эллипсами большого радиуса. Система балансирует между двумя состояниями, характерными для нарушенного и восстановленного биотопа (рис. 5).
Macoma balthica. В губе Медвежьей вклад главного тренда растет с высотой станции, достигая на самой верхней станции 90%. Его поведение различно. На первой станции он имеет характер двух волн со слабо выраженной амплитудой, на второй и четвертой – волна с периодом около 30 лет, на третьей станции – волнообразный рост с выходом на плато. Период длинного квазицикла в среднем около 5–6 лет (табл. 4). Фазовый портрет на первой станции представляет собой сходящийся фокус, на остальных станциях – соответствует смещению системы в сторону увеличения биомассы с формированием предельного цикла (рис. 5).
В губе Сельдяной наибольший вклад в дисперсию главный тренд вносит на первой станции. Здесь рост имеет характер пологой волны с выходом на плато. На остальных станциях вклад в дисперсию меньше – около 60%, и в главном тренде выделяются 2 волны около 12 лет на второй и третьей станциях и 3 волны с периодом порядка 10 лет на четвертой станции. Фазовые портреты интерпретируются с трудом (рис. 5).
Tubificoides benedeni. В губе Медвежьей главный тренд на всех станциях имеет характер пологой волны. Вклад длинного квазицикла в целом небольшой – максимум 21% дисперсии исходного ряда на второй станции. Продолжительность – около пяти лет (табл. 4). Фазовые портреты показывают смещение системы в сторону увеличения биомассы через ряд промежуточных состояний (рис. 5).
В губе Сельдяной на первой станции главный тренд имеет характер пологой волны очень небольшой амплитуды. На остальных станциях – 2 выраженные волны с периодом 12–14 лет. Длинный квазицикл на средних станциях вносит всего 8% вклада в суммарную дисперсию ряда, на крайних станциях это значение достигает 23–27%. Период около 5 лет (табл. 4). Фазовые портреты интерпретируются с трудом (рис. 5).
Scoloplos armiger. В губе Медвежьей главный тренд имеет волнообразный характер с периодом около 15 лет. Период длинного квазицикла – около пяти лет (табл. 4). Фазовые портреты в целом имеют характер предельного цикла, при этом идет смещение, отражающее начавшееся общее снижение биомассы (рис. 5).
В губе Сельдяной вид сравнительно редок.
Chironomus salinarius. В губе Сельдяной главный тренд имеет волнообразный характер, с длиной волны 11–12 лет. Длинный квазицикл на первой станции имеет период 3–4 года, с высотой удлиняясь в среднем до шести (табл. 4). На фазовых портретах, особенно на нижних станциях, прослеживается смена состояний, характерных для нарушенного и ненарушенного сообщества (рис. 5).
В губе Медвежьей встречается единично и не на всех станциях.
Кроме того, была исследована зависимость колебаний биомасс основных видов от динамики температуры и солености поверхностного слоя воды в губе Чупа11. Были рассчитаны корреляции между главными трендами биомассы и температуры, а также между циклическими трендами биомассы и температуры. При этом учитывалось возможное запаздывание реакции биоты на динамику абиотических факторов, для чего корреляции рассчитывались как без смещения, так и со смещением с шагом 1 год за несколько лет. В губе Медвежьей для всех исследованных видов, за исключением Scoloplos armiger, прослеживаются значимые положительные корреляции между главными трендами биомассы вида и главным трендом температуры (рассматриваются только корреляции не меньше 0.5). Для S. armiger обнаружены отрицательные корреляции между главными трендами биомассы и температуры на первой, второй и четвертой станциях. В губе Сельдяной положительные корреляции между главными трендами температуры и биомассы видов обнаружены для следующих видов: Hydrobia ulvae на третьей и четвертой станциях, Macoma balthica и Tubificoides benedeni на первой и четвертой станциях. В то же время обнаружены отрицательные корреляции с главным трендом температуры для T. benedeni на второй и третьей станциях, для Cladophora sericea и Zostera marina на первой станции.
Между квазициклическими 5-летними трендами биомасс видов в обеих губах и циклическим трендом температуры надежные корреляции не обнаружены.
Так же была исследована синхронность колебаний биомасс одного и того же вида на разных станциях. В губе Медвежьей значимые корреляции между циклическими составляющими обнаружены для Macoma balthica на третьей и четвертой станциях и для Scoloplos armiger на первой и третьей станциях. В губе Сельдяной положительные корреляции от 0.4 до 0.8 обнаружены для Hydrobia ulvae на всех станциях, для M. balthica на третьей и четвертой станциях и для Chironomus salinarius на третьей и четвертой станциях.
Связь динамики биомассы видов с многолетней динамикой солености поверхностного слоя воды не обнаружена.
ОБСУЖДЕНИЕ
Циклические процессы в популяциях животных широко распространены в природе и описывались целым рядом авторов. Всем известен классический пример корреляции колебаний численности зайцев и рыси по данным регистрации количества отстрелов Компанией Гудзонова залива (Бигон и др., 1989).
Помимо этого известны 4–4.5-летние и 9–13-летние циклы в популяциях мелких млекопитающих (Максимов, Ердаков, 1985), циклы разной продолжительности у непарного шелкопряда (Колтунов, Ердаков, 2013). Отмечены они и для водных организмов (Лайус и др., 2013). Аналогичные процессы описаны также в пелагических и донных морских сообществах, у планктонных организмов (Усов, 2015), взморника Zostera marina (Наумов, 2007), многощетинковых червей (Халаман, Наумов, 2009), некоторых моллюсков (Луканин и др., 1986; Козминский, 2017; Аристов, 2017; Наумов и др., 2017), бокоплава Monoporeia affinis (Максимов, 2018) и т.д. Такая цикличность может распространяться на целые экосистемы, приводя даже к регулярной смене доминирующих видов (Бурковский, 2006).
Обращает на себя внимание тот факт, что продолжительность квазициклов (согласно данным, приведенным в упомянутых трудах) составляет чаще всего либо 4–6, либо 10–13 лет.
Существуют разные гипотезы, объясняющие наличие квазицикличности. Факторами, вызывающими колебания обилия тех или иных видов, а также различных генеральных характеристик целых сообществ, могут быть изменения климата (Бурковский, 2006), в том числе колебания Северо-Атлантического (NAO) и Арктического (AO) индексов (Максимов, 2012), особенности биотопа (Максимов, Ердаков, 1985), особенности жизненных циклов отдельных видов (Козминский, 2017; Наумов и др., 2017) и т.п.
Как уже говорилось, на наших данных обнаруживаются три типа временны́х переменных: главный тренд, основной цикл (4−6 лет), короткоциклические составляющие (2−3 года).
Главный тренд показывает основное направление изменчивости обилия отдельных видов. В губе Медвежьей практически для всех видов он имеет характер пологой волны с периодом около половины времени наблюдения. При этом прослеживается общая тенденция роста биомассы, исключение составляет Scoloplos armiger. В то же время в губе Сельдяной возникают две волны. Особенно это выражено на второй и третьей станциях, наиболее подверженных нарушениям, связанным с апериодическими ледовыми аномалиями (Naumov, 2013). При этом минимумы приходятся на годы с весенними ветровыми выносами льда по малой воде.
Короткоциклические составляющие на нашем материале – это циклы с периодом 2−3 года, как правило, отражающие стохастические процессы в системе (Ibanez, Dauvin, 1988). Вклад этой составляющей в общую динамику зависит, по-видимому, от ряда факторов. Для некоторых видов с увеличением высоты, на которой расположена станция на литорали, доля ее дисперсии возрастает. Это может означать, что чем выше расположена станция, тем менее стабильны на ней условия (например, за счет более продолжительного времени осушения). Кроме того, циклы с периодом 2−3 года, возможно, могут отражать процессы, связанные со взаимодействием различных генераций или с миграциями. Так, для активно перемещающихся видов, таких как гидробия, стохастические составляющие выражены сильнее. Не исключено, что сравнительно низкие значения этих составляющих на второй и третьей станциях в губе Сельдяной, объясняются тем, что аномальные ледовые явления хоть и вносят деструктивный элемент, но, тем не менее, представляют собой направленный (детерминированный) процесс, снижающий стохастическую изменчивость. В то же время на первой станции в Сельдяной вклад короткопериодической компоненты – наибольший (до 50%). С одной стороны, здесь условия наиболее стабильные, с другой – она в большой степени подвергается воздействию аномальных ледовых выносов. Возможно, здесь происходит взаимодействие двух достаточно сильных, но разнонаправленных процессов – стабилизирующего и дестабилизирующего. Более подробное рассмотрение стохастической изменчивости – тема самостоятельного исследования.
Наибольший интерес представляют циклы с периодом около пяти лет, обнаруженные нами для большинства беспозвоночных, а также кладофоры и зостеры. Эта периодичность нарушается в сообществе губы Сельдяной в результате апериодического зимнего вмерзания грунта и аномальных весенних выносов льда (Naumov, 2013). В период с конца 1980-х гг. такие явления наблюдались с периодичностью 4 года, и на нижних станциях, наиболее подверженных этим нарушениям, циклы гидробионтов также становятся близкими к четырем годам. При этом на верхних станциях 5-летний цикл сохраняется.
За небольшим исключением квазициклы одного и того же вида асинхронны на разных станциях. С увеличением высоты станции на литорали они укорачиваются примерно на год. Это, возможно, связано с уменьшением биомасс видов, для которых условия становятся менее благоприятными с увеличением продолжительности периода осушения. Собственная квазицикличность наиболее полно реализуется на нижних станциях, где биомасса сравнительно выше. В Сельдяной синхронность колебаний может быть вызвана нарушениями, затрагивающими все сообщество.
Амплитуда колебаний меняется с изменением биомассы. При низких значениях биомассы амплитуда колебаний сравнительно ниже. С ростом биомассы амплитуда колебаний, как правило, растет. Дальнейший рост биомассы снова может приводить к уменьшению размаха колебаний, что может быть связано с наложением разных генераций.
Природа автоколебаний может быть различна. Вероятно, есть целый комплекс механизмов, генерирующих подобную динамику. Например, в работе Максимова (2018) показаны зависящие от плотности популяции 6–7летние циклы колебаний обилия рачка Monoporeia affinis в Финском заливе (Балтийское море), связанные с внутривидовой конкуренцией за пищу. Циклические изменения численности Littorina fabalis на Девичьих лудах вблизи о-ва Ряжков (Кандалакшский залив, Белое море) возникают как результат чередования периодов с высоким и низким воспроизводством, что, в свою очередь, также регулируется внутривидовой конкуренцией за пищевые ресурсы (Козминский, 2017).
В ненарушенном сообществе губы Медвежьей в большинстве случаев главные тренды биомасс основных видов коррелируют на уровне не менее 0.5 с главным трендом многолетних изменений температуры поверхностного слоя воды. В губе Сельдяной положительные корреляции между главными трендами биомасс и главным трендом температуры обнаружены только для некоторых видов на станциях, наименее подверженных ледовым выносам. Возможно, общий рост биомассы, наблюдаемый в течение периода исследования, связан со среднегодовым повышением температуры, хотя этот рост не превышает 2°C за время наблюдений (по данным группы планктонологов ББС ЗИН РАН).
Между циклическими составляющими биомасс видов и среднегодовой температуры надежных корреляций не обнаружено. Смещение рядов данных, учитывающее возможное запаздывание реакции биоты на температуру, также не показало значимой связи.
Динамические фазовые портреты для видов в губе Медвежьей имеют характер предельного цикла или последовательности предельных циклов со смещением траектории, что показывает общее увеличение биомассы через ряд последовательных витков, отражающих колебания. В Сельдяной губе картина оказывается не настолько определенной – нарушения сказываются на динамике видов. Для многих видов фазовый портрет отражает два состояния – сообщество после нарушения и восстановленное сообщество. В то же время смещение траектории иллюстрирует общее снижение биомассы.
По нашему мнению, циклы продолжительностью около пяти лет отражают автоколебательные процессы в системе, генерируемые внутренними механизмами самой системы. Автоколебания представляют собой устойчивый динамический режим, фазовый портрет которого имеет характер предельного цикла. Выход за пределы этого аттрактора (области притяжения траектории), наблюдаемый при изменениях биомассы, означает нарушение устойчивости системы. Затем система восстанавливает динамический режим и, соответственно, устойчивость при новых параметрах, с формированием нового предельного цикла. При этом может меняться объем занимаемого фазового пространства. Но, в случае если биомасса падает ниже критического уровня, предельный цикл переходит в устойчивый фокус. При этом амплитуда колебаний существенно уменьшается и имеет тенденцию к затуханию. Это означает, что внутренних ресурсов системы не хватает для поддержания устойчивой автоколебательной динамики. Периодические нарушения в губе Сельдяной из-за аномальных ледовых условий приводят к резкому уменьшению обилия видов. Структура сообщества восстанавливается к концу текущего сезона. При этом для восстановления биомассы нужно более продолжительное время (Naumov, 2013). И идущие подряд (либо с коротким промежутком времени) нарушения, которые мы наблюдаем в последнее время, не позволяют системе восстановиться. Таким образом, если для такого рода систем нормой функционирования является автоколебательная динамика, описываемая предельным циклом, то выход за пределы этого аттрактора может означать потерю устойчивости. В случае, если это происходит при увеличении биомассы, система адаптируется и через некоторое время устанавливается новый предельный цикл с другими параметрами. Если же это происходит на фоне снижения биомассы – у сообщества или популяции возникает дефицит ресурсов, необходимых для поддержания подобного рода динамики.
Итак, хотя общий характер квазициклических осцилляций обилия видов на разных уровнях литорали сходен, сами эти циклы в большинстве случаев не совпадают по времени. Поиск связи с квазицикликой абиотических факторов, таких, как соленость или летняя температура поверхностного слоя воды (по данным декадной станции), показывает, что и эти колебания не синхронны. Продолжительность циклов колебаний солености и температуры иная. Это независимые процессы, у каждого из которых есть свои собственные механизмы, требующие дальнейшего исследования.
Скорее всего, это означает, что обнаруженные периодические изменения не вызваны воздействием внешних факторов и представляют собой автоколебательные процессы. На данном этапе, во всяком случае, мы не находим фактов, позволяющих отвергнуть это предположение.
Список литературы
Азовский А.И., 2018. Анализ многолетних рядов биологических данных: методологические проблемы и возможные подходы // Журнал общей биологии. Т. 79. № 5. С. 329–341.
Айламазян А.К., 1989. Информатика и теория развития. А.К. Айламазян, Е.В. Стась. М.: Наука. 174 с.
Андронов А.А., Витт А.А., Хайкин С.Э., 1981. Теория колебаний. М.: Наука. 918 с.
Аристов Д.А., Генельт-Яновский Е.А., Назарова С.А., 2017. Долговременные изменения размерной структуры литоральных поселений Macoma balthica Linnaeus в окрестностях ББС ЗИН РАН (Мыс Картеш) // Изучение, рациональное использование и охрана природных ресурсов Белого моря. Материалы конференции. СПб. 2017. С. 9−11.
Бигон М., Харпер Дж., Таунсенд К., 1989. Экология. Особи, популяции и сообщества. 2 т. Пер. с англ. М.: Мир. 477 с.
Бурковский И.В., 2006. Морская биогеоценология. Организация сообществ и экосистем. М.: Товарищество научных изданий КМК. 285 с.
Возжинская В.Б., 1986. Донные макрофиты Белого моря. М.: Наука. 192 с.
Володина А.А, Герб М.А., 2013. Макрофиты прибрежной зоны российского сектора Юго-Восточной части Балтийского моря (Калининградская область) // Известия КГТУ. Сер. Биологические и сельскохозяйственные науки. № 38. С. 129–135.
Зародов А.Ю., Наумов А.Д., Савченко О.Н., 2017. “Marine Benthos” – интегрированная информационная система нового типа // Изучение, рациональное использование и охрана природных ресурсов Белого моря. Материалы конференции. СПб. 2017. С. 89−91.
Козминский Е.В., 2017. Внутривидовая конкуренция как причина изменений численности популяции у беломорских моллюсков Littorina obtusata (Gastropoda: Littorinidae) // Изучение, рациональное использование и охрана природных ресурсов Белого моря. Материалы конференции. СПб. 2017. С. 112−114.
Колтунов Е.В., Ердаков Л.Н., 2013. Спектральный анализ многолетней динамики вспышек массового размножения непарного шелкопряда (Lymantria dispar L.) на Урале // Современные проблемы науки и образования. № 2. [Электронный ресурс]. Режим доступа: https://science-education.ru/ru/article/view?id= 8625
Лайус Д.Л., Иванова Т.С., Шатских Е.В., Иванов М.В., 2013. “Волны жизни” беломорской колюшки // Природа. № 4. С. 43–52.
Луканин В.В., Наумов А.Д., Федяков В.В., 1986. Цикличность развития поселений Mytilus edulis (L.) в Белом море //Федяков В.В., Луканин В.В. (ред.). Экологические исследования донных организмов Белого моря. Л. С. 50−63.
Максимов А.А., 2012. Многолетняя изменчивость климатических факторов и динамика сообществ донных животных // Алимов А.Ф. и Голубков С.М. (ред.) Динамика биологического разнообразия и биоресурсов континентальных водоемов. СПб. С. 126–138.
Максимов А.А., 2018. Межгодовая и многолетняя динамика макрозообентоса на примере вершины Финского залива. СПб.: Нестор-История. 260 с.
Максимов А.А., Ердаков Л.Н., 1985. Циклические процессы в сообществах животных (биоритмы, сукцессии). Новосибирск: Наука: Сибирское отделение. 236 с.
Наумов А.Д., 1991. К вопросу об изучении биоценозов макробентоса Белого моря // Бентос Белого моря. Популяции, биоценозы, фауна. Труды Зоологического института. Т. 233. Л. С. 127–147.
Наумов А.Д., 2006. Двустворчатые моллюски Белого моря. Опыт эколого-фаунистического анализа // Исследования фауны морей. Т. 59 (67). СПб. 367 с.
Наумов А.Д., 2007. Многолетние исследования литорального бентоса Белого моря в губе Чупа (Кандалакшский залив): сезонная и многолетняя динамика биомассы взморника Zostera marina // Комплексные исследования процессов, характеристик и ресурсов российских морей Северо-Европейского бассейна. Вып. 2. Апатиты. С. 493−502.
Наумов А.Д., Савченко О.Н., Аристов Д.А., Биягов К.Л., 2017. Десятилетие наблюдений над литоральным бентосом на акватории морского специализированного порта Витино (Северная часть Кандалакшского залива, Белое море): методологические подходы // Зоологический журнал. Т. 96. № 12. С. 1464–1481.
Ризниченко Г.Ю., 2011. Лекции по математическим моделям в биологии. М.–Ижевск: издательство “РХД”. 560 с.
Таблицы приливов, 1990. Т. 1. Воды европейской части СССР. 248 с.
Терещенко В.Г., 2009. Изменение видового разнообразия сообществ гидробионтов как динамический процесс // Вісник Дніпропетровського університету. Біологія. Екологія. Вип. 17. Т. 1. С. 217–225.
Усов Н.В., 2015. Сезонная и многолетняя динамика обилия зоопланктона в прибрежной зоне Кандалакшского залива Белого моря в связи с изменениями температуры воды. Автореф. дис. … канд. биол. наук. СПб.: Зоологический институт. 26 с.
Федяков В.В., Шереметевский А.М., 1991. Характеристика биоценозов илисто-песчаной фации литорали района мыса Картеш (Кандалакшский залив, Белое море) // Труды Зоологического института. Т. 233. С. 148–157.
Халаман В.В., Наумов А.Д., 2009. Многолетняя динамика массовых видов полихет в сообществах обрастания Белого моря // Биология моря. Т. 35. № 6. С. 410–419.
Beukema J.J., Dekker R., Essink K., Michaelis H., 2001. Synchronized reproductive success of the main bivalve species in the Wadden Sea: causes and consequences // Marine Ecology Progress Series. V. 211. P. 143–155.
Beukema J.J., Essink K., Michaelis H., 1996. The geographic scale of synchronized fluctuation patterns in zoobenthos populations as a key to underlying factors: climatic or man-induced // ICES Journal of Marine Science. V. 53. P. 964–971.
Clare D.S., Robinson L.A., Frid C.L.J., 2015. Community variability and ecological functioning: 40 years of change in the North Sea benthos // Marine Environmental Research. V. 107. P. 24–34.
Colebrook J.M., 1978. Continuous plankton records: zooplankton and environment, North-East Atlantic and North Sea 1948–1975 // Oceanologia acta. V. 1. P. 9−23.
Ibanez F., Dauvin J.-C., 1988. Long-term changes (1977–1987) in a muddy fine sand Abra alba – Melinna palmata community from Western English Channel: multivariate time-series analysis // Marine Ecology Progress Series. V. 49. P. 65−81.
Maximov A.A., 2015. The Long-term dynamics and current distribution of macrozoobenthos communities in the Eastern Gulf of Finland, Baltic Sea // Russian Journal of Marine Biology. V. 41. № 4. P. 300–310.
Naumov A.D., 2013. Long-term fluctuations of soft-bottom intertidal community structure affected by ice cover at two small sea bights in the Chupa Inlet (Kandalaksha Bay) of the White Sea // Hydrobiologia. V. 706. P. 159−173.
Poggiale J.-C., Dauvin J.-C., 2001. Long-term dynamics of three benthic Ampelisca (Crustacea-Amphipoda) populations from the Bay of Morlaix (western English Channel) related to their disappearance after the “Amoco Cadiz” oil spill // Marine Ecology Progress Series. V. 214. P. 201–209.
Rousi Y., Lain A. O., Peltomen Y., et al., 2013. Long-term changes in coastal zoobenthos in the northern Baltic Sea: the role of abiotic environment factors // ICES Journal of marine science. V. 70. № 2. P. 440−451.
Sukhotin A., Frost M., Hummel H., Martynova D., Naumov A. (Editors), 2015. Special Section: European Marine Biology Symposium Papers 2014 // Journal of the Marine Biological Association of the United Kingdom. V. 95. Issue 8.
WXTide32 4.7. A small program to know the current tides and predict the following ones [Электронный ресурс]. Режим доступа: https://wxtide32.informer.com/4.7/
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


