Зоологический журнал, 2020, T. 99, № 8, стр. 889-899
Замечания о подсемействе Anataeliinae (Dermaptera, Pygidicranidae), с описанием Challia steineri sp. n. из Лаоса
Зоологический институт РАН
199034 Санкт-Петербург, Россия
* E-mail: leonid.dictyoptera@gmail.com
** E-mail: Leonid.Anisyutkin@zin.ru
Поступила в редакцию 09.07.2019
После доработки 04.10.2019
Принята к публикации 16.01.2020
Аннотация
Подсемейство Anataeliinae Burr 1909 восстановлено в своем первоначальном, как в первоописании, составе двух родов: Anataelia Bolivar 1899 и Challia Burr 1904. Подсемейство Challiinae Steinmann 1973 syn. n. сведено в синоним к Anataeliinae. Описан новый вид, Challia steineri Anisyutkin sp. n., из Лаоса. Обосновано, что описанный из Бразилии “Anataelia” ramalhoi Sakai 1996 не принадлежит ни к Anataelia, ни к Anataeliinae, а, скорее всего, является представителем подсемейства Pygidicraninae. Даны подробное морфологическое переописание A. canariensis Bolivar 1899 и описание Ch. steineri Anisyutkin sp. n. Кратко рассмотрены история изучения группы, диагнозы и возможные апоморфии таксонов. Высказано предположение о том, что современный разорванный ареал Anataeliinae, включающий Канарские острова (Anataelia), Восточную и Юго-Восточную Азию (Challia), имеет реликтовый характер и его возникновение обусловлено глобальными климатическими изменениями, переходом от термо- к криоэре, на рубеже олигоцена–миоцена.
Несмотря на более чем столетние активные исследования, изученность тропической фауны уховерток еще далека от удовлетворительной. Это же можно сказать и о построении надродовой системы отряда. В этой статье, помимо описания нового вида рода Challia, пересмотрен объем подсемейства Anataeliinae и предложена гипотеза о причинах формирования его ареала.
Род Anataelia Bolivar 1899 был описан по единственному виду A. canariensis Bolivar 1899 с о-ва Тенерифе (Bolivar, 1899). Позднее были описаны еще 2 вида с Канарских о-вов (Martin, Oromi, 1988): A. lavicola Martin et Oromi 1988 и A. troglobia Martin et Oromi 1988. Описанный из Бразилии 'Anataelia' ramalhoi Sakai 1996, скорее всего, не принадлежит к этому роду, а является Pygidicraninae gen. sp. (подробнее ниже).
Род Challia Burr 1904 был также описан по единственному виду, Ch. fletcheri Burr 1904, из северо-восточного Китая (Burr, 1904). В первоописании было отмечено его чрезвычайное сходство с родом Anataelia (“This remarkable genus is closely related to, and perhaps even identical with, Anataëlia, Bolivar …” – Burr, 1904, p. 286). Позднее еще 8 видов было описано из Восточного Китая, Кореи, Вьетнама и Лаоса (Nishikawa, 2006; Ho, Nishikawa, 2009).
В подсемейство Anataeliinae Burr 1909 [исходное написание – Anataelinae, исправлено Энгелем и Хаасом (Engel, Haas, 2007)] первоначально включали 2 рода: Anataelia и Challia (Burr, 1909). Такое понимание подсемейства сохранялось (Burr, 1911; Hincks, 1959) вплоть до работы Штайнманна (Steinmann, 1973), в которой род Challia был выделен в монотипическое подсемейство Challiinae Steinmann 1973.
В этой работе я восстанавливаю подсемейство Anataeliinae в его первоначальном объеме, т.е. в составе двух родов, Anataelia и Challia, а Challiinae синонимизирую с Anataeliinae, что снова иллюстрирует интересный пример разорванного ареала – Канарские о-ва с одной стороны и Восточная и Юго-Восточная Азия – с другой.
Изученный экземпляр Anataelia canariensis был наклеен на картонный прямоугольник, экземпляры Challia steineri sp. n. хранились в 70% этаноле. Морфологические структуры препарировали и изучали в чашках Петри в 70% этаноле. Экземпляр A. canariensis был предварительно размочен, а после исследования снова смонтирован на картонный прямоугольник. Экземпляры Ch. steineri sp. n., равно как и гениталии самцов обоих видов, хранятся в 70% этаноле. Для удаления мягких тканей гениталии самцов обрабатывали щелочью по стандартной методике. Рисунки выполняли с помощью рисовального аппарата бинокулярного микроскопа Leica MZ 16, прорисовку деталей и изучение проводили с помощью бинокулярного микроскопа МБС-10.
Изученный экземпляр A. canariensis хранится в коллекции Музея Естественной Истории в Лондоне (BMNH), экземпляры Ch. steineri sp. n., включая голотип, хранятся в коллекции Зоологического института РАН (ЗИН) в Санкт-Петербурге.
Семейство Pygidicranidae Verhoeff 1902
= Challiinae Steinmann 1973 syn. n.
Существующие диагнозы подсемейства (Hincks, 1959; Steinmann, 1986 – для Anataeliinae и Challiinae; Nishikawa, 2006 – для Challiinae) могут быть дополнены признаками строения 10-го тергита брюшка: две пары латеральных выростов расположены по заднему и, частично, по боковым краям тергита, непарный вырост расположен медиально у заднего края тергита. Латеральные выросты небольшие, в виде бугорков у Anataelia и очень крупные, лопастевидные у Challia. Возможно, эти признаки являются аутапоморфиями Anataeliinae.
Род Anataelia Bolivar 1899
Типовой вид Anataelia canariensis Bolivar 1899, по монотипии.
Автор следует ранее данным диагнозам рода (Burr, 1911; Hincks, 1959).
Предложить аутапоморфии рода сложно, представители Anataelia выглядят как неспециализированные Challia, т.е. основные отличия сводятся к меньшей выраженности (пунктировка, гребни на голове, выросты 10-го тергита) или отсутствию (боковые кили на мезонотуме, аролиумы) тех или иных признаков. По-видимому, уникальные признаки следует искать в строении гениталий самцов. Во всяком случае, для этого необходимы дополнительные исследования.
Состав. Anataelia canariensis, A. lavicola Martin et Oromi 1988 и A. troglobia Martin et Oromi 1988.
Географическое распространение. Канарские о-ва: Тенерифе, Гомера (A. canariensis – Hincks, 1959; Martin, Oromi, 1988), Иерро (A. lavicola – Martin, Oromi, 1988) и Пальма (A. lavicola и A. troglobia – Martin, Oromi, 1988).
В 1996 г. из Бразилии, штат Параиба, был описан “Anataelia” ramalhoi Sakai 1996 (Sakai, 1996). Этот вид был описан по единственной самке (согласно первоописанию), самки и личинки экзотических уховерток, не ассоциированные с самцами, как правило, неопределимы.
Такие признаки, как относительно, по сравнению с представителями Anataelia и Challia, широкая голова, короткие ноги и строение антенн – “Head not elongate, slightly longer than wide … Antennae 22 segmented; 1st segment long and slender; 2nd, 3rd and 4th relatively short” (Sakai, 1996, p. 32, см. также Fig. 5 ), не характерны для представителей Anataelia и Challia, для которых характерны удлиненная голова, ноги, а также 3-й и 4-й сегменты антенн (Burr, 1911; Hincks, 1959, см. также описания ниже). По моему мнению, это свидетельствует о том, что эта уховертка не принадлежит ни к роду Anataelia, ни к подсемейству Anataeliinae. В первоописании не указано ни одного признака, который мог бы подтверждать принадлежность этого вида к Anataelia или Anataeliinae. Напротив, расширенная голова, укороченные 3-й и 4-й сегменты антенн и относительно короткие ноги с расширенными бедрами (Sakai, 1996, Fig. 5 ) характерны для представителей подсемейства Pygidicraninae Verhoeff 1902 (Burr, 1911; Hincks, 1959; Горохов, Анисюткин, 1993). Также, исходя из первоописания и рисунка (Sakai, 1996, Fig. 5 ), можно предположить, что “Anataelia” ramalhoi был описан по личинке, а не по бескрылой самке.
Принимая это во внимание, я исключаю “Anataelia” ramalhoi из Anataelia и Anataeliinae, рассматривая его как Pygidicraninae gen. sp.
Anataelia canariensis Bolivar 1899 (рис. 1a–1e; 2a, 2b)
Рис. 1.
Anataelia canariensis, самец, синтип: a – стерниты груди снизу; b – претарзус правой задней лапки; c–e – вершина брюшка сверху (c), сбоку (слева) (d), снизу (e). Пунктировкой показаны мембранозные участки. Масштаб 1 мм.
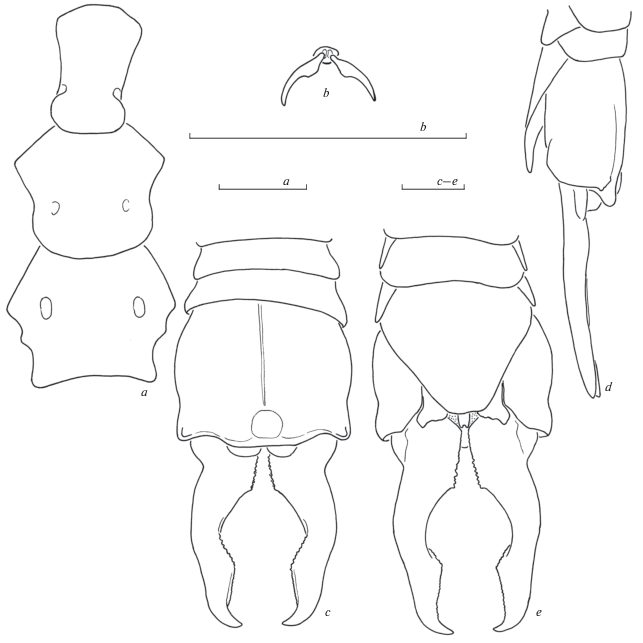
Материал. 1 самец, “Syntype”, “Anataëlia canariensis Boliv. A. Cabrera”, “Tenerife Baja mar 20.IX.1899.”, “♂.”, “Burr Coll. B.M. 1915-120.”
Имеющиеся описания (Bolivar, 1899; Hincks, 1959; Martin, Oromi, 1988) могут быть дополнены следующими данными.
Описание. Самец (синтип). Покровы неровные, мелко пунктированы. Голова, пронотум, средне- и заднегрудь несут многочисленные бугорки, многие из которых увенчаны щетинками.
Голова длиннее ширины; лоб слабо выпуклый, темя немного вогнутое; эпикраниальные швы хорошо развиты; глаза примерно в 2 раза короче заглазничного пространства; глазки отсутствуют; заглазничные гребни слабые, хорошо выражена только наружная пара. Скапус наиболее крупный, в длину примерно равен расстоянию между антеннальными впадинами, педицеллус примерно равной длины и ширины, отношение длин 5 базальных члеников (от 1-го к 5-му) примерно 3.8 : 1.0 : 1.5 : 1.3 : 1.8.
Пронотум немного длиннее ширины, трапециевидный, слабо расширяется каудально. Грудные стерниты (рис. 1a): простернум удлиненный, передний край выступающий, обрублен по переднему краю, боковые края выемчатые, задний – слабо округленный, фуркальные ямки плохо заметны; мезостернум широкий, по заднему краю широко округленный, фуркальные ямки плохо заметны; метастернум шире своей длины, по заднему краю выемчатый, фуркальные ямки хорошо заметны. Коготки лапок простые, симметричные (рис. 1b), аролиум отсутствует.
10-й тергит брюшка крупный, дорсовентрально уплощенный (рис. 1c–1e), с маленькими боковыми бугорками над каудолатеральными выступами, медиально располагается небольшая непарная лопасть; срединная борозда хорошо выражена, располагается в продольном вдавлении. Церки короткие, симметричные, в профиль почти прямые (рис. 1c–1e). Ветви церок включают три участка: проксимальный – короткий и почти прямой, мелко зазубренный по внутренней стороне; медиальный – с широко изогнутыми ветвями, зазубренными только в каудальной половине; дистальный – слабо изогнутый, мелко зазубренный по большей части своей длины. Генитальная пластинка трапециевидная, резко сужается каудально, с почти прямым каудальным краем (рис. 1e).
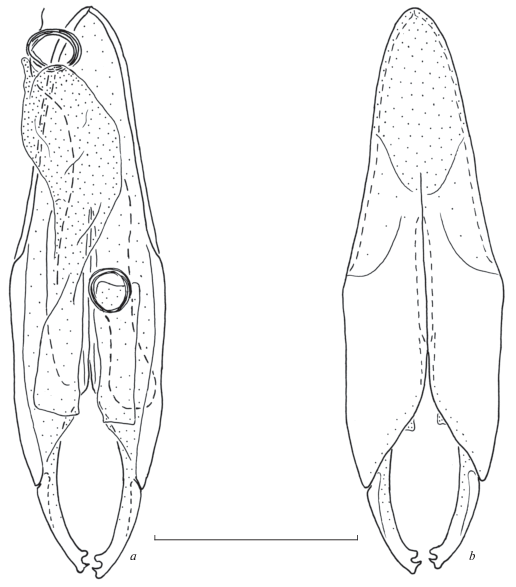
Гениталии самца хорошо склеротизованные, удлиненные и симметричные (рис. 2a, 2b). Метапарамеры короткие, стройные, отчетливо изогнутые, апикально округленные, с двумя субапикальными зубцами простой формы: дистальный зубец заострен и сильнее склеротизован, проксимальный – округленный. Пропарамеры хорошо склеротизованы латерально, в меньшей степени медио-краниально, разделены примерно на 1/3 их длины, с удлиненным склеритом, расположенным вдоль линии сочленения. Генитальные лопасти в состоянии покоя в длину составляют менее половины длины пропарамеров, с тонким, трудно различимым склеритом, расположенным на нижней стороне лопасти; в состоянии эрекции с выворачивающимся мембранозным мешком (левая лопасть на рис. 2a); вирга простая, образует короткую, примерно 5–6 витков, спираль после выхода из генитальной лопасти, дистальный участок, после спирали, очень короткий, простой, без специализаций.
Рис. 2.
Anataelia canariensis, синтип: гениталии самца сверху (a) и снизу (b). Пунктировкой показаны мембранозные участки. Масштаб 1 мм.
Размеры (мм). Длина головы 2.4, ширина головы 1.8, длина пронотума 1.9, ширина пронотума 1.7, ширина метанотума 2.3, длина передних/ средних/задних бедер 1.8/2.1/2.7, ширина 10-го тергита брюшка 2.8, длина церок 3.2. Ширина головы измерена в наиболее широком месте, сразу за глазами; ширина поврежденного мезонотума не указана.
Род Challia Burr 1904
Типовой вид Challia fletcheri Burr 1904, по монотипии.
Род Challia был недавно ревизован Нисикавой (Nishikawa, 2006), и я следую его диагнозу. В качестве аутапоморфии рода можно рассматривать строение 10-го тергита брюшка, а именно наличие двух пар крупных дольчатых округлых лопастей по заднему краю тергита. Подобное строение 10-го тергита брюшка уникально для уховерток в целом.
Состав. В настоящее время род насчитывает 9 видов: Challia fletcheri, Ch. kyusani Moon et Kim 1985, Ch. australis Anisyutkin 1994, Ch. phoenix Anisyutkin et Gorochov 1998, Ch. taewooi Nishikawa 2006, Ch. imamurai Nishikawa 2006, Ch. gigantea Nishikawa 2006, Ch. hongkongensis Ho et Nishikawa 2009 и Ch. steineri sp. n.
Географическое распространение. Восточная Азия с заходом в Юго-Восточную Азию: Корейский п-ов, Восточный Китай, Северный Вьетнам и Лаос.
Challia steineri Anisyutkin sp. n. (рис. 3a–3j; 4a–4g)
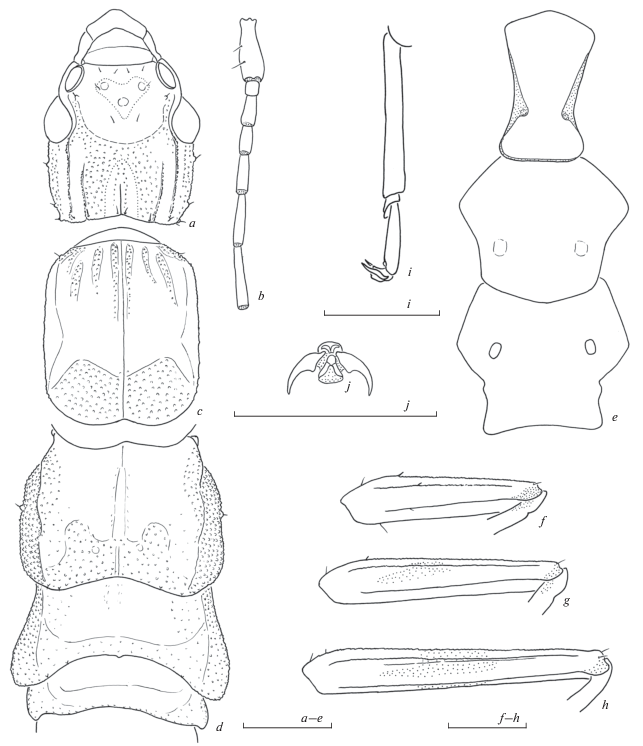
Рис. 3.
Challia steineri Anisyutkin sp. n., самец, голотип: a – голова сверху; b – основание правой антенны; c – пронотум сверху; d – средне-, заднегрудь и первый сегмент брюшка сверху; e – стерниты груди снизу; f–h – переднее (f), среднее (g) и заднее (h) левое бедро спереди (сверху); i – левая задняя лапка спереди (сверху); j – претарзус левой задней лапки. Пунктировкой показаны мембранозные участки (b, e, j) или темная окраска (f–h). Масштаб 1 мм.
Материал. 1 самец (голотип), 1 личинка самца (паратип); Лаос, пров. Кхаммуан (Khammouan), район Боулапха (Boualapha), пещера Xe Bangfai, 17.37496° N, 105.88369° E, между провалом и гигантскими гурами, 27.02.2016, Г. Штайнер coll.
Описание. Самец (голотип). Окраска светлая, коричневато-желтая, последние тергиты брюшка (~5–10) затемнены до красно-коричневого цвета. Голова сверху [за исключением светло-желтого лба, вокруг более темного сердцевидного пятна (рис. 3a), продольных участков, обрамляющих наружный заглазничный киль и каудальную часть коронального шва и белесого антиклипеуса] светло-коричневая. Глаза черные. Скапус и педицеллум светло-желтые, дистальнее сегменты антенн светло-коричневые. Прозона пронотума светло-желтая [за исключением коричневых участков у антеролатеральных углов и слабо затемненных (светло-коричневых) продольных гребней], метазона – коричневая. Средне- и заднегрудь светло-желтые медиально, затемнены (до коричневого или светло-коричневого) латерально, вдоль и латеральнее боковых килей, а также вдоль каудального края. Голова и грудь снизу светло-желтые. Ноги, за исключением небольших коричневых пятен на бедрах и голенях (рис. 3f–3h), светло-желтые; коготки лапок более темные, красновато-коричневые. 1–3-й тергиты брюшка светло-желтые медиально в краниальной половине тергита, латерокаудально более темные (красновато-коричневые), затемнение усиливается от 1-го к 3-му тергитам; на 2–3-м тергитах затемнены вдавленные участки крупной и глубокой пунктировки; 2-й стернит брюшка светло-желтый, 3-й и по переднему краю 4-й стерниты желтые, 3-й стернит густо покрыт красно коричневой пунктировкой; каудальнее тергиты и стерниты брюшка темно-красные; дольчатые лопасти 10 тергита более светлые, коричневато-красные. Церки в проксимальной половине светло-желтые, каудальнее – коричневатые; зубцы темно-коричневые.
Покровы тусклые, матовые, только брюшко, с 3-го сегмента, и церки блестящие. Голова, пронотум, средне- и заднегрудь, 1-й и 2-й тергиты брюшка местами (рис. 3a, 3c–3d) густо покрыты мелкими бугорками; помимо мелких бугорков, на голове, пронотуме и среднегруди симметрично располагаются немногочисленные более крупные бугорки, каждый из которых увенчан крупной щетинкой; тергиты и стерниты брюшка, начиная с 3-го сегмента, густо покрыты крупной вдавленной пунктировкой (рис. 4a, 4c–4d). Опушение очень слабое, немногочисленные крупные щетинки расположены более или менее симметрично.
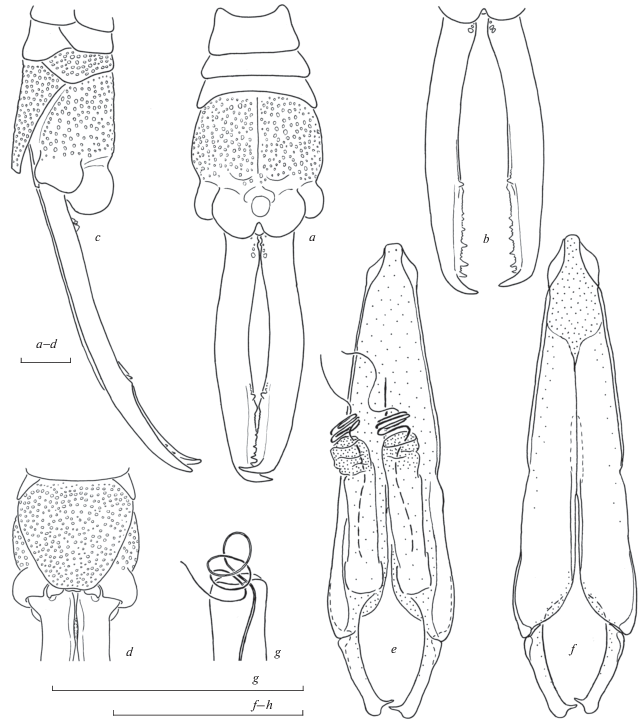
Рис. 4.
Challia steineri Anisyutkin sp. n., самец, голотип: a, c – вершина брюшка, сверху, церки направлены немного вверх (a) и сбоку (слева) (c); b – церки сверху; d – вершина брюшка снизу, показано только основание церок; e, f – гениталии самца сверху (e) и снизу (f); g – вершина генитальной лопасти. Пунктировкой показаны мембранозные участки; на рис. a, c, d пунктировка показана не на всех склеритах брюшка. Масштаб 1 мм.
Голова длиннее ширины, с увенчанными щетинками бугорками, расположенными по заднему и боковым краям головы, а также между глазом и антеннальной впадиной (рис. 3a); лоб выпуклый, темя немного вогнутое; на лбу расположено сердцевидное пятно с тремя нечеткими выпуклостями; фронтальный шов стерт, сохранился в виде U-образного углубления на эпикраниуме, корональный шов присутствует только в каудальной части; глаза небольшие, примерно в 2 раза короче заглазничного пространства; глазки отсутствуют; заглазничных гребней 2 пары, медиальные гребни короче латеральных; каудальный край головы отчетливо вырезан. Антенны 15-члениковые (рис. 3b), скапус наиболее крупный, в длину примерно равен расстоянию между антеннальными впадинами, педицеллус примерно равной длины и ширины, отношение длин пяти базальных члеников (от 1-го к 5-му) примерно 4.5 : 1.0 : 2.3 : 2.0 : 3.0; далее членики немного удлиняются, но два вершинных снова немного укорачиваются.
Пронотум длиннее ширины (рис. 3c), передний край его выступающий, боковые края почти прямые, задний край каудально вырезан; разделение на про- и метазону четкое; срединная борозда отчетливая.
Надкрылья и крылья отсутствуют. Среднегрудь с хорошо развитыми боковыми килями и полустертой срединной бороздой (рис. 3d). Заднегрудь более короткая и широкая (рис. 3d), по сравнению с среднегрудью, боковые кили слабые, срединная борозда неразличима. Грудные стерниты (рис. 3e): простернум удлиненный, передний край угловидно выступающий, боковые края выемчатые, задний – почти прямой, фуркальные ямки плохо заметны, прикрыты мембранозными складками; мезостернум немного шире своей длины, по заднему краю широко округленный, фуркальные ямки плохо заметны; метастернум шире своей длины, по заднему краю выемчатый, фуркальные ямки хорошо заметны.
Ноги удлиненные; бедра с продольными килями, не утолщены (рис. 3f–3h); лапки с наиболее длинным 1-м члеником (рис. 3i), 2-й членик маленький; 1-й и 2-й членики снизу густо покрыты короткими щетинками; коготки простые, симметричные (рис. 3j); аролиум небольшой.
Брюшко стройное, цилиндрическое, резко расширяется от 7-го сегмента (рис. 4a); 2-й и 3-й сегменты с поперечной складкой; 10-й тергит вздутый, с двумя парами больших дольчатых лопастей по заднему краю, медиально располагается дорсальная непарная лопасть меньших размеров (рис. 4a, 4c); срединная борозда хорошо выражена, располагается в продольном вдавлении. Церки удлиненные, симметричные, в профиль изогнутые (рис. 4a–4c). Ветви церок включают три участка: короткий и почти прямой проксимальный, с немногочисленными мелкими зубчиками на внутренней стороне и дорсально направленными – на верхней; медиальный – наиболее длинный участок, с широко изогнутыми ветвями без вооружения; дистальный – с рядами чередующихся зубцов разного размера на внутренней стороне церок; один крупный зубец и несколько мелких дорсально направленных зубцов располагаются на границе второго и третьего участков церок. Генитальная пластинка трапециевидная, с каудальным краем, очень слабо выемчатым (рис. 4d).
Гениталии самца хорошо склеротизованные, удлиненные и симметричные (рис. 4e–4g). Метапарамеры короткие (рис. 4e, 4f), стройные, очень слабо изогнутые, апикально округленные, единственный зубец субапикальный, простой формы. Пропарамеры хорошо склеротизованы латерально, в меньшей степени медио-краниально, разделены примерно на 1/3 их длины, с нечетко выраженным склеритом, расположенным вдоль линии сочленения (рис. 4e, 4f). Генитальные лопасти в состоянии покоя в длину составляют менее половины длины пропарамеров (рис. 4e–4g), слабо склеротизованы в проксимальной части, дистально с выворачивающимися мембранозными мешками; вирга простая, образует короткую, примерно 3 витка, спираль после выхода из генитальной лопасти, дистальный участок, после спирали, короткий, более тонкий, простой, цилиндрический, без специализаций; акцессорные структуры или склериты в генитальной лопасти отсутствуют.
Личинка самца (паратип) сходна с имаго, отличается следующими признаками.
Размеры меньше, окраска более светлая, местами белесая, покровы менее склеротизованные. Лоб светло-коричневый, с двумя парами белесых пятен, медиальные пятна крупнее; 5–6-й сегменты брюшка белесые, остальные – коричневые. Эпикраниальные швы хорошо развиты. Аролиумы отсутствуют. Дольчатые лопасти 10-го тергита относительно меньших размеров. Церки почти прямые, примерно в дистальной трети с зубцами на внутренней стороне.
Самец, голотип. Размеры (мм): длина головы 2.3, ширина головы 1.6, длина пронотума 2.1, ширина пронотума 1.6, ширина мезонотума 2.2, ширина метанотума 2.3, длина передних/средних/ задних бедер 2.7/3.3/4.0; ширина 10-го тергита брюшка 2.7, длина церок 5.7. Ширина головы измерена в наиболее широком месте, сразу за глазами.
Дифференциальный диагноз. Отличается от остальных видов рода следующими признаками:
от Ch. fletcheri – формой церок: очень коротким проксимальным участком, без дорсального поднятия и относительно более длинным дистальным участком, несущим зубцы на внутренней стороне церок (сравнить рис. 4a–4c и Fig. 2g, 2h в Nishikawa, 2006); удлиненными пропарамерами и относительно короткими метапарамерами; отсутствием акцессорных структур в генитальных лопастях (сравнить рис. 4e–4g и Fig. 2m в Nishikawa, 2006);
от Ch. kyusani – простым, нераздвоенным зубцом метапарамеров (сравнить рис. 4e, 4f и Fig. 4 в Moon, Kim, 1985);
от Ch. australis – пронотумом длиннее ширины (у Ch. australis он примерно равной длины и ширины – Анисюткин, 1994), отсутствием конусовидной, покрытой щетинками структуры в генитальной лопасти и неспециализированной вершиной вирги (сравнить рис. 4e–4g и рис. 7, 8 в Анисюткин, 1994);
от Ch. phoenix – длинными, плавно изогнутыми в профиль церками (сравнить рис. 4c и рис. 9 в Анисюткин, Горохов, 1998), отсутствием конусовидной, покрытой щетинками структуры в генитальной лопасти и неспециализированной вершиной вирги (сравнить рис. 4e–4g и рис. 11 в Анисюткин, Горохов, 1998);
от Ch. taewooi – пронотумом длиннее ширины (у Ch. taewooi пронотум почти равной длины и ширины – Nishikawa, 2006, 2007), не расширенным дистальным участком церок (сравнить рис. 4a, 4b и Fig. 3d в Nishikawa, 2006), смещенным от вершины зубцом метапарамера и спирально закрученной, с простой вершиной виргой (сравнить рис. 4e–4g и Fig. 3j в Nishikawa, 2006);
от Ch. imamurai – длинными, плавно изогнутыми в профиль церками (сравнить рис. 4c и Fig. 4d в Nishikawa, 2006) и субапикальным, т.е. смещенным от вершины, зубцом метапарамера (сравнить рис. 4e, 4f и Fig. 4i в Nishikawa, 2006);
от Ch. gigantea – не расширенным дистальным участком церок (сравнить рис. 4a, 4b и Fig. 6d, g в Nishikawa, 2006) и строением метапарамеров: у Ch. gigantea метапарамеры практически прямые, с зубцом, смещенным на вершину (сравнить рис. 4e, 4f и Fig. 6i, h в Nishikawa, 2006);
от Ch. hongkongensis – слабо округленным медиальным и не расширенным дистальным участками церок (сравнить рис. 4a, 4b и Figs 1, 2, 13, 16 в Ho, Nishikawa, 2009) и простой вершиной вирги (сравнить рис. 4f, 4g и Fig. 18 в Ho, Nishikawa, 2009).
Этимология. Вид назван в честь Гельмута Штайнера (Helmut Steiner), собравшего и передавшего описанных уховерток в коллекцию ЗИН РАН.
Замечание. Несмотря на нахождение в глубине пещеры (более 1 км от входа – Г. Штайнер, персональное сообщение), новый вид, также, как и Ch. phoenix, единственный экземпляр которого был также собран в пещере (Анисюткин, Горохов, 1998), очевидно не является троглобионтом, а скорее троглоксеном или троглофилом (см. Kamimura, Ferreira, 2018), о чем свидетельствуют хорошо развитые глаза и окраска.
Представители родов Anataelia и Challia имеют много общих морфологических признаков как во внешней морфологии, так и в строении гениталий самцов: покровы тела с бугорками, несущими на вершине щетинки (рис. 3a, 3c, 3d); голова удлиненная с относительно небольшими глазами и развитыми заглазничными килями (рис. 3a); стерниты груди сходного строения (рис. 1a, 3e); 10-й тергит брюшка с двумя парами латеральных выростов, небольших у Anataelia (рис. 1c, 1d), и крупных у Challia (рис. 4a, 4c, 4d), и одним медиальным выростом; сходный тип церок (рис. 1c–1e, 4a–4c), симметричных, с соприкасающимися базальным, широко округленным медиальным и зазубренным дистальным участками; метапарамеры стройные, с одним или двумя субапикальными зубцами (рис. 2a, 2b, 4e, 4f); вирга спирально закручена (рис. 2a, 2b, 4e–4g). По-видимому, эти признаки не являются уникальными (вероятно, за исключением выростов 10-го тергита), но вместе они образуют комплекс, определяющий характерный облик Anataeliinae. По моему мнению, независимое возникновение такого комплекса признаков, принадлежащих разным системам органов, маловероятно.
Род Challia был выделен в монотипическое подсемейство Challiinae исключительно на основании присутствия развитых аролиумов (Steinmann, 1973). У представителей Anataelia аролиумы полностью отсутствуют. Но степень развития аролиумов является адаптивным признаком и отражает различия в образе жизни, это отмечал и сам Штайнманн (Steinmann, 1973, p. 386). Показано, что аролиум играет ключевую роль при перемещении по вертикальным и гладким поверхностям (Roth, Willis, 1952), и хотя это исследование проведено на тараканах, но вряд ли функционирование этих структур у уховерток принципиально отличается.
Представители рода Anataelia обитают на лавовых потоках, очень бедных растительностью, или в пещерах (Martin, Oromi, 1988; García, Lobo, 2001). К сожалению, данные об образе жизни Challia немногочисленны, но без сомнения для их местообитаний характерна хорошо развитая растительность. Ch. phoenix и Ch. steineri sp. n., несмотря на то, что обнаружены они в пещерах, явно не являются троглобионтами (см. выше), для Ch. kyusani отмечено обитание на соснах и вблизи этих деревьев, но не в почве (“This species was found mainly near or on the Pinus group trees, but the present authors have not observed this species would have burrowed the ground surface…” – Moon, Kim, 1985, p. 58), для Ch. hongkongensis – на скалах, покрытых мхом и растительности (Ho, Nishikawa, 2009).
Очевидно, что наличие или отсутствие аролиумов отражает адаптацию к конкретным условиям обитания – у Challia сохраняется способность к перемещению по вертикальным гладким поверхностям, листве и стеблям растений, тогда как у Anataelia аролиум редуцировался за ненадобностью. Аналогичный случай описан для сверчков из семейства Mogoplistidae, большинство которых имеет расширенный 2-й членик лапок – адаптацию для прикрепления к листве деревьев, тогда как обитающие на острове Вознесения виды рода Discophallus Gorochov 2009 утратили это расширение в связи с уходом от фитофильного образа жизни (Gorochov, 2009).
Наличие или отсутствие аролиумов отражает особенности биологии и может варьировать у близких видов и родов. Поэтому я считаю выделение Challiinae в качестве подсемейства необоснованным и синонимизирую его с Anataeliinae, восстанавливая таким образом последнее подсемейство в понимании Бэрра и Хайнкса (Burr, 1909, 1911; Hincks, 1959).
Подсемейство Anataeliinae демонстрирует интересный случай разорванного ареала: Канарские о-ва (Anataelia), с одной стороны, и Восточная и Юго-Восточная Азия (Challia), с другой. Можно предположить, что современный ареал носит реликтовый характер и его фрагментация связана с глобальными климатическими и тектоническими изменениями, происходившими в конце мезозоя–начале кайнозоя.
Конфигурация материков, а именно простиравшийся в широтном направлении Тетис (Smith et al., 1994), и теплый влажный климат (Величко, 1999; Семихатов, Чумаков, 2004) сделали возможным в конце мезозоя–начале кайнозоя существование более или менее однообразной фауны ортоптероидных насекомых от Котловины Карибского моря и до Юго-Восточной Азии. Действительно, многие таксоны, в настоящее время распространенные лишь в Новом или Старом Свете, в эоцене–миоцене отмечались в обоих полушариях (например, для тараканов – Shelford, 1910; Vršanský et al., 2011; Vršanský et al., 2014).
Уховертки семейства Pygidicranidae существовали уже в “среднем” мелу (апт–сеноман). В настоящее время они достоверно известны только из бирманского янтаря (Engel, Grimaldi, 2004; Engel, 2011). Однако вряд ли можно сомневаться в их более широком распространении – неопределимые до семейства представители подотряда Neodermaptera Engel 2003, включающего всех современных уховерток (Engel, Haas, 2007), известны из раннего мела (баррем-апт) Ливана (Engel et al., 2011) и Бразилии (апт) (Engel, Chatzimanolis, 2005). Поэтому вполне возможно предположить, что предки современных анателиин были широко распространены по берегам Тетиса.
Фрагментация ареала могла быть вызвана глобальными климатическими изменениями, а именно прогрессирующими похолоданием и иссушением, связанными с переходом от термо- к криоэре в конце эоцена–олигоцене (Квасов, 1985; Семихатов, Чумаков, 2004), и закрытием Тетиса на рубеже олигоцена–миоцена (Smith, Smith, Funnel, 1994). Последний удар, после которого ареал Anataeliinae принял современный вид, был очевидно нанесен плейстоценовыми оледенениями.
Список литературы
Анисюткин Л.Н., 1994. Новый вид рода Challia Burr из Вьетнама (Dermaptera, Pygidicranidae) // Новости систематики и фаунистики насекомых Вьетнама. Ч. 4. // Труды Зоологического института РАН. Т. 257. С. 72–76.
Анисюткин Л.Н., Горохов А.В., 1998. Второй вид рода Challia (Dermaptera, Pygidicranidae) из Вьетнама // Зоологический журнал. Т. 77. Вып. 5. С. 610–612.
Величко А.А., 1999. Общие особенности изменений ландшафтов и климата Северной Евразии в кайнозое // Изменение климата и ландшафтов за последние 65 миллионов лет. Отв. ред. Величко А.А. М: Геос. С. 219–233.
Горохов А.В., Анисюткин Л.Н., 1993. К познанию уховерток подсемейства Pygidicraninae (Dermaptera, Pygidicranidae) // Зоологический журнал. Т. 72. Вып. 11. С. 40–49.
Квасов Д.Д., 1985. Резкие изменения климата в кайнозое и их влияние на развитие фаун // Труды Зоологического Института РАН. Т. 130. С. 95–110.
Семихатов М.А., Чумаков Н.М. (ред.), 2004. Климат в эпохи крупных биосферных перестроек. М: Наука. 299 с.
Bolivar I., 1899. Anataelia, genero nuevo de forficulido de las Islas Canarias // Actas de la Sociedad Española de Historia Natural. V. 8. P. 97–99.
Burr M., 1904. Observations on the Dermaptera, including revisions of several Genera, and descriptions of New Genera and Species // Transactions entomological Society London. Part II. June. P. 277–322.
Burr M., 1909. Note on the classification of the Dermaptera // Deutsche Entomologische Zeitschrift. P. 320–328.
Burr M., 1911. Dermaptera // Genera Insectorum. V. 122. P. 1–122.
Engel M.S., 2011. New earwigs in mid-Cretaceous amber from Myanmar (Dermaptera, Neodermaptera) // ZooKeys. V. 130. P. 137–152.
Engel M.S., Chatzimanolis S., 2005. Early Cretaceous earwigs (Dermaptera) from the Santana Formation, Brazil // Polskie Pismo Entomologiczne. V. 74. P. 219–226.
Engel M., Grimaldi D., 2004. A primitive earwig in Cretaceous amber from Myanmar (Dermaptera: Pygidicranidae // Journal of Paleontology. V. 78. № 5. P. 1018–1023.
Engel M.S., Haas F., 2007. Family-Group Names for Earwigs (Dermaptera) // American Museum Novitates. № 3567. P. 1–20.
Engel M.S., Ortega-Blanco J., Azar D., 2011. The earliest earwigs in amber (Dermaptera): A new genus and species from the Early Cretaceous of Lebanon // Insect Systematics & Evolution. V. 42. P. 139–148.
García R., Lobo J.M., 2001. Coexistencia espacial y temporal de Anataelia lavicola y A. troglobia Martín y Oromí, 1988 (Dermaptera, Pygidicranidae) en las cavidades de la isla de La Palma (Islas Canarias) // Vulcania. 2000. V. 4. P. 67–76.
Gorochov A.V., 2009. Crickets of the family Mogoplistidae (Orthoptera) from Ascension and Saint Helena islands, Atlantic Ocean // Proceedings of the Zoological Institute RAS. V. 313. № 1. P. 23–32.
Hincks W.D., 1959. A systematic monograph of the Dermaptera of the World based on material in the British Museum (Natural History). Part two Pygidicranidae excluding Diplatyinae. London: British Museum (Natural History). 218 p.
Ho G.W.C., Nishikawa M., 2009. A New Species of the Genus Challia Burr (Dermaptera, Pygidicranidae, Challiinae) from Hong Kong and a New Record of Challia fletcheri Burr from North Guangdong, China // Japanese Journal of Systematic Entomology. V. 15. № 2. P. 367–374.
Kamimura Y., Ferreira R.L., 2018. Description of a second South American species in the Malagasy earwig genus Mesodiplatys from a cave habitat, with notes on the definition of Haplodiplatyidae (Insecta, Dermaptera) // ZooKeys. V. 790. P. 87–100.
Martin J.L., Oromi P., 1988. Dos nuevas especies de Anataelia Bol. (Dermaptera, Pygidicranidae) de cuevas y lavas recientes del Hierro y La Palma // Mémoires de Biospéologie. V. 15. P. 49–59.
Moon T., Kim C., 1985. A review of the Far-east Palaearctic Genus Challia Burr, including a New Species Challia kyusani sp. nov. (Challiinae: Dermaptera) // The Korean Journal of Entomology. V. 15. № 1. P. 57–60.
Nishikawa M., 2006. Notes on the Challiinae (Dermaptera, Pygidicranidae), with Descriptions of Three New Species from China, Korea and Japan // Japanese Journal of Systematic Entomology. V. 12. № 1. P. 17–38.
Nishikawa M., 2007. Identity of the Korean Earwig Recorded as Challia sp. (Dermaptera, Pygidicranidae) // Japanese Journal of Systematic Entomology. V. 13. № 2. P. 319–320.
Roth L.M., Willis E.R., 1952. Tarsal structure and climbing ability of cockroaches // Journal of Experimental Zoology. V. 119. № 3. P. 483–517.
Sakai S., 1996. A new species of the genus Anataelia from Brazil // Bulletin of the Biogeographical Society of Japan. V. 51. № 2. P. 29–33.
Shelford R., 1910. On a collection of Blattidae preserved in Amber, from Prussia // Journal of the Linnean Society – Zoology. V. 30. P. 336–355.
Smith A.G., Smith D.G., Funnel B.M., 1994. Atlas of Mesozoic and Cenozoic Coastlines. Cambridge University Press. 99 p.
Steinmann H., 1973. A Study for the Higher Taxa of the Pygidicranidae (Dermaptera) // Folia Entomologica Hungarica. V. 26. № 2. P. 385–400.
Steinmann H., 1986. Dermaptera. Catadermaptera I. Berlin, New York: Walter de Gruyter. 343 p.
Vršanský P., Cifuentes-Ruiz P., Vidlička L’., Čiampor F. jr., Vega F.J., 2011. Afro-Asian cockroach from Chiapas amber and the lost Tertiary American entomofauna // Geologica Carpathica. V. 62. № 5. P. 463–475.
Vršanský P., Oružinský R., Barna P., Vidlička L’., Labandeira C., 2014. Native Ectobius (Blattaria: Ectobiidae) From the Early Eocene Green River Formation of Colorado and Its Reintroduction to North America 49 Million Years Later // Annals of the Entomological Society of America. V. 107. № 1. P. 28–36.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


