Зоологический журнал, 2021, T. 100, № 1, стр. 3-16
Оценка приуроченности морфо-экологических групп дождевых червей (Oligochaeta, Lumbricidae) к основным типам леса бассейна реки Большая Лаба (Северо-Западный Кавказ)
А. П. Гераськина a, *, Н. Е. Шевченко a
a Центр по проблемам экологии и продуктивности лесов РАН
117997 Москва, Россия
* E-mail: angersgma@gmail.com
Поступила в редакцию 28.04.2019
После доработки 22.04.2020
Принята к публикации 28.04.2020
Аннотация
Представлены результаты исследования населения дождевых червей в лесах бассейна р. Большая Лаба. Дана оценка приуроченности морфо-экологических групп дождевых червей к типам леса, растительным сообществам и основным местообитаниям: подстилка, почва, мертвая древесина. Найдено 15 видов Lumbricidae, два из которых отмечены впервые на рассматриваемой территории. Установлено, что население дождевых червей во всех типах леса представлено в основном подстилочными, собственно почвенными и норными видами. Почвенно-подстилочные виды встречаются редко. Наибольшее видовое разнообразие и биомасса дождевых червей выявлены в широколиственных лесах с буком, наименьшие показатели в темнохвойных лесах; смешанные и буковые леса занимают промежуточное положение. Среди растительных сообществ всех типов леса более заселены дождевыми червями мелкотравные, щитовниково-мелкотравные, разнотравные и лещиново-разнотравные сообщества, менее заселены – мертвопокровные, зеленомошные и рододенровые. Подстилочные виды обитают преимущественно в валеже во всех типах леса и растительных сообществах, где их биомасса в мертвой древесине значимо выше, чем в горизонте подстилки. Собственно почвенные виды – самая многочисленная группа люмбрицид горно-лесного пояса – обитают в почве во всех типах леса, реже встречаются в мертвой древесине. Норные виды в пробах встречаются реже, но следы их жизнедеятельности (копролиты) и ходы в почве представлены практически во всех типах леса и растительных сообществах.
Исследование структурно-функциональной организации сообществ и ключевых видов в них возможно только в наиболее сохранившихся природных экосистемах. Леса Северо-Западного Кавказа представляют большой интерес как для изучения флоры и фауны, так и для изучения экологических и экосистемных вопросов, поскольку к настоящему времени на этой территории сохранились массивы наименее нарушенных старых лесов. Один из таких уникальных больших лесных массивов занимает бассейн реки Большая Лаба. Разнообразие типов леса, растительных сообществ, их разновозрастной состав, а также многообразие микросайтов и микростаций, необходимых для жизнедеятельности почвенных беспозвоночных, предоставляет большие возможности для решения ряда научных вопросов, касающихся экологии разных групп педобионтов, в том числе и широко распространенных почвообразователей – дождевых червей. Несмотря на большое число работ по экологии дождевых червей и других представителей макрофауны в лесных экосистемах, взаимосвязи тех или иных экологических групп педобионтов, выполняющих разную функциональную роль в переработке опада и почвообразовании, и растительных сообществ, рассматриваются явно недостаточно (Hättenschwiler, 2005; Scheu, 2005; Cesarz et al., 2007; Jacob et al., 2009). Широко известно, что большое влияние на состав люмбрикофауны оказывают свойства почвы (Перель, 1979; Bouche, 1977; Lavelle, 1988) и состав древостоя, от которого зависит качество подстилки (Hendriksen, 1990; Cortez, 1998; Schelfhout et al., 2017; Szlavecz, 2018). При этом, как правило, не учитывается напочвенный покров, который обусловливает формирование микроусловий в верхних горизонтах почвы и влияет на качество подстилки (Campana et al., 2002; Milcu et al., 2008). Кроме того, в последнее время большое внимание уделяется роли других местообитаний, кроме почвы, в поддержании устойчивого состава морфо-экологических групп дождевых червей в лесах. Показано, что зачастую обследование только почвы приводит не только к занижению таксономического, но и функционального разнообразия дождевых червей (Гераськина, 2016; 2016a; Воробейчик и др., 2018; Hendrix, 1996; Schmidt et al., 2015; Römbke et al., 2017). Для ряда видов валеж служит стацией переживания неблагоприятных условий (Гераськина, Шевченко, 2018), для некоторых подстилочных видов – постоянным местообитанием (Römbke et al., 2017).
Известно, что горные районы Кавказа – один из центров видообразования дождевых червей (Квавадзе, 1985). На Северо-Западном Кавказе из семейства Lumbricidae обитает 22 вида, очень часто в лесных сообществах по биомассе и численности доминируют эндемичные виды (Рапопорт, Цепкова, 2015; Гераськина, 2016б). Ряд работ посвящен ландшафтной и биотопической приуроченности дождевых червей в лесах Северо-Западного Кавказа (Рапопорт, 2014; 2014a; 2014б; 2016; Рапопорт, Цепкова, 2015) и в том числе с учетом микросайтной организации лесов (Гераськина, 2016б; 2018; Гераськина, Шевченко, 2018). Исследования люмбрикофауны проводились в лесах среднего течения р. Большая Лаба (Рапопорт, 2017; Рапопорт, Цепкова, 2019). В нашей работе представлен материал по населению люмбрицид от верховьев до нижнего течения р. Большая Лаба с детализацией распределения дождевых червей в летний период по основным местообитаниям, что имеет значение не только для выявления таксономического, но и функционального разнообразия дождевых червей на примере этих лесов.
Цель работы: оценка роли растительного покрова и выраженности основных элементов лесной мозаики в поддержании таксономического и функционального разнообразия дождевых червей, а также количественных параметров населения люмбрицид (численности, биомассы и демографического состояния в летний сезон) в лесном поясе бассейна р. Большая Лаба.
Задачи работы включали выявление закономерностей распределения видов и групп дождевых червей в зависимости от:
1) доминантов древесного яруса, определяющего состав и качество подстилки в разных типах леса;
2) доминантов растительного напочвенного покрова, определяющего микроусловия в подстилке почве;
3) присутствия крупного древесного валежа, как важного постоянного местообитания, так и стации переживания неблагоприятных условий.
МАТЕРИАЛ И МЕТОДЫ
Полевой материал собран в период с 22 мая по 2 июня 2017 г. в наиболее сохранившихся массивах предгорных и горных лесов бассейна р. Большая Лаба на территории Карачаево-Черкесской республики. В пределах Карачаево-Черкессии р. Большая Лаба протекает с юга на север между хребтами Аркасара, Загедан и Мнатацара. С юго-запада и запада р. Большая Лаба ограничена отрогами Главного Кавказского хребта и хребтом Закан, расчлененными глубокими лесистыми ущельями и долинами, по которым протекают многоводные притоки. Лесные массивы ущелий и долин защищены от проникновения холодных северных и северо-восточных ветров высокими горными хребтами, с юго-западной стороны открыт доступ влажным воздушным массам, проникающим с Черного моря. Климат умеренно-континентальный, влажный и мягкий, в среднем за год выпадает около 1000 мм осадков (Гвоздецкий, 1963).
Обследованы леса вблизи населенных пунктов Курджиново (левый берег Большой Лабы), Рожкао (р. Рожкао), Загедан (правый берег р. Большая Лаба), Пхия (правый берег р. Большая Лаба), Соленое (р. Угольная), Дамхурц и леса Дамхурцкого заказника (р. Шантацара) (рис. 1).
Рис. 1.
Карта-схема мест учетов дождевых червей в лесном поясе бассейна р. Большая Лаба (Северо-Западный Кавказ).
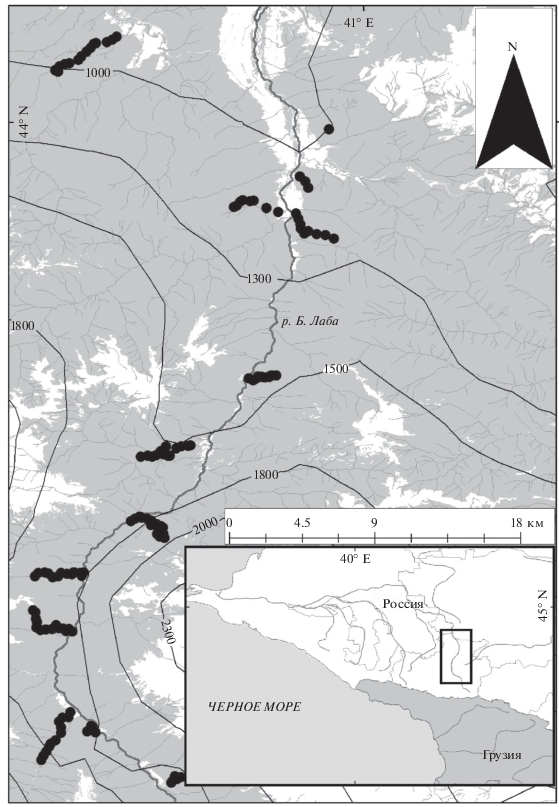
На изученной территории выполнено 126 геоботанических описаний на площадках 20 × 20 м (Заугольнова, Браславская, 2010), проведены количественные учеты дождевых червей; определены тип почвы (World…, 2015) и почвенные параметры (кислотность и текущие температура и влажность – электронный почвенный индикатор PH 300), плотность (измеритель плотности почвы – пенетрометр Wile Soil, стандарт ASAE S313.3), которые характеризуют условия обитания дождевых червей в период сбора материала и во многом определяют (в первую очередь влажность) количественные параметры (численность и биомассу) дождевых червей.
На основании доминантов древесного яруса выделены 4 основных типа леса, в которых в зависимости от напочвенного покрова выделены растительные сообщества. Темнохвойные леса (доминанты Picea orientalis, Abies nordmanniana) представлены щитовниково-мелкотравными, метрвопокровными и горноовсяницевыми растительными сообществами. Почвы лесные буроземы по гранулометрическому составу средне- и тяжелосуглинистые. Подстилка часто слабо выражена (0–3 см), представлена опадом пихты и ели. Кислотность почвы 5.0–6.0, влажность 20–25%, температура 8–10°С, плотность 900–1900 кг/м3.
Смешанные леса (доминанты Fagus orientalis, Picea orientalis, Abies nordmanniana) представлены щитовниково-мелкотравными, горноовсяницевыми и зеленомошными растительными сообществами. Почвы лесные буроземы, по гранулометрическому составу среднесуглинистые, иногда с признаками оглеения (World…, 2015). Подстилка выражена в средней степени (2–4 см), представлена опадом бука, пихты и ели. Кислотность почвы 5.5–6.0, влажность (30–35%), температура 7–10°C, плотность 900–1500 кг/м3.
Буковые леса (доминант Fagus orientalis) представлены мелкотравными, мертвопокровными и рододендровыми сообществами. Почвы лесные буроземы по гранулометрическому составу среднесуглинистые. Подстилка хорошо выражена (4–10 см), представлена опадом бука. Кислотность почвы 6.0–6.5, влажность 30–40%, температура 7–10°C, плотность 700–1300 кг/м3.
Среди широколиственных лесов с буком (доминанты Carpinus betulus, Acer platanoides, Fagus orientalis, Quercus sp.) выделены лещиново-разнотравные, мелкотравные и рододендровые сообщества. Почвы лесные буроземы по гранулометрическому составу средне- и легкосуглинистые. Подстилка умеренно выражена (2–4 см) представлена опадом бука, дуба, граба, клена. Кислотность почвы 6.0–6.5, влажность 35–40%, температура 8–11°C, плотность 600–1300 кг/м3.
Кроме выделенных основных типов леса, фаунистические учеты дождевых червей проведены в черноольшаниках высокотравных и крупнопапоротниковых. Почвы в них лесные буроземы тяжелосуглинистые. Кислотность почвы 5.0–6.0, влажность 45–55%, температура 6–10°C, плотность 1500–2800 кг/м3.
Во всех растительных сообществах каждого типа леса проведены количественные учеты дождевых червей в двух типах местообитаний: почва и валеж 2–3 стадий разложения. В каждом типе леса взято от 28 до 36 почвенных проб (в каждом растительном сообществе от 8 до 16) размером 25 × 25 см, глубиной 30–40 см; обследовали валеж 2–3-й стадий разложения (Спирин, Широков, 2002). Измеряли длину и диаметр стволов. В каждом типе леса обследовано от 6 до 12 участков стволов деревьев длиной 1 м, диаметром от 20 до 60 см. Поскольку дождевые черви в валеже 2–3-й стадий разложения не проникали внутрь гниющих стволов, а обитали главным образом под корой, результаты учетов пересчитывали на 1 м2 как, в почве так и в валеже (Ashwood et al., 2019); для количественных расчетов червей в валеже использовали формулу площади боковой поверхности цилиндра (Гераськина, Шевченко, 2018).
Дождевые черви зафиксированы в 95% этиловом спирте. Биомасса червей определена путем взвешивания зафиксированных червей с наполненным кишечником на электронных весах. Видовой состав установлен по Кадастру и определителю дождевых червей фауны России (Всеволодова-Перель, 1997). Всего собрано и определено 650 особей. При сравнении выборок для выявления значимых различий использован непараметрический тест Краскелла-Уоллиса.
Ординация исследованных местообитаний с векторами почвенных характеристик (температура, влажность, кислотность, плотность почвы) проведена с помощью метода непрямого градиентного анализа на соответствие удаленному тренду и определением уровня корреляции (r) и уровня значимости (p) (Detrended Correspondence Analysis (DCА) в программах PC-ORD 5.0, SpeDiv, Past). Положение векторов определялось суммарной биомассой всех видов дождевых червей в почвенных пробах.
РЕЗУЛЬТАТЫ
В ходе почвенно-зоологических исследований обнаружены 15 видов дождевых червей, которые принадлежат к четырем морфо-экологическим группам (Перель, 1979; Всеволодова-Перель, 1997) и четырем типам ареалов (Рапопорт, 2011, 2013) (табл. 1).
Таблица 1.
Видовой состав, типы ареала и морфо-экологические группы дождевых червей в основных типах леса бассейна Большой Лабы (Северо-Западный Кавказ)
| Вид Lumbricidae | Ареал | Морфо-экологическая группа |
|---|---|---|
| Allolobophora chlorotica (Savigny 1826) | Палеарктический | Собственно почвенная |
| Dendrobaena schmidti (Michaelsen 1907) | Крымско-кавказский | Подстилочная, собственно почвенная |
| Dendrobaena mariupolienis Wyssotzky 1898 | Норная | |
| Dendrobaena attemsi Michaelsen 1902 | Средиземноморский | Подстилочная |
| Dendrobaena hortensis (Michaelsen 1890) | ||
| Dendrobaena veneta (Rosa 1886) | Почвенно-подстилочная | |
| Aporrectodea jassyensis (Michaelsen 1891) | Собственно почвенная | |
| Dendrobaena tellermanica Perel 1966 | Восточноевро-азиатский | |
| Dendrodrilus rubidus tenuis (Eisen 1874) | Космополиты | Подстилочная |
| Eiseniella tetraedra tetraedra (Savigny 1826) | ||
| Dendrobaena octaedra (Savigny 1826) | ||
| Eisenia fetida (Savigny 1826) | Почвенно-подстилочная | |
| Lumbricus rubellus Hoffmeister 1843 | ||
| Octolasion lacteum (Örley 1885) | Собственно почвенная | |
| Aporrectodea rosea (Savigny 1826) |
В темнохвойных (пихтово-еловых) лесах обитает 6 видов Lumbricidae, которые можно условно разделить на три морфо-экологические группы: подстилочные (D. attemsi, Dendrodrilus rubidus tenuis, D. octaedra), собственно почвенные (D. schmidti, A. jassensis) и норный (D. mariupolienis). Численность и биомасса червей в пихто-ельниках щитовниково-мелкотравных значимо выше, чем пихто-ельниках мертвопокровных и горноовсяницевых (табл. 2).
Таблица 2.
Численность (особей/м2, X ± SE) и общая биомасса (г/м2, X ± SE) дождевых червей в почвах основных типов леса бассейна реки Большая Лаба
| Вид | Тип леса | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| темнохвойный (N = 28) | смешанный (N = 28) | буковый (N = 34) | широколиственный с буком (N = 36) | |||||||||
| щитовниково-
мелкотравный (N = 12) |
мертвопокровный (N = 8) |
горноовсяницевый (N = 8) |
щитовниково-
мелкотравный (N = 10) |
горноовсяницевый (N = 9) |
зеленомошный (N = 9) |
мелкотравный (N = 16) |
мертвопокровный (N = 10) |
рододендровый (N = 8) |
лещиново-
разнотравный (N = 16) |
мелкотравный (N = 12) |
рододендровый (N = 8) |
|
| D. attemsi | + | + | + | + | + | + | + | + | + | + | + | + |
| Dendrodrilus rubidus tenuis | + | + | + | + | + | + | + | + | + | + | + | + |
| D. octaedra | 15.0 ± ± 4.1a, b | 6.0 ± ± 0.1a, b | 8.0 ± ± 1.1a, b | 3.0 ± ± 2.1 | 2.0 ± ± 0.9 | + | + | + | + | + | + | + |
| D. hortensis | 0 | 0 | 0 | 1.5 ± ± 1.5 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| D. schmidti подстилочная форма |
0 | 0 | 0 | 0 | 2.5 ± ± 1.7 | 0 | 0 | 0 | 0 | 4.5 ± ± 1.1 | 0 | 0 |
| E. fetida | 0 | 0 | 0 | + | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| D. tellermanica | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 8.0 ± ± 4.4 | 0 | 0 |
| Al. chlorotica | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1.0 ± ± 0.5 | 0 | 0 |
| D. schmidti собственно почвенная форма | 11.0 ± ± 4.5 | 8.5 ± ± 0.1 | 12.9 ± ± 2.3 | 16.9 ± ± 2.8a | 8.9 ± ± 1.1 | 8.9 ± ± 0.3 | 28.0 ± ± 4.5b | 25.0 ± ± 6.5b | 20.5 ± ± 0.8b | 35.0 ± ± 5.8b | 34.0 ± ±9.9b | 35.0 ± ± 8.5b |
| A. jassensis | 9.0 ± ± 2.0 | 4.5 ± ± 3.1 | 6.9 ± ± 1.0 | 9.4 ± ± 3.3 | 11.5 ± ± 0.3 | 6.1 ± ± 0.5a | 16.2 ± ± 4.9 | 12.2 ± ± 4.3 | 8.5 ± ± 0.9a | 43.5 ± ± 11.0a | 33.5 ± ± 12.9 | 21.5 ± ± 8.5 |
| D. mariupolienis | ++ | ++ | 2.0 ± ± 1.0 | 0 | 0 | 0 | 2.0 ± ± 0.7 | ++ | ++ | 4.0 ± ± 3.7 | ++ | 0 |
| O. lacteum | 0 | 0 | 0 | 0 | 2.0 ± ± 1.0b | 0 | 0 | 0 | 0 | 10.0 ± ± 3.4b | 0 | 0 |
| Общая численность | 35.0 ± ± 4.5 | 19.0 ± ± 2.2a | 29.8 ± ± 3.3 | 30.8 ± ± 5.5 | 26.9 ± ± 3.8 | 15.0 ± ± 0.3a | 46.2 ± ± 5.6a | 37.8 ± ± 4.1 | 29.0 ± ± 4.3 | 106.0 ± ± 14.3a, b | 69.5 ± ±10.2b | 56.5 ± ± 10.9b |
| Общая биомасса | 18.0 ± ± 4.8 | 8.9 ± ± 0.5a | 15.4 ± ± 1.5 | 22.4 ± ± 3.5a | 14.1 ± ± 3.1 | 14.0 ± ± 0.6 | 25.2 ± ± 6.4a | 19.2 ± ± 1.6 | 19.8 ± ± 0.8 | 41.0 ± ± 8.6a | 33.0 ± ± 6.5b | 25.0 ± ± 2.5b |
Подстилочные виды D. attemsi и Dendrodrilus rubidus tenuis обнаружены преимущественно в валеже пихты 3-й стадии разложения (численность 12.0 ± 3.7 особей/м2; биомасса 4.3 ± 0.5 г/м2) и единично в валеже ели 3-й стадии разложения (численность 2.0 ± 0.7 особей/м2, биомасса 1.3 ± ± 0.8 г/м2). D. attemsi и Dendrodrilus rubidus tenuis не обнаружены в горизонте подстилки темнохвойных лесов. D. octaedra населяет как подстилку, так и валеж. Общая биомасса подстилочных видов в валеже выше, чем в почве (рис. 2).
Рис. 2.
Биомасса подстилочных видов дождевых червей в основных типах леса бассейна р. Большая Лаба (Северо-Западный Кавказ).
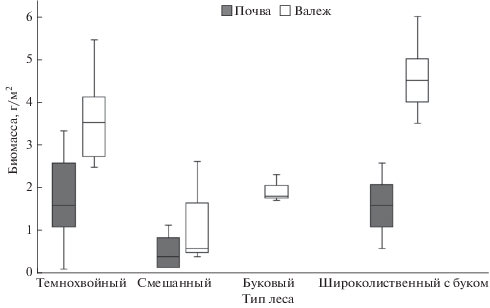
Собственно почвенные виды обнаружены только в почве (в валеже не найдены) доля ювенильных особей выше, чем половозрелых (60 и 40% соответственно).
Норный вид D. mariupolienis обнаружен как в почве, так и в валеже под корой пихты 3-й стадии разложения в темнохвойном горноовсяницевом сообществе. Единичные ходы этого вида и копролиты на поверхности почвы были отмечены и в темнохвойных щитовниково-мелкотравных растильных сообществах.
В смешанных (буково-пихтовые и буково-еловые) лесах обитает 8 видов Lumbricidae, которых можно условно разделить на три морфо-экологические группы: подстилочные (D. attemsi, Dendrodrilus rubidus tenuis, D. octaedra, D. hortensis, D. schmidti), собственно почвенные (D. schmidti, A. jassensis, O. lacteum), почвенно-подстилочный (E. fetida). Наиболее высокие показатели численности, биомассы и разнообразия червей выявлены в смешанных щитовниково-мелкотравных растительных сообществах; в смешанных зеленомошных и горноовсяницевых сообществах количественные показатели значимо ниже (табл. 2).
Подстилочные виды D. attemsi и Dendrodrilus rubidus tenuis выявлены только в валеже, не найдены в горизонте подстилке. Численность и биомасса их в валеже пихты (8.5 ± 0.7 особей/м2, биомасса 2.5 ± 0.6 г/м2) выше, чем в валеже бука (3.0 ± 0.5 особей/м2; биомасса 1.5 ± 0.6 г/м2). D. octaedra населяет как горизонт подстилки, так и валеж (преимущественно пихты). Редкая подстилочная форма D. schmidti обнаружена в горизонте подстилки только буково-пихтового горноовсяницевого леса. D. hortensis обнаружен в подстилке буково-елового щитовниково-мелкотравного сообщества. Общая биомасса подстилочных видов в смешанных лесах в подстилке выше, чем в валеже (рис. 2).
Почвенно-подстилочный вид E. fetida (половозрелые особи) найден в валеже ели 3-й стадии разложения в буково-пихтовом щитовниково-мелкотравном лесу. Других находок данного вида не было в ходе исследований лесов бассейна р. Большая Лаба.
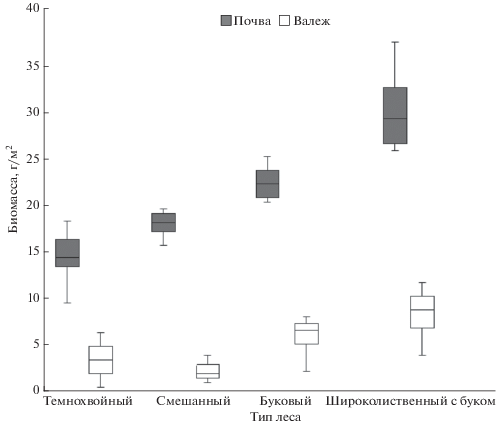
Собственно почвенные виды обитают как в почве, так и в валеже, в почве их биомасса значимо выше, чем в валеже (рис. 3). D. schmidti и A. jassensis встречены во всех типах растительных сообществ смешанных лесов, O. lacteum – только в буково-еловом мертвопокровном сообществе (табл. 2).
Рис. 3.
Биомасса собственно почвенных видов дождевых червей в основных типах леса бассейна р. Большая Лаба (Северо-Западный Кавказ).
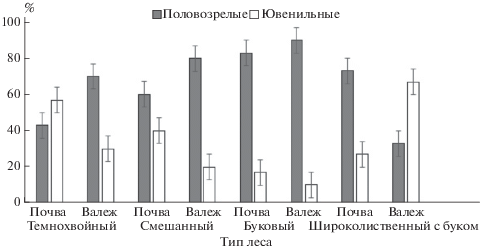
Доля половозрелых червей как в почве, так и в валеже смешанных лесов выше, чем ювенильных (рис. 4).
Рис. 4.
Доля по численности (%) половозрелых и ювенильных дождевых червей в почве и валеже основных типов леса бассейна р. Большая Лаба (Северо-Западный Кавказ).
В буковых лесах обитает 6 видов Lumbricidae, которых можно условно разделить на три морфо-экологические группы: подстилочные (D. attemsi, Dendrodrilus rubidus tenuis, D. octaedra), собственно почвенные (D. schmidti, A. jassensis) и норные (D. mariupolienis). Численность и биомасса червей в буковых мелкотравных сообществах значимо выше, чем в буковых мертвопокровных и буковых рододендровых сообществах (табл. 2).
Группа подстилочных видов обнаружена только в валеже (табл. 1). Подстилочные виды обитают под корой бука 2–3-й стадий разложения, численности и биомасса их низкие (5.0 ± 1.7 особей/м2, 2.3 ± 0.5 г/м2), почти 80% составляют половозрелые особи.
Группа собственно почвенных червей в почве составляет 98% от общей численности дождевых червей и 70% от их общей биомассы. Собственно почвенные виды более многочисленны в буковых мелкотравных сообществах (табл. 2). Собственно почвенные виды найдены в валеже бука 3-й стадии разложения (рис. 3). Как в почве, так и в валеже большая часть особей (80%) – половозрелые.
Норный вид D. mariupolienis найден только в почве букового мелкотравного сообщества, кроме того, ходы этого вида отмечены в буковых мертвопокровных и буковых рододендровых лесах.
В буковых лесах бо́льшую часть червей, населяющих почву и валеж, составляют половозрелые особи (рис. 4).
В широколиственных лесах с буком обитает 10 видов Lumbricidae, которых можно условно разделить на три морфо-экологические группы: подстилочные (D. attemsi, Dendrodrilus rubidus tenuis, D. octaedra, D. schmidti), собственно почвенные (D. schmidti, A. jassensis, D. tellermanica, O. lacteum, Al. chlorotica) и норные (D. mariupolienis). Численность, биомасса и разнообразие червей значимо выше в растительных сообществах широколиственных лесов с буком лещиново-разнотравных в сравнении с мелкотравными и рододендровыми сообществами (табл. 2).
Подстилочные виды: D. attemsi, Dendrodrilus rubidus tenuis, D. octaedra обнаружены только в валеже. Наиболее высокие показатели их численности выявлены в валеже клена и дуба 2–3 стадий разложения (15–20 особей/м2). Подстилочная форма D. schmidti найдена в подстилке буково-грабово-кленового лещиново-разнотравного сообщества. В этой группе более 50% особей – ювенильные черви.
В группе собственно почвенных видов 60% численности составляют D. schmidti и A. jassensis. Они обитают в почве и частично в валеже разных типов широколиственных лесов с буком. D. tellermanica и Al. chlorotica обнаружены только в почве лещиновых и лещиново-разнотравных сообществ. В валеже эти виды не найдены. O. lacteum обитает в почве лещиново-разнотравных растительных сообществ. Бо́льшая часть населения собственно почвенных видов представлена половозрелыми особями.
Норный вид D. mariupolienis обитает в почве грабово-буковых лещиново-разнотравных сообществ. Обнаружены как половозрелые, так и ювенильные особи. Ходы в почве отмечены в широколиственных лесах с буком мелкотравных и рододендровых.
В целом, в данных типах леса бо́льшая часть червей в почве – половозрелые особи, в валеже – ювенильные особи (рис. 4).
При обследовании черноольшаников обнаружены виды, не выявленные в ходе учетов в буковых, темнохвойных, смешанных и широколиственных лесах: подстилочный вид – Eiseniella tetraedra tetraedra, почвенно-подстилочные – D. veneta и L. rubellus и собственно почвенный – A. rosea. Кроме того, в черноольшаниках обитает собственно почвенная форма D. schmidti, другие виды люмбрицид в черноольшаниках не обнаружены.
ОБСУЖДЕНИЕ
В выделенных типах леса население дождевых червей различается по видовому составу, составу морфо-экологических групп, количественным характеристикам (численности и биомассе). Из 15 обнаруженных видов дождевых червей, 13 ранее указывались для лесов бассейна р. Большая Лаба (Рапопорт, 2017; Рапопорт, Цепкова, 2019). В наших исследованиях не выявлен A. c. trapezoides (Duges 1828), поскольку в большей степени приурочен к луговым биотопам (Рапопорт, 2017). Два вида отмечены нами впервые для этой территории: Al. chlorotica и D. mariupolienis. Несмотря на то, что Al. chlorotica широко распространен в Палеарктике, обычен в Закавказье, на Северо-Западном Кавказе встречается редко (Квавадзе, 1985), но высокие способности к расселению этого вида отмечены ранее (Всеволодова-Перель, 1997). Напротив, крымско-кавказский эндемик D. mariupolienis широко распространен на Северо-Западном Кавказе, но не встречен за пределами ареала, вероятно, не был отмечен ранее на этой территории из-за сложности учета норной группы видов, обитающих на больших глубинах.
Основополагающими для жизнедеятельности дождевых червей принято считать почвенные характеристики, которые в лесных почвах, помимо климата, рельефа и свойств материнской породы во многом определяются составом наземной растительности (Wedin, Tilman, 1990; Muys et al., 1992; Pastor et al., 1993; Binkley, Giardina, 1998). В нашем исследовании, согласно ординационной диаграмме (рис. 5), прежде всего различия влажности и кислотности оказались значимыми для распределения дождевых червей (длина вектора отражает степень корреляции почвенных показателей с осями). Ординация пробных площадей по параметру биомассы дождевых червей в четырех типах леса и почвенным характеристикам показывает приуроченность дождевых червей к умеренно влажным почвам широколиственных лесов с буком и буковым лесам. Показатель кислотности почв оказывает влияние на биомассу дождевых червей в смешанных и темнохвойных лесах, где выше кислотность (рН 5.0–6.0) чем в других типах леса, а биомасса червей значимо ниже (табл. 2). Показатели плотности почвы и температуры оказались менее значимы чем показатели кислотности и влажности для распределения дождевых червей и более благоприятны в смешанных лесах с буком и буковых лесах (рис. 5).
Рис. 5.
Ординация пробных площадей по параметру биомассы дождевых червей в основных типах леса в первых двух осях DCA с векторами почвенных характеристик (температура –T, влажность – W, кислотность – pH, плотность – P).
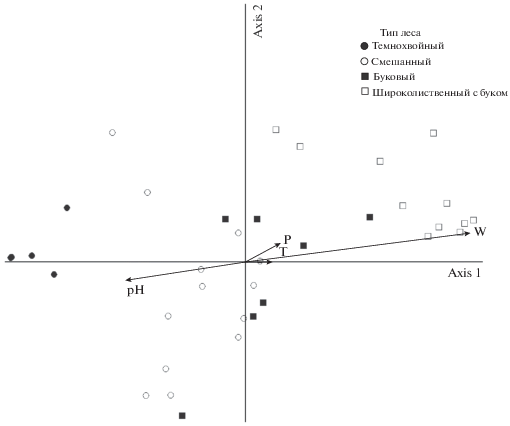
Показатель влажности почвы оказался более значимым в буковых и широколиственных лесах с буком (рис. 5). Благодаря влиянию бука восточного существенно уменьшается эвапотранспирация в этих лесах (Qulehle et al., 2006; Gebauer, 2010), как за счет меньшего испарения влаги с поверхности листьев (Backes, Leuschner, 2000; Kecher et al., 2009), так и за счет более мощной подстилки, которая также препятствует испарению влаги из почвы.
Более высокая кислотность подстилки и почвы в темнохвойных лесах (Shleynis, 1965; Noirfalise, Vanesse, 1975) связана с тем что опад преимущественно молодых деревьев пихты и ели способствует подкислению органогенных горизонтов (Орлова и др., 2011), что, в сочетании с низкой влажностью почв оказывает существенное влияние на снижение биомассы дождевых червей.
Влияние древесной растительности на свойства почвы, обеспечивающие трофические и топические условия для почвенной макрофауны, реализуется также через листовой опад и древесный отпад. В нашем исследовании наиболее высокие показатели видового разнообразия и биомассы дождевых червей выявлены в широколиственных лесах с буком, наименьшие – в темнохвойных лесах; смешанные и буковые леса занимают промежуточное положение.
Роль листового опада древесных растений в формировании трофических и топических условий для почвенной макрофауны хорошо изучена. В темнохвойных лесах отмечается высокое содержание вторичных метаболитов (полифенолов, танинов, лигнина), в опадающей хвое деревьев, которые подавляют развитие почвенных беспозвоночных за счет ингибирования кишечных энзимов (Schultz et al., 1992; Lavelle et al., 1993). Однако в настоящее время приводятся доказательства того, что в кишечнике дождевых червей синтезируются поверхностно-активные метаболиты (drilodefensins), нейтрализующие ингибирующее действие полифенолов (Liebeke et al., 2015). Вероятно, благодаря этим механизмам дождевые черви могут перерабатывать медленно разлагаемый опад и обитать в хвойных лесах. В темнохвойных лесах среднего течения р. Большая Лаба отмечены преимущественно подстилочные черви (Рапопорт, 2017). В нашем исследовании группа подстилочных видов также приурочена в основном к темнохвойным лесам (табл. 2; рис. 2), кроме того, в меньшей численности, чем в других типах леса выявлены собственно почвенные и норные черви.
Наиболее благоприятные трофические условия для дождевых червей формируются в широколиственных лесах, известно, что в насаждениях клена и ясеня биомасса червей в несколько раз выше, чем в хвойных, дубовых или буковых сообществах (Перель, 1979; Reich et al., 2005; Suаrez et al., 2006). В настоящее время ряд исследований показывает преимущество смешанного опада (лиственных и хвойных видов деревьев) для почвенной макрофауны (Hättenschwiler, Gasser, 2005; Sariyildiz, Küçük, 2008), т.к. опад хвойных (также опад дуба и бука) медленно разлагается и служит благоприятным местообитанием для подстилочной группы макрофауны, а доступный быстро разлагаемый опад лиственных – источником питательных веществ и энергии (Sayad et al., 2012). В горных лесах национального парка Хайних (Тюрингия, Германия) показано, что биомасса и функциональное разнообразие дождевых червей напрямую коррелируют с разнообразием состава древостоя и, напротив, в монодоминантных буковых лесах обитает только одна группа подстилочных червей (Cesarz et al., 2007). В нашем исследовании в буковых лесах обнаружены преимущественно собственно почвенные виды, как и по данным о населении дождевых червей в среднем течении р. Большая Лаба (Рапопорт, 2017), кроме того, выявлены подстилочные и норные виды, но они малочисленны.
Роль древесного отпада для поддержания устойчивого состояния населения дождевых червей в лесных сообществах исследована значительно меньше, чем почв. При этом в конце ХХ века были выделены “древесные” виды дождевых червей, обитающие, главным образом, под корой и в стволах гниющих деревьев (Bouche, 1972; Lee, 1985), и была выделена “люмбрицидная” стадия разложения древесины (Мамаев, 1960). Недавние исследования показывают, что ряд видов и даже групп дождевых червей часто остаются незамеченными при обследовании лесов, если исследователи не принимают во внимание такие местообитания как мертвая (Гераськина, 2016; 2016a; Воробейчик и др. 2018; Hendrix, 1996; Schmidt et al., 2015) и даже живая древесина (Römbke et al., 2017). Так, вид D. attemsi был исключен из категории “редких” в Ирландии после детального изучения беспозвоночных в мертвой древесине (Schmidt et al., 2015). Вид Allolobophoridella eiseni в буковых лесах Германии был обнаружен с помощью эклекторных ловушек на живых стволах деревьев в осенних и зимних учетах (Römbke et al., 2017). Поскольку наиболее тесно связаны с древесиной подстилочные виды (Dendrodrilus rubidus tenuis, D. attemsi, D. octaedra), в первую очередь, именно эта группа может быть неверно учтена. В нашей работе показано, что в весенне-летний сезон Dendrodrilus rubidus tenuis и D. attemsi во всех типах леса обнаруживаются только в мертвой древесине и не выявляются при разборе стандартных почвенных проб. D. octaedra встречается как в почве, так и в валеже (табл. 2). При этом биомасса подстилочных видов в валеже часто значимо выше, чем в горизонте подстилки (рис. 2), встречаются как половозрелые, так и ювенильные особи. Кроме подстилочных видов, в валеже часто обнаруживаются собственно почвенные и реже норные виды, как правило, только половозрелые особи, которые заселяют валеж при благоприятных условиях влажности (Гераськина, Шевченко, 2018). Биомасса собственно почвенных видов в несколько раз меньше в валеже, чем в почве во всех типах леса (рис. 3).
Роль напочвенного покрова в формировании населения дождевых червей представлена в небольшом числе работ (Babel et al., 1992; Curry, Schmidt, 2007; Campana et al., 2002; Milcu et al., 2008). В нашем исследовании показано, что во всех типах леса можно выделить растительные сообщества с богатым видовым составом, представленностью всех морфо-экологических групп, высокой численностью и биомассой дождевых червей: мелкотравные, щитовниково-мелкотравные, разнотравные, лещиново-разнотравные сообщества и, наоборот, растительные сообщества с низкими численностью, биомассой и разнообразием дождевых червей: мертвопокровные, зеленомошные и рододендровые (табл. 2). В первой группе сообществ обитают представители всех морфо-экологических групп дождевых червей. Во второй группе сообществ, как правило, сохраняются только собственно почвенные виды, норные встречены редко, подстилочные обитают только в валеже. На примере буковых лесов Франции показана пространственная неоднородность в населении дождевых червей в зависимости от напочвенного покрова: в мертвопокровных лесах (подстилку формирует исключительно опад бука) обитают только собственно почвенные черви; в лесах с папоротниками и мелкотравьем (чаще всего злаки) обитает несколько морфо-экологических групп дождевых червей (Campana et al., 2002). Химические свойства травянистой растительности оказывают прямое и косвенное влияние на почвенных сапрофагов. Известно, что норные черви способны усваивать не только отмершие, но и живые надземные части растений (Needham, 1957; van Rhee, 1963; Schönholzer, 1999). Опосредованное влияние состав травянистого яруса оказывает и на подстилочные, собственно почвенные и почвенно-подстилочные группы дождевых червей – высокое содержание хорошо растворимых углеводов в отмирающих частях надземной растительности обеспечивает хорошие трофические условия всем группам дождевых червей, питающихся как в почве, так и на поверхности (Satchell, 1967). В нашем исследовании среди всего ряда растительных сообществ наиболее благоприятные трофические условия формируются в лещиново-разнотравных широколиственных лесах с буком, где отмечены наибольшее разнообразие и биомасса люмбрицид.
ЗАКЛЮЧЕНИЕ
В лесах бассейна р. Большая Лаба население дождевых червей представлено подстилочными, собственно почвенными и норными видами. Почвенно-подстилочные виды встречаются редко. Биомасса подстилочных видов в валеже во всех типах леса выше, чем в горизонте подстилки. Собственно почвенные виды – самая многочисленная группа люмбрицид горно-лесного пояса – обитают в почве во всех типах леса, при благоприятных условиях расселяются и во фрагменты гнилой древесины. Норные виды в ходе учетов встречаются реже, но следы их жизнедеятельности (копролиты) и ходы в почве представлены практически во всех типах леса и растительных сообществах.
Наибольшее видовое разнообразие и биомасса дождевых червей выявлены в широколиственных лесах с буком, наименьшие показатели – в темнохвойных лесах; смешанные и буковые леса занимают промежуточное положение. В широколиственных лесах с буком и буковых лесах формируются оптимальные условия влажности, кислотности почвы для обитания разных групп дождевых червей. В широколиственных и смешанных лесах отмечены наиболее благоприятные трофические и топические условия. Среди растительных сообществ всех типов леса большей степени дождевыми червями заселены мелкотравные, щитовниково-мелкотравные, разнотравные и лещиново-разнотравные сообщества, менее заселены – мертвопокровные, зеленомошные и рододенровые сообщества.
Список литературы
Воробейчик Е.Л., Ермаков А.И., Нестеркова Д.В., Гребенников М.Е., Нестерков А.В., 2018. Восстановление сообществ почвенной мезофауны после прекращения промышленных выбросов // Материалы XVIII Всероссийского совещания по почвенной зоологии. Проблемы почвенной зоологии 22–26 октября 2018. М.: ИПЭЭ им. А.Н. Северцова РАН. С. 54.
Всеволодова-Перель Т.С., 1997. Дождевые черви фауны России. Кадастр и определитель. М.: Наука. 101 с.
Гвоздецкий Н.А., 1963. Кавказ. Очерк природы. М.: Географгиз. 264 с.
Гераськина А.П., 2016. Проблемы количественной оценки и учета фаунистического разнообразия дождевых червей в лесных сообществах // Russian Journal of Ecosystem Ecology. Т. 1. № 2. С. 1–9.
Гераськина А.П. 2016a. Население дождевых червей (Lumbricidae) в основных типах темнохвойных лесов Печоро-Илычского заповедника // Зоологический журнал. Т. 95. № 4. С. 394–405.
Гераськина А.П., 2016б. Дождевые черви (Oligochaeta, Lumbricidae) окрестностей пос. Домбай Тебердинского заповедника (Северо-Западный Кавказ, Карачаево-Черкессия) // Труды зоологического института РАН. № 4. С. 450–466.
Гераськина А.П., 2018. Динамика комплекса дождевых червей в ходе послерубочных сукцессий в лесах Северо-Западного Кавказа // Вопросы лесной науки. Т. 1. № 1. С. 1–14.
Гераськина А.П., Шевченко Н.Е., 2018. Биотопическая приуроченность дождевых червей в малонарушенных лесах Тебердинского биосферного заповедника // Лесоведение. № 6. С. 464–478.
Заугольнова Л.Б., Браславская Т.Ю., 2010. Методические подходы к экологической оценке лесного покрова в бассейне малой реки. М.: Товарищество научных изданий КМК. 383 с.
Квавадзе Э.Ш., 1985. Дождевые черви (Lumbricidae) Кавказа. Тбилиси: Мецниереба. 283 с.
Мамаев Б.М., 1960. Зоологическая оценка стадий естественного разрушения древесины // Известия АН СССР. Серия биологическая. № 4. С. 610–617.
Орлова М.А., Лукина Н.В., Камаев И.О., Смирнов В.Э., Кравченко Т.В., 2011. Мозаичность лесных биогеоценозов и плодородие почв // Лесоведение. № 6. С. 39–48.
Перель Т.С., 1979. Распространение и закономерности распределения дождевых червей фауны СССР. М.: Наука. 272 с.
Рапопорт И.Б., 2011. Сезонная активность дождевых червей (Oligochaeta, Lumbricidae) субальпийского пояса Центрального Кавказа // Известия Самарского НЦ РАН. Т. 13. № 5. С. 148–151.
Рапопорт И.Б., 2013. Высотное распределение дождевых червей (Oligochaeta, Lumbricidae) в центральной части Северного Кавказа // Зоологический журнал. № 1. С. 3–10.
Рапопорт И.Б., 2014. Биотопическое распределение дождевых червей (Oligochaeta, Lumbricidae) в Тебердинской заповедной территории с наиболее высокой степенью охраны (Архызский участок, Северо-Западный Кавказ) // Современные проблемы ООПТ и пути их решения. Материалы межрег. науч.-практ. конф. Воронеж: изд-во Воронежского гос. университета. С. 214–218.
Рапопорт И.Б., 2014a. Фауна и структура населения дождевых червей (Lumbricidae) в лесных сообществах Тебердинского заповедника и прилегающих территорий (Северо-Западный Кавказ) // Проблемы почвенной зоологии. Материалы XVII Всероссийского совещания по почвенной зоологии, посвященного 75-летию со дня рождения член-корреспондента РАН Д.А. Криволуцкого. С. 176–178.
Рапопорт И.Б., 2014б. Фауна, структура сообществ и высотно-поясное распределение дождевых червей (Oligochaeta, Lumbricidae) центральной части кубанского варианта поясности (Северо-Западный Кавказ, Республика Адыгея) // Вестник Адыгейского государственного университета. Серия 4: Естественно-математические и технические науки. Т. 147. № 4. С. 77–84.
Рапопорт И.Б., 2016. Дождевые черви (Oligochaeta, Lumbricidae) буферной зоны восточного отдела Кавказского заповедника (Северо-Западный Кавказ) // Природа, наука, туризм в ООПТ. Материалы международной юбилейной научной конференции, посвященной 20-летию Рицинского реликтового национального парка. С. 155–161.
Рапопорт И.Б., 2017. Видовой состав и биотопическая приуроченность дождевых червей (Oligochaeta, Lumbricidae) среднего течения р. Большая Лаба (Северо-Западный Кавказ) // Горные экосистемы и их компоненты. Материалы VI Всероссийской конференции с международным участием, посвященной Году экологии в России и 100-летию заповедного дела в России. С. 109–110.
Рапопорт И.Б., Цепкова Н.Л., 2015. Структура населения и топические преферендумы дождевых червей (Oligochaeta, Lumbricidae) в почвах эталонных лесных формаций бассейнов рек Теберда и Большой Зеленчук (Тебердинский заповедник, Северо-Западный Кавказ) // Изв. Самарского научного центра РАН. Т. 17. № 6. С. 33–39.
Рапопорт И.Б., Цепкова Н.Л., 2019. Население дождевых червей (Oligochaeta, Lumbricidae) бассейна среднего течения реки Большая Лаба (Северо-Западный Кавказ, буферная зона Кавказского Заповедника) // Зоологический журнал. Т. 98. № 5. С. 485–503.
Спирин В.А., Широков А.И., 2002. Особенности гумификации валежа в ненарушенных пихтово-еловых лесах Нижегородской области // Микология и фитопатология. Т. 36. № 3. С. 25–31.
Ashwood F., Vanguelova E.I., Benham S., Butt K.R., 2019. Developing a systematic sampling method for earthworms in and around deadwood // Forest Ecosystems, V. 6. № 1. P. 1–12.
Babel U., Ehrmann O., Krebs M., 1992. Relationships between earthworms and some plant species in a meadow // Soil Biology and Biochemistry. V. 24. № 12. P. 1477–1481.
Backes K., Leuschner C., 2000. Leaf water relations of competitive Fagus sylvatica and Quercus petraea trees during 4 years differing in soil drought // Canadian Journal of Forest Research. V. 30. P.335–346.
Binkley D.A.N., Giardina C., 1998. Why do tree species affect soils? The warp and woof of tree-soil interactions // Plant-induced soil changes: Processes and feedbacks. Dordrecht, Springer. P. 89–106.
Bouche M.B., 1972. Lombriciens de France. Ecologie et systematique. Paris: INRA. 671 p.
Bouche M.B., 1977. Strategies lombriciennes // Ecological Bulletins. № 25. P. 122–132.
Campana C., Gauvin S., Ponge J.F., 2002. Influence of ground cover on earthworm communities in an unmanaged beech forest: linear gradient studies // European Journal of Soil Biology. V. 38. № 2. P. 213–224.
Cesarz S., Fahrenholz N., Migge-Kleian S., Platner C., Schaefer M., 2007. Earthworm communities in relation to tree diversity in a deciduous forest // European Journal of Soil Biology. V. 43. P. 61–67.
Cortez J., 1998. Field decomposition of leaf litters: relationships between decomposition rates and soil moisture, soil temperature and earthworm activity // Soil Biology and Biochemistry. V. 30. № 6. P. 783–793.
Curry J.P., Schmidt O., 2007. The feeding ecology of earthworms – a review // Pedobiologia. V. 50. № 6. P. 463–477.
Gebauer T., 2010. Water turnover in species-rich and species-poor deciduous forests: xylem sap flow and canopy transpiration. PhD thesis. Göttingen: University of Göttingen. 128 p.
Hättenschwiler S., 2005. Effects of tree species diversity on litter quality and decomposition. Forest diversity and function: temperate and boreal systems. Ecological Studies. Ed. Scherer-Lorenzen M., Kohler C., Schulze E.-D. Heidelberg: Springer. V. 176. P. 149–164.
Hättenschwiler S., Gasser P., 2005. Soil animals alter plant litter diversity effects on decomposition // Proceedings of the National Academy of Sciences. V. 102. № 5. P. 1519–1524.
Hendriksen N.B., 1990. Leaf litter selection by detritivore and geophagous earthworms // Biology and Fertility of Soils. V. 10. № 1. P. 17–21.
Hendrix P.F., 1996. Earthworms, biodiversity, and coarse woody debris in forest ecosystems of the southeastern USA // Proceedings of the Workshop on Coarse Woody Debris in Southern Forests: Effects on Biodiversity. General Technical Report № SE-94. USDA Forest Service, Athens, GA. P. 43–48.
Jacob M., Weland N., Platner C., Schaefer M., Leuschner C., Thomas F.M., 2009. Nutrient release from decomposing leaf litter of temperate deciduous forest trees along a gradient of increasing tree species diversity // Soil Biology and Biochemistry. V. 41. № 10. P. 2122–2130.
Kecher P., Gebauer T., Horna V., Leuschner C., 2009. Leaf water status and stem xylem flux in relation to soil drought in five temperate broad-leaved tree species with contrasting water use strategies // Annals of Forest Science. V. 66. P. 101–115.
Lavelle P., 1988. Earthworm activities and the soil system // Biology and fertility of soils. V. 6. № 3. P. 237–251.
Lavelle P., Blanchart E., Martin A., Martin S., Spain A., 1993. A hierarchical model for decomposition in terrestrial ecosystems: application to soils of the humid tropics // Biotropica. V. 25. № 2. P. 130–150.
Lee K.E., 1985. Earthworms. Their ecology and relationships with soils and land use. New York: Academic press. P. 211–221.
Liebeke M., Strittmatter N., Fearn S., Morgan A.J., Kille P. et al., 2015. Unique metabolites protect earthworms against plant polyphenols // Nature communications. V. 6. P. 7869.
Milcu A., Partsch S., Scherber C., Weisser W.W., Scheu S., 2008. Earthworms and legumes control litter decomposition in a plant diversity gradient // Ecology. V. 89. № 7. P. 1872–1882.
Muys B., Lust N., Granval P.H., 1992. Effects of grassland afforestation with different tree species on earthworm communities, litter decomposition and nutrient status // Soil biology and biochemistry. V. 24. № 12. P. 1459–1466.
Needham A.E., 1957. Components of nitrogenous excreta in the earthworms Lumbricus terrestris, L. and Eisenia foetida (Savigny) // Journal of Experimental Biology. V. 34. № 4. P. 425–446.
Noirfalise A., Vanesse R., 1975. Consequenses de la monoculture des conifères pour la conservation des sols et pour le bilan hydrologique. Bruxelles: Association des Espaces Verts. 44 p.
Pastor J., Dewey B., Naiman R.J., McInnes P.F., Cohen Y., 1993. Moose browsing and soil fertility in the boreal forests of Isle Royale National Park // Ecology. V. 74. № 2. P. 467–480.
Qulehle F., Hofmeister J., Cudlin P., Hruska J., 2006. The effect of reduced atmospheric deposition on soil solution chemistry at a site subjected to long-term acidification, Nacetin, Czech Republic // Science of the Total Environment. V. 370. № 2-3. P. 532–544.
Reich P.B., Oleksyn J., Modrzynski J., Mrozinski P., Hobbie S.E. et al., 2005. Linking litter calcium, earthworms and soil properties: a common garden test with 14 tree species // Ecology letters. V. 8. № 8. P. 811–818.
Römbke J., Blick T., Dorow W.H.O., 2017. Allolobophoridella eiseni (Lumbricidae), a truly arboreal earthworm in the temperate region of Central Europe // Soil Organisms. V. 89. P. 75–84.
Sariyildiz T., Küçük M., 2008. Litter mass loss rates in deciduous and coniferous trees in Artvin, northeast Turkey: Relationships with litter quality, microclimate, and soil characteristics // Turkish journal of Agriculture and Forestry. V. 32. № 6. P. 547–559.
Satchell J.E., 1967. Lumbricidae. Soil biology. Ed. A. Burges, F. Raw. London: Academic Press. P. 259–322.
Sayad E., Hosseini S.M., Hosseini V., Salehe-Shooshtari M.H., 2012. Soil macrofauna in relation to soil and leaf litter properties in tree plantations // Journal of Forest Science. V. 58. № 4. P. 170–180.
Schelfhout S., Mertens J., Verheyen K., Vesterdal L., Baeten L. et al., 2017. Tree species identity shapes earthworm communities // Forests. V. 8. № 3. P. 85–105.
Scheu S., 2005. Linkages between tree diversity, soil fauna and ecosystem processes. Forest diversity and function: temperate and boreal systems. Ecological Studies. Ed. M. Scherer-Lorenzen, C. Köhler, E.-D. Schulze. Heidelberg: Springer. V. 176. P. 211–233.
Schmidt O., Shutenko G.S., Keith A.M., 2015. Multiple records confirm presence of Dendrobaena attemsi (Oligochaeta: Lumbricidae) in Ireland // Irish Naturalists’ Journal. V. 34. P. 110–112.
Schönholzer F., Hahn D., Zeyer J., 1999. Origins and fate of fungi and bacteria in the gut of Lumbricus terrestris L. studied by image analysis // FEMS Microbiol. Ecol. V. 28. P. 235–248.
Schultz J.C., Hunter M.D., Appel H.M., 1992. Antimicrobial activity of polyphenols mediates plant-herbivore interactions // Plant polyphenols. Boston: Springer. P. 621–637.
Shleynis R.I., 1965. Difference in soil formation beneath spruce and oak forests in Northwestern USSR // Soviet Soil Science-USSR. № 3. P. 226.
Suarez E.R., Fahey T.J., Yavitt J.B., Groffman P.M., Bohlen P.J., 2006. Patterns of litter disappearance in a northern hardwood forest invaded by exotic earthworms // Ecological Applications. V. 16. № 1. P. 154–165.
Szlavecz K., Chang C.H., Bernard M.J., Pitz S.L., Xia L. et al., 2018. Litter quality, dispersal and invasion drive earthworm community dynamics and forest soil development // Oecologia. V. 188. № 1. P. 237–250.
Van Rhee J.A., 1963. Earthworm activities in the breakdown of organic matter in agricultural soils // Soil Organisms: Proceedings of the Colloquium on Soil Fauna, Soil Microflora and Their Relationships. Ed. J. Doeksen, J. Van Der Drift. Amsterdam: North-Holland Publishing Company. P. 55–59.
Wedin D.A., Tilman D., 1990. Species effects on nitrogen cycling: a test with perennial grasses // Oecologia. V. 84. № 4. P. 433–441.
World Reference Base for Soil Resources 2014, International soil classification system for naming soils and creating legends for soil maps, 2015. World Soil Resources Reports / IUSS Working Group. Rome: FAO. № 106. 203 p.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


