Зоологический журнал, 2021, T. 100, № 11, стр. 1214-1223
Особенности термобиологии партеногенетических скальных ящериц (Darevskia armeniaca и Darevskia unisexualis) и обоеполого вида Darevskia valentini (Lacertidae, Squamata)
О. Д. Николаев a, *, Д. А. Белова a, Б. А. Новиков a, И. Б. Симис a, Р. К. Петросян b, М. С. Аракелян b, В. А. Комарова c, Э. А. Галоян c, d, **
a ГБОУ “Школа № 179”
125009 Москва, Россия
b Ереванский государственный университет
0025 Ереван, Республика Армения
c Институт проблем экологии и эволюции имени А.Н. Северцова РАН
119071 Москва, Россия
d Зоологический музей Московского государственного университета
имени М.В. Ломоносова
125009 Москва, Россия
* E-mail: fencov@yandex.ru
** E-mail: saxicola@mail.ru
Поступила в редакцию 03.07.2020
После доработки 22.09.2020
Принята к публикации 03.10.2020
Аннотация
Рассмотрены некоторые аспекты термобиологии трех видов ящериц рода Darevskia (партеногенетических Darevskia armeniaca и Darevskia unisexualis и отцовского для них бисексуального Darevskia valentini) и сравнены особенности термобиологии этих видов в условиях совместного обитания. Для этого в летний период 2007, 2013, 2016 и 2018 года мы отлавливали представителей интересующих нас видов ящериц в различных местах в Армении: Кучаке, Дилижане, Мец Сепасаре и Артавазе. Мы измеряли длину тела (SVL) и клоакальную температуру тела отловленных ящериц, температуру воздуха и субстрата в момент поимки. На основе полученных данных было установлено, что исследованные виды значимо различаются по некоторым термобиологическим характеристикам. Температура активности D. unisexualis на несколько градусов ниже, чем у других видов (T = 22.0–32.8°C против 25.6–35.6°C у D. armeniaca и 25.3–35.4°C у D. valentini). В условиях совместного обитания температуры субстрата и воздуха по-разному влияют на температуру тела разных исследованных видов.
Скальные ящерицы принадлежат к роду Darevskia (Lacertidae), который разделен на семь надвидовых комплексов (raddei, rudis, saxicola, caucasica, chlorogaster, defilippii и steineri (Arribas, 1999; Ahmadzadeh et al., 2013)) и включает 34 вида, среди которых семь размножается партеногенетически (Ahmadzadeh et al., 2013). Последние образовались в результате гибридизации обоеполых видов (Даревский, 1967; Даревский и др., 2000). По одной версии, партеногенетический вид D. armeniaca (Mehely 1909) возник в результате гибридизации особей, принадлежащих обоеполыми видам: самца D. valentini (Boetlger 1892) (группа rudis) и самки D. mixta (Mehely 1909) (группа raddei) (Fu et al., 2000). По другой версии, происхождение этого вида связано с гибридизацией самца обоеполого вида D. valentini и партеногенетической самки D. dahli (Darevsky 1957) (Tarkhnishvili et al., 2017). Другой партеногенетический вид, D. unisexualis (Darevsky 1966), произошел в результате гибридизации самки D. raddei nairensis (Darevsky 1967) (группа raddei) и самца D. valentini (группа rudis) (Murphy et al., 1996). Несмотря на значительное время расхождения основных филогенетических клад в роде Darevskia – около 18 млн лет (Murtskhvaladze et al., 2020) – скальные ящерицы представляют собой группу сходных с биологической точки зрения видов, адаптированных к жизни в горах (Даревский, 1967). Гибридное происхождение партеногенетических видов скальных ящериц и наличие геномов двух видов в пределах одного организма (Spangenberg et al., 2020), как и у других видов рептилий (Sites et al., 1990), косвенно свидетельствуют о заимствовании дочерними видами адаптивных свойств родителей (Anderson, Stebbins, 1954).
Современные ареалы обоеполого родительского вида D. valentini и его дочерних партеногенетических видов D. armeniaca и D. unisexualis значительно перекрываются (Arakelyan et al., 2011). В центральной Армении они образуют совместные поселения, где одновременно можно встретить оба партеногенетических вида, а иногда – все три вида вместе (Danielyan et al., 2008; Галоян, 2010). В этом случае они используют одни укрытия и места для нагревания и постоянно контактируют (Галоян, 2013). Известно, что суточная активность D. armeniaca и D. unisexualis различна: D. armeniaca утром позже, чем D. unisexualis, выходят из ночевочных укрытий, а вечером позже скрываются в них (Abrahamyan et al., 2014). Но некоторые особенности термобиологии этих трех видов остаются неисследованными. В частности, остается непонятным, как зависит их температура от температуры воздуха и субстрата, нет данных о температуре активности D. unisexualis; неизвестно, схожи ли особенности термобиологии D. armeniaca, D. unisexualis и D. valentini в условиях совместного обитания. Мы поставили перед собой цель определить термобиологические характеристики этих видов в условиях синтопии и аллопатрии.
Исследуемые виды
Скальные ящерицы распространены на Кавказе, в Крыму и в Малой Азии. Они тяготеют к местообитаниям с большим количеством скал или камней, которые используют как укрытия (Даревский, 1967; Галоян, 2010). Некоторые виды (D. brauneri (Mehely 1909), D. mixta (Mehely 1909)) в лесах переходят к древесному образу жизни, а некоторые уходят от скал в степи и луга (D. valentini, D. caucasica (Mehely 1909)). Скальные ящерицы используют не только естественные местообитания, но и антропогенные (каменные стены, развалины построек, мосты и плотины), причем иногда их численность в искусственных местообитаниях даже выше, чем в природных (Даревский, 1967; Галоян, 2010).
Армянская ящерица (D. armeniaca) встречается в Армении, Грузии, северо-восточной Турции и северо-западном Азербайджане. Длина половозрелых особей составляет 51–73 мм (SVL). Окраска спины от зеленой или оливковой до бурой. От головы к хвосту по середине спины идет затылочная полоса, состоящая из отдельных вытянутых поперек тела пятен. По бокам спины идут височные полосы, образованные слитыми темными кольцами с белыми центрами. В районе передних конечностей два пятна имеют голубые центры. Ниже височных расположены нижневисочные полосы, также состоящие из слившихся темных кружков. Брюхо бледно-желтое, иногда с голубыми или черными пятнами на крайних пластинках. Голова покрыта мелкими темными пятнами (Даревский, 1967).
Белобрюхая ящерица (D. unisexualis) встречается в Армении, места ее обитания разобщены и расположены на границах ареала D. r. nairensis. Длина от кончика носа до клоакальной щели у половозрелых особей составляет 56–70 мм. Верхняя часть тела бежево-серая, покрыта небольшими темными пятнами. По бокам тела расположены ряды более крупных соприкасающихся пятен, все они, кроме одного голубого на уровне передних конечностей, черные с белыми центрами (Даревский, 1967).
Ящерица Валентина (D. valentini) принадлежит к группе видов rudis. Этот вид встречается в Турции, Грузии и Армении. Окраска спины представителей этого вида варьирует от желто-оливковой до буро-зеленой. Затылочная полоса состоит из крупных черных или бурых пятен неправильной формы. Височные полоски состоят из 1–3 рядов слившихся темных кружков с голубыми центрами (Даревский, 1967). Этот вид считается отцовским для D. armeniaca и D. unisexualis.
Места и время исследования
В работу вошли данные из четырех мест проведения исследований. Мы выбрали пробные площади, где производили необходимые измерения. На первой пробной площади обитали D. armeniaca. Место проведения исследований находилось в Дилижанском национальном парке (40°45′ с.ш., 44°52′ в.д., Тавушский р-н, в окрестностях г. Дилижан, 1400 м над ур. м.), в буково-грабовом лесу. Пробная площадь располагалась на дне долины между двумя водоразделами на южном макросклоне Иджеванского хребта. По дну ущелья проходит русло ручья, которое частично пересыхает летом. Склоны долины крутые – до 50°. Главные лесообразующие породы леса – дуб (Querqus sp. p. и граб Carpinus orientalis) с примесью рябины (Sorbus sp.) и березы (Betula sp.). Поверхность образована “крупнокаменистым склоном”, на котором хорошо задерживается опад, мощность которого достигает 15–20 см, встречаются одиночные растения, а в некоторых местах растительность образует заросли. Работу проводили в период с 21 июня по 3 августа 2007 г.
Вторая пробная площадь, где обитали D. armeniaca, D. unisexualis и D. valentini, располагалась в окрестностях г. Апаран (Арагацонтская обл.), в районе деревни Кучак (40°31″ с.ш., 44°23″ в.д.; 1920 м над ур. м.) на северном макросклоне г. Арагац. Ландшафт представляет собой высокогорный разнотравный луг, на котором встречаются каменистые холмы моренного происхождения высотой 20–30 м, где и живут ящерицы. Выходы базальтовых коренных горных пород, расположенные вдоль дороги, пронизаны глубокими щелями, в которых ящерицы зимуют. На вершине холмов растут кусты шиповника (Rosa sp.). Исследования проводили в июне и июле 2013 г.
Третья пробная площадь располагалась на северо-западе Армении в Ширакской обл., в окрестностях населенного пункта Мец Сепасар, на высоте 2000 м над ур. м. (41.031482 с.ш., 43.829823 в.д.). В сегментах с большим количеством камней наблюдалось больше ящериц. Травянистый ярус преимущественно не превышал высоты в 20–30 см, достигая максимально 40–50 см, и слагался в основном из Bromus sp., Poa sp., Veronica sp., Trifolium spp., Myosotis alpestris, Ornithogalum sp., Rumex confertus, Tragopogon pratensis. Сбор материала по D. valentini производили с 13 мая по 15 июня 2016 г.
Четвертая пробная площадь располагалась в окрестностях деревни Артаваз (Армения, Котайская обл., 40°37′ с.ш., 44°34′ в.д., высота – около 2000 м над ур. м.) на небольшом участке “неуправляемого средневлажного травяного сообщества” (тип Е2.7; Файвуш, Алексанян, 2016). Здесь совместно обитали D. armeniaca и D. unisexualis, однако в выборках были только особи первого вида. Среди растений на площадке преобладали различные злаковые; бобовые, представленные в основном клевером ползучим (Trifolium repens), клевером полевым (Trifolium campestre) и клевером сомнительным (Trifolium ambiguum); астровые, представленные одуванчиком лекарственным (Taraxacum officinale) и тысячелистником Биберштейна (Achillea biebersteinii). Также повсеместно встречался подорожник ланцетолистный (Plantago lanceolata). Площадка была ограничена с трех сторон дорогой, а с четвертой – левым берегом реки Мармарик. На ней находилось бетонное здание с трещинами в северной стене. Эти трещины служили ящерицам укрытием. Кроме того, площадка была с востока на запад рассечена неглубоким оврагом, заполненным бетонными плитами. В щелях между ними также укрывались ящерицы. Здесь исследования проводили 16 и 17 июня 2018 г.
МАТЕРИАЛЫ И МЕТОДИКА
Сбор полевого материала
Полевые исследования проводили в период активности ящериц в первой половине дня. Ящериц отлавливали с помощью удочки с подвижной петлей. Сразу после поимки у ящерицы измеряли длину тела от кончика носа до клоакальной щели (SVL) линейкой с точностью до 1 мм и клоакальную температуру тела термопарой (AZ8803) с точностью до 0.1°С. Ящериц во время измерений мы держали в руках, поэтому старались измерить температуру в течение 10 с, чтобы температура тела ящериц не успела измениться из-за контакта с руками и стресса животного. После проведения необходимых манипуляций с ящерицей термопарой измеряли температуру субстрата, на котором была отловлена ящерица, и температуру воздуха около поверхности субстрата на высоте 2–3 см.
В работу не вошли данные о неполовозрелых особях, длина которых составляла менее 50 мм (Даревский, 1967). Скорость нагревания и охлаждения у мелких ящериц выше, чем у крупных того же вида (Carothers et al., 1997), отчего включение их в выборку могло исказить полученные результаты. В настоящем исследовании мы использовали данные по 22 особям D. armeniaca из окрестностей Артаваза, 26 особям D. armeniaca и 21 особи D. unisexualis из Кучака, 18 особям D. armeniaca из Дилижана, 8 самцам и 21 самке D. valentini из Мец Сепасара и 19 самцам и 4 самкам D. valentini из Кучака.
Под диапазоном температур активности (activity temperature range) принято понимать диапазон температур тела рептилии, при котором она может проявлять такие формы активности как перемещения, питание, охота и т.д., хотя может и оставаться неподвижной или регулировать температуру тела (Bauwens et al., 1996; Espinoza, Tracy, 1997). Для достижения и поддержания этого показателя температур рептилии используют физиологические (затемнение или осветление покровов, увеличение или уменьшение частоты сердечных сокращений) и поведенческие (переход из освещенных участков в тень и наоборот, перемещение между субстратами с разной температурой) реакции (Espinoza, Tracy, 1997). В Артавазе мы отлавливали только ящериц, которые лежали вблизи убежища более или менее неподвижно на освещенной солнцем поверхности (т.е., вероятно, занимались нагреванием, или баскингом). В других местах проведения исследования отлавливали только ящериц, очевидно проявлявших формы рутинной активности – перемещение, кормление и т.д. (Черлин, 2015).
Обработка материала
Для каждого вида ящериц мы находили среднюю арифметическую температуры тела активности ящериц (Huey, 1982; Espinoza, Tracy, 1997), что позволило сравнить полученные данные с имеющимися материалами по другим видам скальных ящериц (Целлариус, Целлариус, 2001). Мы также рассчитывали для каждой выборки клоакальных температур тела ящериц медиану (Me). Кроме того, для описания температуры тела изучаемых ящериц мы строили графики зависимости клоакальной температуры тела от температуры субстрата и окружающей температуры воздуха и приводили уравнения регрессии для этих зависимостей (во всех уравнениях x − температура воздуха или субстрата, y − клоакальная температура тела).
Мы разделили выборку армянских ящериц из Артаваза на две группы: достигшие и не достигшие температуры активности. Для этого мы сравнили клоакальные температуры тела ящериц из Артаваза с клоакальными температурами тела ящериц из объединенной выборки из Кучака и Дилижана, поскольку достоверных различий между температурами тела ящериц из этих мест не выявлено (тест Манна–Уитни, N = 26, 18 соответственно, p = 0.684).
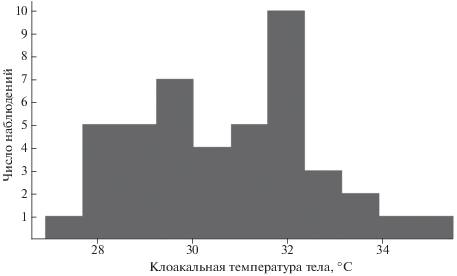
Мы считали, что эти выборки отражают диапазон температур активности армянских ящериц, поскольку в этих местах проведения исследований температуру тела измеряли только у активных особей, ориентируясь на их поведение. В объединенной выборке армянских ящериц из Кучака и Дилижана мы нашли среднее значение температуры тела и значения, ограничивающие доверительный интервал в 95% (их рассчитывали как M ± 2SD, где M – среднее значение, SD – стандартное отклонение; М = 30.7, SD = 1.84, М + 2SD = 34.41, М-2SD = 27.05). Расчет по такой формуле мы считаем возможным, т.к. распределение значений клоакальной температуры тела в объединенной выборке из Кучака и Дилижана значимо не отличается от нормального (Тест Шапиро–Уилка, p = 0.192, N = 44, рис. 1). Затем из выборки температур тел ящериц из Артаваза убрали значения, меньшие нижней границы рассчитанного доверительного интервала.
Все вычисления мы проводили и с выборкой из Артаваза, из которой не убирали данные о ящерицах, температура которых была ниже рассчитанного доверительного интервала. Выборки, из которых убрали или не убрали значения температур тела ящериц ниже рассчитанного доверительного интервала, мы называли соответственно “усеченной” и “неусеченной”.
Для анализа данных по значениям температуры использовали непараметрические методы (тест Манна–Уитни, тест Краскелла–Уоллиса, коэффициент корреляции Спирмана). Для сравнения коэффициентов уравнений регрессии температуры тела ящериц и температуры окружающей среды использовали тест Чоу со статистикой с распределением χ2. Перед проведением теста Чоу исследуемые выборки проверили на равенство остаточных дисперсий с помощью F-критерия. Если по результатам этого теста мы обнаруживали значимое различие остаточных дисперсий, тест Чоу не проводили. Для всех анализов альтернативную гипотезу принимали при р < 0.05. Данные обрабатывали с помощью языка R, пакетов strucchange (Zeileis et al., 2002) и dunn.test (Dinno, 2017), графики строили с помощью пакета ggplot2 (Wickham, 2016).
РЕЗУЛЬТАТЫ
Температура воздуха
Мы обнаружили значимые различия между температурами воздуха в Мец Сепасаре и Дилижане и Мец Сепасаре и Кучаке, значимых различий между другими точками не обнаружили (тест Краскелла-Уоллиса, тест Данна, метод Хольма) (табл. 1 ).
Влияния размера тела и пола на температуру
Мы не выявили достоверной связи между длиной тела ящериц и их клоакальной температурой для D. armeniaca из Дилижана, Кучака и Артаваза с учетом и без учета ящериц, температура которых была ниже рассчитанного нами диапазона температур тела активных ящериц (Rs = 0.29, 0.1, 0.09, 0.007, p = 0.249, 0.644, 0.703, 0.977; N = 18, 26, 21, 22 соответственно) и D. unisexualis из Кучака (Rs = = 0.03, p = 0.915, N = 20). Также мы не обнаружили значимых различий между температурами активности самцов и самок D. valentini (тест Манна–Уитни, p = 0.634, N = 27, N = 25 соответственно), поэтому в дальнейших анализах данные по самцам и самкам мы использовали как единую выборку.
Температура активности
Достоверных различий между температурами активности D. armeniaca из Кучака, Артаваза и Дилижана с использованием “усеченной” и “неусеченной” выборок из Артаваза (Тест Краскелла-Уоллиса, р = 0.192, 0.221; N = 26; 21, 22; 18 соответственно) и D. valentini из Кучака и Мец Сепасара (Тест Манна–Уитни, p = 0.549, N = 23, 29 соответственно) мы не обнаружили, поэтому для вычисления температур активности D. armeniaca и D. valentini мы объединили выборки из разных мест (табл. 2 ).
Таблица 2.
Показатели клоакальной температуры тела исследованных ящериц
| Вид | Пол | Место | M | Med | Max | Min | N | SD | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Отдельно | Общая выборка | Отдельно | Общая выборка | Отдельно | Общая выборка | Отдельно | Общая выборка | Отдельно | Общая выборка | ||||
| D. armeniaca | Самки | Артаваз | 31.8 | 31.1 | 31.7 | 30.95 | 35.6 | 35.6 | 27.3 | 27.2 | 21(22) | 2.35 (2.66) | 2.08 (2.17) |
| Кучак | 30.9 | 31 | 35 | 27.8 | 26 | 1.94 | |||||||
| Дилижан | 30.6 | 30.85 | 33.4 | 27.2 | 18 | 1.72 | |||||||
| D. unisexualis | Самки | Кучак | 27.8 | – | 29 | – | 32.8 | – | 22 | – | 21 | 3.07 | – |
| D. valentini | Самки | Мец Сепасар | 31.4 | 31.5 | 31.3 | 31.6 | 35.4 | 35.4 | 26.7 | 25.3 | 21 | 2.52 | 2.17 |
| Кучак | 32.8 | 32.65 | 34.6 | 31.2 | 4 | 1.52 | |||||||
| Самцы | Мец Сепасар | 31.2 | 31.15 | 34.2 | 28.3 | 8 | 2.19 | ||||||
| Кучак | 31.4 | 31.8 | 33.8 | 25.3 | 19 | 1.91 | |||||||
Нижняя граница температуры активности армянских ящериц по данным объединенной “усеченной” выборки из Артаваза, Кучака и Дилижана составила 27.2°С, по данным “неусеченной” выборки – 25.6°C, верхняя граница – 35.6°С. Среднее значение температуры тела с учетом данных “усеченной” выборки равняется 31.1 (±2.08)°С, медиана – 31°C, с учетом данных “неусеченной” выборки среднее значение равняется 31 (±2.17)°C, медиана – 30.95°C.
Диапазон температур тела белобрюхих ящериц находился в пределах 22–32.8°С. При этом среднее значение составило 27.8 (±3.25)°С, а медиана – 29°С и достоверно отличалась от медианы температур тела армянских ящериц с использованием данных как “усеченной”, так и “неусеченной” выборки из Артаваза (тест Данна, метод Хольма, p < 0.001).
Сравнение температур активности партеногенетических видов с температурой активности обоеполого родительского вида D. valentini показало, что она сходна с D. armeniaca при анализе “усеченной” и “неусеченной” выборок из Артаваза и значимо отличается от D. unisexualis (тест Данна, метод Хольма, p = 0.127, p = 0.102, p < 0.001 соответственно) и составляет в среднем 31.5 (±2.17)°С (25.3–35.4°С, Ме = 31.6°С, N = 52) (рис. 2, табл. 2 ).
Рис. 2.
Температуры активности D. armeniaca из Артаваза (A1), Кучака (A2) и Дилижана (A3), D. unisexualis из Кучака (U) и D. valentini из Мец Сепасара (V1) и Кучака (V2). Черная линия – медиана; границы ящика – верхняя и нижняя квартили; концы усов – наименьшее и наибольшее значения, находящиеся в пределах 1.5 интерквартильных размахов; точка – выброс.
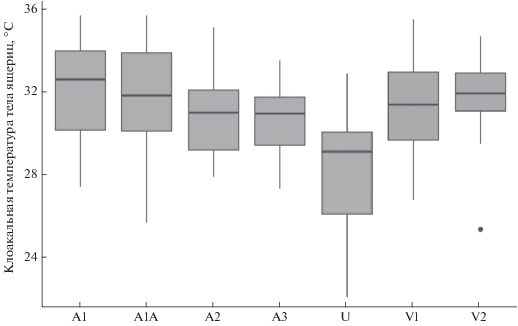
Связь клоакальной температуры ящериц с температурой воздуха и субстрата
Мы выявили положительную связь между температурой воздуха в приземном слое и клоакальной температурой тела D. armeniaca в Артавазе в “усеченной” (Rs = 0.477, N = 21, p = 0.029, y = = 0.3382x + 24.3588) и “неусеченной” (Rs = 0.51, N = 22, p = 0.016, y = 0.3854x + 23.0622) выборках, Дилижане (Rs = 0.477, N = 18; p = 0.045; y = 0.2734x + + 25.0264) и Кучаке ( Rs = 0.151, p = 0.459, N = 26, y = 0.3404x + 24.2269), при этом разницы в коэффициентах уравнений регрессии между Кучаком и Дилижаном (тест Чоу, N = 26, 18, p = 0.668, рис. 3B, 3C), Дилижаном и Артавазом (тест Чоу, N = 18, 21, p = 0.539, рис. 3A, 3B) и Артавазом и Кучаком с использованием “усеченной” (тест Чоу, N = 21, 26, p = 0.991; рис. 3A, 3C) и “неусеченной” (тест Чоу, N = 22, 26, p = 0.922) выборок мы не обнаружили. Температура субстрата и клоакальная температура тела D. armeniaca из Артаваза в “усеченной” (Rs = 0.61, p = 0.003, N = 21, y = 0.31x + + 23.09) и “неусеченной” (Rs = 0.568, p = 0.006; N = 22; y = 0.355x + 21.631) выборках и выборке из Кучака (Rs = 0.746, p < 0.001, N = 26, y = 0.2851x + + 21.8152) достоверно связаны (рис. 3E, 3G). Однако коэффициенты уравнений регрессии клоакальной температуры тела и температуры субстрата и клоакальной температуры тела и температуры воздуха у D. armeniaca из “усеченной” (тест Чоу, N = 21, p = 0.026; рис. 3A, 3E) и “неусеченной” (тест Чоу, N = 22, p = 0.026) выборок из Атраваза значимо различаются (рис. 3C, 3G).
Рис. 3.
Связь клоакальной температуры D. armeniaca с температурой воздуха в Артавазе (A), Дилижане (B) и Кучаке (С), связь клоакальной температуры тела D. unisexualis с температурой воздуха (D) и субстрата (F), связь клоакальной температуры тела D. armeniaca с температурой субстрата в Артавазе (E) и Кучаке (G). Связь клоакальной температуры тела D. valentini с температурой субстрата в Мец Сепасаре (H) и Кучаке (J) и с температурой воздуха в Мец Сепасаре (I) и Кучаке (K). *Статистически значимые связи, белая точка – данные об этой особи были удалены из “усеченной” выборки.
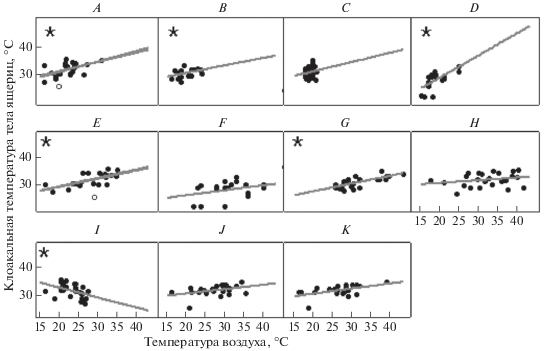
Температура воздуха в приземном слое и клоакальная температура D. unisexualis из Кучака оказались связаны (Rs = 0.62, p = 0.004, N = 20, y = = 0.8085x + 12.7479). Связи между температурой субстрата и клоакальной температурой тела D. unisexualis из Кучака мы не выявили (Rs = = 0.254, p = 0.28, N = 20, y = 0.1833x + 22.3913). Коэффициенты уравнений регрессии клоакальной температуры тела и температуры субстрата и клоакальной температуры тела и температуры воздуха у D. unisexualis из Кучака (тест Чоу, N = 20, p = = 0.005, рис. 3D, 3F) значимо различаются.
Корреляция между клоакальной температурой тела D. valentini и температурой субстрата оказалась статистически незначимой в выборках из Кучака и Мец Сепасара (Rs = 0.32, 0.25, p = 0.134, 0.233, N = 23, 24, y = 0.1598x + 27.2479; y = 0.097x + + 28.645 соответственно), но мы обнаружили связь клоакальной температуры тела и температуры воздуха в группах из Кучака (Rs = 0.42, p = = 0.046, N = 23, y = 0.1884x + 26.6143) и Мец Сепасара (Rs = –0.53, p = 0.005, N = 26, y = –0.3367x + + 40.0517), причем в последнем случае связь оказалась обратной. Коэффициенты уравнений регрессии клоакальной температуры тела и температуры воздуха не различаются значимо в выборках D. valentini из Кучака и Мец сепасара (тест Чоу, p = 0.404, N = 23, 26), коэффициенты уравнений регрессии температуры тела и температуры субстрата в этих выборках также не различаются (тест Чоу, p = 0.993, N = 23, 24, рис. 3H, 3J).
Коэффициенты уравнений регрессии температуры воздуха (тест Чоу, N = 23, 20, p = 0.003; рис. 3D, 3K) и клоакальной температуры у D. valentini и D. unisexualis из Кучака значимо различаются. Коэффициенты уравнений регрессии клоакальной температуры тела D. armeniaca и D. unisexualis и температур субстрата (тест Чоу, N = 26, 20, p < 0.001, рис. 3F, 3G) и воздуха (тест Чоу, N = 26, 20, p < 0.001, рис. 3C, 3D) в Кучаке также значимо различаются. Коэффициенты уравнений регрессии температуры воздуха и клоакальной температуры D. valentini и D. armeniaca из Кучака значимо не различаются (тест Чоу, N = 23, 26, p = 0.669, рис. 3C, 3K), а коэффициенты уравнений регрессии температуры субстрата и клоакальной температуры тела значимо различаются (тест Чоу, N = 23, 26, p < 0.001, рис. 3G, 3J).
ОБСУЖДЕНИЕ
Из литературы известно, что температура тела активных ящериц лесного вида D. brauneri (Mehely 1909) в среднем составляет 32.0 (±2.2)°С (Целлариус, Целлариус, 2001) и сходны с температурами, полученными нами для видов, обитающих в высокогорных лугах. Данные о предпочитаемой температуре тела D. armeniaca, полученные нами, довольно близки к литературным данным по этому виду (примерно 30°C по литературным данным) (Даревский, 1967) и некоторым другим видам, хотя и отличаются от них примерно на 1°C. В литературе отсутствуют данные о температурах активности D. unisexualis, а по нашим данным они составляют в среднем (и по медиане) 27.8–29.0°С, что на несколько градусов ниже, чем у иных исследованных представителей рода Darevskia. По некоторым признакам, зафиксированным нами у исследованных видов (диапазон температур активности находится в районе 30°C, а у D. unisexualis даже ниже, после нагревания утром наблюдается продолжительный баскинг, что заметно по выборке D. armeniaca из Артаваза, а оптимальные температуры тела можно зарегистрировать во время баскинга), их всех можно отнести к потенциально ночным рептилиям (Черлин, 2010).
Ранее было показано, что ящерицы D. unisexualis начинают выходить из ночных укрытий раньше утром и уходят в них раньше вечером, чем D. armeniaca, обитающие совместно с ними (Abrahamyan et al., 2014). Относительно ранний выход D. unisexualis из укрытий можно связать с тем, что их температуры активности ниже, чем у D. armеniaca, а значит, для того чтобы начать рутинную активность, они нуждаются в меньшей температуре тела и, вероятно, окружающей среды.
Можно предположить, что низкий по сравнению с D. armeniaca диапазон температур активности D. unisexualis связан с происхождением этого вида от высокогорного подвида D. raddei – D. raddei nairensis (Vergun et al., 2020), обитающего на высотах 2000–3000 м над ур. м. (Arakelyan et al., 2011), в то время как виды, которые считают материнскими для D. armeniaca – D. mixta и D. dahli (Fu et al., 2000; Vergun et al., 2014), встречаются в более теплом климате и на меньших высотах: 1250–1500 (Petrosyan et al., 2019) и 700–1500 м над ур. м. соответственно.
Есть основания полагать, что экологические ниши D. valentini и D. armeniaca близки, поскольку они обладают сходными требованиями к температуре, влажности и другим параметрам среды (Petrosyan et al., 2019). Обнаруженное нами сходство температур активности этих видов свидетельствует также об их экологической близости (рис. 2), что подтверждается и в эксперименте в термоградиентприборе (Galoyan et al., 2019). Таким образом, экспериментальные данные и наблюдения показывают различия в термобиологии D. unisexualis с одной стороны и D. armeniaca и D. valentini – с другой, что интересно с биологической точки зрения и позволяет строить гипотезы о биологических различиях этих двух видов. В Кучаке температура субстрата по-разному влияет на клоакальную температуру ящериц D. valentini и D. armeniaca, что может свидетельствовать о разном использовании этими видами тепла субстрата для нагревания. Также температура обоих этих видов не так, как температура D. unisexualis, зависит от температур окружающей среды, что может свидетельствовать о разном использовании ресурсов для нагревания разными видами скальных ящериц в условиях совместного обитания. Возможно, эти различия позволяют сосуществующим видам снижать межвидовую конкуренцию в смешанных популяциях с высокой плотностью населения.
Найденный нами статистически значимый отрицательный коэффициент корреляции между температурой воздуха в Мец Сепасаре и клоакальной температурой D. valentini мы связываем с малым объемом выборки, т.к. найти объяснение такого феномена затруднительно. Найденный нами статистически значимый коэффициент корреляции между температурой воздуха в Кучаке и клоакальной температурой тела D. valentini показывает довольно слабую связь. Таким образом, можно считать, что мы не нашли биологически значимых связей между клоакальными температурами тела представителей этого вида и температурами окружающей среды.
Список литературы
Галоян Э.А., 2010. Распределение партеногенетических скальных ящериц Darevskia armeniaca и Darevskia unisexualis в северной Армении и сравнение с бисексуальными видами // Зоологический журнал. Т. 89. № 4. С. 470–474.
Галоян Э.А., 2013. Межвидовые и внутривидовые интерсексуальные взаимоотношения у скальных ящериц рода Darevskia // Статьи по материалам докладов Первой международной молодежной конференции герпетологов России и сопредельных стран. Зоологический институт РАН. СПб. С. 61–66.
Даревский И.С., 1967. Скальные ящерицы Кавказа: Систематика, экология, филогения полиморфной группы кавказских скальных ящериц подрода Аrchаеolасеrtа. Санкт-Петербург: Наука. 235 с.
Даревский И.С., Гречко В.В., Куприянова Л.A., 2000. Ящерицы, размножающиеся без самцов // Природа. № 9. С. 131–133.
Файвуш Г.М., Алексанян А.С., 2016. Местообитания Армении. Ереван: НАН РА, Институт ботаники. 360 с.
Целлариус А.Ю., Целлариус Е.Ю., 2001. Динамика пространственной структуры популяции Lacerta saxicola в широколиственных лесах хребта Навагир // Зоологический журнал. Т. 80. № 7. С.1–8.
Черлин В.А., 2010. Термобиология рептилий. Общие сведения и методы исследований (руководство). СПб.: Русско-Балтийский информационный центр “БЛИЦ”. 124 с.
Черлин В.А., 2015. Тепловые адаптации рептилий и механизмы их формирования // Принципы экологии. № 1. С. 17–76.
Abrahamyan M.R., Petrosyan R.K., Galoyan E.A., Danielyan F.D., Arakelyan M.S., 2014. Seasonal and daily activities of two syntopic parthenogenetic lizards of genus Darevskia // Chemistry and Biology. № 2. P. 39–42.
Ahmadzadeh F., Flecks M., Carretero M. A., Mozaffari O., Bohme W., et al., 2013. Cryptic Speciation Patterns in Iranian Rock Lizards Uncovered by Integrative Taxonomy // PLoS ONE. V. 8. № 12. P. 1–17.
Anderson E., Stebbins G., 1954. Hybridization as an Evolutionary Stimulus // Evolution. V. 8. № 4. P. 378–388.
Arakelyan M.S., Danielyan F., Corti C., Sindaco R., Leviton A., 2011. Herpetofauna of Armenia and Nagorno-Karabakh. Salt Lake City: Society for the Study of Amphibians and Reptiles. 181 p.
Arribas O.J., 1999. Phylogeny and relationships of the mountain lizards of Europe and Near East (Archaeolacerta Mertens, 1921, Sensu Lato) and their relationships among the eurasian lacertid radiation // Russian Journal of Herpetology. V. 6. № 1. P. 1–22.
Bauwens D., Hertz P.E., Castilla A.M., 1996. Thermoregulation in a Lacertid lizard: the relative contributions of distinct behavioral mechanisms // Ecology. V. 77. № 6. P. 1818−1830.
Carothers J.H., Fox S.F., Marquet P.A., Jaksis F.M., 1997. Thermal characteristics of ten Andean lizards of the genus Liolaemus in central Chile // Revista Chilena de Historia Natural. V. 70. P. 297−309.
Danielyan F., Arakelyan M., Stepanyan I., 2008. Hybrids of Darevskia valentini, D. armeniaca and D. unisexualis from a sympatric population in Armenia // Amphibia-Reptilia. V. 29. P. 487–504.
Dinno A., 2017. Dunn’s Test of Multiple Comparisons Using Rank Sums. Режим доступа: https://cran.r-project.org/web/packages/dunn.test/. Дата обновления: 27.10.2017
Espinoza R.E., Tracy R.C., 1997. The biology, husbandry and health care of reptiles. V. 1. Biology of reptiles. Biological resources research center and Department of biology. 184 p.
Fu J., McCulloch R.D., Murphy R.W., Darevsky I.S., 2000. Clonal variation in the Caucasian rock lizard Lacerta armeniaca and its origin // Amphibia-Reptilia. V. 21. P. 83−89.
Galoyan E., Bolshakova A., Abrahamyan M., Petrosyan R., Komarova V., et al., 2019. Natural history of Valentin’s rock lizard (Darevskia valentini) in Armenia // Zoological research. V. 40. № 4. P. 277−292.
Huey R.B., 1982. Temperature, Physiology, and the Ecology of Reptiles. New York: Academic Press. V. 12. P. 25−91.
Murphy R.W., Darevsky I.S., MacCulloch R.D., Fu J., Kupriyanova L.A., 1996. Evolution of the bisexual species of caucasian rock lizards: a phylogenetic evaluation of allozyme data // Russian Journal of Biology. V. 3. № 1. P. 18−31.
Murtskhvaladze M., Tarkhnishvili D., Anderson C., Kotorashvili A., 2020. Phylogeny of caucasian rock lizards (Darevskia) and other true lizards based on mitogenome analysis: Optimisation of the algorithms and gene selection // PLoS ONE. № 15. https://doi.org/10.1371/journal.pone.0233680
Petrosyan V., Osipov F., Bobrov V., Dergunova N., Nazarenko E., et al., 2019. Analysis of geographical distribution of the parthenogenetic rock lizard Darevskia armeniaca and its parental species (D. mixta, D. valentini) based on ecological modelling // SALAMANDRA. V. 55. № 3. P. 173−190.
Sites J.W., Peccinini-Seale D.M., Moritz C., Wright J.W., Brown W.M., 1990. The evolutionary history of parthenogenetic Cnemidophorus lemniscatus (Sauria, Teiidae). I. evidence for a hybrid origin // Evolution. V. 44. № 4. P. 906–921.
Spangenberg V., Arakelyan M., Cioffi M.d.B., Liehr T., et al., 2020. Cytogenetic mechanisms of unisexuality in rock lizards // Sci Rep. V. 10. № 8697.
Tarkhnishvili D., Murtskhvaladze D., Anderson C.L., 2017. Coincidence of genotypes at two loci in two parthenogenetic rock lizards: how backcrosses might trigger adaptive speciation // Biological Journal of the Linnean Society. V. 121. P. 365–378.
Vergun A.A., Martirosyan I.A., Semyenova S.K., Omelchenko A.V., Petrosyan V.G., et al., 2014. Clonal Diversity and Clone Formation in the Parthenogenetic Caucasian Rock Lizard Darevskia dahli // PLoS ONE. V. 9. № 3.
Vergun A.A., Girnyk A.E., Korchagin V.I., Semyenova S.K., Arakelyan M.S., et al., 2020. Origin, clonal diversity, and evolution of the parthenogenetic lizard Darevskia unisexualis // BMC Genomics. V. 21. № 351.
Wickham H., 2016. ggplot2: Elegant Graphics for Data Analysis. New York: Springer-Verlag. ISBN 978-3-319-24277-4
Zeileis A., Leisch F., Hornik K., Kleiber C., 2002. strucchange: An R Package for Testing for Structural Change in Linear Regression Models // Journal of Statistical Software. V. 7. № 2. P. 1–38.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал