Зоологический журнал, 2021, T. 100, № 11, стр. 1224-1235
О решении навигационных задач серым вараном (Varanus grisius, Reptilia, Sauria) в естественных условиях
А. Ю. Целлариус *
Институт проблем экологии и эволюции имени А.Н. Северцова РАН
119071 Москва, Россия
* E-mail: ale5386@yandex.ru
Поступила в редакцию 23.08.2020
После доработки 04.04.2021
Принята к публикации 07.05.2021
Аннотация
Данные полевых наблюдений свидетельствуют, что Varanus griseus способен с единичного предъявления запоминать места значимых событий и через продолжительное время целенаправленно возвращаться к этим местам, не придерживаясь того маршрута, которым он следовал туда непосредственно перед событием. Варан способен определить свое местоположение, будучи лишен информации о маршруте, который его в это место привел, и проложить относительно прямой путь к объекту, находящемуся за пределами его прямого восприятия. Функциональные блоки индивидуального участка могут быть разнесены на расстояние до 10 км, переходы между блоками каждый раз совершаются частично или полностью по новому маршруту, расстояние между маршрутами может достигать 2 км. Поведение варана хорошо объясняется в рамках гипотезы, предполагающей наличие у него аллоцентрической мозаичной ментальной карты. Интеграция пути, вероятно, служит не столько средством навигации, сколько одним из инструментов построения такой карты.
Навигация, по сути, это способность субъекта проложить маршрут из точки А, в которой он в данный момент находится, в некую точку В, находящуюся за пределами его прямого восприятия. Термин “навигация” употребляется как при изучении дальних, часто трансконтинентальных сезонных миграций, так и при изучении локальных перемещений животных в пределах их постоянных участков обитания. Однако между этими вариантами навигации имеются существенные различия.
Если перемещения в ходе дальних сезонных миграций могут и, по-видимому, должны основываться преимущественно на врожденных механизмах реагирования, то локальная навигация должна базироваться в первую очередь на индивидуальном опыте животного. Именно когнитивные основы такой навигации, хотя само понятие при этом не употреблялось, изучались зоопсихологами в ходе экспериментов по поведению животных в лабиринтах, и именно на основании этих экспериментов Толменом была предложена концепция когнитивной карты (Tolman, 1948), предполагающая ментальную репрезентацию местности и в том или ином виде лежащая в основе значительной части современных представлений о навигации животных. Исследования последних десятилетий показали, что существует возможность не только ментальной репрезентации местности, как таковой, но и возможность репрезентации последовательности предстоящих действий по достижению удаленной цели (Moser et al., 2014; Цукерман и др., 2014). Последнее, и на наш взгляд это очень важно, расширяет круг понятий, которые могут быть использованы зоологом для описания поведения животных без риска подвергнуться самым страшным обвинениям прошлого столетия – обвинениям в телеологичности и антропоморфизме. Не исключено, что ментальные механизмы локальной навигации лежат в основе возникновения и развития когнитивных способностей вообще (Buzsáki, Moser, 2013; Меньшикова и др., 2018). Таким образом, изучение навигации животных из разряда, в общем, специальной области исследований неуклонно переходит в область исследований фундаментальных.
Очевидно, что, если нас интересуют происхождение и эволюция биологических навигационных инструментов, имеет прямой смысл присмотреться, каковы навигационные способности животных из нескольких параллельных филогенетических стволов. В рамках клады высших позвоночных такими стволами являются: Theromorpha, рецентные представители – млекопитающие (Mammalia); Archosauromorpha – крокодилы (Crocodilia), черепахи (Testudines) и птицы (Aves); Lepidosauromorpha – гаттерии (Rhynchocephalia), ящерицы и змеи (Squamata). При этом экспериментальные работы по изучению локального пространственного поведения велись преимущественно на млекопитающих, в первую очередь на грызунах (Rodentia), все другие группы изучены существенно хуже. Для млекопитающих (и почти исключительно для них) более или менее известны также нейробиологические основы локальной навигации (Hafting et al., 2005; Moser et al., 2014; и др.). Для Lepidosauromorpha такие данные, насколько нам известно, полностью отсутствуют. При этом с точки зрения сравнительных исследований ящерицы представляются весьма перспективным объектом. Во-первых, в силу некоторых, сближающих их с млекопитающими, особенностей экологических и поведенческих стратегий (Regal, 1983; Hertz et al., 1988; Bauwens, Diaz-Uriarte, 1997; Целлариус, 2011), во-вторых – просто в силу удобства этой группы для полевых наблюдений (Fox et al., 2003).
Навигационные способности ящериц практически не изучены, возможно потому, что преобладает мнение о примитивности поведения представителей этой группы, в том числе и связанного с использованием пространства. Мнение это неверно. У многих видов участки постоянного обитания достаточно обширны и обладают выраженной функциональной структурой (Evans, 1951; Rand, Rand, 1978; Auffenberg, 1981; Tsellarius et al., 1997; и др.), что предполагает вполне развитые навигационные способности. В экспериментах по экстраполяции траектории движения приманки по короткому видимому отрезку этой траектории показано, что частота правильных решений у ящериц превышает таковую у многих птиц и некоторых млекопитающих (Крушинский, 1977).
По-видимому, для первичной оценки навигационных способностей не обязательны углубленные экспериментальные исследования, в том числе нейробиологические, достаточно знаний о функциональной структуре индивидуального пространства (sensu Иваницкий, 1989) конкретной особи и наблюдений за перемещениями этой особи в контексте определенных экологических и/или социальных обстоятельств. В настоящем сообщении приведены данные о структуре участков обитания и перемещениях серого варана (Varanus griseus Daud.), полученные нами в ходе полевых исследований поведенческой экологии данного вида. Следует иметь в виду, что при планировании исследований задача изучения навигации серого варана не ставилась. Приведенные данные – это те фрагменты наблюдений, которые позволяют получить какое-то представление о сложности и путях решения навигационных задач у серого варана и могут, в определенной степени, служить точкой опоры для построения предварительных гипотез и планирования исследований навигации и ориентирования у ящериц.
МАТЕРИАЛ И МЕТОДЫ
Работы проведены в 1990–1994 гг. на территории Кызылкумского заповедника (40°40′ N, 62°08′ E). Участок, на котором велись основные наблюдения, размером 6 × 3.5 км, вытянут вдоль правого берега Амударьи; основной ландшафт – грядовые пески под илаковыми белосаксаульниками (рис. 1). С запада обрывы и крутые осыпные склоны коренного берега (общая высота до 40 м) отделяют пески от поймы, заросшей тугайным лесом.
Рис. 1.
Грядовые пески под илаковыми белосаксаульниками – основной биотоп серого варана в районе исследований.

Отловленных варанов измеряли, фотографировали, на подошвы обеих задних лап наклеивали индивидуальную метку – тот или иной значок из тонкой кожи, оставляющий характерный отпечаток на грунте (Tsellarius, Cherlin, 1991). Кроме того, животные распознавались по рисунку на спине, имеющему строго индивидуальный характер (Tsellarius, Cherlin, 1991). Каждый варан получал свой буквенно-цифровой картотечный индекс. Однако постоянно находившиеся под наблюдением животные получали имена, которые давались им либо по форме следовой метки, либо по каким-то физическим или поведенческим особенностям. В данной статье мы обозначаем особей под их картотечным индексом (литерой M маркируются самцы, литерой F – самки), но, дабы сохранить преемственность с предшествующими статьям, в скобках указываем имена.
Варанов, отловленных для мечения и прочих манипуляций, приносили в лагерь, а на следующий день, иногда через день, выпускали приблизительно в районе поимки в любую подходящую нору. В лагерь и обратно животные транспортировали в мешках из плотной ткани, часто помещенных в брезентовый рюкзак. Маршрут транспортировки никогда не был прямолинейным, отчасти в силу рельефа местности, но в основном потому, что исследователь попутно выполнял ряд других задач, не связанных с транспортировкой.
В самом начале первого сезона нами была составлена карта-схема участка работ и прилегающих территорий в масштабе 1 : 2000, на которую наносились все точки встреч варанов, их следов, траектории перемещения и основные события. Далее на карту-схему накладывалась сетка со стороной ячейки 100 × 100 м в масштабе схемы и подсчитывалось число точек регистрации животного или его следа в каждом квадрате. Под индивидуальным участком варана в рамках данной статьи подразумевается оконтуренная методом выпуклого многоугольника совокупность квадратов, в которых число точек регистрации достоверно превышало среднюю (Samuel et al., 1985).
Визуальные наблюдения за варанами велись из специально устроенных укрытий – засидок. Однако львиная доля информации об экологии и поведении серого варана получена нами в результате тропления, общая протяженность которого составляет несколько сотен километров. При определенном навыке, след взрослого варана и метка на нем распознаются даже на участках, покрытых глинистой корочкой, а отдельные отпечатки – даже на участках, покрытых пустынным мхом. По следу варана хорошо распознаются многие поведенческие комплексы (Tsellarius, Tsellarius, 1997), не говоря уж о таких событиях, как охота или уход в убежище. При троплении начальная точка привязывалась к местности, затем, через тот или иной интервал, привязывалась вторая точка, и так далее. Величина интервала между точками зависела от рельефа местности, сложности траектории и происходящих событий. В каждой последующей точке делалось описание предыдущего отрезка траектории.
РЕЗУЛЬТАТЫ
Сенсорные приоритеты серого варана и ознакомительное поведение
Данные наблюдений безусловно свидетельствуют, что у серого варана при восприятии более или менее удаленных объектов главную роль играет зрение. Ознакомительное (exploratory) поведение типично для животного с доминированием зрения – варан приподнимает на лапах переднюю часть тела и вытягивает шею (рис. 2) – т.е. явно сканирует местность визуально. Такое поведение почти обязательно после встречи с сородичем и при выходе варана из норы, как после ночевки, так и в процессе охоты.
Рис. 2.
Варан осматривает окрестности: А – при уходе с места контакта с сородичем, В – при выходе из норы.

Хеморецепция у серого варана также весьма совершенна, животное, в частности, способно к индивидуальному различению следов сородичей (Tsellarius, Men’shikov, 1994). Однако реакция на след (повышение частоты выбрасывания языка) обнаруживается только при непосредственном столкновении со следом. На скрытый пищевой объект регистрировалась реакция с расстояния не более четырех–пяти метров. Следует также принимать во внимание, что характерные для мест обитания серого варана сильные дневные ветра сильно осложняют дистанционную хеморецепцию.
Конфигурация индивидуальных участков
Индивидуальные участки серого варана в районе исследований образуют скопления (поселения, Tsellarius et al., 1995). Участки всех членов одного поселения почти полностью перекрываются. Не менее 80% всего времени активности вараны придерживались открытого ландшафта (рис. 1), склоны коренного берега и тугай посещались лишь эпизодически, преимущественно весной. У большей части меченых особей индивидуальные участки были более или менее компактны, расстояние между наиболее удаленными точками участка не превышало 2 км, площадь индивидуальных участков в среднем составляла около 65 ± 21 га11 (n = 28). Однако у некоторых особей участок распадался на два, изредка на три фрагмента. Расстояние между фрагментами составляло от 2 до 10 км, при переходе между фрагментами вараны практически никогда не охотились и не останавливались на ночевку, уходы на дневку отмечались лишь в единичных случаях.
Зимовочные убежища большинства наблюдавшихся особей располагались в норах в основании обрывов коренного берега. Животные зимовали поодиночке, убежище использовалось в течение нескольких лет. Как правило, варан весь дальнейший период активности обитал на участке, прилегающем к месту зимовки (компактные индивидуальные участки). Несколько самцов до месяца держались в окрестностях зимовки, после чего уходили далеко в глубь песков на все лето, т.е. индивидуальный участок состоял из зимовочно-весеннего и летнего (основного) фрагментов.
Для укрытия от жары в середине дня и для ночевки варан может использовать первую попавшуюся нору подходящего размера. Однако более чем в половине случаев животное использует “гостиницы” – расширенные и модифицированные норы грызунов. Каждая особь использует от четырех до 10 гостиниц, при этом какой-либо правильный порядок их размещения и использования не улавливается. Гостиницу могут посещать несколько особей, но, как правило, не одновременно.
В районе исследований весь период активности основными местами охоты серого варана являются поселения (колонии) большой песчанки (Rhombomys opimus Licht.). Весной вараны могут активно разыскивать кладки фазана (Phasianus colchicus L.) и охотиться на выходящих с зимовки гюрз (Vipera lebetina L.) (Tsellarius et al., 1997). Зимовки гюрз концентрируются на обрывах и склонах коренного берега, гнезда фазанов – вдоль его подножия, на опушке тугая, колонии песчанки – только в песках.
Для откладки яиц самка роет специальную гнездовую нору, каждый год новую и в разных районах участка обитания. Из года в год самка в брачный период контактирует с одним и тем же самцом (или небольшой группой самцов) (Tsellarius et al., 1995; Tsellarius, Tsellarius, 1996). Обычно партнеры принадлежат к одному поселению, и их индивидуальные участки широко перекрываются. Реже партнеры принадлежали к разным поселениям, в этом случае в брачный период один из них на несколько дней посещал поселение партнера, т.е. участок состоял из основного и брачного фрагментов. В период ухаживания самцы в течение несколько дней следуют за самкой (Tsellarius, Tsellarius, 1996), и места контактов с самкой широко распределены по ее участку.
Перемещения варана по участку постоянного обитания
При охоте на колониях песчанки варан перемещается от одной колонии к другой. Какая-либо устойчивая последовательность обследования колоний отсутствует. На колонии варан обследует выходы нор, время от времени уходит под землю. Переход между колониями почти прямолинеен, как и уход в убежище после охоты (рис. 3). Следует иметь в виду, что большинство крупных колоний расположены в котловинах, а расстояние между ними может превышать 200 м, т.е. из одной колонии другая не видна. Точно так же с места окончания охоты обычно не видно место расположения убежища.
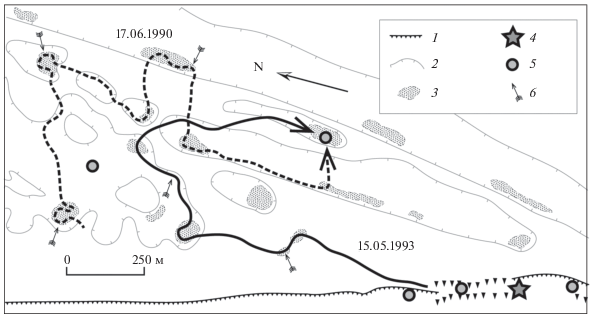
Рис. 3.
Перемещения самца М-16 (Мафиози) в первой половине дня в процессе охоты на колониях большой песчанки с уходом в нору при наступлении жары: 1 – обрывы коренного берега, 2 – изогипсы, 3 – колонии песчанки, 4 – место зимовки, 5 – гостиницы, 6 – заходы в норы.
Когда самка приступает к устройству гнездовой норы, то в течение нескольких дней она роет до полутора десятков так называемых пробных нор (Целлариус, Меньшиков, 1995), разбросанных на площади 4–15 га. На время ночевки самка обычно покидает этот район. Пробные норы никак не связаны ни с гостиницами, ни с норами грызунов вообще. В какой-то момент самка возвращается к одной из пробных нор (иногда к одной из первых) и заканчивает на ее основе устройство полноценной гнездовой норы, т.е. самка помнит места расположения (и, по-видимому, качество) пробных нор. После откладки яиц самка в течение около 5–10 дней большую часть времени проводит в гнездовой норе или в непосредственной близости от нее. Затем самка начинает охотиться, уходя от норы на расстояние до 1.5–2 км, но продолжает ее посещать с интервалом в несколько дней (Целлариус, Меньшиков, 1995). Какого-либо намека на постоянство маршрутов ухода от норы или возвращения к ней не наблюдается.
Самец, идущий в брачный период по следу самки (такое следование может продолжаться несколько дней) (Tsellarius, Tsellarius, 1996), при наступлении вечера оставляет ее след и направляется к ближайшему ночному убежищу, иногда за несколько сотен метров. Утром, выйдя из норы, он может прямо возвращаться к месту, где был оставлен след самки, не придерживаясь своего вечернего следа (рис. 4).
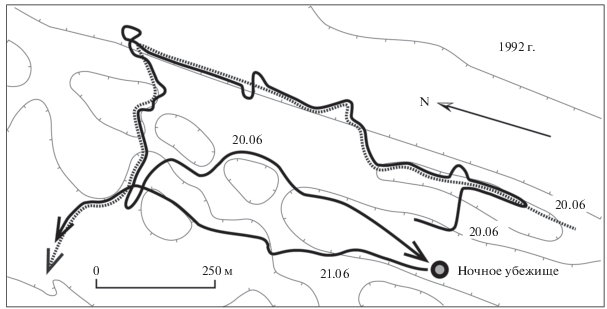
Рис. 4.
Траектория перемещения самца М-57 (Ромбик, сплошная линия), идущего по следу самки F-37 (Жека, пунктирная линия) с перерывом на ночевку. В первый день преследования (20.06) след самки был старше следа самца приблизительно на 4–5 часов.
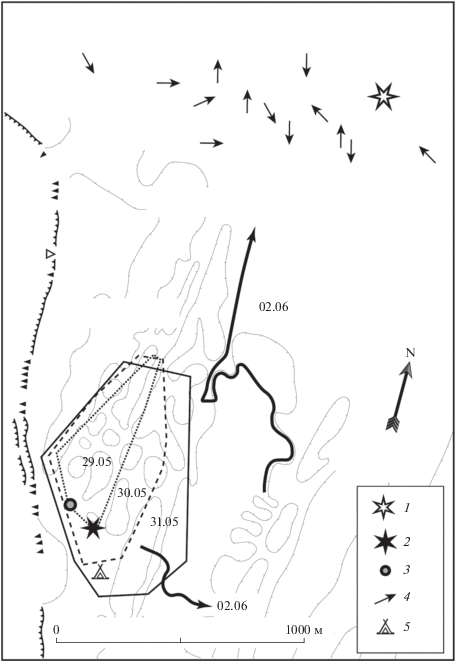
Самка F-2 (Кусачая) в течение нескольких лет подряд в период спаривания приходила со своего индивидуального участка на участок самца М-9 (Эс Девятый). Здесь она держалась на площади с поперечником около 300 м, где ее рано или поздно находил Эс Девятый, после чего происходило неоднократное спаривание. Затем самка возвращалась на свой участок (рис. 5). Протяженность перехода в один конец составляла 2.0–2.5 км. При этом маршруты самки в разные годы, а также по пути туда и обратно не совпадают, однако траектория перемещения почти прямолинейна (рис. 5). Аналогичная ситуация наблюдалась при посещении участка самки самцом.
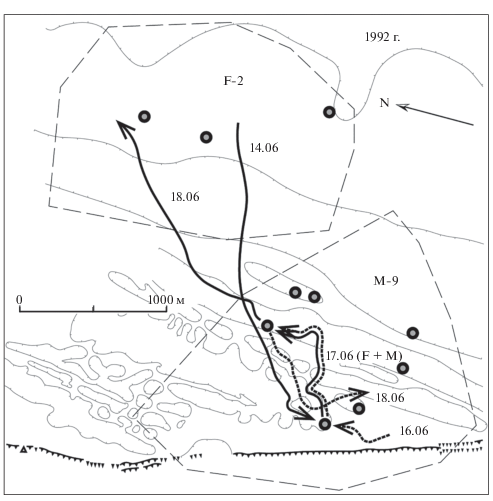
Рис. 5.
Визит самки F-2 (Кусачая, жирная сплошная линия) на индивидуальный участок самца М-9 (Эс Девятый, жирная пунктирная линия) в брачный период. Тонким пунктиром обозначены границы индивидуальных участков самца и самки.
У самца М‑1 (Вася) участок состоял из двух фрагментов, западного и восточного, расстояние между фрагментами составляло около 10 км (рис. 6). Западный фрагмент использовался в начале сезона активности и включал участок пустыни, прилегающий к обрывам коренного берега, где располагалась зимовка. Здесь самец держался в течение 1–2 недель после выхода с зимовки, после чего уходил на восточный фрагмент. Однако в мае – начале июня периодически возвращался на западный участок на срок до 5–6 дней, где охотился на гюрз и разыскивал кладки фазана. Затем посещения западного участка прекращались до августа, когда самец возвращался в район зимовки и не покидал его до следующей весны. Переход с одного фрагмента участка на другой занимал 4–6 ч, часто переход проходил по маршруту, который полностью или частично не совпадал с предыдущими, расстояние между маршрутами могло достигать 2 км (рис. 6). По возвышенным участкам варан шел почти прямолинейно. Спустившись в долину между грядами, иногда начинал отклоняться от взятого направления, а поднявшись на гряду, – выправлял курс. В масштабе схемы это не очень заметно, но при троплении бросается в глаза. В конце перехода варан довольно точно выходил к одной из “гостиниц”, в которую и уходил на ночевку.
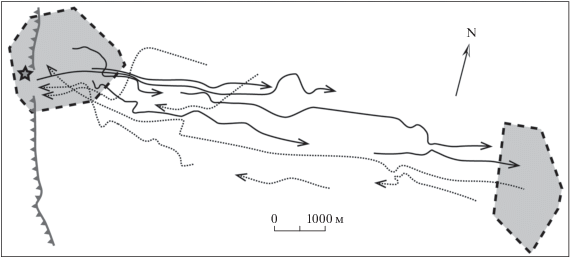
Рис. 6.
Отслеженные траектории переходов старого самца М-1 (Вася) с западного фрагмента индивидуального участка на восточный и обратно в разные годы. Звездочкой отмечено место зимовки.
Как уже упоминалось, отловленных варанов мы приносили в лагерь, а на следующий день, а иногда и через день, выпускали в районе поимки в первую попавшуюся нору. Варан выходил на поверхность обычно в течение 1–2 ч, но иногда только на следующее утро. Каких-либо признаков дезориентации выявить по следу не удалось – полежав у входа в нору, варан отправлялся либо на охоту, к одному из кормовых участков, либо к одной из “гостиниц”.
Однако в разные годы двух самок и трех самцов (все пятеро – половозрелые особи старше четырех лет), пойманных вдали от нашей базы в мае–июле, нам пришлось выпустить около лагеря. Одна из самок (пойманная приблизительно в 3 км к NO от лагеря) так и осталась в районе выпуска. Следы другой (поймана в 5 км к SOO) встречались в месте выпуска 5 дней, затем были обнаружены в районе поимки при первом же его посещении наблюдателем (через 16 дней после ухода самки с места выпуска), где продолжали встречаться и в последующие 3 года, до окончания работ. Следы одного из самцов (пойман в 3.5 км к O от лагеря) встречались в месте выпуска два дня, после чего нигде не регистрировались в течение двух лет (до конца работ). Еще один самец (пойман приблизительно в 7 км к SSO от лагеря) регистрировался в районе выпуска 5 дней. Место поимки в дальнейшем нами не посещалось, но на следующий год после поимки-выпуска его следы были однажды зарегистрированы приблизительно в 1 км к NО от этого места.
Более или менее детальные данные о характере перемещения животного после выпуска мы имеем лишь по самцу М-64, пойманному на расстоянии 2 км к NNO от лагеря и выпущенному рядом с лагерем на следующий день (рис. 7). Самец был выпущен в нору, не использовавшуюся местными варанами, где провел остаток дня и ночь. На следующее утро, выйдя из норы, самец за два (приблизительно) часа описал петлю, вернулся в окрестности лагеря и ушел не в ту нору, в которую был выпущен, а в местную “гостиницу”, т.е. в нору, периодически используемую местными особями, в которой ночевал и в последующие дни. В течение этого и последующих дней охота не зарегистрирована. На коротких отрезках перемещения иногда казались хаотическими, однако в целом суточный путь самца представлял петлю, описываемую против часовой стрелки, и заканчивался ночевкой в районе выпуска. При этом продолжительность пути и район обследования день ото дня увеличивались (рис. 7). На четвертый день, описывая очередную петлю, самец, поднявшись на вершину гряды в точке максимального удаления от места выпуска, резко, практически на 180°, изменил направление движения и прямо направился в район поимки (рис. 7). Далее, в течение лета и на следующий год его следы неоднократно встречались в районе поимки, т.е. именно здесь, по-видимому, располагался постоянный участок обитания этого самца.
Рис. 7.
Последовательное увеличение обследуемого пространства (оконтурено методом выпуклого многоугольника) самцом М-64 после выпуска в незнакомой местности, и отслеженная часть его траектории в день ухода на постоянный участок обитания: 1 – место поимки (27.05.1992); 2 – место выпуска (28.05.1992); 3 – место ночевок; 4 – встречи следов М-64 во второй половине 1992 г. после событий, отраженных на карте-схеме, и далее в 1993 г. (стрелки указывают направление следа); 5 – лагерь.
Аллюры варана в разных обстоятельствах
Основные аллюры серого варана – шаг, рысеобразный шаг и рысь (sensu Суханов, 1968), хорошо различающиеся по следовой цепочке. В процессе охоты варан перемещается почти исключительно шагом, кроме моментов преследования добычи. При перемещениях между местами охоты, на ночевку или между фрагментами индивидуального участка преобладает рысеообразный шаг. При следовании за самкой – рысеобразный шаг, временами переходящий в рысь. У животного, выпущенного в незнакомой местности, резко преобладающий аллюр – рысь. У М‑64 вскоре после того, как он взял направление на место поимки (рис. 7), рысь сменилась на рысеобразный шаг – нормальный крейсерский аллюр.
ОБСУЖДЕНИЕ
По данным наблюдений, серый варан решает достаточно сложные навигационные задачи. Во-первых, как свидетельствуют возвращения самцов на след самки и самок к одной из пробных нор, варан, очевидно, способен с единичного предъявления запоминать места значимых событий и при необходимости целенаправленно возвращаться к этим местам, в том числе через весьма продолжительное время, не придерживаясь того маршрута, которым он следовал туда непосредственно перед событием. Во-вторых, в пределах постоянного участка обитания варан способен определить место своего нахождения относительно объектов, находящихся вне его прямого восприятия, опираясь только на ориентиры, видимые с данного места, в отсутствие информации о маршруте, который его в это место привел. В-третьих, варан способен к прокладке сравнительно прямого пути из точки своего нахождения к известному ему (посещавшемуся ранее) месту/объекту, находящемуся за пределами его прямого восприятия. Тот факт, что дальние маршруты между двумя фрагментами участка могут не повторяться, и при этом могут быть разнесены за пределы видимости один от другого (рис. 5, 6), позволяет предполагать, что варан способен прокладывать новые маршруты.
Прокладка нового маршрута подразумевает представление о цели (Цукерман и др., 2014) и, как минимум, представление о направлении, ведущем к цели. Одним из методов определения направления может служить так называемая интеграция пути (path integration или dead reckoning) – непрерывная в ходе перемещения суммация кинестетической (проприоцептивной) информации, в результате чего животное сохраняет представление о направлении на исходную точку перемещения (Barlow, 1964; O’Keefe, Nadel, 1978; Etienne et al., 1996; McNaughton et al., 2006) и, возможно, о расстоянии до этой точки. Логично предположить, что “исходной точкой” может являться любая “заслуживающая внимания” точка траектории, например точка, в которой животное обнаруживает высокую концентрацию корма.
Насколько концепция интеграции пути адекватна поведению варана? В большинстве случаев от момента, когда варан покинул то или иное место, до того, как он начал целенаправленное движение к этому же месту, могут пройти недели, иногда месяцы, а в случае посещения удаленных участков с сезонной концентрацией ресурсов или места встреч с партнером может пройти полный год. За этот период животное проходит десятки, иногда сотни километров по весьма замысловатой траектории. Интеграция пути, в ее классическом виде, в таких обстоятельствах вряд ли возможна. В частности, потому, что при использовании только кинестетической информации, при увеличении протяженности и сложности траектории происходит лавинообразное накопление ошибок (Etienne et al., 1996).
Гораздо точнее направление на исходный пункт определяется при наличии визуальных ориентиров (Etienne et al., 1996), что наводит на мысль о другом способе прокладки нового прямого пути, связанном с понятием ментальной (когнитивной) карты (Tolman, 1948; O’Keefe, Nadel, 1978). В этом случае основой для прокладки пути является не столько кинестетическая информация, как информация топографическая – представление о взаиморасположении ориентиров и ассоциированных с ними биологически значимых объектов. Одной из основ формирования ментальной карты, очевидно, является так называемое латентное обучение (latent learning) – обучение в ходе перемещений, не связанных с внешним подкреплением. Эксперименты на млекопитающих показывают, что животное, имевшее возможность свободного перемещения в лабиринте, впоследствии, после помещения в лабиринт приманки, формирует кратчайший путь к месту ее нахождения после первого предъявления, в отличие от животного, такой возможности не имевшего (Tolman, 1948).
Рассмотрим с этой точки зрения поведение варана, выпущенного в незнакомой местности. Животное явно испытывает стресс, о чем свидетельствует, в частности, нехарактерный для рутинных перемещений аллюр – рысь. Стресс стимулирует ознакомительное поведение и интенсифицирует выделение среди окружения контрастных объектов (ориентиров) и их запоминание (Tolman, 1948). В нашем случае это, вероятно, в первую очередь ориентиры, связанные с убежищем. При этом передвижение по замкнутой траектории позволяет увидеть эти ориентиры с разных ракурсов. Способность распознавания объекта с разных ракурсов является одним из необходимых условий для прокладки новых маршрутов и инверсии пройденного маршрута (O’Keefe, Nadel, 1978; Bennett, 1996). В случае неизбежного временного исчезновения из поля зрения ассоциированных с убежищем ориентиров, интеграция пути позволяет запоминать другие контрастные объекты, лежащие в направлении убежища. Видимое смещение различных ориентиров относительно друг друга (параллакс) дает возможность животному оценить расстояние между ними (Walk, 1965). Поэтапное расширение обследуемой территории включает в схему все новые и новые ориентиры, в том числе, возможно, связанные не только с убежищем, но и с местом расположения каких-то других “возбуждающих” объектов22. Таким образом, поведение варана в незнакомой местности, резко отличное от рутинного, можно интерпретировать как латентное обучение, как поведение, способствующее эффективному формированию аллоцентрической (sensu Меньшикова и др., 2018) мозаичной (Чернецов, 2016) ментальной карты. При этом интеграция пути является не столько методом навигации непосредственно, сколько одним из инструментов “топографической съемки”, возможно, наряду с оценкой расстояний на основе параллакса33. Тесная взаимосвязь процессов обработки визуальной и кинестетической информации подтверждается экспериментами на млекопитающих (Laptev, Burgess, 2019).
В заключение можно сказать, что поведение варана хорошо объясняется при принятии гипотезы о существовании у него аллоцентрической мозаичной ментальной карты, при этом способность варана к решению навигационных задач в целом сопоставима с аналогичными способностями млекопитающих. У млекопитающих за нейронную репрезентацию пространства ответственны гиппокампальная формация и неокортекс (Moser et al., 2014), а за формирование эпизодической памяти еще и гипоталамически-гипофизарная область (Aggleton et al., 2010). У Lepidosauromorpha эти структуры отсутствуют, однако зоны, гистологически сходные и, вероятно, гомологичные этим структурам, у них есть, хотя и в существенно ином анатомическом исполнении (Northcutt, 1978; Butler, Molnar, 2002; Дзержинский, 2005; Tosches et al., 2018). Развитие исследований навигации ящериц, в том числе нейробиологических, позволит, быть может, ответить на вопрос – каким образом сходные когнитивные задачи решаются на различном морфологическом субстрате.
Список литературы
Дзержинский Ф.Я., 2005. Сравнительная анатомия позвоночных животных. М.: Аспект-Пресс. 320 с.
Иваницкий В.В., 1989. Индивидуальное пространство у птиц: структурно-функциональные и экологические аспекты // Зоологический журнал. Т. 68. № 4. С. 83–93.
Крушинский Л.В., 1977. Биологические основы рассудочной деятельности. М: Издательство МГУ. 272 с.
Меньшикова Г.Я., Савельева О.А., Ковязина М.С., 2018. Оценка успешности воспроизведения эгоцентрических и аллоцентрических пространственных репрезентаций при использовании систем виртуальной реальности // Национальный психологический журнал. Т. 30. № 2. С. 113–122.
Суханов В.Б., 1968. Общая система симметричной локомоции наземных позвоночных и особенности передвижения низших тетрапод. Л.: Наука. 225 с.
Целлариус А.Ю., 2011. Социальные отношения у Squamata: подходы к изучению // Вопросы герпетологии. Материалы Четвертого съезда Герпетологического общества им. А.М. Никольского. СПб.: Русская коллекция. С. 293–303.
Целлариус А.Ю., Меньшиков Ю.Г., 1995. Устройство гнездовых нор и охрана кладки самками серого варана // Зоологический журнал. Т. 74. № 1. С. 119–129.
Цукерман В.Д., Харыбина З.С., Кулаков С.В., 2014. Математическая модель пространственного кодирования в гиппокампальной формации. II. Нейродинамические корреляты ментальных траекторий и проблема принятия решений // Математическая биология и биоинформатика. Т. 9. № 1. С. 216–256.
Чернецов Н.С., 2016. Ориентация и навигация мигрирующих птиц // Зоологический журнал. Т. 95. № 2. С. 128–146.
Adler K., 1986. Orientation mechanisms in a Desert Lizard, Uma notata // Studies in Herpetology, Proceedings of the European Herpetological Meeting, Prague, August 19–23, 1985. Prague. P. 583–588.
Aggleton J.P., O’Mara S.M., Vann S.D., Wright N.F., Tsanov M., Erichsen J.T., 2010. Hippocampal–anterior thalamic pathways for memory: uncovering a network of direct and indirect actions // European Journal of Neuroscience. V. 31. P. 2292–2307.
Auffenberg W., 1981. The behavioral Ecology of the Komodo Monitor. Gainesville: University of Florida Book. 406 p.
Barlow G.S., 1964. Inertial Navigation as a Basis for Animal Navigation // Journal Theoretical Biology. № 6. P. 76–117.
Bauwens D., Diaz-Uriarte R., 1997. Covariation of life-history traits in lacertid lizards: a comparative study // American Naturalist. V. 149. № 1. P. 91–111.
Beltrami G., Bertolucci C., Parretta A., Petrucci F., Foà A., 2010. A sky polarization compass in lizards: the central role of the parietal eye // Journal Experimental Biology. V. 213. P. 2048–2054.
Bennett A.T.D., 1996. Do animals have cognitive maps? // Journal Experimental Biology. V. 199. P. 219–224.
Butler A.B., Molnar Z., 2002. Development and evolution of the collopallium in amniotes: A new hypothesis of field homology // Brain Research Bulletin. V. 57. № 3/4. P. 475–479.
Buzsáki G., Moser E., 2013. Memory, navigation and theta rhythm in the hippocampal-entorhinal system // Nature Neuroscience. V. 16. № 2. P. 130–138.
Etienne A.S., Maurer R., Séguinot V., 1996. Path integration in mammals and its interaction with visual landmarks // Journal Experimental Biology. V. 199. № 1. P. 201–209.
Evans L.T., 1951. Field study of the social behavior of the black lizard, Ctenosaura pectinata // American museum novitates. V. 1493. P. 1–26.
Fox S.F., McCoy J.K., Baird T.A., 2003. The evolutionary study of social behavior and the role of lizards as model organisms // Lizard social behavior. Baltimor and London: The Johns Hopkins University Press. P. xi–xiv.
Hafting T., Fyhn M., Molden S., Moser M.-B., Moser E.I., 2005. Microstructure of a spatial map in the entorhinal cortex // Nature. V. 436. P. 801–806.
Hertz P.E., Huey R.B., Garland Th. Jr., 1988. Time budgets, thermoregulation, and maximal locomotor performance: are reptiles olympians or boy scouts? // American Zoologist. V. 28. № 3. P. 927–938.
Laptev D., Burgess N., 2019. Neural Dynamics Indicate Parallel Integration of Environmental and Self-Motion Information by Place and Grid Cells // Frontiers Neural Circuits. 20 p. https://doi.org/10.3389/fncir.2019.00059
McNaughton B.L., Battaglia F.P., Jensen O., Edvard I., Moser E.I., Moser M.-B., 2006. Path integration and the neural basis of the cognitive map // Nature Reviews. Neuroscience. V.7. P. 663–678. https://doi.org/10.1038/nrn1932
Moser E.I., Roudi Y., Witter M.P., Kentros C., Bonhoeffer T., Moser M.-B., 2014. Grid cells and cortical representation // Nature Reviews. Neurosciens. V. 15. P. 466–481.
Northcutt R.G., 1978. Forebrain and midbrain organization in lizards and its phylogenetic significance // Greenberg N., McLean P.D. (Eds). Behavior and Neurology of Lizards. Rockville, Maryland: U.S. National Institute Mental Health. P. 11–64.
O’Keefe J., Nadel L., 1978. The hippocampus as a cognitive map. Oxford University Press. 570 p.
Rand A.S., Rand W.M., 1978. Display and dispute settlement in nesting iguanas // Greenberg N., MacLean P.D. (Eds). Behavior and Neurology of Lizards. Rockville, Maryland: U.S. National Institut Mental Health. P. 245–251.
Regal Ph.J., 1983. The adaptive zone and behavior of lizards // Huey R.B., Pianka E.R. and Schoener T.W. (Eds). Lizard Ecology. Harvard University Press. P. 105–118.
Samuel M.D., Pierce D.J., Garton E.O., 1985. Identifying areas of concentrated use within the home range // Journal Animal Ecology. V. 54. № 3. P. 711–719.
Tolman E.C., 1948. Cognitive maps in rats and men // Psychological Review. V. 55. № 4. P. 189–208.
Tosches M.A., Yamawaki T.M., Naumann R.K., Jacobi A.A., Tushev G., Laurent G., 2018. Evolution of pallium, hippocampus, and cortical cell types revealed by single-cell transcriptomics in reptiles // Science. V. 360. I. 6391. P. 881–888.
Tsellarius A.Yu., Men’shikov Yu.G., 1994. Indirect communication and its role in the formation of social structure in Varanus griseus // Russian Journal of Herpetology. V. 1. № 2. P. 121–132.
Tsellarius A.Yu., Men’shikov Yu.G., Tsellarius E.Yu., 1995. Spacing pattern and reproduction in Varanus griseus of Western Kyzylkum // Russian Journal of Herpetology. V. 2. № 2. P. 153–165.
Tsellarius A.Yu., Tsellarius E.Yu., 1996. Courtship and mating in Varanus griseus of Western Kyzylkum // Russian Journal of Herpetology. V. 3. № 2. P. 122–129.
Tsellarius A.Yu., Tsellarius E.Yu., 1997. Behavior of Varanus griseus during encounters with conspecifics // Asiatic Herpetological Research. V. 7. P. 108–130.
Tsellarius A.Yu., Tsellarius E.Yu., Men’shikov Yu.G., 1997. Notes on the diet and foraging of Varanus griseus // Russian Journal of Herpetology. V. 4. № 2. P. 170–181.
Tsellarius A.Yu.,Cherlin V.A., 1991. Individual identification and new method of marking of Varanus griseus in field conditions // Herpetological researches, 1. Leningrad: LISS. P. 104–118.
Walk R.D., 1965. The study of visual depth and distance perception in animals // Advances in the study of behavior. V. 1. P. 99–154. https://doi.org/10.1016/s0065-3454(08)60057-1
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


