Зоологический журнал, 2021, T. 100, № 12, стр. 1359-1370
Вокальный онтогенез у неворобьиных птиц
А. А. Марченко a, *, И. Р. Бёме a, **
a Московский государственный университет имени М.В. Ломоносова
119234 Москва, Россия
* E-mail: ptyhozoon@gmail.com
** E-mail: irbeme@mail.ru
Поступила в редакцию 12.11.2020
После доработки 12.02.2021
Принята к публикации 17.02.2021
Аннотация
Развитие сигналов у представителей неворобьиных птиц до сих пор изучено только у нескольких видов из разных отрядов. Становление сигналов у них происходит двумя разными способами. В первом случае частота сигналов понижается постепенно по мере увеличения массы тела птенца (гусеобразные, курообразные, соколообразные, ястребообразные). Во втором случае у птенца сохраняются высокочастотные сигналы длительное время, несмотря на значительное увеличение массы тела, а переход на взрослые сигналы происходит за короткий период (журавлеобразные, ржанкообразные, голубеобразные, ракшеобразные). Такая резкая смена ювенильной высокочастотной вокализации на взрослую низкочастотную получила название ломки голоса. Предполагается, что ломка голоса характерна для видов с длительной родительской опекой. В данном обзоре мы систематизировали знания о развитии вокализации у неворобьиных птиц. Все изученные виды были сгруппированы в зависимости от типа онтогенеза (от выводковых до птенцовых), что позволило оценить вклад типа развития в становление вокализации. Оказалось, что характер развития вокализации не связан очевидным образом с типом онтогенеза птенцов.
Развитию акустических сигналов у птиц посвящено множество публикаций. Однако в основном исследования касаются изучения развития песни и позывов у певчих птиц (подотряд Passeri, отряд Воробьинообразные (Passeriformes)), которые обладают способностью к вокальному обучению: для правильного формирования взрослого репертуара необходим учитель. Молодая птица имеет недифференцированный предшественник песни, который через продолжительный процесс изменений преобразуется во взрослую видоспецифичную песню (Бёме, 2006; Jellis, 1977; Kroodsma, Miller, 1996; Catchpole, Slater, 2008). Изучению позывов певчих птиц уделялось меньше внимания, и процесс их развития был описан не так давно. Выделяют три пути: независимый (основные категории сигналов появляются вне зависимости друг от друга), преемственный (основные категории дефинитивных позывов обнаруживают связь с птенцовыми) и “взрывной” (комбинирование независимого и преемственного типов развития позывов) (Бёме, 2006, 2006а; Бёме, Горецкая, 2013). Для воробьинообразных было показано, что тип развития сигналов зависит от социальности вида и местоположения гнезда (открыто- либо закрытогнездящиеся виды). У таких стайных видов как синицы (Paridae) репертуар формируется в сжатые сроки, и в нем преобладают стайные и оборонительные сигналы. У птиц-дуплогнездников растянуто время пребывания в гнезде, и формирование оборонительных сигналов сдвинуто на время после вылета из гнезда (Бёме, 1986, 2014). Несмотря на многочисленные сведения о вокальном онтогенезе птиц из отряда воробьинообразных, знания о развития сигналов у представителей других отрядов остаются отрывочными и неполными.
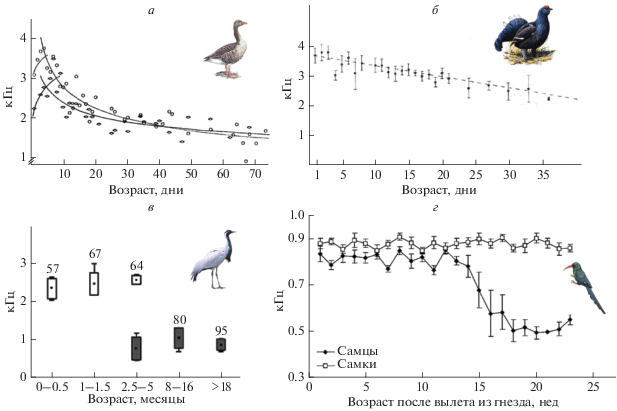
Для птиц, у которых вокальное обучение отсутствует, было описано два способа развития акустических сигналов в онтогенезе. У части видов временны́е и частотные параметры звуков изменяются постепенно, по мере увеличения массы тела птенца и развития его звукопроизводящего органа (сиринкса, или нижней гортани). В этом случае чем крупнее становится птица, тем все более низкие по частоте звуки она издает (рис. 1а, 1б). У других видов частотно-временны́е параметры звуков изменяются скачкообразно в определенный момент жизни птицы, но независимо от изменения массы тела (рис. 1в, 1г). Такой феномен быстрой смены ювенильных высокочастотных сигналов на взрослые низкочастотные получил название ломки голоса (Abs, 1983; Radford, 2004; Klenova et al., 2007, 2010). Морфологическая основа этого процесса до сих пор не изучена.
Рис. 1.
Типы вокального онтогенеза: постепенный (а – серый гусь (ten Thoren, Bergmann, 1987), б – тетерев (Meinert, Bergmann, 1983)); скачкообразный (в – журавль-красавка (Klenova et al., 2014), г – зеленый лесной удод (Radford, 2004)).
В настоящее время процесс формирования звуков известен только для малой части неворобьиных птиц (всего порядка трех десятков видов). При этом описанные выше два типа развития сигналов встречаются у разных таксонов, и иногда взрослый репертуар формируется по-разному даже у представителей одного отряда. Это затрудняет определение типа развития сигналов у видов с неизученным вокальным онтогенезом. Целью данного обзора являются обобщение известной информации об онтогенезе сигналов у неворобьиных птиц и попытка систематизации этих знаний.
Используемые русские названия птиц приведены по: Бёме, Флинт, 1994, латинские – по: Billerman et al., 2020.
Классификация птиц по степени зрелости вылупляющихся птенцов
Систематизировать знания о развитии вокализации представляется удобнее, если использовать не систематическое положение вида, а классификацию по степени зрелости вылупляющихся птенцов. Различия по “способу взросления” птенцов затрагивают сразу поведенческие, физиологические и анатомические особенности, а также степень заботы, которую им оказывают родители. Мы считаем, что закономерности развития сигналов обусловлены скорее типом онтогенеза птенцов, а не систематическим положением вида.
Впервые разделение птиц на группы в соответствии с их типом развития было предложено еще в начале XIX века Лоренцом Океном и стало основой традиционной классификации на “выводковых” и “птенцовых” (Oken, 1816, цит. по: Ковтун, Шатковская, 2011). Птенцовые приходят в мир голыми и слепыми и выкармливаются родителями в гнезде, а выводковые вылупляются зрячими, покрытыми пухом, не нуждаются в кормлении родителями и с первых дней жизни питаются сами. Несмотря на значительное различие птенцов, процесс вылупления происходит сходным образом у всех птиц, кроме представителей семейства большеногих кур (Megapodiidae), для птенцов которых характерны иные движения для выхода из яйца и некоторые другие особенности (Oppenheim, 1972). Ответа на вопрос, какой тип онтогенеза был исходным, до сих пор нет. Во времена Ламарка считалось, что наиболее прогрессивным является выводковый тип развития. Он писал, что вершиной является развитие гусеобразных, поскольку птенцы с рождения могут сами добывать корм и могут не только ходить, но и плавать (Карташев, 1974; Поповкина, Поярков, 2002). Сейчас преобладает точка зрения, что именно птенцовый тип (от полуптенцовых до птенцовых – птенцы которых остаются в гнезде и нуждаются в родительской заботе длительное время) развития является более прогрессивным, так как именно среди этих птиц преобладают самые “умные”: хищные, попугаи и воробьинообразные (Jarvis et al., 2014). К целиком выводковым относятся только древние отряды (такие, как страусообразные и гусеобразные), к птенцовым (в широком смысле – от полуптенцовых до птенцовых) – как относительно древние (семейство аистовые отряда аистообразные, Jarvis et al., 2014), так и эволюционно более молодые (попугаеобразные и воробьинообразные) (Бёме, 2011). Очевидно, птенцовость появлялась в эволюционной истории птиц несколько раз (Starck, Ricklefs, 1998).
У птенцовых птиц после вылупления птенец способен совершать только генерализованные хаотичные движения и на тактильное движение отвечает пищевой реакцией – открывает клюв. Лишь через какое-то время он начинает активно склевывать предложенную пищу. Проявление клевательной реакции у однодневного цыпленка (выводковые) соответствует воробью (птенцовые) в возрасте 12–15 дней (Промптов, 2010). Период гнездовой жизни птенцовых птиц обычно длится до 30 сут, период роста заканчивается быстро. Выводковые вылупляются более самостоятельными, они рано покидают гнездо, но темп роста у них замедленный, а крупные виды могут расти до второго года жизни (Ковтун, Шатковская, 2011).
Дальнейшее изучение онтогенеза птиц привело к созданию подробных классификаций, где разные авторы выделяли от четырех (выводковые, полувыводковые, полуптенцовые, птенцовые) до восьми типов развития (Starck, Ricklefs, 1998; табл. 1). Сначала для описания типов развития использовали до девяти различных характеристик (наличие оперения при вылуплении, локомоторная активность, самостоятельный поиск еды, нахождение в гнезде, следование за родителями и др.). По тому, покидает ли птенец гнездо, разделяли, например, выводковых и птенцовых. Однако в этом случае не учитывается контекст: покидание гнезда может зависеть не только от типа онтогенеза, но и от расположения гнезда или наличия пищевых ресурсов. В конце 20 века было предложено четыре главных признака, по которым можно выделить типы онтогенеза (Starck, Ricklefs, 1998; табл. 1):
Таблица 1.
Типы развития птенцов (по: Starck, Ricklefs, 1998)
| Портманн, 1935 | Найс, 1962 | Старк, 1993 | Большинство других | Оперение | Глаза при вылуплении | Присутствие в гнезде | Родительская забота | Примеры |
|---|---|---|---|---|---|---|---|---|
| Группа 1 | Выводковые 1 | Супервыводковые | Выводковые | Контурные перья | Открыты | Покидают гнездо | Нет | Megapodiidae |
| Группа 2 | Выводковые 2 | Выводковые 1 | Пух | Обогрев | Anatidae, много Charadriiformes | |||
| Выводковые 3 | Выводковые 2 | Показывают птенцам еду | Rheidae, Numididae, Meleagrididae, Tetraoninae | |||||
| Выводковые 4 | Выводковые 3 | Полувыводковые | Кормят птенцов | Cracidae, Turnicidae, Gruidae, Rallidae | ||||
| Группа 3 | Полувыводковые | Полувыводковые | В районе гнезда | Большинство Alcidae, Laridae, Stercorariidae | ||||
| Группа 4 | Полуптенцовые 1 | Полуптенцовые | Полуптенцовые | Остаются в гнезде | Accipitridae, Ciconiidae | |||
| Группа 5 | Полуптенцовые 2 | Птенцовые 1 | Птенцовые | Закрыты | Columbidae, Phalacracrocoracidae | |||
| Группа 6, 7 | Птенцовые | Птенцовые 2 | Отсутствует | Sulidae, Psittacidae, Passeriformes |
1. Оперение (нет/пух/перья)
2. Глаза (открыты/закрыты)
3. Нахождение в гнезде (да/нет/около)
4. Родительская забота (кормят/показывают еду/ греют и защищают/нет).
По мнению авторов этой классификации, такие признаки лучше совмещают поведенческие и экологические черты развития.
Тем не менее с определением типа развития у некоторых птиц остаются сложности. Например, буревестниковые (Procellariidae) и качурки (Hydrobatidae) вылупляются покрытыми пухом и с открытыми глазами, а в дальнейшем могут долго оставаться в норе без родителей. Их терморегуляция более сходна с выводковыми, хотя обычно их помещают в полувыводковых или полуптенцовых. Многие голуби и горлицы (Columbidae) вылупляются типично птенцовыми, но покидают гнездо при достижении всего половины взрослого веса (например, капская горлица (Oena capensis)). Заметные различия бывают и внутри одного отряда. Так, отряд ржанкообразные (Charadriiformes) включает много различных типов (табл. 1 по: Найс (Starck, Ricklefs, 1998)): от выводковых 2 (ржанковые Charadriidae) до полувыводковых (чайковые Laridae) и полуптенцовых (рачьи ржанки Dromadidae). Некоторые признаки, например наличие или отсутствие пуха при вылуплении, могут различаться даже внутри одного рода: у альпийской галки (Pyrrhocorax graculus) птенцы вылупляются опушенные, а у клушицы (P. pyrrhocorax) – голые (Starck, Ricklefs, 1998).
Развитие сигналов в онтогенезе у неворобьиных птиц
Развитие сигналов у воробьинных птиц (отряд Passeriformes) – в основном песни и в меньшей степени позывов – довольно подробно изучено на многих представителях отряда (Бёме, 2006; Jellis, 1977; Kroodsma, Miller, 1996; Catchpole, Slater, 2008). Однако процесс формирования сигналов у остальных отрядов остается менее изученным, т.к. к настоящему моменту вокальный онтогенез описан только для трех десятков видов. Согласно данным литературы, у представителей неворобьиных птиц формирование сигналов может происходить двумя способами: постепенно, по мере увеличения массы тела птенца и развития сиринкса, либо скачкообразно. В первом случае (рис. 1а, 1б) частота сигналов плавно понижается по мере роста птенца (Meinert, Bergmann, 1983; ten Thoren, Bergmann, 1987). Во втором случае птенец длительное время сохраняет высокочастотные сигналы, несмотря на значительное увеличение массы тела. Переход на взрослую вокализацию происходит скачкообразно в определенный момент жизни птицы (рис. 1в, 1г). Этот процесс получил название ломки голоса и описан у нескольких видов из разных отрядов (Abs, 1983; Radford, 2004; Klenova et al., 2007, 2010, 2014; Klenova, Kolesnikova, 2013), но его морфологическая основа остается до сих пор не ясной.
Далее мы постараемся обобщить имеющиеся данные об онтогенезе вокального поведения у неворобьиных птиц и найти закономерности, объясняющие присутствие постепенного или скачкообразного типа развития сигналов. Для этого все виды с изученным типом вокального онтогенеза мы разделили на группы в зависимости от типа развития по классификации Найс (Starck, Ricklefs, 1998) (табл. 1).
К выводковым 1 типа относится только одно семейство – большеногие куры (Megapodiidae, отряд Galliformes). Другое название этой группы – супервыводковые, что, на наш взгляд, лучше описывает их главную особенность: полное отсутствие заботы родителей о птенцах. Птенцы вылупляются оперенными и могут летать уже на следующий день (Starck, Ricklefs, 1998). У взрослых особей богатый вокальный репертуар, они много и часто вокализируют (Jones, 1999). Однако развитие сигналов в этом семействе не изучено. В единственной публикации (Saiya et al., 2016) подробно разобрана вокализация молуккского большенога (Eulipoa wallacei), состоящая из пяти типов сигналов (частота от 2 до 5 кГц). К сожалению, в работе не указан возраст особей, упоминается только, что записывали сигналы двух взрослых и двух молодых особей. Остается неясным, есть ли различие в частотном диапазоне сигналов у птиц разных возрастов.
Среди выводковых 2 типа наиболее подробно изучен репертуар и развитие сигналов у гусеобразных (Anseriformes). Вокальный онтогенез был описан для нескольких видов: серый гусь (Anser anser) (ten Thoren, Bergmann, 1987), белощекая казарка (Branta leucopsis) (ten Thoren, Bergmann, 1987а), горный гусь (A. indicus), белый гусь (A. сaerulescens), белолобый гусь (A. albifrons), канадская казарка (B. canadensis) (Von Wurdinger, 1970), пеганка (Tadorna tadorna) (Engländer, Bergmann, 1990).
Для серого гуся и белощекой казарки (ten Thoren, Bergmann, 1987, 1987) развитие акустических сигналов прослежено с момента вылупления птенца до достижения 90–100-дневного возраста (к этому времени достигается масса взрослой птицы и заканчивается развитие птенца). Быстрое морфологическое развитие у этих птиц сопровождается и быстрым изменением акустических сигналов. Для обоих видов в вокальном репертуаре были выделены 4 типа сигналов (“плач”, “крик уходящего”, “ви” и “трель”). Все четыре крика, наряду с добавлением новых, переходят во взрослый репертуар.
Для всех изученных видов гусеобразных было показано сходное изменение акустических сигналов. Все частотные параметры звуков птенцов постепенно и равномерно снижаются по мере взросления (рис. 1а). Однако у всех видов имеется краткосрочный подъем основной частоты во всех типах криков сразу после вылупления, причем максимум достигается к 8-му дню. Авторы (ten Thoren, Bergmann, 1987) рассматривают этот ранний подъем основной частоты как выражение функционального созревания. Гусята рано начинают следовать за родителями, но их способность к активным передвижениям полностью формируется как раз к 5–8-му дню. Дальнейшее постепенное понижение частоты идет синхронно с увеличением массы тела и развитием сиринкса. При этом площадь внутренней тимпаниформной мембраны сиринкса увеличивается в 44 раза, площадь наружной мембраны – в 18 раз (Von Wurdinger, 1970). Самцы и самки начинают различаться по массе примерно с 30-го дня, с этого же времени их сигналы начинают различаться по частоте. По мере роста птенцов в их криках увеличивается количество шумов, которое достигает максимума к 40-му дню жизни. Наряду с падением частоты это характеризует, по мнению авторов, процесс созревания (ten Thoren, Bergmann, 1987, 1987a). Увеличение шумов в криках авторы называют “ломкой голоса”. Но резкого скачка основной частоты от высокой птенцовой к низкой взрослой – т.е. того, что в настоящее время называется ломкой голоса – у гусеобразных не наблюдается. В дальнейшем в данном обзоре “ломкой голоса” в кавычках мы обозначаем увеличение доли шумов в звуках, а ломка голоса без кавычек – это резкая смена частот в сигналах птенцов.
Сходный с гусями и казарками процесс развития сигналов описан для пеганки (вид из того же семейства Anatidae). После кратковременного подъема частоты, который длится до 5-го дня после вылупления, частота сигналов птенцов постепенно уменьшается и достигает минимума в возрасте 60–70 дней. В это время в сигналах пеганки, как и у гусей и казарок, увеличивается количество шумов – происходит “ломка голоса”, выраженная в зашумлении сигналов, а не скачке основной частоты. Репертуар самок напрямую развивается из птенцовых сигналов, а у самцов добавляются новые элементы и комбинации сигналов, а также происходит вторичное повышение частоты сигналов (Engländer, Bergmann, 1990).
У выводковых 3 типа развитие сигналов в онтогенезе описано на примере курообразных (Galliformes). У этого отряда вокальный онтогенез протекает сходно с вокальным онтогенезом гусеобразных. У птенцов тетерева (Tetrao tetrix, семейство Phasianidae) происходит постепенное понижение основной частоты сигналов с 4.0 (в период от вылупления) до 2.2 кГц (возраст 40 дней) (рис. 1б). Изменение основной частоты коррелирует с изменением массы тела птенца (Meinertand, Bergmann, 1983): более крупная птица издает более низкие сигналы. По такому же сценарию формируются сигналы у японского перепела (Coturnix japonica): частотные параметры сигналов постепенно снижаются по мере роста птенца, и ломка голоса отсутствует (Жарская, Черный, 1979; цит. по: Klenova et al., 2014).
Отряд журавлеобразные (Gruiformes) является наиболее полно и подробно изученной группой не только среди выводковых 4 типа, но и среди выводковых всех типов. Онтогенез вокального поведения описан для шести видов журавлей (семейство Gruidae): это стерх (Leucogeranus leucogeranus) (Худякова, 2002, цит. по: Klenova et al., 2014; Bragina, Beme, 2010), восточный венценосный журавль (Balearica regulorum) (Budde, 1999, 2001), канадский журавль (Antigone canadensis) (Niemeier, 1979, цит. по: Klenova et al., 2014; Nesbitt, Bradley, 1997), серый журавль (G. grus) (Gebauer, Kaiser, 1998), японский журавль (G. japonensis) (Klenova et al., 2007, 2010) и журавль-красавка (Anthropoides virgo) (Klenova et al., 2014), а также для двух видов пастушковых (семейство Rallidae): американская лысуха (Fulica americana) (Cosens, 1981) и кювьеров пастушок (Dryolimnas cuvieri) (Wilkinson, Huxley, 1978).
У всех изученных видов журавлей птенцы сохраняют высокочастотные сигналы без изменений или со слабыми изменениями в течение длительного периода времени, несмотря на значительное увеличение массы тела. Основная частота сигналов взрослых птиц при этом значительно ниже (Nesbitt, 1997; Budde, 1999, 2001; Bragina, Beme, 2010). Для птенцов восточного венценосного журавля был показан даже подъем основной частоты с возрастом для контактного сигнала (около 1.5 кГц в возрасте 5 недель, до 2.5 кГц в возрасте 9 недель), а сигнал выпрашивания пищи оставался в интервале 1.0–2.3 кГц в течение первых 9 недель (Budde, 2001). При этом основная частота сигналов взрослых венценосных журавлей не превышает 0.6 кГц (Budde, 1999).
Процесс преобразования птенцовых сигналов во взрослые впервые был описан для серого журавля (Gebauer, Kaiser, 1998). В дальнейшем формирование сигналов было подробно описано в работах по японскому журавлю (Klenova et al., 2007, 2010) и журавлю-красавке (Klenova et al., 2014). Птенцы журавлей этих видов также сохраняют высокочастотные птенцовые сигналы (2.0–3.5 кГц) длительное время. Однако в возрасте 7–8 (японский журавль, Klenova et al., 2007, 2010) или 2.5–5 месяцев (журавль-красавка, Klenova et al., 2014) в сигналах птенцов появляется вторая основная частота (0.5–1.0 кГц, рис. 1в), которая лежит гораздо ниже основной частоты птенцового сигнала. В результате в определенный период времени в сигналах птенцов присутствуют обе основные частоты, а затем птенцовая частота постепенно исчезает. В сигналах остается только низкочастотная составляющая, которая не отличается от основной частоты взрослых птиц. Период, когда в сигналах птенцов присутствуют 2 основные частоты, соответствует периоду ломки голоса (Klenova et al., 2007, 2010, 2014).
Обычно процесс ломки голоса длится несколько месяцев. Окончание ломки голоса в среднем совпадает с окончанием интенсивного роста тела птенца и началом разрыва связи между родителями и потомством. Ломка голоса происходит на первом году жизни, а половое созревание – на втором или третьем (Klenova et al., 2007, 2010). Интересно, что у журавлят, выращенных в питомнике, начало ломки голоса зависело от времени отъема от родителей – чем раньше забирали птенца, тем раньше начиналась ломка голоса. У диких журавлей родители продолжают заботиться о птенцах и на зимовках, а связь между ними рвется только перед новым сезоном размножения (Klenova et al., 2007).
Вокальный онтогенез представителей семейства пастушковых демонстрирует некоторое сходство с развитием сигналов у журавлей. У американской лысухи не происходит резких изменений частотных характеристик сигналов в первый месяц жизни, несмотря на интенсивный рост и развитие птенцов. В двух сигналах (из четырех, которые присутствуют в репертуаре в это время) с возрастом происходит даже повышение частоты (примерно на 0.4 кГц, а сами звуки лежат в диапазоне от 0.8 до 2.3 кГц). Сигналы взрослых самцов лысух практически не отличаются по частотным характеристикам от птенцовых (1.2–1.5 кГц). Сигналы взрослых самок по основной частоте примерно в 2 раза ниже птенцовых сигналов и сигналов самцов (0.4–0.6 кГц). Падение основной частоты сигналов молодых самок связано, как предполагает автор, с гормональными перестройками и начинается примерно в возрасте 1.5–2 месяцев (Cosens, 1981).
Частотные характеристики сигналов птенцов кювьерова пастушка также не сильно изменяются в первый месяц жизни (в это время основная частота выше 3.5 кГц). Первые сигналы, идентичные взрослым, появляются в репертуаре примерно с 12-й недели, их основная частота ниже, чем у птенцовых, и не превышает 1.5 кГц. Еще четыре новых сигнала появляются в репертуаре не раньше 9-го месяца – при достижении половозрелости (Wilkinson, Huxley, 1978). И у американской лысухи, и у кювьерова пастушка появление в репертуаре дефинитивных сигналов совпадает с приобретением птенцами независимости от родителей.
Однако у шилоклювки (Recurvirostra avosetta, семейство Recurvirostridae, отряд Charadriiformes), которая также относятся к этой группе по типу развития, было показано постепенное развитие сигналов в онтогенезе. Основная частота сигналов понижается с 2.0–4.5 до 1.0–1.5 кГц в течение 11 месяцев после вылупления. Взрослый репертуар формируется только в 9–11 месяцев, хотя рост птенцов заканчивается уже к двум месяцам. Сходная с гусеобразными “ломка голоса”, выраженная в увеличении шумов в звуках, начинается в 9-месячном возрасте, что совпадает с моментом приобретения птенцами независимости от родителей (Adret, 2012).
Следующую группу, полувыводковых, отличает от предыдущих то, что птенец не покидает гнездо, а остается в нем или рядом длительное время. Развитие вокализации в этой группе носит сходный характер у всех описанных видов.
Подробно изучен онтогенез вокального поведения у трех видов из семейства чистиковые Alcidae: большая конюга (Aethia cristatella), топорок (Fratercula cirrhata) и ипатка (F. corniculata) (Klenova, Kolesnikova, 2013). Птенцы всех трех видов сохраняют высокочастотные птенцовые сигналы примерно до 30-го дня после вылупления. Основная частота сигналов растет медленно, несмотря на активное увеличение массы тела. Для топорка была показана ломка голоса, аналогичная журавлям: в возрасте 30–31-го дня в сигналах птенцов появляется вторая основная частота, которая гораздо ниже птенцовой и соответствует основной частоте сигналов взрослых птиц (птенцовая основная частота варьирует от 1.0 до 5.0 кГц, вторая основная частота лежит ниже 1.0 кГц). Ломка голоса происходит незадолго до покидания норы. Несмотря на то, что в данной работе не показана ломка голоса для двух других видов (их онтогенез прослежен только до 28 дней), предполагается, что она протекает по такому же сценарию, как и у топорка.
У других видов этой группы процесс ломки голоса не описан, но имеющиеся данные дают основание предполагать ее наличие. Например, у обыкновенной глупой крачки (Anous stolidus, семейство Laridae, отряд Charadriiformes) птенцовые сигналы сохраняются долгое время (в среднем от 1.0 до 3.2 кГц) – до 60 дней после вылупления (Riska, 1986). При этом птенцы покидают нору в возрасте 42–49 дней. Сигналы взрослых птиц лежат в диапазоне от 0.2 до 3.2 кГц (Riska, 1986а). Сходным образом происходит развитие сигналов у северной качурки (Oceanodroma leucorhoa, семейство Hydrobatidae, отряд Procellariiformes). В течение гнездового периода у птенцов не изменяется частота сигналов, оставаясь на уровне 2–4 кГц (Naugler, Smooth, 1992). При этом частота сигналов взрослых птиц лежит ниже 1 кГц (Taoka et al., 1989). У других представителей отряда буревестникообразных – тонкоклювых китовых птичек (Pachyptila belcheri, семейство Procellariidae) – частота сигналов птенцов также не изменяется в течение гнездового периода (оставаясь на уровне 2 кГц), а увеличивается только их длительность. Маленькие птенцы используют короткие сигналы, но группируют их в серии. Сигнал выпрашивания пищи остается в репертуаре и после окончания гнездового периода. Сходные со взрослыми сигналы появляются только в конце гнездового периода (Duckworh et al., 2009). Сигналы взрослых особей гораздо ниже по частоте и лежат в диапазоне 0.5–1.0 кГц (Bretagnolle et al., 1990).
У авдотки (Burhinus oedicnemus, семейство Burhinidae, отряд Charadriiformes) онтогенез вокализации также происходит скачкообразно. Сигналы у птенцов почти не меняются в течение 70 дней жизни; несмотря на то, что птенцы растут и развиваются (Dragonetti et al., 2013). Птенцы также способны самостоятельное питаться уже в первые дни жизни, родители только приносят и показывают корм, но не кормят птенцов (Karavaev, 1998; Sharma, Sharma, 2015). Если отсутствует фактор беспокойства, выводок держится в районе гнезда около 20 дней. После 75–80 дней молодые птицы перестают использовать птенцовую вокализацию. Хотя процесс ломки голоса и не описан у этого вида, различие сигналов молодых и взрослых птиц и длительное сохранение высокочастотных сигналов у птенцов дают основание предполагать ее наличие (Dragonetti et al., 2013).
К полуптенцовым 1 типа, птенцы которых вылупляются зрячими и в пуху, но не покидают гнездо до вылета, относятся дневные хищные птицы. Развитие сигналов описано для некоторых представителей отрядов соколообразные (Falconiformes) и ястребообразные (Accipitriformes): для них характерен постепенный тип развития сигналов. Как у воробьиной (Falco sparverius) (Smallwood, Dudajek, 2003), так и у обыкновенной пустельги (Falco tinnunculus) (Михайленко, 2012)11 частота сигналов изменяется постепенно по мере роста птенцов. Наиболее быстро вокальные характеристики меняются в первые две недели жизни птенцов. К 16-му дню жизни птенцы начинают воспроизводить крик, звучащий как взрослый “кли”, в это же время их вес достигает веса взрослой особи. Самцы быстрее начинают вокализировать как взрослые, хотя половых различий в сигналах птенцов найдено не было (Smallwood, Dudajek, 2003). Сходный тип развития показан для еще одного представителя соколообразных – балобана (Falco cherrug), а также для одного вида из отряда ястребообразные – ястреба-тетеревятника (Accipiter gentilis) (Марченко и др., 2018). У птенцов балобана с возрастом увеличивается число нелинейных феноменов в звуках, особенно шума, который иногда полностью маскирует структуру сигнала. Такой процесс сходен с развитием сигналов у гусеобразных (“ломка голоса”), у которых число шумов также увеличивается в сигналах с возрастом (ten Thoren, Bergmann, 1987). Возможно, в случае с соколообразными увеличение числа нелинейных феноменов наряду с падением частоты сигналов можно трактовать как процесс созревания (Марченко и др., 2018).
Полуптенцовые 2 типа вылупляются незрячими, но, в отличие от настоящих птенцовых, имеют пух. К ним относятся, например, голубеобразные (отряд Columbiformes), для которых характерна ломка голоса. Обычно она происходит в возрасте 7–8 недель у птенцов обоего пола (Abs, 1983; Ballintijn, ten Cate, 1997). В это время основная частота птенцового сигнала у сизого голубя (Columba livia) падает с 4.5 до 0.25 кГц, и птенцовый крик выпрашивания пищи переходит во взрослый крик “хууу”. В это время на спектрограмме сигнала различимы две основные частоты. В период ломки голоса у самцов вес сиринкса увеличивается на 36%. А сразу после ломки голоса (9–10-я неделя жизни) у птенцов обоего пола утолщается внешняя тимпаниформная мембрана сиринкса. Ломка голоса может зависеть от концентрации андрогенов: у птиц, которым вводили тестостерон, она наступала раньше, у кастрированных – позже. Причем у последних утолщение внешней тимпаниформной мембраны не было отмечено. Также в период ломки голоса спокойные и малоактивные молодые птицы проявляли признаки агрессии. Все это говорит о том, что вокальное поведение молодых птиц находится под влиянием эндокринной системы (Abs, 1983). У кольчатой горлицы (Streptopelia decaocto) ломка голоса также затрагивает сигналы птенцов обоего пола. У взрослых особей основная частота сигнала самцов (в районе 0.55 кГц) находится несколько ниже основной частоты сигнала самок (в районе 0.625 кГц), но длительность сигнала одинакова как у самок, так и у самцов (Ballintijn, ten Cate, 1997).
К этому же типу развития принадлежат древесные удоды (семейство Phoeniculidae, отряд Bucerotiformes), птенцы которых вылупляются покрытыми длинным белым пухом (Winkler et al., 2015). Для зеленого лесного удода (Phoeniculus purpureus) показана ломка голоса (рис. 1г), которая затрагивает только сигналы самцов и происходит в возрасте 12–14 недель (Radford, 2004). Частотные характеристики их звука “кек” резко понижаются с 0.8–0.9 до 0.5–0.6 кГц, при этом основная частота этого сигнала у самок остается прежней (в районе 0.9 кГц). Сигналов самцов с промежуточными значениями основных частот найдено не было, т.е. птицы издавали либо только высокочастотные (выше 740 Гц), либо только низкочастотные сигналы (ниже 570 Гц). При таком резком падении основной частоты у самцов не происходит изменения размеров тела. Возможно, это объясняется тем, что сиринкс самцов в онтогенезе постепенно начинает отличаться от сиринкса самок, и быстрая ломка голоса происходит благодаря внутренним изменениям в сиринксе, однако, каким именно изменениям, остается пока неизученным. Еще одним объяснением может служить косвенное действие андрогенов. Во время ломки голоса у молодых самцов начинается линька горлового пятна, которая контролируется гормонально. Возможно, ломка голоса является следствием гормональных изменений на этой стадии развития (Radford, 2004).
Птенцовые, к которым относятся большинство воробьинообразных, вылупляются слепыми и голыми, они долгое время не покидают гнездо и выкармливаются родителями. Среди представителей воробьинообразных интерес вызывает развитие позывов у обыкновенной сороки (Pica pica), у которой отсутствует вокальное научение. Птенцы начинают вокализировать в первые 1–2 дня жизни. При этом в период с 1-го по 18-й день после вылупления частота двух сигналов понижается с 4.7 до 1.7 кГц (выпрашивание пищи) и с 3.4 до 1.9 кГц (свист) (Redondo, 1991). По всей видимости, ломка голоса у этого вида отсутствует, но с возрастом частота сигналов снижается, и они становятся более “шумными”. Сходный процесс развития сигналов описан для гусеобразных (выводковые 2) и соколообразных (полуптенцовые 1). Подобных данных о процессе развития позывов у других воробьинообразных в литературе пока нет.
Тремя десятками видов исчерпываются знания о развитии вокализации у неворобьиных птиц. Кратко информация по типам вокального онтогенеза этих видов представлена в табл. 2. В настоящий момент говорить о сходствах/различиях в формировании позывов у воробьинообразных и у неворобьиных птиц сложно ввиду недостатка данных для обeих групп. Но, по-видимому, ”преемственный“ тип развития у воробьинообразных можно соотнести с ”постепенным“ типом развития у неворобьиных, т.к. в обоих случаях изменения происходят плавно. Однако такое сравнение остается спекулятивным, так как при рассмотрении развития позывов у певчих птиц упор делается на сходство структур сигналов птенцов и взрослых, а не на изменение частоты сигналов.
Таблица 2.
Виды с изученным типом вокального онтогенеза и тип развития птенцов
| Тип развития | Постепенное развитие сигналов (нет ломки голоса) | Скачкообразное развитие сигналов (есть ломка голоса) |
|---|---|---|
| Выводковые 2 | Пеганка, серый гусь, белощекая казарка, горный гусь, белый гусь, белолобый гусь, канадская казарка | – |
| Выводковые 3 | Тетерев, японский перепел | – |
| Выводковые 4 | Шилоклювка | Американская лысуха, белогорлый пастушок, венценосный журавль, канадский журавль, стерх, японский журавль, серый журавль, журавль-красавка |
| Полувыводковые | – | Топорок, тупик, ипатка, глупая крачка, северная качурка, авдотка |
| Полуптенцовые 1 | Обыкновенная пустельга, американская пустельга, балобан, ястреб-тетеревятник | – |
| Полуптенцовые 2 | – | Сизый голубь, кольчатая горлица, зеленый лесной удод |
| Птенцовые | Обыкновенная сорока | – |
Два типа развития сигналов – постепенный и скачкообразный – распределены почти поровну среди изученных видов (15 и 17 соответственно) неворобьиных птиц. “Ломку голоса” (у гусеобразных и соколообразных, шилоклювки и сороки, принадлежащей к воробьинообразным) в настоящее время следует относить к постепенному типу развития сигналов. При этом однозначные данные о том, увеличивается ли зашумленность сигналов с возрастом у других видов с постепенным типом развития вокализации, в литературе пока отсутствуют.
Таким образом, тип развития птенцов (выводковость и птенцовость), по-видимому, не связан напрямую со способом развития сигналов. Предположение о том, что для птиц с длительной родительской опекой характерны сохранение высокочастотных сигналов продолжительное время и последующая ломка голоса, опровергается наличием постепенного типа развития сигналов у таких птенцовых птиц, как дневные хищные птицы и обыкновенная сорока. Мы не исключаем, что тип онтогенеза вносит вклад в способ развития вокализации, но является при этом лишь одним из факторов. Вероятно, развитие вокализации, в том числе и ломка голоса, зависит от действия гормонов, что косвенно показано для американской лысухи, сизого голубя и зеленого лесного удода. Поэтому изучение гормональной регуляции развития вокализации является весьма перспективным направлением в изучении онтогенеза сигналов у неворобьиных птиц. В том числе в плане понимания существующего разнообразия способов такого развития.
Влияние гормонов на развитие позывов у воробьинообразных также остается пока малоизученным. Так, изменения уровня тестостерона в крови на разных стадиях жизненного цикла довольно хорошо изучены у взрослых особей многих видов воробьинообразных птиц (Wingfield et al., 1990, 2000), в то время как динамика этого гормона у молодых птиц практически не исследована. Повышение уровня тестостерона было отмечено у молодых канареек (Serinus canaria): на 55–75-й день жизни у самцов и на 30–55-й день у самок, что по времени совпадает с началом исполнения подпесни (Weichel et al., 1986, 1989). Повышение уровня тестостерона у молодых больших синиц (Parus major) также, предположительно, совпадало с началом песенной продукции (Rost, 1990).
Чтобы определить, является постепенное развитие сигналов у соколообразных, ястребообразных и обыкновенной сороки исключением или это характерно для всех полуптенцовых 1 и птенцовых, необходимы данные о других представителях этих групп, которые пока отсутствуют в литературе. Также еще предстоит выяснить, какие другие биологические, морфологические особенности или особенности поведения определяют тип развития вокализации у неворобьиных птиц.
Список литературы
Бёме И.Р., 1986. Типы развития акустических сигналов воробьиных птиц в онтогенезе // Доклады Академии Наук. Т. 291. № 3. С. 749–751.
Бёме И.Р., 2006. Формирование вокализации воробьиных птиц (Passeriformes) в онтогенезе. Современное состояние проблемы // Журнал общей биологии. Т. 67. № 4. С. 268–279.
Бёме И.Р., 2006а. Взаимоотношение врожденного и приобретенного в песне птиц // Развитие современной орнитологии Северной Евразии. Труды XII Международной орнитологической конференции Северной Евразии. Ред. Коблик Е.А. Издательство СГУ. С. 625–634.
Бёме И.Р., 2011. Онтогенез акустических сигналов выводковых и птенцовых птиц: эволюционные аспекты // Труды Мензбировского орнитологического общества. Т. 1. Материалы XIII Международной орнитологической конференции. Ред. Белик В.П., Джамирзоев Г.С. АЛЕФ (ИП Овчинников). С. 31–39.
Бёме И.Р., 2014. Формирование позывов у птиц-дуплогнездников // Птицы дуплогнездники как модельные объекты в решении проблем популяционной экологии и эволюции. Материалы международной конференции. Ред. Ильина Т.А. М.: Товарищество научных изданий КМК. С. 33–35.
Бёме И.Р., Горецкая М.Я., 2013. Песни птиц. М.: Товарищество научных изданий КМК. 78 с.
Бёме Р.Л., Флинт В.Е., 1994. Пятиязычный словарь названий животных. Птицы. Латинский, русский, английский, немецкий, французский // Под общ. ред. акад. В.Е. Соколова. М.: Русский язык, РУССО. 471 с.
Карташев Н.Н., 1974. Систематика птиц. / Высшая школа. 342 с.
Ковтун М.Ф., Шатковская О.В., 2011. Возникновение модели птенцового развития у птиц: к проблеме эволюции онтогенеза // Вестник зоологии. Т. 45. № 2. С. 161–171.
Марченко А.А., Бёме И.Р., Сарычев Е.И., 2018. Онтогенез вокального поведения дневных хищных птиц на примере балобана (Falco cherrug) и ястреба-тетеревятника (Accipiter gentilis) // Зоологический журнал. Т. 97. № 6. С. 712–722.
Поповкина А.Б., Поярков Н.Д., 2002. История исследований филогенетических отношений и построения систем гусеобразных (Anseriformes) // Казарка. Т. 8. С. 41–77.
Промптов А.Н., 2010. Очерки о проблеме биологической адаптации поведения воробьиных птиц. М.: Книжный дом “ЛИБРОКОМ”. 320 с.
Abs M., 1983. Physiology and behavior of the pigeon. Federal Republic of Germany: Academic Press. 18 p.
Adret P., 2012. Call development in captive-reared Pied Avocets, Recurvirostra avosetta // Journal of Ornithology. V. 153. P. 535–546.
Ballintijn M.L., ten Cate C., 1997. Vocal Development and Its Differentation in a Non-Songbird: the Collared Dove (Streptopelia decaocto) // Behaviour. V. 134. № 7. P. 595–621.
Billerman S.M., Keeney B.K., Rodewald P.G., Schulenberg T.S. (Eds), 2020. Birds of the World. Ithaca, NY, USA: Cornell Laboratory of Ornithology. https://birdsoftheworld.org/bow/home
Bragina E.V., Beme I.R., 2010. Siberian Crane duet as an individual signature of a pair: comparison of visual and statistical classification techniques // Acta Ethologica. V. 13. P. 39–48.
Bretagnolle V., Zotier R., Jouventin P., 1990. Comparative Population Biology of Four Prions (Genus Pachyptila) from the Indian Ocean and Consequences for Their Taxonomic Status // The Auk. V. 107. № 2. P. 305–316.
Budde C., 1999. The vocal repertoire of the Grey Crowned Crane Balearica regulorum gibbericeps. I. The tonal and the non-harmonic calls // Bioacoustics. V. 10. P. 161–173.
Budde C., 2001. Ontogeny of calls of a nonpasserine species: of the Grey Crowned Crane Balearica regulorum gibbericeps // African Journal of Ecology. V. 39. P. 33–37.
Catchpole C.K., Slater P.J.B., 2008. Bird Song: Biological Themes and Variations. Cambridge: Cambridge Univ. Press. 335 p.
Cosens S.E., 1981. Development of vocalizations in the American Coot // Canadian journal of zoology. V. 59. P. 1921–1928.
Dragonetti M., Caccamo C., Corsi F., Farsi F., Giovachini P., et al., 2013. The Vocal Repertoire of the Eurasian Stone-Curlew (Burhinus oedicnemus) // The Wilson Journal of Ornithology. V. 125. № 1. P. 34–49.
Duckworth A., Masello J.F., Mundry R., Quillfeldt P., 2009. Functional characterization of begging calls in Thin-billed Prions Pachyptila belcheri chicks // Acta Ornithologica. V. 44. № 2. P. 127–137.
Engländer W., Bergmann H.-H., 1990. Sex specific voice development in the Shelduck Tadorna tadorna // Journal für Ornithologie. V. 131. P. 174–176.
Gebauer A., Kaiser M., 1998. Anmerkung zur Lautentwicklung und zum Stimmbruch beim Grauen Kranich (Grus grus) // Brandenburgische Unwelt Berichte. V. 3. P. 25–33.
Jarvis E.D., Mirarab S., Aberer A.J., Li B., Houde P., et al., 2014. Whole-genome analyses resolve early branches in the tree of life of modern birds // Science. V. 346. P. 1311–1320.
Jellis R., 1977. Bird Sounds and Their Meaning. Cambridge: British Broadcasting Corporation. 256 p.
Jones D.N., 1999. What we don’t know about megapodes // Zoologische Verhandelingen. V. 327. P. 159–168.
Karavaev A.A., 1998. Daily activity of Stone Curlew Burhinus oedicnemus during the breeding period // International Wader Studies. V. 10. P. 329–332.
Klenova A.V., Volodin I.A., Volodina E.V., 2007. The vocal development of the Red-Crowned Crane Grus japonensis // Ornithological Science. V. 6. P. 107–119.
Klenova A.V., Volodin I.A., Volodina E.V., Postelnykh K.A., 2010. Voice breaking in adolescent red-crowned cranes (Grus japonensis) // Behaviour. V. 147. P. 505–525.
Klenova A.V., Kolesnikova Y.A., 2013. Evidence for a non-gradual pattern of call development in Auks (Alcidae, Charadriiformes) // Journal of Ornithology. V. 154. № 3. P. 705–716.
Klenova A.V., Goncharova M.V., Bragina E.V., Kashentseva T.A., 2014. Vocal development and voice breaking in Demoiselle Cranes (Anthropoides virgo) // Bioacoustics. V. 23. № 3. P. 247–265.
Kroodsma D.E., Miller E.H., 1996. Ecology and Evolution of Acoustic Communication in Birds. Ithaca and London: Comstock Pub. Associates. 587 p.
Meinert U., Bergmann H-H., 1983. Zur Jugendentwicklung der Lautäußerungen beim Birkhuhn (Tetrao tetrix) // Behaviour. V. 85. № 3. P. 242–258.
Naugler C.T., Smoth P.C., 1992. Vocalizations of nestling Leach’s Storm-petrels // The Condor. V. 94. № 4. P. 1002–1006.
Nesbitt S.A., Bradley R.A., 1997. Vocalizations of sandhill cranes // North American Crane Workshop Proceeding. V. 227. P. 29–35.
Oppenheim R.W., 1972. Prehatching and hatching behaviour in birds: a comparative study of altricial and precocial species // Animal Behaviour. V. 2. № 4. P. 644–655.
Radford A.N., 2004. Voice breaking in males results in sexual dimorphism of Green woodhoope calls // Behaviour. V. 141. № 5. P. 559–569.
Redondo T., 1991. Early stages of vocal ontogeny in the Magpie (Pica pica) // Journal für Ornithologie. V. 132. P. 145–163.
Riska D.E., 1986. An analysis of vocal communication in young Brown Noddies (Anous stolidus) // The Auk. V. 103. P. 351–358.
Riska D.E., 1986a. An analysis of vocal communication in adult Brown Noddies (Anous stolidus) // The Auk. V. 103. P. 359–369.
Rost R., 1990. Hormones and behaviour: A joint examination of studies on seasonal variation in song production and plasma levels of testosterone in the Great Tit Parus major // Journal of Ornithology. V. 131. P. 403–411.
Saiya H.G., Verboom W.C., Heij C.J., 2016. Vocal communication between Moluccan Megapodes (Eulipoa wallacei) // JunoBioacoustics. № 201604. P. 1–19.
Sharma M., Sharma R.K., 2015. Ecology and Breeding Biology of Indian Stone Curlew (Burhinus indicus) // Nature Environment and Pollution Technology. V. 14. № 2. P. 423–426.
Smallwood J.A., Dudajek V., 2003. Vocal development in American kestrel (Falco sparverius) nestlings // The Raptors Research Foundation. V. 37. № 1. P. 37–43.
Starck J.M., Ricklefs R.F., 1998. Patterns of development: the altricial-precocial spectrum // Avian growth and development: evolution within the altricial-precocial spectrum. New York–Oxford: Oxford University Press. P. 3–30.
Taoka M., Won P.-O., Okumura H., 1989. Vocal Behavior of Swinhoe’s Storm-Petrel (Oceanodroma monorhis) // The Auk. V. 106. № 3. P. 471–474.
Ten Thoren A., Bergmann H.-H., 1987. Die Entwicklung der Lautausserungen bei der Graugans (Anser anser) // Journal für Ornithologie. V. 128. № 2. P. 181–207.
Ten Thoren A., Bergmann H.-H., 1987a. Veraenderung und Konstanz von Mermalen in der Jugendlichen Stimmentwicklung der Nonnengans (Branta leucopsis) // Behaviour. V. 100. № 1-4. P. 61–90.
Weichel K., Schwager G., Heid P., Güttinger H.R., Pesch A., 1986. Sex differences in plasma steroid concentrations and singing behavior during ontogeny in Canaries (Serinus canaria) // Ethology. V. 73. P. 281–294.
Weichel K., Schwager G., Heid P., Güttinger H.R., 1989. 17 βEstradiolbenzoate-dependent song induction in juvenile female Canaries (Serinus canaria) // Long-term Measurements of Song Activity. V. 80. P. 55–70.
Wilkinson R., Huxley C.R., 1978. Vocalizations of chicks and juveniles and the development of adult calls in the Aldabra White-Throated Rail Dryolimnas cuvieri aldabranus (Aves: Rallidae) // Journal of Zoology. V. 186. P. 487–505.
Wingfield J.C., Hegner R.E., Dufty Jr. M.A., Ball G.F., 1990. The “Challenge Hypothesis”: Theoretical Implications for Patterns of Testosterone Secretion, Mating Systems, and Breeding Strategies // The American Naturalist. V. 136. № 6. P. 829–846.
Wingfield J.C., Jacobs J.D., Tramontin A.D., Perfito N., Meddle S., et al., 2000. Toward an ecological basis of hormone–behavior interactions in reproduction of birds // Reproduction in Context: Social and Environmental Influences on Reproduction. Wallen K., Schneider J.E. (Eds). Cambridge, MA: MIT Press. P. 85–128.
Winkler D.V., Billerman S.M., Lovette I.J., 2015. Bird Families of the World. Lynx Edicions and the Cornell Lab of Ornithology. 600 p.
Von Wurdinger I., 1970. Erzeugung, Ontogenie und Funktion der Lautauberungen bei vier Gansearten (Anser indicus, A. caerulescrns, A. albifrons und Branta canadensis) // Zeitschrift fur Tierpsychologie. V. 27. P. 257–302.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


