Зоологический журнал, 2021, T. 100, № 3, стр. 344-360
Реализованное размножение таймырских диких северных оленей (Rangifer tarandus) пясинских миграционных потоков в репродуктивном цикле 2006–2007 гг.
А. М. Шапкин a, *, Н. С. Суханова b, **
a Научно-исследовательский институт сельского хозяйства и экологии Арктики –
филиал Красноярского научного центра СО РАН
663302 Норильск, Россия
b ФГБНУ “Всероссийский научно-исследовательский институт охотничьего хозяйства и звероводства
имени профессора Б.М. Житкова”
610035 Киров, Россия
* E-mail: anatoliy-shapkin@rambler.ru
** E-mail: nat55209@yandex.ru
Поступила в редакцию 06.06.2019
После доработки 14.05.2020
Принята к публикации 16.05.2020
Аннотация
Представлены результаты размножения локальных миграционных потоков диких северных оленей в среднем течении р. Пясина на границе Западного и Центрального Таймыра (71°30′–71°43′ с.ш.) в постнатальный период 2007 г. Результаты сравнительного анализа размножения в двух различных потоках показали, что меньшая плодовитость выявлена среди оленей пуропясинской ветви. В их “маточных” стадах зафиксировано снижение воспроизводства: на 100 взрослых самок приходилось 47 телят. У второй локальной ветви – тарейско-пясинских диких оленей – этот показатель составил 64 теленка на 100 половозрелых самок. Тем не менее в обоих исследованных потоках (n = 546), с разными значениями яловости в разных возрастных группах, в размножении участвовали животные всех репродуктивных возрастов от двух до 16 лет. Однако максимальный репродуктивный вклад принадлежал наиболее многочисленному высокопродуктивному поколению 7-летних самок.
В локальных группировках природной популяции, как и для разных ландшафтных зон ее популяционного ареала, существуют количественные различия в воспроизводстве в течение годового жизненного цикла (Наумов, 1975). Тем самым устойчивость населения популяции, баланс ее численности будут складываться из тактики сезонного размножения всех репродуктивных групп пространственно обособленных и самостоятельных миграционных потоков разного ранга с различным уровнем пополнения в репродуктивные циклы. У оленьих основным показателем воспроизводства и одним из оценочных критериев стабильности популяции служит доля сеголеток в стадах (Филонов, 1993).
У таймырских тундровых диких северных оленей (Rangifer tarandus (L. 1756)), совершающих значительные сезонные миграции в жизненном пространстве тундровых и таежных биогеоценозов Средней Сибири, темпы воспроизводства исходно связаны с емкостью неоднородных местообитаний, с разными сроками достижения половой зрелости животными и их выживаемостью в условиях многомерных факторов среды. На конечные показатели воспроизводства популяции ежегодно влияют и промышленные масштабы легального и браконьерского изъятия (Михайлов и др., 2008; Шапкин, Забелин, 2016). В Канаде, между рекой Макензи и заливом Гудзона, самые катастрофические изменения численности у части популяций карибу, когда рождаемость в стадах не покрывала годовую убыль животных, зафиксированы в 40–50-е годы предыдущего столетия при массовой истребительной охоте местных жителей на мигрировавших на зимние пастбища или на “родовые” участки весной карибу (Clarke, 1940; Banfield, 1954, 1957; Kelsall, 1957, 1960).
При достижении же предельной численности в популяциях оленей нередко под влиянием тех или иных экологических факторов включаются популяционные механизмы саморегуляции численности (Северцов, 1941; Лэк, 1957; Филонов, 1993; Данилкин, 1999). Так, стадо Porcupine (PCH), использующее пастбища континентальной Канады и обширную область на северо-востоке п-ова Аляска (Fancy et al., 1989; Fancy,Whitten, 1991; Whitten et al., 1992; Whitten, 1995), достигло самых высоких значений численности за всю историю наблюдений к 1989 г: в этом стаде было учтено 179 тыс. карибу. В июле 1998 г. данное стадо оценено уже в 129 тыс., т.е. стадо PCH уменьшалось ежегодно на 3–4%; к 3 июля 2001 г. в стаде насчитывалось 123052 карибу и с 1998 по 2001 г. поголовье стада сокращалось на 1.5% в год, причем первоначальное снижение стада карибу Porcupine в 1991–1993 гг. исследователи связывают в первую очередь с падением уровня плодовитости взрослых самок и низкой выживаемостью телят (Stephenson, 2005).
Ослабление темпов размножения некоторых стад карибу связывают и с минимальной численностью и невыраженной агрегацией животных: у лесных карибу стада Pen Island, использующих местообитания южного побережья залива Гудзон и к северу от его берегов, летом 2008 и 2009 г. при переписи стада насчитали 3529 и 3304 особей; соотношение потомства в этом стаде после отела составило соответственно 30.4 и 20.7 телят на 100 взрослых особей (Abraham et al., 2012). По сравнению с данными, полученными при аэровизуальном обследовании в 1994 г., тогда в этом же районе обнаружили 10798 карибу (Thompson, Abraham, 1994), численность стада Pen Island за 15–16-летний перерыв между учетами снизилась в 3.06 и в 3.27 раза. По многочисленным наблюдениям за динамикой населения локальных стад карибу на Американском Севере, порог устойчивости стада близок к выживаемости к концу зимы 12–15% телят (Bergerud, 1996). Вместе с тем на особенности воспроизводства малочисленных субпопуляций бореальных карибу влияет и пространственное размещение с повышенной внутривидовой и межвидовой конкуренцией за одни и те же источники питания, как у канадского стада Red Wine в Лабрадоре: пищевые ресурсы территории одновременно используют большое стадо Rivier George, другие мигрирующие тундровые карибу и другие виды копытных. Подобная симпатрия, с точки зрения Schaefer et al. (2001) и Schmelzer et al. (2004), увеличивает интенсивный приток хищников, как и риск, стать добычей охотников (цит. по: Festa-Bianchet et al., 2011, с. 426).
Между тем результаты анализа накопленных материалов спутникового слежения за миграциями животных из 25 локальных популяций карибу континентальной Канады демонстрируют тесную линейную связь между темпами воспроизводства стад и степенью нарушения среды в границах обитания животных. Эта связь свидетельствует о критических изменениях биотопов экосистемы, когда репродуктивное ядро этих популяций карибу может оказаться неспособным к восстановлению прежней численности (Sorensen et al., 2008; Environment Canada 2009) (цит. по: Festa-Bianchet et al., 2011, с. 425). Другим ключевым фактором, негативно влияющим на современное состояние многих популяций карибу, обитающих как в северных, так и в горных районах Канады, считаются колебания погоды с нынешним темпом и трендом климатических изменений, которые, безусловно, могут затронуть и показатели пополнения стад, и показатели выживания всех возрастных групп животных (Festa-Bianchet et al., 2011). Например, размер островной арктической популяции карибу Peary за период между 1980 и 2001 г. уменьшился примерно на 72% (COSEWIC, 2004) (цит. по: Festa-Bianchet et al., 2011; с. 428).
Таким образом, в настоящее время во многих частях циркумполярного ареала данного вида наблюдаются глобальные и синхронные сокращения численности многих локальных стад карибу и северных оленей (Vors, Boyce, 2009) (цит. по: Abraham et al., 2012; с. 270). На севере Средней Сибири в стадах таймырских тундровых диких северных оленей в отдельные репродуктивные циклы, с крайне неблагоприятными условиями существования, какая-то часть половозрелых самок каждого репродуктивного возраста не участвует в размножении (Мичурин, 1964; Колпащиков, Павлов, 2001; Шапкин, 2012). Одновременно другая часть взрослых самок теряет приплод в постнатальный период, и далее их априори относят к не размножавшимся особям (Шапкин, 2016).
По нашим наблюдениям в период 1998–2006 гг. количество яловых самок от 2+ до 15 лет и старше в весенних миграционных потоках диких северных оленей Западного Таймыра варьировало от 12.5 (10-летние) до 40.0% в возрастной группе старше 2-х лет. К августу–сентябрю средние показатели яловости среди всех репродуктивных поколений животных из-за потери потомства достигали 26.0–63.06% (Шапкин, 2016). При этом в популяциях оленей уменьшение рождаемости наряду с большой гибелью молодняка может кардинально замедлить темпы роста популяции, хотя, по мнению Лэка (1957), увеличение смертности, вероятно, имеет гораздо большее значение, чем снижение плодовитости. Вместе с тем ежегодно меняющиеся темпы размножения в миграционных ветвях популяции, различный уровень выживаемости телят в различных потоках и в разных частях ареала в отдельные репродуктивные циклы кардинально изменяют конечные показатели воспроизводства в популяционных группировках таймырских тундровых диких оленей, что отражается и на общем текущем пополнении таймырской популяции. Так, при последнем летнем обследовании миграционных потоков таймырской популяции Бондарем и Колпащиковым (2018) в стадах западнотаймырских ветвей доля телят сеголетков равнялась 27.9%; среди восточнотаймырских диких оленей текущий приплод определен в 12.8%, в верхнетаймырской группировке пополнение составило 19.0%, и в это же самое время у арктических диких северных оленей шренковской ветви в северной области популяционного ареала доля телят была на уровне 20.5%.
Таким образом, с точки зрения рационального использования охотничьих ресурсов таймырской популяции долговременный мониторинг реализованной плодовитости различных миграционных ветвей и репродуктивных групп таймырских диких оленей может способствовать более объективной оценке успеха размножения миграционных потоков в конкретном репродуктивном цикле. Безусловно, это будет повышать точность стратегических прогнозов величины годичного прироста стада, как и оценку демографической жизнестойкости интенсивно эксплуатируемых группировок этой природной промысловой популяции.
Цель настоящего исследования – изучение возрастной плодовитости диких оленей различных пясинских миграционных потоков и определение величины реального пополнения этой части таймырской популяции в репродуктивном цикле 2006–2007 гг. при существующей промысловой нагрузке на поголовье этих миграционных потоков.
МАТЕРИАЛ И МЕТОДИКА
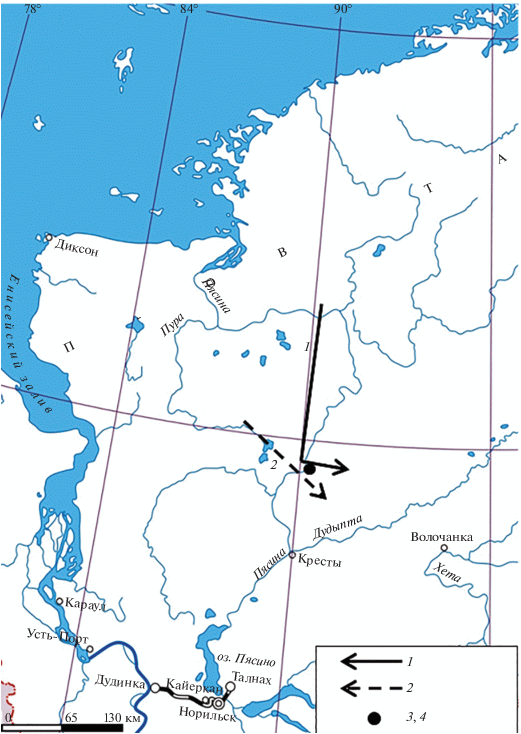
Район и объект исследования. Полевые исследования проводились с 04.08. по 20.10.2007 г. в полосе переходных пастбищ южной субарктической тундры среднего течения р. Пясина (Матвеева, 1998) на промысловых точках “Хатыстах” и “Яким” ООО “Пясино” (71°43′913″ с.ш.; 90°01′339″ в.д.). Сбор материала совпал с активной сезонной миграцией стад диких северных оленей с летних пастбищ арктических и типичных тундр Западного Таймыра на переходные пастбища Центрального Таймыра. При благоприятных погодных условиях (отсутствие тумана и хорошая видимость) на локальном участке популяционного ареала таймырского тундрового дикого оленя отслеживались дневные пространственные перемещения животных и общее количество телят в двух различных миграционных ветвях таймырской популяции: сначала тарейско-пясинской ветви (04.08–02.09), затем в стадах пуропясинского потока (31.08–19.10) (рис. 1).
Рис. 1.
Карта-схема района полевых исследований в среднем течении р. Пясина с направлениями сезонной миграции диких северных оленей пясинских миграционных потоков таймырской популяции в августе–октябре 2007 г.; 1 – направление миграционного пути тарейско-пясинской ветви таймырских диких северных оленей; 2 –направление миграционной откочевки стад пуропясинской ветви таймырских диких северных оленей; 3, 4 – промысловые точки “Хатыстах”, “Яким”.
Согласно многолетним наблюдениям (Шапкин, 2004, 2009, 2017) в среднем течении р. Пясина мигрируют два потока таймырской популяции. Эти два потока диких оленей приходят разными миграционными путями и в разные календарные сроки. В конце июля, в августе, даже в начале сентября откочевывают с северных летних пастбищ арктических и типичных тундр на юг полуострова, параллельно р. Пясина на этом ее участке тарейско-пясинские тундровые олени. Однако в конце августа, в первой декаде сентября или иногда позже, в зависимости от абиотических и биотических условий, их сменяют стада пуропясинских тундровых оленей, которые подкочевывают к этому прибрежному участку долины р. Пясина с запада, от расположенных невдалеке Пуринских озер.
Дикие северные олени из этих разных миграционных потоков (ветвей) таймырской популяции фенотипически отличаются друг от друга (Шапкин, 2017). Принадлежность их к разным локальным потокам без труда визуально распознается по фенотипу голов животных. У тарейско-пясинских диких оленей основным маркером служит “горбинка” в области носовой кости черепа: местные промысловики так и называют этих животных “горбоносыми”, фенотипическое отличие пуропясинских же оленей – сужающаяся, более короткая морда. В границах значительных пространств, где миграционные ветви видовой популяции длительно существуют в различающихся сложных условиях разнородных биоценозов, животные подвергаются формирующему воздействию разных абиотических и биотических факторов, что и приводит к закреплению в популяции различных морфологических признаков и фенотипов (Гиляров, 1954). С другой стороны, присутствие и усиление подобной фенотипической изменчивости в пределах видовой популяции может происходить только при условии, если ниша данного вида обладает высокой межфенотипической компонентой (Джиллер, 1988). Очевидно, экологические условия существования таймырских тундровых диких оленей, зональная разнородность их местообитаний только способствуют сохранению в пространстве и во времени всех выработанных этой природной популяцией локальных фенотипов оленей.
Методы и материалы исследования. Наблюдения и сбор первичного материала по репродуктивным способностям самок дикого северного оленя осуществлялись по общепринятым методикам зоологических исследований (Новиков, 1953; Gunn, Nixon, 2007–2008).
Окончательную дифференциацию по половым признакам в период осенней миграции и массового промысла диких оленей на водных переправах (август–октябрь) осуществляли на промысловых комплексах “Хатыстах” и “Яким” в процессе осмотра добытых промысловиками партий животных. Среди попавших в промысловые выборки особей выявляли в первую очередь самок с признаками лактации и яловых самок; также учитывали общее количество телят-сеголетков в некоторых “маточных” стадах и их долю в промысловой добыче. Всего в указанные выше календарные сроки было обследовано 1193 диких северных оленя, из них самок в возрасте от года и старше – 546 особи, разнополых телят-сеголетков – 174 особи (101 самец, 73 самки). Фактическую плодовитость животных устанавливали по выборочным данным из общего количества лактирующих и яловых самок. Первых метили продольным разрезом вдоль ушной раковины от кончика уха, вторых – удалением половины левого уха. У всех помеченных оленей брали резцы, которые составляли индивидуальные промысловые выборки с определенными номерами: с календарным сроком добычи и выявленными признаками – лактирующие и яловые. Причем в период с 31.08. по 02.09., когда через район “Хатыстаха” и “Якима” совместно мигрировали и переплывали р. Пясина стада двух разных локальных ветвей тундровых диких оленей, пробы самок тарейской и пуропясинской миграционных ветвей не перемешивали, а брали раздельно. Выборки на этом этапе сборов сопровождали дополнительной этикеткой – “тарейские” или “пуринские”. Установленному числу лактирующих самок, в целом, соответствовала и расчетная доля телят.
Для расчета средней плодовитости по возрастным когортам (реализованная плодовитость) в репродуктивном сезоне 2006–2007 гг. мы воспользовались методикой Коли (таблица плодовитости самок: гл. 7, табл. 7.5 ) (Коли, 1979). К этим расчетам привлечены данные о 524 самках старше двух лет. При выявлении средней возрастной реализованной плодовитости (после отела) по собранным материалам промысловых проб количественное соотношение телят-самцов и телят-самок для всех возрастных групп половозрелых самок условно принято 1 : 1 (Мичурин, 1964).
Ошибки полученных значений возрастной рождаемости по этим материалам (средняя фактическая плодовитость самок) рассчитаны по формуле (1) стандартного отклонения доли “успехов” для величины n опытов в биномиальном распределении:
где p – вероятность успеха (шанс, что самка принесет в потомстве самку), q = 1 – p, n – размер выборки. Отсюда ошибка (среднее квадратическое отклонение) равна корню из дисперсии: $\sigma = \sqrt D $ (Балинова, 2004).Репродуктивный вклад (самки) для каждого возрастного класса найден по формуле (2):
где fx – численность возрастного класса, mx – число самок, рожденных каждой самкой в возрастном интервале x. В нашем исследовании это индивидуальный возраст каждой конкретной самки из возрастной группы 2+, 3+ 4+ и т.д. Самки же от 12 лет и старше, из-за малочисленности, объединены в одну группу животных предельного возраста.Среднее значение плодовитости для половозрелых самок разного возраста в репродуктивном цикле 2006–2007 гг. для этой части таймырской популяции вычислено по взвешенному среднему по формуле (3), предложенной Коли (1979):
(3)
${{\bar {m}}_{w}} = \frac{{{{n}_{2}} + {{n}_{3}} + ...{{n}_{{16}}}}}{{{{N}_{2}} + {{N}_{3}} + ...{{N}_{{16}}}}},$Возраст животных определяли по слоистым структурам резцов (Клевезаль, Клейненберг, 1967; Klevezal, 1996) сформировавшихся слоев цемента резца I1, предварительно декальцинированных 5% раствором азотной кислоты. Срезы резцов самок получали на замораживающем микротоме модели Х МЗ-1 Харьковского завода точного медицинского приборостроения ‘‘ТОЧМЕДПРИБОР’’, 1971 г. выпуска. Для подсчета годовых колец диких северных оленей образцы окрашивались гематоксилином Эрлиха. Годовые слои видны в цементе на окрашенных срезах резцов; число слоев в I1 равно возрасту животного в годах.
У всех попавших в промысловые выборки телят (n = 174) определяли пол (вторичное соотношение полов) (Большаков, Кубанцев, 1984). В расчетах плодовитость лактирующих и яловых самок (животных без потомства) приняты в сумме за 100%. Показатель воспроизводства (количество телят на 100 взрослых важенок) в исследуемый репродуктивный сезон 2006–2007 гг. в районе среднего течения р. Пясина рассчитывали по соотношению всех самок репродуктивного возраста и лактирующих особей. Таким же методом рассчитана и величина пополнения в миграционных потоках (ветвях) тарейско-пясинских и пуропясинских диких северных оленей таймырской популяции.
Кроме того, в период с 08.08. по 02.10., в соответствии с поставленными целями исследования, выборочно определяли количественные различия в изменчивости живой массы лактирующих и яловых половозрелых самок. Этой операции подвергли 19 особей в возрасте от двух до 13 лет. Взвешивание производили на динамометре общего назначения ДПУ-2-2 (производитель ООО “ТОЧПРИБОР-КБ”, г. Иваново).
Регулярные наземные визуальные наблюдения за миграционными перемещениями, дневной пастьбой на пойменной террасе и переправами оленьих стад через р. Пясина выполняли в светлое время суток в 6-километровой учетной полосе левобережных ивняковых лайд речной поймы с использованием 20-кратного призменного бинокля “Юкон”. Всего осуществлено 216 наблюдений. Их объем составил 71 ч 20 мин. Было просчитано 6030 животных. Определить половую группу удалось у 670 самцов, 1369 самок и 437 телят. У 3554 особей из-за предельного расстояния установить половую принадлежность не удалось. Дополнительно, с целью уточнения конкретной численности мигрирующих диких оленей, на протяжении всего периода сезонной миграции стад животных, проводились ежедневные опросы промысловиков, которые дежурили в дневное время на наблюдательных постах на правом берегу р. Пясина.
Статистический анализ выборочных данных. Из стандартных методов математической статистики при обработке выборочных данных – по живой массе разновозрастных яловых (n = 7), лактирующих (n = 12) и объединенной группы самок (n = 19) – предпочтение было отдано показателям амплитуды изменчивости (lim), средней арифметической (М) со статистической ошибкой средней арифметической (m), квадратическому отклонению (σ), коэффициенту вариации (C), корреляционной связи (r) и корреляционному отношению (η2), регрессивному анализу (построение линии регрессии) (Плохинский, 1970; Zar, 2010).
Достоверность различий между двумя выборками из пясинских потоков таймырских тундровых диких оленей (численность взрослых самок и численность лактирующих самок) исследована с применением статистического критерия λ (лямбда) Колмогорова, Смирнова (Песенко, 1982). Различия считались статистически значимыми при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ
Сроки сезонной миграции и численность диких северных оленей в среднем течении р. Пясина. Проведенные наблюдения в 2007 г. показали, что сезонная миграция тарейско-пясинской ветви оленей таймырской популяции продолжалась с 31.07 по 02.09.2007. Активный миграционный ход смешанных стад диких оленей (самцы, самки, телята) тарейской ветви в среднем течении р. Пясина, с кратковременными перерывами 3, 4, 13, 14 августа, отмечался в течение 29 дней. После 2 сентября миграция стад и групп тарейско-пясинских оленей не наблюдалась. 31 августа в тарейско-пясинский поток диких оленей влились животные пуропясинской ветви таймырской популяции. Перемещения этой ветви оленей через данную территорию прибрежных тундр наблюдались практически весь сентябрь, кроме 20 сентября, когда возник однодневный перерыв в миграционном ходе животных. Последние мигрирующие дикие олени – две группы и четыре небольших табуна – отмечены в районе наблюдений 13, 18 и 19 октября при общем количестве 128 голов.
По прямым наблюдениям и данным регулярных опросов промысловиков, сезонная миграция двух потоков диких оленей в среднем течении р. Пясина (промысловые точки “Хатыстах” и “Яким”) заняла 67 дней; 15 дней миграционные перемещения животных в районе исследований не регистрировались. В летний период с фенологическими явлениями осени (31.07–31.08) миграция оленей отмечалась 28 дней. В сентябре ход сохранялся 29 дней с однодневной паузой в миграции 20 сентября. Особенно продолжительные паузы в сезонной миграции вида отмечены в октябрьский период наблюдений: в две первые декады зарегистрировано 10 дней с полным отсутствием животных в контролируемой полосе учета.
За весь период прямых визуальных наблюдений через локальный участок кустарниковой поймы р. Пясина в полосе учета в светлое время суток откочевали 6030 диких северных оленей или 139 стад со средним показателем стадности 31.9 голов (Шапкин, 2009). По причине большой удаленности части стад и групп диких оленей от стационарных точек наблюдений точно установить пол удалось лишь у 2476 животных: 670 самцов, 1369 самок и 437 телят. Еще около 2 тысяч диких северных оленей, по опросам дежуривших в дневные часы промысловиков, проследовали вне зоны визуального мониторинга, преодолев речную пойму юго-западнее, в 10–12 км выше промысловой точки “Хатыстах” по течению.
По данным прошлых многолетних наблюдений за сезонными миграциями вида в среднем течении р. Пясина в 2002, 2004–2006 гг. (Шапкин, 2004, 2009; Шапкин, Арсентьева, 2006) численность мигрирующих оленей летом-осенью 2007 г. через эту территорию популяционного ареала несколько снизилась. Следует, впрочем, указать, что количество оленей, составляющих тот или иной миграционный поток, может резко меняться в различные годы (Баскин, 1976). Но визуальный мониторинг мигрирующих стад, с ежедневными опросами дежуривших на наблюдательных постах промысловиков (31.07–19.10.2007 г.), позволяют оценить количественные показатели состоявшейся осенней миграции вида в этом районе популяционного ареала примерно в 11–16 тысяч диких северных оленей.
Промысловая нагрузка на пясинские миграционные потоки диких северных оленей в среднем течении р. Пясина в летне-осенние сроки охотничье-промыслового сезона 2007 г. (промысловые точки “Хатыстах”, “Яким”) составила по нашей экспертной оценке 7.5–10.9%: промысловики добыли за весь период сезонной миграции 1193 диких оленей.
Реализованное размножение в пясинских потоках диких северных оленей таймырской популяции. Из исследованных 524 самок старше двух лет, добытых за период летне-осенней миграции на водных переправах через р. Пясина, с признаками лактации выявлено 321 животное из 15 репродуктивных поколений (табл. 1). Продолжительность репродуктивной жизни в исследуемых потоках, по нашим данным, составляет16 лет (одна кормящая самка). Самый предельный возраст осмотренных взрослых самок из собранных за летне-осенний промысловый сезон проб – 18 лет (одна яловая особь). По общему количеству лактирующих и половозрелых самок, не имеющих или потерявших в течение постнатального периода телят, значение яловости среди поголовья взрослых самок объединенных пясинских миграционных потоков в репродуктивном сезоне 2006–2007 гг. составило 38.7%, размер приплода – 23.9%, или 61 теленок на 100 взрослых самок. Это достаточно высокий численный показатель репродуктивного успеха в этой части таймырской популяции. Более того, расчетное взвешенное среднее значение плодовитости (Коли, 1979) для этих объединенных локальных популяционных потоков в репродуктивном цикле 2006–2007 гг. оказалось равным 0.306 самки на одну взрослую самку.
Таблица 1.
Фактическая плодовитость самок (n = 546) диких северных оленей пясинских миграционных потоков таймырской популяции (август–октябрь 2007 г.)
| Возраст, лет x | Численность выборки, особей fx |
Число кормящих самок Bx |
Число новорожденных самок (mx ± σ) на одну самку (B/2 fx) |
Яловость в возрастных группах, % |
Репродуктивный вклад возрастной группы (телята-самки) (fmx)mv |
|---|---|---|---|---|---|
| 0+ | 321 | – | – | – | 160.51 |
| 1+ | 22 | – | – | – | – |
| 2+ | 25 | 6 | 0.120 ± 0.065 | 76.0 | 3 |
| 3+ | 49 | 8 | 0.082 ± 0.039 | 83.7 | 4.02 |
| 4+ | 65 | 33 | 0.254 ± 0.054 | 49.2 | 16.5 |
| 5+ | 69 | 39 | 0.283 ± 0.054 | 43.5 | 19.53 |
| 6+ | 70 | 41 | 0.293 ± 0.055 | 41.4 | 20.51 |
| 7+ | 72 | 52 | 0.361 ± 0.057 | 27.8 | 25.9 |
| 8+ | 57 | 46 | 0.404 ± 0.065 | 19.3 | 23.03 |
| 9+ | 42 | 33 | 0.393 ± 0.075 | 21.4 | 16.51 |
| 10+ | 26 | 22 | 0.423 ± 0.097 | 15.4 | 11 |
| 11+ | 19 | 13 | 0.342 ± 0.109 | 31.6 | 6.5 |
| 12+ | 14 | 14 | 0.5 ± 0.134 | – | 7 |
| 13–16+ | 16 | 14 | 0.438 ± 0.124 | 12.5 | 7.01 |
Интенсивность воспроизводства, а именно 76% пополнения объединенных пясинских потоков диких оленей обеспечило репродуктивное ядро молодых самок от 4–5 лет и средневозрастные поколения самок от 6 до 9 лет. Половозрелые самки старших и предельных возрастов 10–16-лет (n = 75) принесли 19.6% пополнения данных потоков. Индивидуальный вклад молодых 2–3-летних самок (n = 31) в реализованном воспроизводстве пясинских миграционных потоков составил по нашим выборочным эмпирическим данным 4.4% пополнения. С другой стороны, выживаемость телят у оленьих на протяжении первого года жизни во многом зависит от конкретного возраста самки (Филонов, 1993), отсюда, совершенно очевидно, что и потери новорожденных у молодых самок будут выше, чем у особей старшего возраста.
Результаты размножения диких северных оленей тарейско-пясинской ветви. Фактическую плодовитость в стадах тарейско-пясинской ветви диких оленей в августовский период мониторинга обеспечили по собранным выборочным материалам 14 репродуктивных поколений самок от 2-х до 15 лет. Крайние значения плодовитости среди половозрелых групп животных определены в пределах 0.086–0.475 самки на одну взрослую самку (табл. 2). При оценке продуктивности этой локальной ветви таймырских диких оленей яловость в их стадах зафиксирована при исследовании на уровне 36.3%, или на 100 взрослых самок приходилось в данный период годового жизненного цикла 64 теленка. Вместе с тем показатели яловости в возрастных группах колебались от 5% у 12–15-летних особей и до 82.6% среди молодых 3-летних самок. Наиболее результативными по репродуктивному вкладу в тарейско-пясинском потоке признаны средневозрастные важенки от 5 до 9 лет: они принесли примерно 69.2% нулевого поколения.
Таблица 2.
Фактическая плодовитость самок (n = 397) тарейско-пясинской миграционной ветви диких северных оленей таймырской популяции в августе 2007 г.
| Возраст, лет x |
Численность выборки, особей fx |
Число кормящих самок Bx |
Число новорожденных самок (mx ± σ) на одну самку (B/2 fx) |
Яловость в возрастных группах, % |
Репродуктивный вклад возрастной группы (телята-самки) (fmx)mv |
|---|---|---|---|---|---|
| 0+ | 253 | – | – | – | 126.54 |
| 1+ | 19 | – | – | – | – |
| 2+ | 14* | 3** | 0.107 ± 0.083 | 78.6 | 1.50 |
| 3+ | 29* | 5** | 0.086 ± 0.052 | 82.6 | 2.49 |
| 4+ | 43* | 22** | 0.256 ± 0.067 | 48.8 | 11.01 |
| 5+ | 53* | 35** | 0.330 ± 0.065 | 33.9 | 17.5 |
| 6+ | 57* | 36** | 0.316 ± 0.062 | 36.8 | 18.01 |
| 7+ | 54* | 41** | 0.380 ± 0.066 | 24.1 | 20.5 |
| 8+ | 42* | 36** | 0.429 ± 0.076 | 14.3 | 18.02 |
| 9+ | 32* | 27** | 0.422 ± 0.087 | 15.6 | 13.5 |
| 10+ | 21* | 18** | 0.429 ± 0.108 | 14.3 | 9.01 |
| 11+ | 13* | 11** | 0.423 ± 0.137 | 15.4 | 5.5 |
| 12–15+ | 20* | 19** | 0.475 ± 0.112 | 5.0 | 9.5 |
Самыми же многочисленными репродуктивными поколениями в группах и стадах тарейско-пясинского потока оленей оказались по выборочным материалам самки 5–7-лет (n = 164). Существенным оказался и репродуктивный вклад этих трех поколений в пополнение стада – 43.6% телят. Кроме того, к 7-летнему возрасту животные достигают практически удвоения показателей размножения по такому признаку как репродуктивный вклад, но с этого возраста начинается и убывание численности самок этой репродуктивной группы. Тем не менее заметное снижение яловости со стабильным повышением показателей плодовитости выявлено среди самок старших и предельных репродуктивных поколений 8–15 лет: 0.422–0.475 самки, рожденных на одну взрослую самку данных групп. Рассчитанное взвешенное среднее значение плодовитости (Коли, 1979) в тарейско-пясинской миграционной ветви определено на уровне 0.335 самки, рожденной на одну половозрелую самку.
Результаты размножения диких северных оленей пуропясинской ветви таймырской популяции. В “маточных” стадах пуропясинских оленей амплитуда колебаний реализованной плодовитости среди половозрелых самок составила 0.075–0.450 самки, рожденной на одну взрослую самку. В воспроизводстве участвовали животные 15 возрастных поколений от 2-х до 16 лет, но норма размножения составила 53.4%: 46.6% самок репродукционного возраста оказались по наблюдениям без потомства. Таким образом, на 100 взрослых самок на данный момент времени годового жизненного цикла (31.08–19.10 2007) отмечено только 47 телят. В некоторых возрастных группах яловыми оказались от 61.5 до 85.0% поголовья взрослых самок. У 4-летних половина животных не имела потомства. Лишь среди 8-, 10-летних и немолодых самок 12–16 лет величина возрастной плодовитости оценена на уровне 0.333–0.450 самки, рожденных на одну самку этих возрастных групп (табл. 3). Взвешенное же среднее значение плодовитости (Коли, 1979) в репродуктивном цикле 2006–2007 гг. в постнатальный период (сентябрь–октябрь) для самок диких оленей пуропясинского потока оказалось на уровне 0.233 самки, рожденной на одну взрослую самку, т.е. в 1.44 раза ниже, чем в соседнем тарейско-пясинском потоке.
Таблица 3.
Фактическая плодовитость самок (n = 149) пуропясинской миграционной ветви диких северных оленей таймырской популяции (сентябрь–октябрь 2007 г.)
| Возраст, лет x | Численность выборки, особей fx |
Число кормящих самок Bx |
Число новорожденных самок (mx ± σ) на одну самку (B/2 fx) |
Яловость
в возрастных группах, % |
Репродуктивный вклад возрастной группы (телята-самки) (fmx)mv |
|---|---|---|---|---|---|
| 0+ | 68 | – | – | – | 34.0 |
| 1+ | 3 | – | – | – | – |
| 2+ | 11* | 3** | 0.136 ± 0.103 | 72.7 | 1.50 |
| 3+ | 20* | 3** | 0.075 ± 0.059 | 85.0 | 1.50 |
| 4+ | 22* | 11** | 0.250 ± 0.092 | 50.0 | 5.5 |
| 5+ | 16* | 4** | 0.125 ± 0.083 | 75.0 | 2.0 |
| 6+ | 13* | 5** | 0.192 ± 0.109 | 61.5 | 2.5 |
| 7+ | 18* | 11** | 0.306 ± 0.108 | 38.9 | 5.51 |
| 8+ | 15* | 10** | 0.333 ± 0.122 | 33.3 | 4.99 |
| 9+ | 10* | 6** | 0.300 ± 0.145 | 40.0 | 3.0 |
| 10+ | 5* | 4** | 0.400 ± 0.219 | 20.0 | 2.0 |
| 11+ | 6* | 2** | 0.167 ± 0.152 | 66.7 | 1.0 |
| 12–16+ | 10* | 9** | 0.450 ± 0.157 | 10.0 | 4.5 |
Возможно, прошлогодний летне-осенний нагул животных на летних и переходных пастбищах перед репродуктивным циклом, лимитирующие условия с ограничением пищи на зимних пастбищах, растянутая весенняя миграция, а главным образом, условия отела с низкой выживаемостью новорожденных, по всей вероятности, сказались на уровне пополнения пуропясинской ветви диких оленей. По данным спутниковой локации аляскинских карибу, в первые дни после отела самка с теленком в среднем за день преодолевает расстояние лишь в 2.5 ± 0.69 км (Lynn, Jonn, 2003). Совершенно очевидно, что в данный период существования новорожденное неокрепшее потомство диких оленей наиболее уязвимо перед всеми видами-потребителями.
Однако результаты статистической проверки достоверности различий между двумя распределениями (распределения разного объема), по признаку общей численности выборок половозрелых самок тарейско-пясинского и пуропясинского потоков таймырской популяции на данный момент наблюдений (август–октябрь 2007 г.) и по результативному признаку плодовитость (учтены только лактирующие самки) с использованием статистического критерия λ (лямбда) Колмогорова, Смирнова (Песенко, 1982), показали достоверность расхождения между распределением численности самок (λ = 1.17) и распределением между численностью кормящих самок (λ = 0.96). Найденные величины лямбды (λ) оказались ниже постоянного стандартного значения для первого порога вероятности (1.36 при p = 0.95), что не отвергает нулевую гипотезу. Следовательно, расхождения между сопоставляемыми распределениями (общая численность половозрелых самок и численность только лактирующих самок в обоих миграционных потоках) носят, скорее всего, случайный характер. Таким образом, наше предположение о выявленной эмпирической разнице в реализованной плодовитости двух различных пясинских миграционных потоков таймырской популяции в среднем течении р. Пясина остается в данном случае недоказанным.
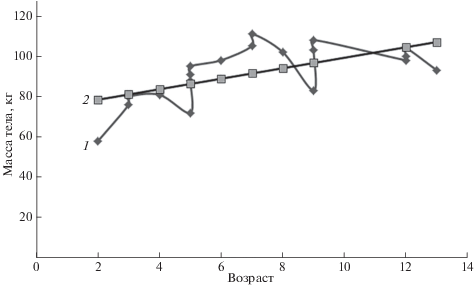
Результаты оценки живой массы самок диких северных оленей в летне-осенний миграционный период. Живая масса самок, в зависимости от их возраста и физиологического состояния, в тех варьирующих условиях существования изменялась в пределах от 58 до 111 кг (табл. 4). Наибольшими возрастными различиями в живой массе в период с 08.08 по 02.10.2007 г. характеризовались яловые самки в возрасте от двух до девяти лет: коэффициент вариации признака в этой группе оказался самым значительным – 20.2%. Также у этих самок выявлена и сильная корреляционная связь между живой массой и возрастом (r = 0.91, p < 0.01). Уравнение регрессии, линейная зависимость между двумя изменчивыми величинами y и x при увеличении живой массы с увеличением возраста характеризовалась у яловых самок цифрами: y = = 53.29 + 6.27x.
Таблица 4.
Сезонные изменения живой массы самок диких северных оленей пясинских миграционных потоков в летне-осенний период (08.08–02.10.2007 г.) в зависимости от возраста
| Группа самок | n | Возраст, лет | Масса (lim), кг | M ± m | C, % | σ | r | η2 |
|---|---|---|---|---|---|---|---|---|
| Яловые | 7 | 2–9 | 58–108 | 82.9 ± 6.3 | 20.2 | 16.73 | 0.91* | 0.95 |
| Лактирующие | 12 | 4–13 | 81–111 | 97.2 ± 2.48 | 8.82 | 8.57 | 0.05 | 0.89 |
| Всего | 19 | 2–13 | 58–111 | 91.9 ± 3.7 | 14.94 | 13.73 | 0.68* | 0.87 |
У взрослых 4–13-летних самок с признаками лактации в рассматриваемый летне-осенний нагульный период величина живой массы изменялась меньше всего (С = 8.2%) Отсюда, с одной стороны, следует, что пищевые потребности данной группы животных еще качественно и количественно обеспечивались сохраняющейся пастбищной растительностью. Но, с другой стороны, разброс между минимальным и максимальным значением живой массы тела в 30 кг убеждает, что физиологическое состояние этих выборочно обследованных разновозрастных самок было разное. Более того, математическое выражение уравнения регрессии этой группы: y = 90.65 + 0.75x, т.е. зависимость одной величины при изменении другой переменной очень незначительная. Масса кормящей самки увеличивается с возрастом лишь на 0.75 кг (правда, для тех же 10-летних самок прибавка может составить 7.5 кг). В целом же этому факту есть практическое объяснение: эти животные в период лактации постоянно расходовали часть веществ и энергии на выкармливание родившегося потомства, поэтому увеличение их живой массы ожидаемо не могло быть существенным.
Для объединенной группы молодых и взрослых самок (яловые, лактирующие) линия регрессии (рис. 2) устранила некоторую часть суммарного разброса y (Бейли, 1962), т.е. величины живой массы животных, а математическое выражение уравнения регрессии показала оценочные коэффициенты линейной зависимости между данными признаками на уровне: y = 73.36 + 2.59x. Таким образом, по выполненным исследованиям количественных показателей живой массы выборочной группы разновозрастных самок можно признать, что для особей каждого возрастного интервала будет существовать свой оптимальный вес, который будет создавать животным в конкретных природных условиях возможность благополучного размножения и выращивания потомства (Филонов, 1993).
ОБСУЖДЕНИЕ
По данным исследований репродуктивных циклов 2001–2006 гг. (Шапкин, 2016), максимальные реализованные воспроизводственные показатели в миграционных ветвях таймырской популяции на Западном Таймыре были характерны для самок высокого репродуктивного статуса в возрасте 7–9-лет (lim: 0.360–0.368 самки такого статуса на одну половозрелую самку). По данным 2006–2007 гг. в обоих пясинских потоках наиболее высокая возрастная плодовитость выявлена среди немолодых самок в возрасте от 12 до 16 лет (n = 30, или 5.73% общей выборки) из немногочисленных возрастных групп. В этих размножавшихся группах величина плодовитости варьировала от 0.422 до 0.475 самки на одну особь данной генерации. Следовательно, большая часть самок предельных возрастных групп принесла потомство. Подобные максимальные показатели изучаемого признака у средневозрастных самок, находящихся в возрасте оптимальной плодовитости, в репродуктивный период 2006–2007 гг. не выявлены.
Особый интерес представляет в этой связи для исследования и численная характеристика плодовитости 2-летних самок с определением конкретной доли этой группы в ежегодном размножении. Данная младшая группа молодых самок теоретически является самой многочисленной и в возрастной структуре, и в сравнении с каждым последующим взрослым поколением таймырских диких оленей. По сути же дела группа самок этого возраста вносит минимальный вклад в пополнение популяции. Здесь важно, прежде всего, что какая-то часть молодняка таймырских оленей в разных природных условиях действительно может достигать половозрелости на второй год жизни, в возрасте 16–17 месяцев и в возрасте двух лет может принести первое потомство. Вместе с тем в популяциях оленьих такое раннее наступление половой зрелости, конечно же, далеко не общее стабильное явление (Мичурин, 1964; Филонов, 1993; Данилкин, 1999; Сафронов и др., 1999; Колпащиков, Павлов, 2001; Шапкин, 2012, 2016). Напротив, для большей части 1.5-годовалых особей подобная ранняя физиологическая зрелость достаточно нетипична. Кроме того, в возрасте 13–24 месяцев, как отмечалось выше, воспроизводительные способности важенок обычно ниже, чем у самок старших возрастных групп (Юргенсон, 1966).
При этом изначальная плодовитость впервые размножающихся животных невелика (Лэк, 1957). У следующей младшей репродуктивной группы 3-летних самок тарейско-пясинского миграционного потока (n = 29), впервые приступивших к размножению в два года, реализованная продуктивность оказалась все-таки несколько выше, чем у рожавшего 2-летнего поколения. Хотя доля выявленных яловых особей в репродуктивной группе 3-летних самок была даже выше – 82.6%.
Среди самок диких оленей тарейско-пясинской ветви оптимальным возрастом участия в размножении можно считать 3.5 года. Вероятно, именно в этом возрасте большинство самок, составляющих таймырскую популяцию, становятся, наконец, половозрелыми, при этом завершается набор необходимой живой массы тела с приемлемой упитанностью. Не набранный вес задерживает, прежде всего, наступление половой зрелости животного (Scogland, Wildl, 1986). С этой точки зрения, обследованная группа 4-летних самок тарейско-пясинского потока (n = 43) подтверждает возросшие индивидуальные воспроизводительные способности этих животных. А в сравнении с плодовитостью младших репродуктивных поколений 2–3-летних особей, продуктивность этой группы возросла в 2.8 раза. Процент яловых самок в ней сократился. Таким образом, в репродуктивный период 2006–2007 гг. возрастная группа 4-летних самок по результатам воспроизводства заняла, по нашей эмпирической оценке, промежуточное демографическое положение.
Удвоение величины фактической плодовитости в тарейско-пясинском потоке продемонстрировала возрастная группа 7-летних самок (0.380 самки на одну особь). Однако в самых немногочисленных возрастных группах (10–15 лет) обследованного миграционного потока преобладали размножающиеся самки с максимальной характеристикой плодовитости, которые с учетом других половозрелых самок остальных возрастных генераций и обеспечили тарейско-пясинскому потоку в природной обстановке репродуктивного цикла 2006–2007 гг. успешное воспроизводство и компенсацию потерь за прошедший годовой жизненный цикл.
В стадах пуропясинской ветви диких оленей наименьшая плодовитость (0.075 самки на одну самку репродуктивного класса) выявлена среди 3-летних особей, что довольно близко по показателям изучаемого признака к 3-летней группе соседнего тарейско-пясинского потока диких оленей. Следовательно, данные возрастные группы молодых самок в двух обследованных потоках оказались в репродуктивном цикле 2006–2007 гг. с близкими значениями яловости как вероятно имели и меньшее число выживших потомков к летне-осеннему сроку постнатального периода. Расхождения по изучаемому признаку составили всего 2.4%. Отчасти это опять же подтверждает, что самки таймырских диких северных оленей достигают половой зрелости в самом разном возрасте: отдельные особи – на второй год жизни или в 16–17 месяцев (их доля 27.2% по нашим приблизительным расчетам). Другие вступают в первое размножение на третьем году жизни (в 27–28 месяцев), остальная неравноценная часть может участвовать в репродукции на четвертом году жизни или в 40 месяцев.
Воспроизводственные возможности пуринского миграционного потока поддерживались средневозрастными и старшими возрастными классами 4, 7, 8–10-летних животных, как и классами немолодых важенок 12–16 лет (см. табл. 3). Тем не менее доля яловых особей в каждой из этих перечисленных воспроизводственных групп была достаточно существенна. Без телят в них находилось от 33.3 до 75% половозрелых самок, лишь у 10-летнего поколения и самок предельных возрастов параметры размножения были очень высокими. Впрочем, при обсуждении крайне важно указать на текущие потери размножавшихся самок. Какая-то часть новорожденного потомства, как и какая-то часть половозрелых самок, подвергались элиминации на всем протяжении сезонной миграции. Причем эти события в течение сезонной миграции происходили в данном районе популяционного ареала с большей или меньшей регулярностью. Так, 22 сентября 2007 г. в середине дня выше промысловой точки “Хатыстах” с ходу забежало в воду и начало переплывать р. Пясина с левого на правый берег стадо из 55 диких северных оленей. Всех заплывших животных промысловики добыли. Впоследствии мы установили, что это “маточное” стадо состояло из 16 лактирующих важенок с 14 телятами (8 самцов, 6 самок) и из 19 разновозрастных яловых самок от 2-х до 11-лет. Однако две взрослые самки из этих выявленных 16 особей с признаками лактации были к этому дню уже без потомства. С этим же “маточным” поголовьем двигалась к реке и вместе с самками ее переплывала группа из 5 самцов старше 2-, 3-, 4-х (2 особи) и 5 лет.
2 октября 2007 г. при следовании в направлении участка речной переправы с непродолжительными задержками на пастьбу на левобережной ивняковой пойме на протяжении двух часов наблюдалась до захода в воду одна комолая 7-летняя самка с тремя телятами. Эту группу животных все это время сопровождал и 6-летний самец. Все животные были добыты. Судя по всему, двое из добытых разнополых телят (самец и самка) еще ранее потеряли матерей, после чего, очевидно, присоединились к встреченной 7-летней самке. При наблюдении 19 октября за смешанным оленьим стадом из 34 животных были отмечены в отдалении от этого стада двое телят без самок. Они держались вместе, сохраняя определенное расстояние и визуальный контакт с перемещавшимся впереди них стадом.
Вообще интенсивное поисково-охотничье освоение хищниками данного района популяционного ареала вида неоднократно подтверждались и прямыми визуальными наблюдениями. Так, 8 сентября 2007 г. напротив второго наблюдательного поста на противоположном левом берегу р. Пясина отмечена медведица (Ursus arctos (L. 1758)) с двумя медвежатами. Звери с 13 до 19 ч не покидали прибрежный участок кустарниковой тундры, настойчиво исследуя его в поисках растительной и животной пищи. На следующий день, 9 сентября близ промысловой точки “Яким” в овраге на подъеме на крутой береговой яр обнаружен незадолго до этого убитый бурым медведем молодой 2-летний самец дикого северного оленя. Не исключено, что перемещения именно этого же некрупного медведя наблюдались в тундре возле “Якима” и 18 сентября. Кроме того, в окрестностях р. Сахыр-Юрях (правый приток р. Пясина) на снегоходном маршруте 30 сентября 2007 г. бригадиром Н.А. Демьяненко (личное сообщение) встречены три матерых волка (Canis lupus (L. 1758)). Хищников повторно видели в том же самом районе и 4 октября, а 16 октября свежий одиночный проходной волчий след зарегистрирован на учетном маршруте, на правом берегу р. Пясина между промысловой точкой “Хатыстах” и первым отстрельным постом.
Таким образом, все виды “местных” и кочующих хищников периодически оказывали давление на отдельные половозрастные группы мигрирующих в среднем течении р. Пясина диких северных оленей. Мы не исключаем, что только биотопической избирательностью хищников-потребителей на этом пространственном миграционном участке популяционного ареала можно объяснить наблюдаемое порой явное нежелание оленьих стад в отдельные временные отрезки спускаться на пясинские ивняковые лайды. Это пастбищное пространство, изрезанное озерами, расчлененное распадками и ивняком с многолетними тропами к традиционным участкам речных переправ, вдруг переставало использоваться оленями. Животные предпочитали частично кормиться в сентябре по склонам и открытым вершинам возвышающейся гряды, опоясывающей с запада данный участок пясинской долины, но только не выпасаться на закустаренных лайдах речной поймы с очень ограниченным обзором.
Другим абиотическим фактором среды, сильно ограничивающим проникновение мигрирующих оленей на восточный правый берег, а значит и влияющим на оценку фактических показателей реализованного размножения в пуропясинском потоке, являлось продолжающееся остывание воды в р. Пясина. Из учтенных в полосе наблюдений в светлое время суток в сентябре 2007 г. 1657 диких северных оленей реку на этом “хатыстахском” участке решилось переплыть в дневные часы лишь 249 животных, или 15.03% от визуально учтенного поголовья. С наступлением предзимья и началом образования льда на водоемах в первой половине октября, число преодолевших р. Пясина диких оленей сократилось уже до 165 особей, т.е. 4.5% от наблюдаемых за этот период в окрестностях “Хатыстаха” и “Якима” 1697 диких оленей в стадах и группах, и 2 тыс. голов в скоплениях. Девять мигрировавших оленьих стад в наблюдаемый период доходили до реки, но затем разворачивались и возвращались в тундру.
С другой стороны, выполненная эмпирическая оценка реализованного размножения в пуропясинском миграционном потоке на основании материалов промысловой выборки вряд ли будет критически отличаться от реальной величины размножения в стадах диких оленей исследованного в сентябре–октябре 2007 г. миграционного потока.
Вместе с тем демографическая оценка репродуктивного цикла 2006–2007 гг. по объединенным выборочным данным (тарейско-пясинский и пуропясинский потоки, n = 546 особей) характеризует размножение как достаточно успешное (см. табл. 1). Численность родившегося потомства через два-четыре месяца после отела в постнатальный период (август–октябрь 2007 г.) оценена в 61 теленка на 100 самок репродуктивного возраста от двух лет и старше. Эмпирическое пополнение этой локальной части популяции составило по собранным материалам 23.9%. У 38.7% взрослых самок пясинских миграционных потоков (среднее течение р. Пясина) приплод по проведенным исследованиям отсутствовал. Так, по исследованиям Зырянова и Винокурова (1990), спустя месяц после отела потомство остается только у 70% самок таймырских оленей. Под воздействием факторов среды в первый месяц жизни элиминируются все слабые и не имеющие шансы выжить особи.
Минимальные показатели продуктивности оказались у младшего поколения 2-летних самок с ранним половым созреванием в возрасте 15–16 месяцев. Максимальные значения яловости в репродуктивном цикле 2006–2007 гг., как и пониженная плодовитость, выявлены в пясинских миграционных потоках среди поколения молодых трехлетних самок (см. табл. 1), т.е. вступивших в первое размножение в возрасте старше 2-х лет (27–28.5 месяцев).
Реальное повышение воспроизводительных способностей животных наступает с 3.5-летнего возраста, когда большая часть самок достигает половой зрелости. Количество прохолоставших среди следующей половозрелой группы 4-летних самок заметно снижается, что свидетельствует о возросшем морфофизиологическом качестве животных. У самок карибу канадского стада Peary шансы на успешное размножение в естественных условиях арктической среды значительно возрастают при живой массе животных от 57 кг и выше (Thomas, 1982). Так, на островах арктической Канады в марте–апреле 1974–1977 гг. доля беременных самок составляла меньше 8% среди особей с массой менее 53 кг, 75% у тех, кто обладал массой тела свыше 57 кг, а среди самок с массой 67 кг 100% были беременными.
По нашим же наблюдениям, минимальная оптимальная масса беременной 3-летней самки таймырского дикого северного оленя, зимовавшей в апреле 2004 г. на юге Западного Таймыра в Хараелахских горах (северо-запад плато Путорана), равнялась 57 кг. Максимальной для данной группы 3-летних беременных животных была масса 86 кг; средняя же масса беременных самок 3-летнего возраста (n = 11) оказалась 74.1 ± 2.6 кг (Шапкин, Арсентьева, 2006). Но максимальной живой массой обладала 8-летняя беременная важенка, весившая на тот весенний период 95 кг. Средняя же живая масса беременных самок таймырских диких северных оленей (n = 60) в весенних миграционных потоках в апреле–мае 2004 и 2006 гг. составила 77.18 ± 1.65 кг (Шапкин, 2012).
С другой стороны, длительное зимнее недоедание затрагивает в первую очередь репродуктивные способности животных. У молодых полуторагодовалых самок, переживших зимний дефицит кормов, задерживаются сроки наступления половой зрелости, а у особей средневозрастных и старших групп недоедание отражается на продуктивности (Филонов, 1993). При этом даже в летний период для всех растительноядных млекопитающих в реальной природной обстановке характерны напряженные трофические связи со средой: обилие высокопитательных кормов в местообитаниях отмечается лишь в периоды вегетации и плодоношения (Абатуров, Холодова, 1989). Не требует особого пояснения, что в арктических и субарктических биоценозах такие благоприятные периоды для потребления полноценных кормов дикими северными оленями по времени очень непродолжительны. Поэтому при любых сезонных миграционных перемещениях, с учетом положительного градиента температур, животные всегда нацелены на активнейший поиск и освоение пастбищных участков с максимально полноценной растительностью (Баскин, 2007).
Как у самок, так и у самцов оленей в августе–сентябре происходит активное наращивание мышечной ткани, и весовые показатели животных растут (Баскин, 1970). Кроме того, в миграционных потоках таймырской популяции идет популяционный процесс подготовки вида к приближающемуся следующему репродуктивному циклу. Тем не менее, в зависимости от состояния среды обитания, прежде всего количества и качества корма, воспроизводство в популяциях оленьих может приспособительно меняться, что проявляется в замедлении скорости роста численности и падении уровня плодовитости (Филонов, 1993).
Анализируя результаты фактического размножения в пясинских миграционных потоках в репродуктивном цикле 2006–2007 гг. на основании объединенных выборочных данных, полученных для 15 возрастных репродуктивных поколений самок (см. табл. 1), хорошо видно, что увеличение возрастной плодовитости и продуктивности наступает с 4-летней группы. В последующих группах взрослых самок, ежегодно участвующих в воспроизводстве, реальный вклад в поддержание численности данной локальной части таймырской популяции только возрастает, как и репродуктивный статус самих животных, достигая к 8-летнему возрасту довольно значительных средних значений плодовитости (0.404 самки на самку). Впрочем, именно с данного 8-летнего возраста в рассматриваемых миграционных потоках у животных начинается неуклонное снижение общей продуктивности группы, поскольку общее сокращение числа особей (индивидуальная смертность) уже доминирует над пополнением поголовья этих репродуктивных поколений и их долей в возрастном распределении миграционных потоков.
Собранные в среднем течении р. Пясина материалы наглядно демонстрируют: общие показатели продуктивности среди животных 9-летнего поколения, с их конечным вкладом в пополнение пясинских миграционных потоков, сравнялись с итоговыми показателями продуктивности 4-летних особей (см. табл. 1). Хотя средняя возрастная плодовитость 9-летних самок осталась достаточно высокой – 0.393 самки на одну 9-летнюю самку против 0.254 на одну 4-летнюю самку. Однако их вклад в текущее пополнение поддерживался лишь весомым репродуктивным потенциалом равноценных 9-летних самок, но уже не самой численностью 9-летнего возрастного поколения в возрастной структуре стад исследуемых потоков.
Между тем репродуктивный цикл любого вида завершается с окончанием лактации, когда новорожденное потомство полностью переходит на самостоятельное питание. У многих самок таймырских диких северных оленей, по нашим многолетним наблюдениям, процесс лактации занимает и большую часть ноября, хотя в данные сроки годового жизненного цикла протекает уже брачный период следующего репродуктивного сезона. Так, 17 ноября некоторые самцы диких северных оленей, участвовавшие в гоне, уже сбрасывают рога (личное сообщение охотпользователя С. Железнякова). В среднем течении р. Пясина, район промысловых точек “Хатыстах” и “Яким”, первые признаки приближающегося очередного цикла размножения визуально зафиксированы 21 и 26 сентября 2007 г. Поведение присутствующих взрослых быков в стадах и группах изменилось: самцы стали преследовать некоторых взрослых самок. 28 сентября взрослый самец, шедший с группой из 6 самок, совершил единичную попытку покрыть самку, но та мгновенно отскочила от него. Первый брачный “гарем” из 18 диких северных оленей (самки с телятами) во главе с самцом-доминантом с мощными рогами отмечен 18 октября 2007 г. 19 октября в “маточном” стаде самок и телят (n = 31) наблюдались сразу три взрослых самца. Таким образом, с конца второй декады октября в пясинских миграционных потоках диких северных оленей наступил следующий репродуктивный цикл 2007–2008 гг.
ЗАКЛЮЧЕНИЕ
Таким образом, экологическую нишу южных субарктических тундр долины р. Пясина в среднем ее течении пространственно и трофически используют в разные отрезки времени годового жизненного цикла два различных миграционных потока диких северных оленей таймырской популяции. Разделение и освоение ниши этими локальными пясинскими потоками выражается в том, что в конце июля и в августе через этот локальный участок популяционного ареала мигрирует ветвь (поток) тарейско-пясинских оленей тарейской группировки, далее в конце августа, в сентябре и первой половине октября ее сменяют стада пуропясинских оленей (Шапкин, 2009, 2012, 2017). Общая продолжительность сезонной миграции вида и сроки использования данного локального участка популяционного ареала в среднем течении р. Пясина (полоса южных субарктических тундр) составили по выполненным наблюдениям 67 дней. У тарейско-пясинской ветви диких оленей миграционные перемещения заняли 29 дней, у пуропясинских оленей сезонная откочевка с запада на восток (см. рис. 1) на этой географической широте длилась 40 дней. Причем 31 августа, 1, 2 сентября стада оленей этих двух различных потоков мигрировали через данные прибрежные пастбища поймы р. Пясина одновременно. Всего же через эту территорию популяционного ареала, за весь период визуальных наблюдений (05.08–20.10.2007) и по регулярным опросам промысловиков, откочевали в тундры Центрального Таймыра около 11–16 тыс. диких северных оленей.
В исследованных миграционных потоках оленей в размножении участвовали 15 репродуктивных поколений от 2-х до 16 лет (1 особь). Тем не менее основная репродуктивная активность пришлась на высокопродуктивных самок 4–9-летних поколений. Их реализованный уровень пополнения пясинских потоков оценен по выборочным материалам (n = 375 особей) в 76%. Немолодые самки 10–16 лет (n = 75 особей) обеспечили в количественном соотношении 19.6% пополнения потоков. Молодые 2–3-летние половозрелые самки (n = 31 особь) принесли 4.4% телят. Таким образом, процент самок в младших поколениях, не участвующих в размножении, всегда выше, чем в последующих репродуктивных группах, что, в конце концов, отражается на фактической продуктивности этих поколений (Юргенсон, 1966).
Неодинаковая роль в размножении половозрелых самок диких северных оленей в той или иной степени объясняется неодинаковым физиологическим развитием животных и неблагоприятными условиями существования, что естественно затягивает наступление периода половой зрелости у большей части самок. По данным всех предыдущих исследований, только небольшая часть самок таймырских диких северных оленей достигает половой зрелости на втором году жизни (Мичурин, 1964; Соколов, 1999; Колпащиков, Павлов, 2001; Шапкин, 2012, 2016). Однако основная масса самок становится половозрелыми лишь на третьем году жизни, проходя жесткий природный отбор на возможность участвовать в воспроизводстве в последующих циклах размножения. В общем, для осуществления успешного воспроизводства в репродуктивный период годового жизненного цикла животное должно накопить достаточно питательных веществ и энергии и одновременно должно обладать оптимальным весом. По двум таким признакам как живая масса и возраст самки прослеживается положительная связь (r = 0.68, η2 = 0.87, p < 0.01), вытекающая из развития организма животного (n = 19 особей) в летне-осенний пастбищный период. Наклон линии регрессии или коэффициент регрессии для объединенных групп лактирующих и яловых самок показал среднее возрастание y (живой массы самки) при увеличении x (возраст самки) на коэффициент пропорциональности (b) 2.59 (y = = 73.36 + 2.59x).
В целом, результаты репродуктивного цикла 2006–2007 гг. в данной локальной части таймырской популяции, в пределах объединенных двух пясинских миграционных потоков диких северных оленей можно признать как относительно успешные: на 100 взрослых самок приходилось 61 теленок (n = 546 самок). Среднее взвешенное значение плодовитости (Коли, 1979) определено на уровне 0.306 самки на одну взрослую самку этих объединенных потоков. Однако по отдельности у тарейско-пясинских оленей на 100 половозрелых самок в августе было 64 теленка, у пуропясинских оленей в сентябре–октябре на 100 самок выявлено 47 телят. Вместе с тем по другим не менее важным демографическим переменным, таким как валовая рождаемость, чистая скорость роста (R0), продолжительность генерации, среднее время генерации (T0), удельная скорость роста (r) (Коли, 1979; Пианка, 1981), рассчитанным по сглаженным многолетним промысловым выборкам самок из этих потоков (Смирнов, 1983; Дьяконов, 1987), репродуктивный цикл в пясинских миграционных потоках характеризуется соответственно валовой рождаемостью – 5.312, R0 > 1.06, продолжительностью генерации – 7.06, T0 – 6.7 и удельной скоростью роста r – 0.008 (Шапкин и др., 2018).
Таким образом, сохраняющееся число половозрелых самок в репродуктивных возрастных группах данных миграционных потоков (среднее течение р. Пясина), как и их репродуктивный потенциал, обеспечили на разных стадиях годового цикла 2006–2007 гг., при существующем промысловом изъятии диких северных оленей из пясинских миграционных потоков на уровне 7.5–10.9%, текущее пополнение этой локальной части таймырской популяции.
Список литературы
Абатуров Б.Д., Холодова М.В., 1989. Изменчивость и оптимизация уровня потребления питательных веществ и энергии у растительноядных млекопитающих // Зоологический журнал. Т. 68. № 1. С. 111–123.
Балинова В.С., 2004. Статистика в вопросах и ответах: Учебное пособие. М.: Издательство Проспект. 344 с.
Баскин Л.М., 1970. Северный олень. Экология и поведение. М.: Наука. С. 152.
Баскин Л.М., 1976. Поведение копытных животных. М.: Наука. 295 с.
Баскин Л.М., 2007. Популяции диких и одичавших северных оленей Сибири и Дальнего Востока // Бюллетень Московского общества испытателей природы. Отд. Биол. Т. 112. Вып. 4. С. 3–9.
Бейли Н., 1962. Статистические методы в биологии. Пер. с англ. М.: Изд-во иностранной литературы. 260 с.
Большаков В.Н., Кубанцев Б.С., 1984. Половая структура популяций млекопитающих и ее динамика. М.: Наука. 233 с.
Бондарь М.Г., Колпащиков Л.А., 2018. Оценка численности и летнее размещение таймырской популяции диких северных оленей в 2017 г. // Научные труды Федерального государственного бюджетного учреждения ‘‘Объединенная дирекция заповедников Таймыра’’. Выпуск 2. Норильск: изд-во ‘‘Апекс’’. С. 29–45.
Гиляров М.С., 1954. Вид, популяция и биоценоз // Зоологический журнал. Т. 33. № 4. С. 769–778.
Данилкин А.А., 1999. Оленьи. Млекопитающие России и сопредельных регионов // Род Северные олени. М.: Геос. С. 301–364.
Джиллер П., 1988. Структура сообществ и экологическая ниша. Пер. с англ. М.: Мир. 184 с.
Дьяконов В.П., 1987. Справочник по алгоритмам и программам на языке бейсик для персональных ЭВМ. М.: Наука. 240 с.
Зырянов В.А., Винокуров Ю.И., 1990. Сравнительная эколого-морфологическая характеристика новорожденных диких и домашних северных оленей Таймыра // Ресурсы, экология и рациональное использование диких северных оленей в СССР. Новосибирск. С. 74-84.
Клевезаль Г.А., Клейненберг С.Е., 1967. Определение возраста млекопитающих по слоистым структурам зубов и кости. М.: Наука.144 с
Коли Г., 1979. Анализ популяций позвоночных. Пер. с англ. М.: Мир. 362 с.
Колпащиков Л.А., Павлов Б.М.,2001. Плодовитость самок диких северных оленей Таймыра // Научное обеспечение рационального природопользования Енисейского Севера. Новосибирск: ООО “Ревик-К”. С. 55–64.
Лэк Д., 1957. Численность животных и ее регуляция в природе. Пер. с англ. М.: Изд-во иностранной литературы. 404 с.
Матвеева Н.В., 1998. Зональность в растительном покрове Арктики: Тр. Ботанического института им. Комарова. Вып. 21. СПб. 220 с.
Михайлов В.В., Колпащиков Л.А., Шапкин А.М., 2008. Проблемы контроля и управления популяцией диких северных оленей в современных социальных экономических условиях на севере Средней Сибири // Биологические ресурсы Крайнего Севера: современное состояние и перспективы использования. СПб.: ГУАП. С. 23–35.
Мичурин Л.Н., 1964. Дикий северный олень Таймырского полуострова и рациональное использование его запасов. Дис. … канд. биол. наук. Норильск. 227 с.
Наумов Н.П., 1975. Механизмы взаимодействия популяций (на примере некоторых млекопитающих и птиц) // Зоологический журнал. Т. 54. № 6. С. 832–847.
Новиков Г.А., 1953. Полевые исследования по экологии наземных позвоночных. М.: Советская наука. 502 с.
Песенко Ю.А.,1982. Принципы и методы количественного анализа в фаунистических исследованиях. М.: Наука. 288 с.
Пианка Э., 1981. Эволюционная экология. Пер. с англ. М.: Мир. 400 с.
Плохинский Н.А., 1970. Биометрия. М.: Издательство Московского Университета. 368 с.
Сафронов В.М., Решетников И.С., Ахременко А.К., 1999. Северный олень Якутии. Новосибирск: Наука. 224 с.
Северцов С.А., 1941. Динамика населения и приспособительная эволюция животных. М.-Л.: изд-во АН СССР. 316 с.
Смирнов В.С., 1983. Принципы анализа возрастной структуры популяций по выборочным данным // Экология. № 1. С. 69–76.
Соколов А.А., 1999. Ретроспективная оценка по костным остаткам состояния популяций северных оленей (Rangifer tarandus L., 1758) из районов с разным уровнем радиационного загрязнения. Автореф. дис. …канд. биол. наук. М. 27 с.
Филонов К.П., 1993. Оценка состояния популяции оленьих. М.: Наука. 272 с.
Шапкин А.М., 2004. Миграции, поведение и структура стад диких северных оленей в среднем течении р. Пясина осенью 2002г. // Актуальные проблемы природопользования на Крайнем Севере. Новосибирск. С. 46–53.
Шапкин А.М., 2009. Осенние миграции, миграционные потоки диких северных оленей и их пространственная структура в среднем течении реки Пясина // Биологические ресурсы Крайнего Севера: изучение и использование. СПб.: ГУАП. С. 156–165.
Шапкин А.М., 2012. Мониторинг основных группировок дикого северного оленя (Rangifer tarandus L.) в экосистеме Западного Таймыра. Автореф. дис. … канд. биол. наук. Красноярск: Красноярский государственный аграрный университет. 23 с.
Шапкин А.М., 2016. Анализ плодовитости самок таймырской популяции дикого северного оленя (Rangifer tarandus) // Зоологический журнал. Т. 95. № 12. С. 1475–1486
Шапкин А.М., 2017. О фенотипической изменчивости таймырских тундровых диких северных оленей (Rangifer tarandus) // Генетика и разведение животных. № 1. С. 22–30.
Шапкин А.М., Арсентьева Н.Ф., 2006. Плодовитость самок диких северных оленей на Западном Таймыре // Биологические ресурсы Крайнего Севера: современное состояние и проблемы использования. Новосибирск. С. 77–88.
Шапкин А.М., Забелин М.М., 2016. Новые знания об угрозе существования таймырской популяции диких северных оленей. Система сохранения таймырской популяции диких северных оленей // Руководство. Норильск. 103 с.
Шапкин А.М., Арсентьева Н.Ф., Суханова Н.С., 2018. О показателях воспроизводства диких северных оленей в первом десятилетии XXI века на Таймыре // TerraАрктика-2018: Биологические ресурсы и рациональное природопользование. Материалы IV Международной научно-практической конференции. Норильск. С. 112–115.
Юргенсон П.Б., 1966. Возрастная структура популяций и динамика плодовитости охотничьих животных // Зоологический журнал. Т. 45. № 2. С. 161–171.
Abraham K.F., Pond B.A., Tully S.M., Trim V., Hedman D., Chenier C., Racey G.D., 2012. Recent changes in summer distribution of migratory caribou on the southern Hudson Bay coast // Rangifer Specical Issue № 20. P. 269–276.
Banfield A.W., 1954. Preliminary investigation of the barren-ground caribou // Can. Wildl. Serv. 79 p.
Banfield A.W., 1957. The plight of the barren-ground caribou // J. Fauna Preservat. Soc. V. 4. Issue 1. P. 5–20.
Bergerud A.T., 1996. Evolving perspectives on caribou population dynamics, have we got it right yet? // Rangifer Specical Issue № 9. P. 95–116.
Clarke C.H., 1940. A biological investigation of the Thelon Game Sanctura // Nat. Mus. Can. Bull. 96. (Biol. Ser. № 25). 135 p.
COSEWIC, 2004. COSEWIC assessment and update status report on the Peary caribou Rangifer tarandus pearyi and the barren-ground caribou Rangifer tarandus groenlandicus (Dolphin and Union population) in Canada. Committee on the Status of Endangered Wildlife in Canada (COSEWIC), Ottawa, Ont.
Environment Canada, 2009. Scientific review for the identification of critical habitat for woodland caribou (Rangifer tarandus caribou), boreal population, in Canada. Environment Canada, Ottawa, Ont.
Fancy S.G., Pank L.F., Whitten K.R., Regelin W.L., 1989. Seasonal movements of caribou in Artic Alaska as determined by satellite // Canadian Journal of Zoology. V. 67. P. 644–650.
Fancy S.G., Whitten K.R., 1991. Selection of calving sites by Porcupine Herd caribou // Canadian Journal of Zoology. V. 69. P. 1736–1743.
Festa-Bianchet M., Ray J.C., Boutin S., Côte S.D., Gunn A., 2011. Conservation of caribou (Rangifer tarandus) in Canada: an uncertain future // Canadian Journal of Zoology. V. 89. P. 419–434. https://doi.org/10.1139/Z11-025
Gunn A., Nixon W., 2007-2008. Rangifer Health & Body Condition Monitoring. Manual // Circum Arctic Rangifer Monitoring and Assessment (CARMA) Network. IPY-API International Polar Year Annee polaire internationale. 30 p.
Kelsall J.P., 1957. Continued barren-ground caribou studies // Can. Wildl. Serv., Wildl. Mgmt. Bull. Ser. I. № 12. 148 p.
Kelsall J.P., 1960. Cooperative studies of barren-ground caribou 1957-58 // Can. Wildl. Serv., Wildl. Mgmt. Bull. Ser. I. № 15. 14 p.
Klevezal G.A., 1996. Recording structures of mammals: determination of age and reconstruction of life history. Rotterdam/Brookfield, A.A. Balkema, Rotterdam. 274 p.
Lynn E. Noel, Jonn G. George, 2003. Caribou distribution during calving in the northeast National Petroleum he serve-Alaska, June 1998 to 2000 // Rangifer, Special Jussue № 14. P. 283–291.
Schaefer J.A., Veitch A.M., Harrington F.H., Brown W.K., Theberge J.B., Luttich S.N., 2001. Fuzzy structure and spatial dynamics of a declining woodland caribou population // Oecologia (Berl V. 126 (4). P. 507-514. https://doi.org/10.1007/s004420000555
Schmelzer I., Brazil J., Chubbs T., French S., Hearn B., Jeffery R., LeDrew L., Martin H., McNeill A., Nina R., Otto R., Phillips F., Mitchell G., Simon N., and Yetman G., 2004. Recovery strategy for three woodland caribou herds (Rangifer tarandus caribou; boreal population) in Labrador. Department of Environment and Conservation, Government of Newfoundland and Labrador, Corner Brook.
Scogland T., Wildl J., 1986. Density dependent food limitation and maximal production in wild reindeer herds // Manage. V. 50. (№ 2). P. 314–319.
Sorensen T., McLoughlin P.D., Hervieux D., Dzus E., Holan J., Wynes B., Boutin S., 2008. Determining sustainable levels of cumulative effects for boreal caribou // J. Wildl. Manage. V. 72. № 4. P. 900–905. https://doi.org/10.2193/2007-079
Stephenson R.O., 2005. Porcupine caribou herd management report // Caribou management report of survey and inventory activities 1 July 2002-30 June 2004. Alaska Department of Fish and Game. Project 3.0. Juneau. P. 219–234.
Thomas D.C., 1982. The relationship between fertility and bat reserves of Peary caribou // Canadian Journal of Zoology IV. LX. P. 597–602.
Thompson J.E., Abraham K.F., 1994. Range, Seasonal Distribution and Population Dynamics of the Pen Island Caribou Herd of Southern Hudson Bay // Ontario Ministry of Natural Resources, Final Technical Report, Moosonee, Ontario. 94 p.
Vors L.S., Boyce M.S., 2009. Global declines of caribou and reindeer // Global Change Biology 15 (11). P. 1365–2486.
Whitten K.R., Garner G.W., Mauer F.J., Harris R.B., 1992. Productivity and early calf survival in the Porcupine caribou herd // J. Wildl. Manage 56. P. 201–212.
Whitten K.R., 1995. Antler loss and udder distention in relation to parturition in caribou // J. Wildl. Manage 59. P. 273–277.
Zar J.H., 2010. Biostatistical analysis. Northern Illinois University, New Jersey. 944 p.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал