Зоологический журнал, 2022, T. 101, № 10, стр. 1127-1135
Гребенчатый тритон (Triturus cristatus Laurenti 1768, Caudata, Salamandridae) у восточной границы ареала на Среднем Урале
Д. Л. Берзин a, *, В. Л. Вершинин a, b
a Институт экологии растений и животных УрО РАН
620144 Екатеринбург, Россия
b Уральский федеральный университет имени Б.Н. Ельцина
620002 Екатеринбург, Россия
* E-mail: berzin_dl@ipae.uran.ru
Поступила в редакцию 10.11.2021
После доработки 12.03.2022
Принята к публикации 06.04.2022
- EDN: FXNMRC
- DOI: 10.31857/S0044513422080037
Аннотация
Приведены анализ информации о распространении Triturus cristatus на восточном макросклоне Урала (Южный и Средний Урал) и актуальные сведения по исследованным популяциям. На основании мечения с повторными отловами впервые оценены численность репродуктивного ядра, соотношение полов, также изучена морфологическая специфика. С позиций оценки физико-химических особенностей среды местообитаний обсуждаются возможные лимитирующие факторы (термо- и влагообеспеченность, геохимические особенности, континентальность, наличие карстовых полостей, расселение инвазивных видов), оказывающие влияние на распространение и численность гребенчатого тритона на северо-восточной границе ареала.
Гребенчатый тритон – преимущественно европейский вид. На территории России распространен в центральных областях европейской части (где проходит северная граница его ареала). Восточный предел его распространения включает западный макросклон Уральских гор. В Пермском крае встречается в основном в средней и южной частях (Чащин, Соловьева, 1969), самая северная находка сделана в окрестностях г. Соликамск (Хазиева, Болотников, 1972). Несмотря на то, что T. cristatus имеет в Международной Красной книге статус LC – вид, вызывающий наименьшее опасение с точки зрения снижения численности популяций (Arntzen et al., 2009), он внесен в Красные книги Латвии, Литвы, Эстонии. На границе ареала вид находится под угрозой исчезновения и, безусловно, заслуживает охраны (Terhivuo, Mannerkoski, 2010). Установлено, что численность гребенчатого тритона в Европе повсеместно снижается (Denoël, 2012). В России включен в региональные Красные книги: Архангельской, Брянской, Вологодской, Ивановской, Курской, Ленинградской, Липецкой, Московской, Тамбовской, Тверской, Ульяновской, Челябинской, Свердловской и Курганской областей, города Москвы и Санкт-Петербурга, Республик Башкортостан, Карелии, Татарстана, Чувашии. Считается, что на восточном склоне Урала граница ареала проходит в Южном Зауралье через Челябинскую и Курганскую области, где он очень редок (Кузьмин, 2012). Отрицательное влияние на распространение гребенчатого тритона оказывают уничтожение лесов, урбанизация, загрязнение пестицидами, расчистка прудов (Шарыгин, Ушаков, 1979; Мантейфель, Бастаков, 1989; Лада, Соколов, 1995; Кузьмин, 2012). При антропогенной трансформации местообитаний вымирает быстрее других видов синтопичных амфибий, в связи с высокой чувствительностью к качеству гидрохимических параметров (Кузьмин, 2012). Наличие рыб в нерестовых прудах и нарушение обмена между отдельными метапопуляциями гребенчатого тритона могут представлять опасность для воспроизводства вида (Vuorio et al., 2016). Значительное влияние на распространение и численность T. cristatus оказывает появление такого инвазивного вида как ротан (Perccottus glenii (Dybowski 1877)) (Решетников, 2003).
В 1996 г. T. cristatus был внесен в Красную книгу Среднего Урала – III категория. Редкий, малочисленный вид на периферии ареала. В Красной книге Свердловской области (Вершинин, Берзин, 2018) статус гребенчатого тритона – II категория.
Информация о наличии T. cristatus за пределами европейской части ареала нуждается в широкой ревизии. Исследования по уточнению статуса и распространения гребенчатого тритона показали, что наличие вида в Полевском и Сысертском районах Свердловской обл. (Топоркова, 1973), также как информация по ряду местонахождений в Челябинской обл. (Лагунов и др., 2006; Перепелкин, 2016; Вандышев, 2019; Гашек, Красуцкий, 2020), к сожалению, не получили фактического подтверждения. Не исключены ошибки в ряде сообщений (Перепелкин, 2016), возможно также, что с момента проведения наблюдений T. cristatus в этих районах, произошли изменения ареала. Вместе с тем имеются отдельные публикации о находках, подтверждающих существование ряда популяций гребенчатого тритона на территории Красноуфимского р-на Свердловской обл. (Ищенко, 2018; Поляков и др., 2018). Для сохранения вида и уточнения статуса T. cristatus на территориях, где он обладает охранным статусом, а также на границе ареала необходимы данные о численности и популяционной структуре. Настоящее исследование выполнено с целью изучить специфику популяций и получить представление о статусе гребенчатого тритона на восточной границе его распространения.
МАТЕРИАЛ И МЕТОДИКА
Материал собран на восточной периферии ареала гребенчатого тритона в местообитаниях, расположенных на территории северо-западной части Нязепетровского р-на, с. Шемаха Челябинской обл. (56°15′2.58″ с.ш., 59°16′36.18″ в.д.; h = = 257 м), а также в юго-западной части Красноуфимского р-на Свердловской обл., дер. Большое Кошаево (56°50′26.33″ с.ш., 57°33′13.68″ в.д.; h = = 239 м) и дер. Верхняя Ирга (56°48′13″ с.ш., 57°34′57.30″ в.д.; h = 245 м). Сбор материала проведен в весенне-летний период 2016–2021 гг. Общее число изученных животных 383 экз. (взрослых 253, неполовозрелых 23, сеголетков 13, личинок 94). Весенние тотальные отловы животных выполнены с помощью водного сачка “слепым тралением”, в летний период сеголеток отлавливали вручную.
Проведены основные стандартные для хвостатых земноводных промеров тела (Терентьев, Чернов, 1949; Банников и др., 1977). Морфометрия произведена с помощью цифрового штангенциркуля Kraftool (Германия) с ценой деления 0.01 мм. Также отмечали стадию развития, пол и наличие внешних морфологических аномалий, которые определены в соответствии с современными классификациями (Вершинин, 2015; Henle et al., 2017). Сравнение частот аномалий выполнено с использованием критерия χ2 (с поправкой Йейтса).
Учеты численности взрослых особей гребенчатого тритона (2018 и 2019 гг.) проводились с применением массовой метки (ампутация одного пальца целиком или частично) с повторными отловами в весенний период в водную фазу жизненного цикла. У хвостатых земноводных данная метка отчетливо заметна в течение 2–3 мес. (регенерация после мечения длится более 6 мес.) (Griffith, 1984). После мечения животных выпускали в местообитании, где они были отловлены. Численность половозрелых особей рассчитывали с помощью формулы Петерсена–Линкольна (Petersen, 1896) в модификации Бейли (Bailey, 1951):
Для корректной оценки численности использовали формулу стандартной ошибки по Бэйли:
Изучение химического состава нерестовых водоемов гребенчатого тритона выполнены в лаборатории инженерно-экологических испытаний ООО “АкваСолум”. Для оценки состояния водоемов использовали следующие показатели: общая минерализация, pH, химическое потребление кислорода (ХПК).
Статистическая обработка проведена с использованием прикладных статистических пакетов Microsoft Excel и Statistica for Windows 7.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Проверка сведений по распространению гребенчатого тритона на Среднем Урале показала, что вид присутствует на западном макросклоне в Красноуфимском р-не Свердловской обл., где он отмечен в двух местообитаниях, а также в Челябинской обл. у границы со Свердловской обл. (рис. 1).
Рис. 1.
Распространение гребенчатого тритона на северо-восточной границе ареала: 1 – Свердловская обл., Красноуфимский р-н, дер. Большое Кошаево; 2 – Челябинская обл., Нязепетровский р-н, с. Шемаха. Темные кружки – места находок, актуализированные фактическими данными (коллекционными материалами); светлые кружки с крестом – не подтвержденные фактическим материалом точки, указанные в литературных источниках.
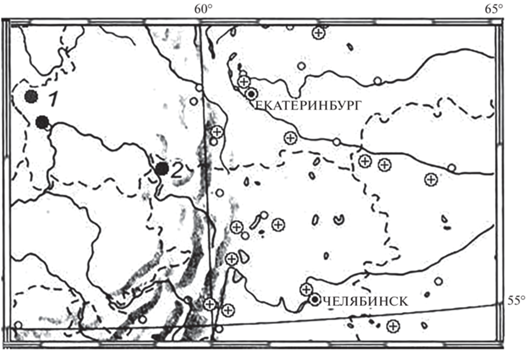
Анализ литературы показал, что за последние 20 лет, вследствие перекрестного цитирования старых источников, год от года тиражировалось значительное число непроверенных, ошибочных и неактуализированных сведений о распространении гребенчатого тритона на Восточном макросклоне Урала. Использование опросных данных о распространении T. cristatus – еще одна причина появления недостоверной информации из-за ошибочного определения вида респондентами, принимающими самцов обыкновенного тритона за самцов гребенчатого. К настоящему времени сведения обо всех точках, расположенных восточнее 57°–59° в.д., не подтверждены никакими фактическими материальными свидетельствами (коллекционные сборы личинок, сеголетков, половозрелых особей или их фотографии) и не могут быть рассмотрены как актуальные современные данные (рис. 1). Так, ряд местообитаний, приводимых со ссылкой на данные из публикации Сабанеева (1874), не представляют иной ценности, кроме исторической. В целом, из 16 приводимых рядом авторов (Кузьмин, 2012; Чибилев, 2003, 2005; Вершинин, 2007; Литвинчук, Боркин, 2009) точек подтверждены фактическим материалом по половозрелым особям лишь две из них (район Нижне-Иргинской дубравы – 114 экз., г. Красноуфимск – 1 экз.). Также обнаружена одна новая точка на северо-западе Челябинской обл. (139 экз.).
Нерестовые водоемы в Свердловской обл. расположены в лесостепной зоне на окраинах деревень Большое Кошаево и Верхняя Ирга, вдоль русла р. Иргина. Из других позвоночных в водоемах присутствуют серебряный карась (Carassius gibelio (Bloch 1782)), травяная лягушка (Rana temporaria (L. 1758)), остромордая лягушка (Rana arvalis (Nilsson 1842)) и обыкновенный тритон (Lissotriton vulgaris (L. 1758)). Местообитание представляет собой серию карстовых воронок, часть из которых заселена рыбами – P. glenii и C. gibelio. Все пруды умеренно заросли водной растительностью. В Свердловской обл. гребенчатый тритон встречается в водоемах со слабощелочным pH и умеренной минерализацией (табл. 1).
Таблица 1.
Физические и гидрохимические параметры нерестовых водоемов
| Область | t °, C | pH | ХПК, мг/л | Минерализация, мг/л | Макс. глубина, м | Площадь водного зеркала, м2 |
Происхождение |
|---|---|---|---|---|---|---|---|
| Челябинская (n = 5) |
18.6 ± 1.2 15.0–22.0 |
7.3 ± 0.2 7.0–7.8 |
22.3 ± 3.8 13.2–34.8 |
375.6 ± 148.3 132.0–960.0 |
1.8 | 1522.0 | Техногенное |
| Свердловская (n = 5) |
16.0 ± 1.1 13.0–18.0 |
7.6 ± 0.2 7.1–7.9 |
13.2 ± 4.4 5.6–25.2 |
186.3 ± 50.9 90.0–330.0 |
4.0 | 472.0 | Карстовое |
В Челябинской обл. T. cristatus обитает в пруду склонового типа (водоем, который сооружают в балках и верховьях долин, характеризуется большой глубиной) (Житин, Парахневич, 2003) техногенного происхождения, который располагается в 5 м от проселочной дороги в пойме р. Шемаха. Из других амфибий встречается R. arvalis. Почва в водоеме глинистая, торфяная. Воды эвтрофные, довольно минерализованные со слабощелочным pH (табл. 1). Не исключено загрязнение бытовыми отходами, поскольку пруд примыкает к малоэтажной застройке и часто посещается сельскохозяйственными животными. Водоем заполнен обильной водной растительностью, среди которой встречаются ряска трехдольная (Lemna trisulca (L. 1753)), ряска малая (Lemna minor (L. 1753)), пузырчатка (Utricularia vulgaris (L. 1753)). По берегам и на поверхности воды встречаются куртины сфагнума (Sphagnum sp.).
Рядом находится обширный заболоченный участок (протяженностью свыше 1000 м), где также был отмечен гребенчатый тритон.
Во многих частях ареала распространение гребенчатого тритона носит мозаичный характер. Так, в Челябинской обл. из 10 обследованных водоемов, расположенных на прилегающих к месту находки территориях, T. cristatus обнаружен в одном, а в Свердловской обл. – в четырех водоемах из 25 обследованных. Для двух из исследованных нерестовых прудов впервые для Уральского региона получены данные по численности репродуктивного ядра популяций (табл. 2).
Таблица 2.
Численность T. cristatus в исследуемых популяциях
| Область | Взрослые, шт. | Личинки, шт. | Наличие других позвоночных |
|---|---|---|---|
| Челябинская (Водоем 1) | 187 ± 103 (2018 г.) |
873 ± 292 (2017 г.) |
R. arvalis |
| Свердловская (Водоем 1) | 42 ± 21 (2019 г.) |
Нет данных | C. gibelio, P. glenii, R. temporaria, L. vulgaris, R. arvalis |
| Свердловская (Водоем 2) | 49 ± 19 (2019 г.) |
Нет данных | R. temporaria, R. arvalis, L. vulgaris |
Установлено, что в обследованном местообитании в Челябинской обл. численность гребенчатого тритона в 3.5 раза выше, чем в Свердловской. Отмеченные различия могут быть обусловлены как физическими (различия в температурном режиме), так и биотическими (кормообеспеченность, наличие хищных рыб) причинами.
На распространение и численность T. cristatus значительное влияние оказывает наличие ротана, негативно воздействующего на численность, в первую очередь, хвостатых амфибий (Решетников, 2003). Согласно информации, полученной от жителей дер. Большое Кошаево, с 1992 по 2019 гг. произошло расселение ротана по 20 близлежащим водоемам, которое привело к исчезновению гребенчатого тритона из данных местообитаний. Проведенные годом позже отловы показали элиминацию гребенчатого и обыкновенного тритонов в результате инвазии ротана при слиянии карстовых воронок в период весеннего паводка 2021 г.
Вода в техногенном пруду Челябинской обл. хорошо прогревается. Высокая минерализация воды способствует развитию водной растительности и большого числа водных беспозвоночных как потенциальных пищевых объектов (табл. 1). Эти факторы обусловливают успешное обитание и воспроизводство T. cristatus в условиях резко-континентального климата Среднего Урала.
Установлено, что соотношение полов в репродуктивном ядре популяции незначительно сдвинуто в сторону преобладания самок (в Свердловской обл. – 58%, в Челябинской – 51%). Анализ основных морфологических признаков гребенчатого тритона на восточной границе распространения (табл. 3, рис. 2) показал, что в целом самки в сравнении с самцами имеют значимо бо́льшую длину тела (более чем на 5 мм) (F(1, 250) = 44.294, p = 0.00001), абсолютный размер головы (F(1, 250) = = 16.476, p = 0.00007) и длину хвоста (на 6 мм больше) (F(1, 249) = 69.923, p = 0.00001). Соответственно, отмечены межполовые различия по относительному размеру головы (F(1, 250) = 20.831, p = 0.00001) и относительной дине хвоста (F(1, 249) = = 7.9432, p = 0.05).
Таблица 3.
Морфологические признаки T. cristatus
| Область | L, мм lim |
Lc, мм lim |
Lcd, мм lim |
L-Lc/Lc Lim |
L/Lcd lim |
Pa/Pp lim |
Пол | N |
|---|---|---|---|---|---|---|---|---|
| Челябинская | 63.9 ± 0.7 49.8–73.9 |
13.1 ± 0.1 11.2–15.2 |
55.4 ± 0.7 43.2–61.9 | 3.9 ± 0.04 2.8–4.6 |
1.2 ± 0.01 0.9–1.4 |
1.0 ± 0.2 0.8–1.2 |
Самцы | 67 |
| 68.3 ± 0.7 56.1–81.3 |
13.5 ± 0.1 11.4–15.8 |
62.3 ± 0.7 40.0–83.0 |
4.1 ± 0.04 3.1–4.8 | 1.1 ± 0.01 0.8–1.4 | 1.0 ± 0.1 0.8–1.3 | Самки | 72 | |
| 30.3 ± 0.5 28.1–33.1 |
8.2 ± 0.1 7.8–8.9 |
23.5 ± 0.4 21.7–25.9 |
2.7 ± 0.0 2.6–2.9 |
1.3 ± 0.0 1.2–1.4 |
1 ± 0.0 0.9–1.1 |
Сеголетки | 10 | |
| 45.8 ± 1.1 43.4–55.5 |
11.0 ± 0.1 9.9–11.6 |
41.6 ± 0.9 37.0–49.7 | 3.2 ± 0.1 2.9–3.8 | 1.1 ± 0.0 1.0–1.2 |
1.0 ± 0.0 0.8–1.1 |
Субад. | 16 | |
| Свердловская | 61.7 ± 0.9 49.1–73.2 |
12.9 ± 0.1 11.3–15.1 | 52.8 ± 0.9 44.5–60.1 | 3.8 ± 0.05 3.0–4.3 |
1.2 ± 0.01 1.0–1.3 |
1.4 ± 0.2 0.9–1.0 |
Самцы | 47 |
| 67.5 ± 0.7 48.0–86.1 |
13.6 ± 0.1 11.4–18.8 | 58.9 ± 0.7 41.5–77.0 | 4.0 ± 0.04 2.2–4.6 |
1.2 ± 0.01 1.0–1.5 |
1.0 ± 0.2 0.8–1.1 |
Самки | 67 | |
| 34.7 ± 0.1 34.5–34.9 |
9.1 ± 0.1 9.0–9.2 |
31.5 ± 2.1 28.6–34.6 |
2.8 ± 0.0 2.8–2.9 |
1.1 ± 0.1 1.0–1.2 | 1.1 ± 0.1 1.0–1.2 | Сеголетки | 3 | |
| 37.9 ± 1.7 33.0–42.4 |
9.9 ± 0.4 8.8–11.0 |
34.0 ± 1.8 28.5–39.6 |
2.8 ± 0.1 2.5–3.1 |
1.1 ± 0.0 1.0–1.2 |
1.0 ± 0.0 0.9–1.1 |
Субад. | 7 |
Рис. 2.
Распределение по длине тела половозрелых особей: А – Свердловская обл., B – Челябинская обл.
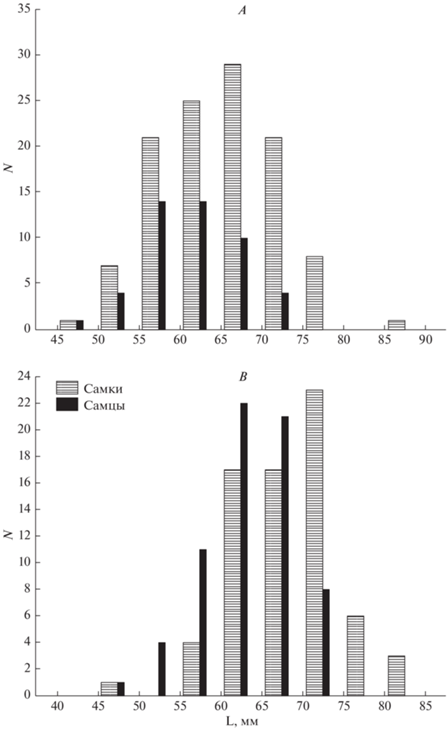
Длина тела сеголетков значимо (F(1, 11) = 28.312, p = 0.00024) больше в Свердловской обл. Также больше длина головы (F(1, 11) = 20.558, p = 0.00085), хвоста (F(1, 11) = 48.016, p = 0.00002) и относительная длина хвоста (F(1, 11) = 19.492, p = 0.00104).
Неполовозрелые животные существенно (F(1, 21) = = 16.028, p = 0.00064) крупнее в популяции из Челябинской обл. – на 8 мм. Соответственно, больше (F(1, 21) = 17.931, p = 0.0004) абсолютная длина хвоста, головы (F(1, 21) = 12.817, p = 0.002), но не их соответствующие индексы.
Абсолютные размеры животных исследованных популяций (и пределы их изменчивости) в целом сходны с таковыми в других частях ареала вида (табл. 4). Как правило, длина тела самок T. cristatus превышает длину тела самцов. Крупные размеры тела самок положительно связаны с плодовитостью, что характерно для большинства видов земноводных. Установленные различия в пропорциях тела самцов и самок следует связывать с их идентификационным значением для половозрелых животных в период размножения (табл. 3, рис. 2). Межпопуляционных различий по основным морфометрическим показателям взрослых животных не выявлено.
Таблица 4.
Морфологические показатели T. cristatus для других частей ареала
| Место исследований | Пол | L, мм | Lcd, мм | L/Lcd, мм | Pa/Pp | Автор |
|---|---|---|---|---|---|---|
| Западные Балканы | Самцы | Нет данных | Нет данных | Нет данных | Нет данных | Furtula et al., 2008 |
| Самки | 60.1–80.7 | |||||
| Франция | Самцы | 64.8 62.3–67.0 |
Нет данных | Нет данных | Нет данных | Arntzen, 2000 |
| Самки | 73.9 71.2–76.5 |
|||||
| Норвегия | Самцы | 67.3 64.8–69.8 |
Нет данных | Нет данных | Нет данных | Arntzen, 2000 |
| Самки | 59.3 56.8–61.7 |
|||||
| Россия и сопредельные страны | Самцы | 59.8 ± 5.6 47.0–77.0 |
50.4 ± 4.6 37.0–67.0 | 1.19 ± 0.08 0.97–1.56 | 0.96 ± 0.07 0.73–1.26 |
Литвинчук, Боркин, 2009 |
| Самки | 65.1 ± 6.7 50.0–89.8 |
57.0 ± 5.5 43.2–80.0 | 1.14 ± 0.06 0.96–1.44 | 0.98 ± 0.06 0.82–1.26 |
Необычными для изученных популяций оказались высокая частота и широкий спектр морфологических отклонений, которые отличаются от сведений для северо-запада России (7.5% (n = 40) и три варианта аномалий у половозрелых животных) (Литвинчук, 2014). Встречаемость аномалий выше в популяции Свердловской обл. по сравнению с Челябинской, как у сеголетков – 66.7 против 38.5%, так и у взрослых – 43.2 против 16.3% (χ2 = 9.42, p = 0.002) соответственно. Причем, если в Челябинской обл. частота аномалий у самцов (15.3%) и самок (13.4%) значимо не различается (χ2 = 0.00, p = 0.945), то в Свердловской обл. встречаемость аномалий у самцов (46.8%) существенно (χ2 = 5.54, p = 0.02) выше, чем у самок (23.9%). У взрослых животных в целом спектр включает 11 вариантов отклонений: эктродактилия, синдактилия, схизодактилия, олигодактилия, полидактилия, эктромелия, анофтальмия, пигментные отклонения, новообразования, утолщения костей конечностей, аномалии плавательной складки (10 вариантов в Челябинской обл. и 11 – в Свердловской). Преобладают аномалии дистальных частей конечностей: эктро-, схизо- и синдактилия. Возможно, значительная доля отклонений связана с тем, что исследованные популяции являются пределом распространения гребенчатого тритона на северо-востоке, где условия обитания далеки от оптимальных для этого центральноевропейского вида. Более высокая частота отклонений в популяции Свердловской обл., вероятно, объясняется ее более северным положением, а также синтопическим обитанием тритонов с рыбами (Литвинчук, 2014) в период размножения.
В условиях Уральской горной страны с запада на восток происходит нарастание континентальности климата, выражающееся в снижении термо- и влагообеспеченности. Так, восточный макросклон Урала имеет низкий гидротермический коэффициент – 1.26 против 1.5–1.6 на западном (Дьяченко, 1997).
Распространение гребенчатого тритона на восточной границе ареала зависит от сочетания комплекса благоприятствующих и лимитирующих факторов. К благоприятным факторам можно отнести наличие достаточно глубоких (более 2 м) приемлемых для нереста водоемов, щелочное pH среды, наличие водной растительности, мест для зимовки в виде карстовых полостей с устойчивыми положительными зимними температурами. Лимитирующими факторами являются: континентальность климата, присутствие в нерестовых водоемах хищных рыб, в первую очередь ротана, антропогенная трансформация местообитаний (Петровский, 2021).
T. cristatus на Среднем Урале редок и исходно распространен мозаично (Литвинчук, Боркин, 2009; Вершинин, Берзин, 2018) в связи с физико-географическими особенностями территории. В настоящее время наблюдается сокращение ареала T. cristatus, связанное с расселением инвазивного вида – P. glehni, а также нарастающей деградацией состояния среды.
Список литературы
Банников А.Г., Даревский И.С., Ищенко В.Г., 1977. Определитель земноводных и пресмыкающихся фауны СССР. М.: Просвещение. 414 с.
Вандышев Д.И., 2019. Хвостатые амфибии водоемов города Челябинска: исследование сокращения их численности // Проба пера. Сборник тезисов докл. школьников – участников XXVI Междунар. науч. конф. “Ломоносов – 2019”. Севастополь. С. 27–30.
Вершинин В.Л., 2007. Амфибии и рептилии Урала. Екатеринбург: Изд-во УрО РАН. 170 с.
Вершинин В.Л., 2015. Основы методологии и методы исследования аномалий и патологий амфибий. Екатеринбург: Изд-во Уральского ун-та. 80 с.
Вершинин В.Л., Берзин Д.Л., 2018. Гребенчатый тритон Triturus cristatus (Laurenti, 1768) // Красная книга Свердловской области: Животные. Растения. Грибы. Екатеринбург; Воронеж: Мир. С. 100.
Гашек В.А., Красуцкий Б.В., 2020. Регистрации редких видов амфибий и рептилий в Челябинской области // Фауна Урала и Сибири. № 1. С. 48–50.
Дьяченко А.П., 1997. Флора листостебельных мхов Урала. Ч. 1. Екатеринбург: Изд-во Урал. гос. ун-та. 264 с.
Житин Ю.Е., Парахневич Т.М., 2003. Ландшафтоведение: Учебное пособие. Воронеж: Воронежский государственный аграрный университет. 218 с.
Ищенко В.Г., 2018. К распространению земноводных и пресмыкающихся в Свердловской области // Фауна Урала и Сибири. № 2. С. 72–74.
Кузьмин С.Л., 2012. Земноводные бывшего СССР. М.: Товарищество научных изданий КМК. 370 с.
Лагунов А.В., Вейсберг Е.И., Захаров В.Д., Куликов П.В., Чичков Б.М., 2006. Особо охраняемые природные территории лесостепной зоны Челябинской области // Степи и лесостепи Зауралья: Материалы к исследованиям. Челябинск: Изд-во “Крокус”. С. 97– 131.
Лада Г.А., Соколов А.С., 1995. Редкие земноводные Центрального Черноземья // Проблемы сохранения разнообразия природы степных и лесостепных регионов. Материалы Рос.-Укр. науч. конф. М.: Товарищество научных изданий КМК. С. 231–232.
Литвинчук С.Н., 2014. Аномалии у двух видов тритонов на северо-западе России: сравнительный анализ // Аномалии и патологии амфибий и рептилий: методология, эволюционное значение, возможность оценки здоровья среды. Материалы междунар. школы-конф. Екатеринбург: Изд-во Урал. ун-та. С. 127–135.
Литвинчук С.Н., Боркин Л.Я., 2009. Эволюция, систематика и распространение гребенчатых тритонов (Triturus cristatus complex) на территории России и сопредельных стран. Спб.: Европейский Дом. 592 с.
Мантейфель Ю.Б., Бастаков В.А., 1989. Земноводные заказника “Глубокое озеро”: численность и особенности поведения // Земноводные и пресмыкающиеся Московской области. М. С. 70–80.
Перепелкин О.Н., 2016. Находки гребенчатого тритона и сибирского углозуба в Кусинском районе Челябинской области // Актуальные вопросы современного естествознания Южного Урала. Челябинск. С. 152–156.
Петровский А.Б., 2021. Современное состояние амфибий на территории “старой” Москвы // Вопросы герпетологии. Прогр. и тез. докл. VIII cъезда Герпетол. общества им. А.Н. Никольского “Современные герпетологические исследования Евразии”. М. С. 22–23.
Поляков В.Е., Гурин А.Е., Ерёменко И.Н., 2018. Новые регистрации охраняемых видов амфибий и рептилий в Свердловской области // Фауна Урала и Сибири. № 2. С. 75–77.
Решетников А.Н., 2003. Влияние ротана Perccottus glenii на амфибий в малых водоемах. Автореф. дис. … канд. биол. наук. М. 24 с.
Сабанеев Л.П., 1874. Позвоночные Среднего Урала и географическое распространение их в Пермской и Оренбургской губерниях. М. 183 с.
Терентьев П.В., Чернов С.А., 1949. Определитель пресмыкающихся и земноводных. М.: Советская наука. 340 с.
Топоркова Л.Я., 1973. Амфибии и рептилии Урала // Фауна европейского Севера, Урала и Западной Сибири. Свердловск. С. 84–117.
Хазиева С.М., Болотников А.М., 1972. Земноводные Пермской области // Учен. зап. Перм. гос. пед. ин-та. Т. 107. С. 54–61.
Чащин С.П., Соловьева Н.С., 1969. Пресмыкающиеся, земноводные и рыбы Пермской области // Календарь-справочник Пермской области на 1970 г. Пермь. С. 176–180.
Чибилев Е.А., 2003. Батрахо- и герпетофауна города Челябинска и окрестностей // Животные в антропогенном ландшафте. Материалы 1 Междунар. науч.-практ. конф. Астрахань: Изд-во Астраханского гос. ун-та. С. 73–76.
Чибилев Е.А., 2005. Данные по герпетофауне Челябинской области с учетом находок сезона 2005 года (с картами распространения). http://www.steppe.ru/ article-topic-3.html
Шарыгин С.А., Ушаков В.А., 1979. Амфибии и рептилии в крупных городах // Эколого-фаунистические исследования в нечерноземной зоне РСФСР. Саранск. Вып. 2. С. 83–96.
Arntzen J.W., 2000. A Growth Curve for the Newt Triturus Cristatus // Journal of Herpetology. V. 34. № 2. P. 227–232.
Arntzen J.W., Kuzmin S., Jehle R., Beebee T., Tarkhnishvili D., Ishchenko V., Ananjeva N., Orlov N., Tuniyev B., Denoël M., Nyström P., Anthony B., Schmidt B., Ogrodowczyk A., 2009. Triturus cristatus // IUCN Red List of Threatened Species. Version 2012.2. – Short citation: Jan Willem Arntzen et al.: e.T22212A9365894. Дата обновления: 07.12.2021.https://doi.org/10.2305/IUCN.UK.2009.RLTS.T22212A9365894
Bailey N.T.J., 1951. On estimating the size of mobile populations from recapture data // Biometrika. V. 38. P. 293–306.
Denoël M., 2012. Newt decline in Western Europe: highlights from relative distribution changes within guilds // Biodiversity and Conservation. V. 21. № 11. P. 2887–2898.
Furtula. M., Ivanović. A., Džukić. G., Kalezić. M. L., 2008. Egg size variation in crested newts from the western Balkans (Caudata, Salamandridae, Triturus cristatus superspecies) // Zoological Studies. V. 47. № 5. P. 585–590.
Griffith R.A., 1984. Seasonal behaviour and intrahabitat movements in an urban population of a Smooth newts, Triturus vulgaris (Amphibia: Salamandridae) // Journal of Zoology. V. 5. № 2. P. 241–251.
Henle K., Dubois A., Vershinin V., 2017. Commented glossary, terminology, and synonymies of anomalies in natural populations of amphibians // Mertensiella. V. 25. P. 9–48.
Petersen C.G.J., 1896. The yearly immigration of young plaice into Limfjord from the German sea // Report Biological station. V. 6. P. 1–48.
Terhivuo J., Mannerkoski I., 2010. Reptiles and amphibians // The 2010 Red List of Finnish Species / Rassi P., Hyvärinen E., Juslén A. & Mannerkoski I. (eds). Ympäristöministeriö & Suomen ympäristökeskus. Helsinki. P. 332–335.
Vuorio V., Reunanen P., Tikkanen O.P., 2016. Spatial Context of Breeding Ponds and Forest Management Affect the Distribution and Population Dynamics of the Great Crested Newt // Annales Zoologici Fennici. V. 53. № 1/2. P. 19–34.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


