Зоологический журнал, 2022, T. 101, № 10, стр. 1140-1154
Половой диморфизм в онтогенезе черной лесостепной гадюки (Pelias berus nikolskii (Vedmederja, Grubant et rudaeva 1986), Serpentes, Viperidae) из Воронежской области на основе традиционных измерений
М. В. Ушаков a, *, Е. Н. Фролова b, **
a Воронежский государственный университет, заповедник “Галичья гора”
399240 Липецкая область, Задонский район, п/о Донское, Россия
b Воронежский государственный университет
394018 Воронеж, Россия
* E-mail: ushakov@dev-reserve.vsu.ru
** E-mail: katerina199128@mail.ru
Поступила в редакцию 24.09.2021
После доработки 03.12.2021
Принята к публикации 14.12.2021
- EDN: JINGQC
- DOI: 10.31857/S0044513422080116
Аннотация
Самцы и самки черной лесостепной гадюки (Pelias berus nikolskii), населяющей Воронежскую область, показывают внешнее сходство. Исследованы различия в онтогенезе 118 самцов и самок, отловленных в 2008–2017 годах в семи местах Воронежской области. Для анализа использованы семь традиционных признаков размеров тела и один рассчитанный признак общего размера головы. По нашим данным, при рождении змея имеет относительно более крупную голову, чем в более позднем возрасте. Размеры головы по отношению к длине тела уменьшаются с возрастом. При рождении самки были крупнее самцов по следующим признакам: относительной ширине головы на уровне глаз, относительной длине пилеуса, относительной длине морды и общему размеру головы. Во взрослом состоянии более высокие значения этих признаков проявляются у самцов. Самцы имеют более длинные хвосты. Различия в длине хвостов появляются при рождении и сохраняются на протяжении роста. Половые различия в ростовых изменениях изучаемых признаков, за исключением различий в длине головы, наибольшей ширине головы и длине хвоста, имеют неаллометрический характер и помимо дородового (т.е. в пренатальный период) расхождения вызваны большей скоростью роста у самцов. Рост хвоста у обоих полов носит, по-видимому, изометрический характер. Правило Ренча предсказывает, что половой диморфизм в размере (SSD) будет положительно коррелировать с размером у таксонов, у которых самцы являются более крупным полом, и отрицательно – у таксонов, у которых более крупным полом являются самки. Изучение аллометрии SSD показало, что с этим правилом согласуются только ширина головы на уровне глаз, длина пилеуса, длина морды и общий размер головы. Поэтому предполагается, что более крупная голова у самцов сформировалась под действием полового отбора. Это может быть связано с необходимостью их участия в поединках за доступ к самке во время брачного сезона.
В некоторых изданиях (например, Дунаев, Орлова, 2012) говорится, что самки гадюк достигают более крупных размеров, чем самцы. При этом Фейрберн (Fairbairn, 1997) указывает на более крупные размеры у самцов гадюковых змей. Однако в таких публикациях возраст змей не приводится. Поэтому неясно, чем вызваны различия в размерах у особей разного пола.
Половой диморфизм, будучи следствием разграничения репродуктивной роли полов, проявляется в их морфологических различиях. Различия в органах и структурах, влияющих на успешность спаривания, нашли свое выражение в правиле Ренча, или Ренша (Rensch’s rule). Ренч утверждал, что половой диморфизм усиливается с увеличением размеров организма (Rensch, 1950). Несмотря на широкое подтверждение правила (например, Blanckenhorn et al., 2007; Ceballos et al., 2013; Liao, Chen, 2012; Székely et al., 2004), его распространенность ставится под сомнение (например, Abouheif, Fairbairn, 1997; Fairbairn, 1997; Webb, Freckleton, 2007).
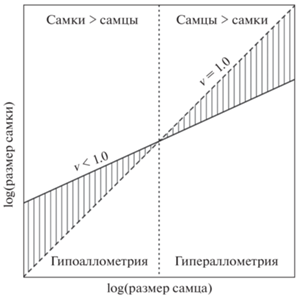
Правило Ренча связано с аллометрическим отношением между размерами двух полов (рис. 1; Fairbairn, 1997; Fairbairn, Preziosi, 1994). Оно предсказывает, что половой диморфизм в размерах (sexual size dimorphism, SSD) будет положительно коррелировать с размером тела (гипераллометрия) у таксонов, у которых самцы являются более крупным полом, и отрицательно коррелировать с размером тела (гипоаллометрия) у таксонов, у которых более крупным полом являются самки (рис. 1). В этом случае наблюдается бóльшая изменчивость самцов, чем самок. Однако если SSD положительно коррелирует с размером тела у таксонов, у которых более крупным полом являются самки, то характер аллометрии будет обратным и не будет соответствовать правилу Ренча. В этом случае более изменчивыми являются самки.
Рис. 1.
Количественное представление правила Ренча (по: Fairbairn, Preziosi, 1994 и Fairbairn, 1997). Общей моделью аллометрии для SSD является размер самки = = b(размер самца)v (Leutenegger, 1978; LaBarbera, 1989). Аллометрический показатель степени v представляет собой наклон регрессии log(размер самки) от log(размер самца). Прерывистая линия с наклоном равным 1.0 определяет соотношение размеров 1 : 1. Сплошная линия показывает v < 1.0, а вертикальная штриховка – степень SSD. Если самки крупнее самцов и v < 1.0, то SSD уменьшается по мере увеличения в размере (гипоаллометрия). Если самцы крупнее самок, то v < 1.0 дает положительную корреляцию между размером и SSD (гипераллометрия). По всему диапазону размеров самцов и самок изменения в размере самцов больше изменений в размере самок. Регрессия log(размер самца) от log(размер самки) дает такое же заключение, но v будет > 1. Если v > 1.0 (пунктирно-точечная линия), то аллометрия для SSD носит обратный характер и не согласуется с правилом Ренча. В этом случае размер самки изменяется больше, чем размер самца.
Посредством анализа аллометрии исследуется изменение формы (измерения, не являющегося размером организма) в ответ на изменение размера организма. Можно выделить три типа аллометрии. Эволюционная аллометрия (evolutionary allometry) описывает изменение формы на одной возрастной стадии между родственными таксонами. Она устанавливает тенденции изменения формы в ходе эволюции. Для анализа SSD в основном используются средние размеры взрослых организмов. Для организмов с конечным ростом (например, птицы, млекопитающие) здесь нет проблемы. Но организмы с продолжающимся ростом (например, рыбы, пресмыкающиеся) нужно сравнивать при одинаковом возрасте, т.к. выборка взрослой стадии может состоять из животных разного возраста и соответственно разного размера и поэтому может давать неправильные представления о половом диморфизме. Например, в приводимом выше исследовании (Fairbairn, 1997) не указывается, для какого возраста установлены половые различия в размерах гадюковых змей.
Онтогенетическая аллометрия (ontogenetic allometry), или аллометрия роста (growth allometry), описывает изменение формы с изменением размера организма11. В контексте статьи она описывает формирование половых различий в ходе развития. Статическая аллометрия (static allometry) описывает изменение формы между особями одной возрастной стадии. Считается, что статическая аллометрия отражает действие полового отбора в формировании полового диморфизма (Clutton-Brock et al., 1977; Fairbairn, Preziosi, 1994; Leutenegger, 1978; Smith, 1977; Webster, 1992). Однако такая точка зрения оспаривается (Bonduriansky, 2007).
Линия онтогенетической аллометрии представляет собой траекторию онтогенеза. Онтогенетическая аллометрия является частью гетерохронии, которая помимо осей формы и размера имеет еще и ось возраста (Alberch et al., 1979). К аллометрическим исследованиям часто прибегают из-за отсутствия информации о возрасте. Однако прямая линия в пространстве “размер–форма” в пространстве “размер–форма–возраст” в силу нелинейности связи между размером и возрастом приобретает форму кривой. Трехмерное пространство охватывает разные варианты онтогенеза, но изменения в сравниваемых траекториях являются гетерохронными и аллометрическими лишь тогда, когда траектории совпадают в положениях и направлениях.
Объектом наших исследований является черная лесостепная гадюка, или гадюка Никольского (Pelias berus nikolskii (Vedmederja, Grubant et Rudaeva 1986)), – одна из двух видов гадюк, встречающихся в Воронежской обл. (Ушаков и др., 2006; Ушаков, Зиненко, 2013). Черная лесостепная гадюка населяет главным образом пойменные леса. Внешние половые различия, за исключением в длине хвоста, не заметны. В Воронежской обл. часть самок имеет красную радужку глаза. У самцов радужка глаза всегда черная. Самки также могут иметь красно-коричневые пятна на голове, главным образом на нижней челюсти; иногда встречаются взрослые особи, имеющие тело красно-коричневого цвета с неясным черным рисунком на спине. Однако подавляющая часть самок и все встреченные самцы имеют меланистическую окраску тела.
У нас нет информации о возрасте змей, но мы исходим из предположения, что в силу генетических корреляций возрастные изменения в росте самцов и самок P. berus nikolskii различаются слабо. Поэтому работа будет ограничена анализом аллометрии. Есть и другие доводы в пользу такого решения. Анализ аллометрии позволяет исследовать связь между формой и размером. Размер является не только заменителем хронологического (календарного) возраста22, но и предоставляет информацию о биологическом (развитийном) возрасте33 (Zelditch et al., 2012). Кроме того, математическая модель для аллометрии является решением разностного уравнения скорости роста в зависимости от времени, и для описания характера роста хронологическое время не имеет теоретического преимущества перед другими оценками биологического возраста, включая размер (Strauss, 1987).
Задачей работы является аллометрическое описание характера роста двух полов и полового диморфизма P. berus nikolskii из Воронежской обл.
МАТЕРИАЛ
Черную лесостепную гадюку отлавливали с 2008 по 2017 годы на территории Воронежской обл. (рис. 2). За период исследований выборки были взяты из семи разных мест. Всего было отловлено 118 особей, из них 84 самца и 34 самки (табл. 1).
Рис. 2.
Места взятия выборок Pelias berus nikolskii в Воронежской области: 1 – Борисоглебский городской округ, окр. пос. Мировой Октябрь, 51°19ʹ56ʺ с.ш. и 42°09ʹ44ʺ в.д., 2-4 – окр. с. Богана, 51°30ʹ24ʺ с.ш. и 42°11ʹ23ʺ в.д., 51°31ʹ20ʺ с.ш. и 42°11ʹ51ʺ в.д., 5 – Новоусманский район, окр. пос. Маклок, 51°48ʹ45ʺ с.ш. и 39°24ʹ13ʺ в.д., 9 – Аннинский район, окр. пос. Анна, 51°26ʹ42ʺ с.ш. и 40°28ʹ59ʺ в.д., 10 – Бобровский район, Хреновской бор, 51°04ʹ05ʺ с.ш. и 40°07ʹ00ʺ в.д. Координаты даны в проекции WGS 84 (World Geodetic System 1984).
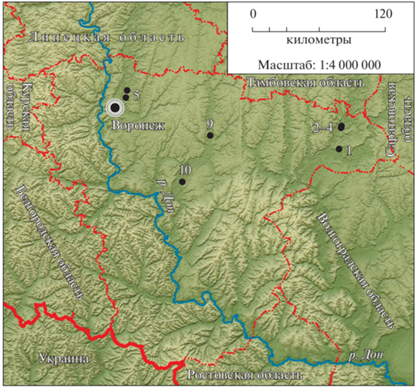
Таблица 1.
Статистические сведения о собранных измерениях Pelias berus nikolskii из Воронежской области
| Признак, мм | Пол | Число особей | Наименьшее значение | Наибольшее значение |
|---|---|---|---|---|
| L. | Самцы | 77 | 244 | 652 |
| Самки | 24 | 178 | 665 | |
| L.cd. | Самцы | 77 | 40 | 109 |
| Самки | 23 | 26 | 88 | |
| L.cm. | Самцы | 76 | 12.7 | 23.8 |
| Самки | 24 | 11.9 | 24.2 | |
| L.at.cm. | Самцы | 77 | 7.6 | 14.5 |
| Самки | 22 | 6.9 | 14.8 | |
| L.at.m. | Самцы | 77 | 5.0 | 10.7 |
| Самки | 23 | 5.5 | 10.0 | |
| L.pil. | Самцы | 72 | 9.7 | 17.9 |
| Самки | 24 | 8.0 | 17.5 | |
| L.m. | Самцы | 77 | 3.8 | 8.5 |
| Самки | 24 | 3.4 | 7.5 |
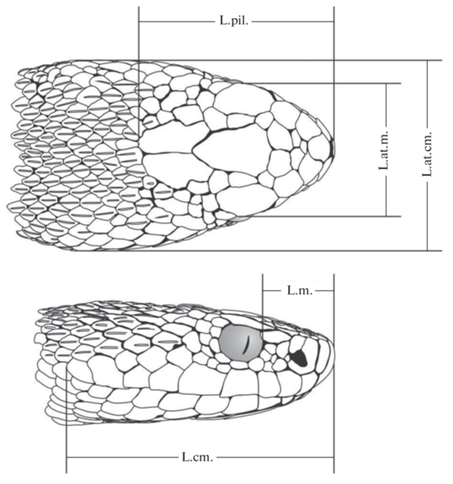
У отловленных змей были измерены: L. – длина туловища (от кончика морды до переднего края клоакального отверстия), L.cd. – длина хвоста (от переднего края клоакального отверстия до кончика хвоста), L.cm. – длина головы (от кончика морды до заднего края последнего верхнегубного щитка), L.at.cm. – наибольшая ширина головы, L.at.m. – ширина головы на уровне глаз (между внешними краями надглазничных щитков), L.pil. – длина пилеуса (от кончика морды до заднего края теменных щитков), L.m. – длина морды (от переднего края глаза до кончика морды) (рис. 3). Также рассчитывали общий размер головы, HeadSize, по методу геометрического среднего Мосиманна (Mosimann, 1970) путем вычисления корня в пятой степени из произведения пяти измерений головы. Измеренных рептилий возвращали в среду своего обитания.
МЕТОДЫ
Аллометрическое изменение в размере поддерживает функциональную равнозначность по всему диапазону размеров для таких основных физических свойств, как отношение площади поверхности к объему (Zelditch et al., 2012). Оно связывает увеличение в размере одной части тела с изменением в размере другой и описывается моделью степенного закона Y = bX k (Huxley, 1932), где k является скоростью роста части Y по отношению к скорости роста размера X, а b является размером Y при единичном размере X. Для упрощения подгонки к данным модель представляют в линейном виде: log(Y) = log(b) + k log(X). Поэтому в статье используются размеры, преобразованные в результате взятия натурального логарифма (log) числа. Используемая для подгонки к данным простая линейная регрессия методом наименьших квадратов (Ordinary Least Squares [OLS] regression, модель I) во многих случаях изучения аллометрии является приемлемой. Но так как она может давать искаженные значения оцениваемых коэффициентов (McArdle, 1988; Sokal, Rohlf, 1995), что является существенным недостатком для применения к аллометрии SSD, то для подгонки к данным использовалась регрессия методом сокращенной главной оси (Reduced Major Axis [RMA] regression, модель II) (Ricker, 1984). Ее коэффициент вычисляется как отношение стандартных отклонений двух размеров и связан с коэффициентом регрессии OLS с помощью выражения ${v} = \frac{{{{\sigma }_{Y}}}}{{{{\sigma }_{X}}}} = \frac{k}{R}$, где σY и σX – стандартные отклонения размеров Y и X соответственно, k – коэффициент регрессии OLS, R – коэффициент корреляции двух размеров. Свободный член регрессии вычисляется обычным способом: $b = \overline Y - {v}\overline X $, где $\overline Y $ и $\overline X $ являются средними значениями размеров Y и X. Если коэффициент аллометрии v > 1, то рост является положительным аллометрическим (positively allometric); если v < 1, то рост является отрицательным аллометрическим (negatively allometric). Если v = 1, то аллометрия отсутствует и рост является изометрическим (isometric).
Для каждого из полов траектории онтогенетической аллометрии вычислялись отдельно. При этом рассчитывали два варианта: в первом варианте в качестве размера (X) была взята длина тела, log(L.), во втором варианте – общий размер головы, log(HeadSize). Формой (Y) в первом варианте были все измеренные признаки (кроме длины тела) плюс общий размер головы, во втором варианте – только пять признаков головы. Для проверки коэффициента на отличие от единицы вычислялись 95% доверительные интервалы v ± ts, где t – статистика Стьюдента для $\frac{{\alpha = 0.05}}{2}$ уровня значимости с N – 1 степенями свободы, а $s = \sqrt {\frac{{{{{v}}^{2}}(1 - {{R}^{2}})}}{{N - 2}}} $, где R – корреляция между формой и размером, N – объем выборки (Ricker, 1984). Если доверительный интервал коэффициентов включал единицу, то рост рассматривался как возможный изометрический. Для вычисления угла между онтогенетическими траекториями двух полов сначала определялась разница коэффициентов (тангенс угла) двух регрессий $\kappa = \frac{{\left| {{{{v}}_{{\text{f}}}} - {{{v}}_{{\text{m}}}}} \right|}}{{{\text{1}} + {{{v}}_{{\text{m}}}}{{{v}}_{{\text{f}}}}}}$, где m обозначает самцов, f – самок. Сам угол вычислялся по формуле: ${\text{arctg}}(\kappa )\frac{{180}}{\pi }$. Корреляция между траекториями равна cos(arctg(κ)). Проверку значимости угла проводили с использованием бутстрэп-процедуры остатков (Zelditch et al., 2012). Для этого для формы для каждого пола вычислялись остатки от соответствующей регрессии RMA. Затем формировалась псевдовыборка путем случайного выбора остатка (с возвращением в исходный набор) и его добавления к предсказанному значению формы, и так для каждого значения размера. После этого для псевдовыборки вычислялась регрессия RMA от размера с последующим определением ее коэффициента. Эти действия повторялись отдельно для самцов и самок 1000 раз. В итоге для каждого пола было получено по 1000 бутстрэп-коэффициентов регрессий. Для них были определены 95% диапазоны. Угол между наклонами линий регрессий для каждого пола рассчитывался между пограничными значениями коэффициентов диапазона. Угол между двумя онтогенетическими траекториями считался значимым на 5% уровне, если он превышал углы между наклонами линий регрессий у каждого пола.
Для сравнения величин признаков (форм) у змей при рождении к остаткам, полученным на предыдущем шаге, были добавлены предсказанные значения, рассчитанные для самых молодых змей, т.е. для длины тела, равной log(170 мм). Вычислялась наблюдаемая разница между средними значениями признаков двух полов. Далее к сравниваемым выборкам был применен перестановочный тест, когда обе выборки объединялись в одну, а затем объединенная выборка случайным образом разделялась на две псевдовыборки, имеющие размеры исходных выборок. Вычислялась разница между средними значениями псевдовыборок. Эта процедура повторялась 1000 раз. Затем подсчитывалось количество пар псевдовыборок ϖ, у которых разница между средними значениями была больше или равна наблюдаемой. Вероятность принятия нулевой гипотезы о том, что выборки взяты из одной совокупности, оценивалась по формуле $p = \frac{{\varpi + 1}}{{B + 1}}$, где B = 1000 – количество пар псевдовыборок (Davison, Hinkley, 1997; Шитиков, Розенберг, 2013).
Для количественного измерения полового диморфизма преимущественно применяется индекс полового диморфизма (sexual dimorphism index, SDI), предложенный Ловичем и Гиббонсом (Lovich, Gibbons, 1992). Однако мы использовали видоизмененный нами индекс Сторера (Storer, 1966). Наша модификация
Также вычислялись траектории аллометрии SSD путем построения регрессии RMA размеров самок от размеров самцов.
Для вычисления и SDI и траекторий аллометрии SSD использовались остатки, полученные при вычислении траекторий онтогенетической аллометрии, к которым добавлялись предсказанные значения признаков и общего размера головы для логарифмически преобразованных длин тела в 200, 300, 400, 500, 600 и 700 мм, т.е. для 5.298, 5.704, 5.991, 6.215, 6.397 и 6.551. Полученные для обоих полов значения для шести наборов данных затем в каждом наборе усреднялись и использовались для вычисления индекса и построения аллометрической траектории. Значимостью отклонения линии аллометрии SSD от единицы являлась вычисленная ранее значимость угла между онтогенетическими траекториями двух полов.
Все расчеты производились в PTC Mathcad 6.0, для которого были написаны соответствующие алгоритмы.
РЕЗУЛЬТАТЫ
Рост длины хвоста, log(L.cd.), по отношению к росту тела, log(L.), у обоих полов видимо является изометрическим, т.е. величина формы вместе с размером изменяется пропорционально (табл. 2). Измерения головы и общий размер головы проявляют отрицательный аллометрический рост, т.е. с увеличением размера тела относительные размеры формы уменьшаются. По отношению к log(HeadSize) возможный изометрический рост у обоих полов показывают длина головы, log(L.cm.), и длина пилеуса, log(L.pil.) (табл. 3). Однако рост других признаков у самцов и самок различается. Рост у самцов наибольшей ширины головы, log(L.at.cm.), и длины морды, log(L.m.), показывает положительную аллометрию, а у самок видимо является изометрическим. Рост ширины головы на уровне глаз, log(L.at.m.), у самцов, по-видимому, является изометрическим, а у самок является отрицательно аллометрическим.
Таблица 2.
Параметры онтогенетической аллометрии [регрессия RMA log(форма) от log(длина тела)] для самцов (N = 71) и самок (N = 20) Pelias berus nikolskii из Воронежской области
| Форма | Самцы | Самки | ||||
|---|---|---|---|---|---|---|
| v | c.f. (v) | b | v | c.f. (v) | b | |
| L.cd. | 1.035 | 0.947–1.122 | –2.051 | 0.991 | 0.893–1.088 | –2.009 |
| HeadSize | 0.640 | 0.593–0.688 | –1.552 | 0.556 | 0.475–0.637 | –1.065 |
| L.cm. | 0.632 | 0.577–0.686 | –0.949 | 0.575 | 0.472–0.678 | –0.628 |
| L.at.cm. | 0.708 | 0.633–0.783 | –1.902 | 0.657 | 0.504–0.811 | –1.610 |
| L.at.m. | 0.673 | 0.612–0.734 | –2.038 | 0.507 | 0.398–0.616 | –1.065 |
| L.pil. | 0.637 | 0.566–0.707 | –1.288 | 0.520 | 0.424–0.615 | –0.601 |
| L.m. | 0.752 | 0.655–0.850 | –2.817 | 0.672 | 0.523–0.821 | –2.377 |
Таблица 3.
Параметры онтогенетической аллометрии [регрессия RMA log(форма) от log(HeadSize)] для самцов (N = 71) и самок (N = 20) Pelias berus nikolskii из Воронежской области
| Форма | Самцы | Самки | ||||
|---|---|---|---|---|---|---|
| v | c.f. (v) | b | v | c.f. (v) | b | |
| L.cm. | 0.986 | 0.919–1.054 | 0.581 | 1.034 | 0.925–1.143 | 0.474 |
| L.at.cm. | 1.105 | 1.016–1.194 | –0.187 | 1.128 | 0.988–1.268 | –0.213 |
| L.at.m. | 1.051 | 0.967–1.134 | –0.407 | 0.873 | 0.759–0.988 | 0.001 |
| L.pil. | 0.994 | 0.917–1.071 | 0.255 | 1.042 | 0.915–1.168 | 0.133 |
| L.m. | 1.175 | 1.065–1.284 | –0.994 | 1.112 | 0.943–1.282 | –0.850 |
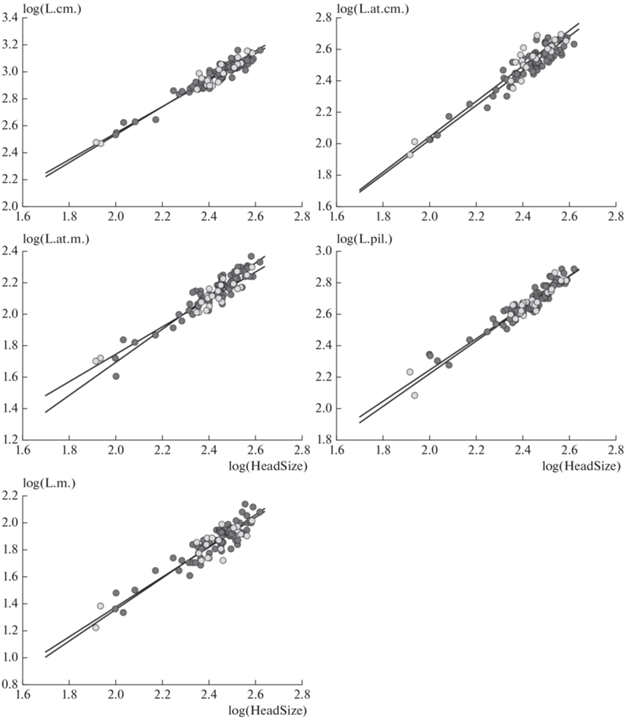
Сравнение онтогенетических траекторий (размером является длина тела, log(L.)) не выявило различий в их направлениях у обоих полов для длины хвоста, log(L.cd.), длины головы, log(L.cm.), и наибольшей ширины головы, log(L.at.cm.) (табл. 4, рис. 4). При этом траектории для длины хвоста у самцов и самок являются скорее параллельными, чем совпадающими, что характерно для аллометрии с переносом или транспозиционной аллометрии (transpositional allometry). Во всех других случаях направления онтогенетических траекторий между полами различаются. У самцов и самок, по-видимому, совпадают траектории, связанные с размерами головы (за исключением ширины головы на уровне глаз, log(L.at.m.)), когда размером выступает log(HeadSize) (табл. 5, рис. 5). Половые различия при наименьшем размере тела, т.е. при L. = 170 мм, отмечены для всех рассматриваемых признаков, за исключением длины морды, log(L.m.) (табл. 4). Во всех случаях онтогенетические траектории показывали высокую корреляцию между полами (табл. 4, 5).
Таблица 4.
Сравнение онтогенетических траекторий [регрессий RMA log(форма) от log(длина тела)] самцов (N = 71) и самок (N = 20) Pelias berus nikolskii из Воронежской области
| Форма | Межполовой угол между онтогенетическими траекториями, в градусах | Внутриполовой угол между онтогенетическими траекториями, в градусах | Корреляция между полами | Значимость различий между полами при наименьшем размере тела | |
|---|---|---|---|---|---|
| самцы | самки | ||||
| L.cd. | 1.254 | 2.744 | 2.875 | 1.000 | 0.001 |
| HeadSize | 3.583 | 2.648 | 2.453 | 0.998 | 0.001 |
| L.cm. | 2.393 | 2.780 | 2.675 | 0.999 | 0.023 |
| L.at.cm. | 1.958 | 2.678 | 2.509 | 0.999 | 0.041 |
| L.at.m. | 7.074 | 2.535 | 2.293 | 0.992 | 0.001 |
| L.pil. | 5.025 | 2.722 | 2.561 | 0.996 | 0.001 |
| L.m. | 3.057 | 2.370 | 2.115 | 0.999 | 0.196 |
Рис. 4.
Онтогенетические траектории самцов (темные кружки) и самок (светлые кружки) P. berus nikolskii для длины хвоста, L.cd., общего размера головы, HeadSize, и шести измерений головы из рис. 3. В качестве размера используется длина тела, L.
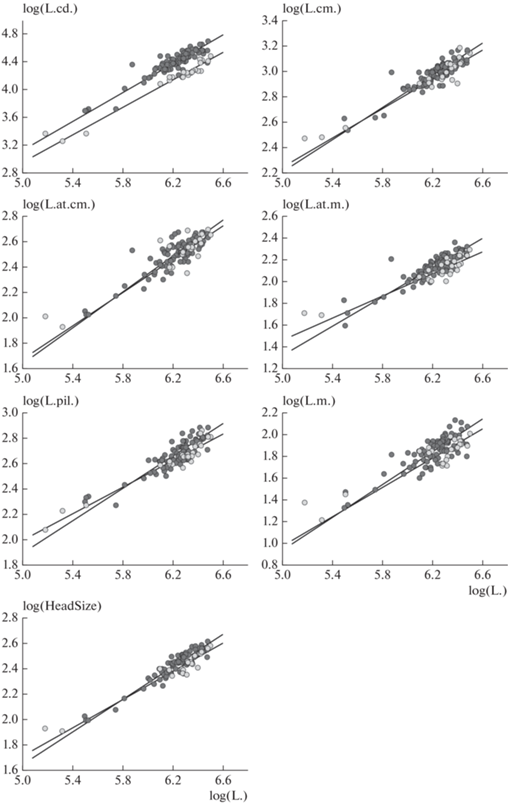
Таблица 5.
Сравнение онтогенетических траекторий [регрессий RMA log(форма) от log(HeadSize)] самцов (N = 71) и самок (N = 20) Pelias berus nikolskii из Воронежской области
| Форма | Межполовой угол между онтогенетическими траекториями, в градусах | Внутриполовой угол между онтогенетическими траекториями, в градусах | Корреляция между полами | |
|---|---|---|---|---|
| самцы | самки | |||
| L.cm. | 1.362 | 2.743 | 2.966 | 1.000 |
| L.at.cm. | 0.591 | 2.775 | 2.785 | 1.000 |
| L.at.m. | 5.293 | 2.798 | 2.681 | 0.996 |
| L.pil. | 1.344 | 2.736 | 2.774 | 1.000 |
| L.m. | 1.546 | 2.764 | 2.562 | 1.000 |
Рис. 5.
Онтогенетические траектории самцов (темные кружки) и самок (светлые кружки) P. berus nikolskii для шести измерений головы из рис. 3. В качестве размера используется общий размер головы, HeadSize.
На рис. 6 приводятся изменения индексов полового диморфизма (SDI) с увеличением размера тела, log(L.). На всем протяжении развития индекс показывает довольно устойчивые различия между полами в относительной длине хвоста, L.cd., с более крупными его размерами у самцов. Изменения в индексе для общего размера головы, HeadSize, отражают общие изменения в половых различиях признаков головы. Они состоят в том, что при наименьших размерах тела значения признаков головы являются бóльшими у самок, с увеличением размеров змей бóльшими значения становятся у самцов. Такой характер возрастных изменений находит отражение и в аллометрии SSD (табл. 6, рис. 7).
Рис. 6.
Изменение индекса полового диморфизма (SDI) с увеличением размера тела, L., P. berus nikolskii. Пунктирная линия при SDI = 0 указывает на отсутствие половых различий.
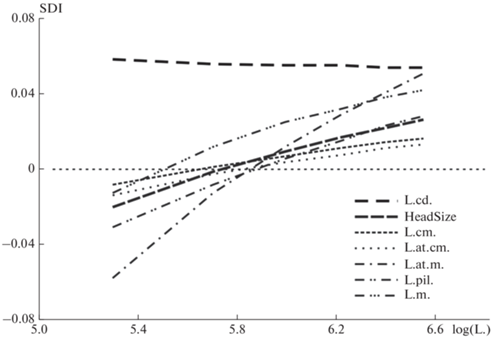
Таблица 6.
Параметры аллометрии полового диморфизма в размере [регрессия RMA log(форма самки) от log(форма самца)] Pelias berus nikolskii из Воронежской области
| Форма | v | b |
|---|---|---|
| L.cd. | 0.958 | –0.048 |
| HeadSize | 0.867 | 0.283 |
| L.cm. | 0.910 | 0.236 |
| L.at.cm. | 0.930 | 0.155 |
| L.at.m. | 0.753 | 0.468 |
| L.pil. | 0.817 | 0.448 |
| L.m. | 0.867 | 0.283 |
Примечания. v – коэффициент аллометрии, b – свободный член. Если направления онтогенетических траекторий в табл. 4 не различаются, то коэффициент v не отличается от единицы.
Рис. 7.
Аллометрия полового диморфизма в размерах (SSD) P. berus nikolskii. Тонкая линия показывает изометрию. Толстая линия с кружками показывает наблюдаемые результаты.
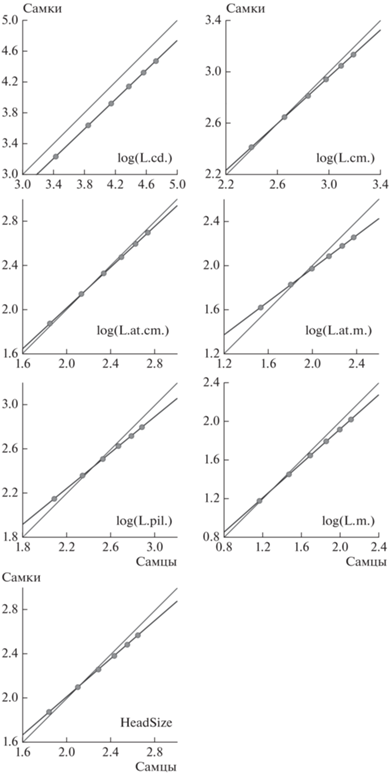
Из всех признаков аллометрические отношения между полами выявлены только для log(HeadSize), log(L.at.m.), log(L.pil.) и log(L.m.). Для них отмечена отрицательная аллометрия, характерная для правила Ренча.
ОБСУЖДЕНИЕ
Сравнение онтогенетических траекторий говорит о высокой коррелированности развития самцов и самок черной лесостепной гадюки, что может быть объяснено генетической корреляцией.
Бóльшая длина хвоста у самцов по сравнению с самками змей является довольно распространенной чертой (Gregory, 2004; Lucchini et al., 2020; Silva et al., 2017; Tamagnini et al., 2018). Мы нашли, что характер роста хвоста у обоих полов P. berus nikolskii, по всей видимости, является случаем аллометрии с переносом. Устойчивые половые различия в его длине говорят о том, что самцы и самки рождаются с хвостами разной длины и расхождение в их размерах происходит в период дородового (пренатального) развития. После рождения хвосты змей разных полов растут практически с одинаковой скоростью. Кингом (King, 1989) было выдвинуто несколько объяснений для полового диморфизма у змей. Одним из объяснений более длинного хвоста у самцов считается необходимость вмещения гемипенисов и их втягивающих мышц. Но такое предположение нашло подтверждение лишь для короткохвостых видов, когда репродуктивные органы ограничивают наименьший размер хвоста. Лоуинг и др. (Lawing et al., 2012) связывают длину хвоста с подвижностью и маневренностью змей и для их оценивания использовали индекс L.cd./L. У американских полуроющих змей этот индекс был ниже 0.05 (род Typhlops), а у древесных – достигал почти 0.50 (роды Leptophis и Uromacer). Широкая изменчивость длин хвостов, очевидно связанная с их функциями, ограничивает применимость первого объяснения Кинга. Черная лесостепная гадюка является засадным охотником, добычу активно не преследует и не имеет относительно длинного хвоста; среднее значение индекса у самцов составило 0.16 ± 0.001 (N = 77), у самок – 0.13 ± 0.002 (N = 23). Другая предложенная Кингом (1989) гипотеза состояла в том, что более длинный хвост у самцов помогает в их ухаживании за самкой и таким образом способствует спариванию. Эта гипотеза Кингом подтверждена не была, но Шайн и др. (Shine et al., 1999) нашли практические свидетельства в ее пользу. Также длина хвоста может быть важна во время ритуальных боев между самцами в период спаривания. Однако, по-видимому, изометрический рост хвоста может указывать на отсутствие давления естественного отбора на размер органа в процессе онтогенеза. Третье объяснение, данное Кингом (1989), заключается в том, что у самок уменьшение в длине хвоста связано с увеличением их репродуктивной способности. Среди 56 проанализированных родов змей из семейства Colubridae он нашел отрицательную связь между половым диморфизмом в длине тела и половым диморфизмом в длине хвоста. Мы полагаем, что уменьшение длины хвоста у самок может быть вызвано бóльшими, чем у самцов затратами на воспроизводство.
Все признаки головы, а также общий размер головы показывают отрицательную онтогенетическую аллометрию. Гадюки рождаются с относительно более крупными головами, и относительные размеры головы по мере роста уменьшаются. При этом изменения в общем размере головы сопряжены с изменениями всех ее измерений, за исключением ширины головы на уровне глаз. Длина головы и наибольшая ширина головы у обоих полов растут с одинаковой скоростью, рост значений других признаков, а также общего размера головы, у самцов происходит с более высокой скоростью, чем у самок. При рождении значения всех признаков (кроме длины головы и наибольшей ширины головы), а также общего размера головы были больше у самок, чем у самцов. Как и в случае с хвостами это указывает на дородовое расхождение онтогенетических траекторий. Отсюда онтогенетические траектории являются сходящимися, утрачивая половые различия при длине тела в 330–350 мм (для признака длины морды длина тела составляла около 250 мм), затем траектории расходятся, приводя к усилению полового диморфизма в признаках с их более высокими значениями у самцов. Это говорит о неаллометрическом характере различий в онтогенезах двух полов. Изменения в длине головы и наибольшей ширине головы у самцов и самок происходят вдоль сходных траекторий развития. Однако мы не можем сказать, существуют ли половые различия в траекториях, т.к. для этого необходимы данные по размеру самцов и самок при рождении и при наибольшем возрасте своей жизни.
Относительно более крупные размеры головы в раннем возрасте исследователи (King et al., 1999) пытаются объяснить более широким спектром потребляемой пищи, необходимой для развития. Однако различия между полами остаются неясными. Во взрослом состоянии, согласно нашим результатам, самцы P. berus nikolskii по сравнению с самками предрасположены иметь по ряду параметров (общий размер головы, ширина головы на уровне глаз, длина пилеуса и длина морды) более крупные головы. Предполагается, что более крупные головы у самцов могут быть связаны с необходимостью участвовать в поединках с другими самцами за доступ к самкам во время брачного периода (Tomović et al., 2002).
Согласно Зельдич и др. (Zelditch et al., 2012) размещение коэффициентов онтогенетической аллометрии на схематическом теле змей позволяет увидеть их пространственную связность (рис. 8). Фуиман (Fuiman, 1983) нашел, что характер пространственного роста молоди рыб носит обратный характер по отношению к пространственному росту личинок, т.е. аллометрический рост молоди уравновешивается аллометрическим ростом личинок. Исходя из этого, можно дать развитийное толкование аллометрическим коэффициентам. Полученные нами аллометрические коэффициенты с наименьшими значениями принадлежат признакам головы (ширина головы на уровне глаз, длина головы и длина пилеуса), описывающим рост мозгового черепа. Это говорит о том, что мозговой череп после рождения змей растет медленнее других частей тела. Но это также говорит о том, что в дородовой период мозговой череп рос более быстрыми темпами по отношению к остальному телу. Таким образом, этот процесс связан с развитием мозга, отвечающим за поведение и выполнение организмом основных функций. Дородовое развитие мозга, вызывающее рост мозгового черепа и сопряженных с ним частей головы, приводит к формированию при рождении относительно более крупных голов.
Проведенное исследование показывает, что из всех изученных характеристик тела с правилом Ренча согласуются только ширина головы на уровне глаз, длина пилеуса, длина морды и общий размер головы. При этом при длине тела менее 330–350 мм (для длины морды – приблизительно 250 мм) наблюдается гипоаллометрия SSD с бóльшими значениями признаков у самок. И, наоборот, при длине тела, превышающей указанную величину, наблюдается гипераллометрия SSD с бóльшими значениями тех же признаков у самцов. Предполагается, что аллометрия SSD, согласующаяся с правилом Ренча, эволюционирует в ответ на половой отбор самцов (Clutton-Brock, 1985; Leutenegger, 1978; Webster, 1992; Fairbairn, Preziosi, 1994). Здесь мы вынуждены повторить, что самцы черной лесостепной гадюки участвуют в поединках за доступ к самкам и, видимо, особи с более массивными головами имеют больше шансов оставить свое потомство. Аллометрия SSD, согласующаяся с правилом Ренча, также указывает на бóльшую изменчивость признаков у самцов. В свою очередь, бóльшая изменчивость самцов поддерживает представления Геодакяна (1965, 1972) о том, что самцы представляют собой полигон естественного отбора и определяют направление изменения признака в филогенезе.
ЗАКЛЮЧЕНИЕ
Наши результаты свидетельствуют о том, что при рождении молодые гадюки имеют относительно более длинные и широкие головы, причем у самок головы крупнее, чем у самцов. В дальнейшем относительные размеры головы уменьшаются, голова становиться более сжатой. У самок этот процесс оказывается выраженным сильнее, в результате чего головы у самцов становятся больше и шире, чем у самок. Но такие различия, видимо, должны наблюдаться у более возрастных особей. Для полового диморфизма у P. berus nikolskii нами выявлено два источника: дородовое расхождение в развитии и разные скорости роста. Аллометрия SSD показала, что в целом лишь различия в размерах головы могут быть объяснены половым отбором самцов. Хотя для большей надежности также желательно проводить анализ статической аллометрии.
Список литературы
Геодакян В.А., 1965. Роль полов в передаче и преобразовании генетической информации // Проблемы передачи информации. Т. 1. Вып. 1. С. 105–112.
Геодакян В.А., 1972. О структуре эволюционирующих систем // Проблемы кибернетики. Вып. 25. М.: Наука. С. 81–91.
Дунаев Е.А., Орлова В.Ф., 2012. Земноводные и пресмыкающиеся России. Атлас-определитель. М.: Фитон+. 320 с.
Ушаков М.В., Зиненко А.И., 2013. Подвидовая принадлежность обыкновенной гадюки (Serpentes: Viperidae) из Воронежской и Липецкой областей // Вестник Тамбовского университета. Серия Естественные и технические науки. Тамбов. Т. 18. Вып. 6. С. 3093–3097.
Ушаков М.В., Климов А.С., Ткаченко А.В., 2006. К изучению распространения восточной степной гадюки, Vipera renardi (Christoph, 1861), в Воронежской области // Актуальные проблемы герпетологии и токсинологии. Сборник научных трудов. Вып. 9. Тольятти. С. 172–175.
Шитиков В.К., Розенберг Г.С., 2013. Рандомизация и бутстреп: статистический анализ в биологии и экологии с использованием R. Тольятти: Кассандра. 314 с.
Abouheif E., Fairbairn D.J., 1997. A Comparative Analysis of Allometry for Sexual Size Dimorphism: Assessing Rensch’s Rule // The American Naturalist. V. 149. № 3. P. 540–562. https://doi.org/10.1086/286004
Alberch P., Gould S.J., Oster G.F., Wake D.B., 1979. Size and Shape in Ontogeny and Phylogeny // Paleobiology. V. 5. № 3. P. 296–317. https://doi.org/10.1017/S0094837300006588
Blanckenhorn W.U., Dixon A.F.G., Fairbairn D.J., Foellmer M.W., Gibert P., Van Der Linde K., Meier R., Nylin S., Pitnick S., Schoff C., Signorelli M., Teder T., Wiklund C., 2007. Proximate Causes of Rensch’s Rule: Does Sexual Size Dimorphism in Arthropods Result from Sex Differences in Development Time? // The American Naturalist. V. 169. № 2. P. 245–257. https://doi.org/10.1086/510597
Ceballos C.P., Adams D.C., Iverson J.B., Valenzuela N., 2013. Phylogenetic Patterns of Sexual Size Dimorphism in Turtles and Their Implications for Rensch’s Rule // Evolutionary Biology. V. 40. № 2. P. 194–208. https://doi.org/10.1007/s11692-012-9199-y
Clutton-Brock T.H., 1985. Size, Sexual Dimorphism, and Polygyny in Primates // Size and scaling in primate biology. MA, Boston: Springer. P. 51–60. https://doi.org/10.1007/978-1-4899-3647-9_4
Clutton-Brock T.H., Harvey P.H., Rudder B., 1977. Sexual Dimorphism, Socionomic Sex Ratio and Body Weight in Primates // Nature. V. 269. № 5631. P. 797–800. https://doi.org/10.1038/269797a0
Davison A., Hinkley D., 1997. Bootstrap Methods and Their Application (Cambridge Series in Statistical and Probabilistic Mathematics). Cambridge: Cambridge University Press. 582 p.
Fairbairn D.J., 1997. Allometry for Sexual Size Dimorphism: Pattern and Process in the Coevolution of Body Size in Males and Females // Annual Review of Ecology and Systematics. V. 28. № 1. P. 659–687. https://doi.org/10.1146/annurev.ecolsys.28.1.659
Fairbairn D.J., Preziosi R.F., 1994. Sexual Selection and the Evolution of Allometry for Sexual Size Dimorphism in the Water Strider, Aquarius remigis // The American Naturalist. V. 144. № 1. P. 101–118. https://doi.org/10.1086/285663
Fuiman L.A., 1983. Growth Gradients in Fish Larvae // Journal of fish biology. V. 23. № 1. P. 117–123. https://doi.org/10.1111/j.1095-8649.1983.tb02886.x
Gregory P., 2004. Reptiles Sexual Dimorphism and Allometric Size Variation in a Population of Grass Snakes (Natrix natrix) in Southern England // Journal of Herpetology. V. 38. № 2. P. 231–240. https://doi.org/10.1670/122-03A
Huxley J.S., 1932. Problems of Relative Growth. New York: The Dial Press, MacVeagh. 276 p.
King R.B., 1989. Sexual Dimorphism in Snake Tail Length: Sexual Selection, Natural Selection, or Morphological Constraint? // Biological Journal of the Linnean Society. V. 38. № 2. P. 133–154. https://doi.org/10.1111/j.1095-8312.1989.tb01570.x
King R.B., Bittner T.D., Queral-Regil A., Cline J.H., 1999. Sexual Dimorphism in Neonate and Adult Snakes // Journal of Zoology. V. 247. № 1. P. 19–28. https://doi.org/10.1111/j.1469-7998.1999.tb00189.x
LaBarbera M., 1989. Analyzing Body Size as a Factor in Ecology and Evolution // Annual review of ecology and systematics. V. 20. № 1. P. 97–117. https://doi.org/10.1146/annurev.es.20.110189.000525
Lawing A.M., Head J.J., Polly P.D., 2012. The Ecology of Morphology: The Ecometrics of Locomotion and Macroenvironment in North American Snakes // Paleontology in ecology and conservation. Berlin–Heidelberg: Springer. P. 117–146. https://doi.org/10.1007/978-3-642-25038-5_7
Leutenegger W., 1978. Scaling of Sexual Dimorphism in Body Size and Breeding System in Primates // Nature. V. 272. № 5654. P. 610–611. https://doi.org/10.1038/272610a0
Liao W.B., Chen W., 2012. Inverse Rensch’s Rule in a Frog with Female-Biased Sexual Size Dimorphism // Naturwissenschaften. V. 99. № 5. P. 427–431. doi:10.1007%2Fs00114-012-0913-5
Lovich J.E., Gibbons J.W., 1992. A Review of Techniques for Quantifying Sexual Size Dimorphism // Growth Development and Aging. V. 56. № 4. P. 269–269.
Lucchini N., Kaliontzopoulou A., Val G.A., Martínez-Freiría F., 2020. Sources of Intraspecific Morphological Variation in Vipera seoanei: Allometry, Sex, and Colour Phenotype // Amphibia-Reptilia. № 1. P. 1–16. https://doi.org/10.1163/15685381-bja10024
McArdle B.H., 1988. The Structural Relationship: Regression in Biology // Canadian Journal of Zoology. V. 66. № 11. P. 2329–2339. https://doi.org/10.1139/z88-348
Mosimann J.E., 1970. Size Allometry: Size and Shape Variables with Characterizations of the Lognormal and Generalized Gamma Distributions // Journal of the American Statistical Association. V. 65. № 330. P. 930–945. https://doi.org/10.1080/01621459.1970.10481136
Rensch B., 1950. Die Abhängigkeit der relativen Sexualdifferenz von der Körpergrösse // Bonner Zoologische Beiträge. № 1. S. 58–69.
Ricker W.E., 1984. Computation and Uses of Central Trend Lines // Canadian Journal of Zoology. V. 62. № 10. P. 1897–1905. https://doi.org/10.1139/z84-279
Shine R., Olsson M.M., Moore I.T., LeMaster M.P., Mason R.T., 1999. Why Do Male Snakes Have Longer Tails Than Females? // Proceedings of the Royal Society of London. Series B: Biological Sciences. V. 266. № 1434. P. 2147–2151. https://doi.org/10.1098/rspb.1999.0901
Silva F.M., Oliveira L.S., Souza Nascimento L.R., Machado F.A., Costa Prudente A.L., 2017. Sexual Dimorphism and Ontogenetic Changes of Amazonian Pit Vipers (Bothrops atrox) // Zoologischer Anzeiger. № 271. P. 15–24. https://doi.org/10.1016/j.jcz.2017.11.001
Smith J.M., 1977. Parental Investment: A Prospective Analysis // Animal Behaviour. V. 25. № 1. P. 1–9. https://doi.org/10.1016/0003-3472(77)90062-8
Sokal R.R., Rohlf F.J., 1995. Biometry, The Principles and Practice of Statistics in Biological Research. New York: W.H. Freeman and Co. 887 p.
Storer R.W., 1966. Sexual Dimorphism and Food Habits in Three North American Accipiters // The Auk. V. 83. № 3. P. 423–436. https://doi.org/10.2307/4083053
Strauss R.E., 1987. On Allometry and Relative Growth in Evolutionary Studies // Systematic zoology. V. 36. № 1. P. 72–75. https://doi.org/10.2307/2413309
Székely T., Freckleton R.P., Reynolds J.D., 2004. Sexual Selection Explains Rensch’s Rule of Size Dimorphism in Shorebirds // Proceedings of the National Academy of Sciences. V. 101. № 33. P. 12224–12227. https://doi.org/10.1073/pnas.0404503101
Tamagnini D., Stephenson J., Brown R.P., Meloro C., 2018. Geometric Morphometric Analyses of Sexual Dimorphism and Allometry in Two Sympatric Snakes: Natrix helvetica (Natricidae) and Vipera berus (Viperidae) // Zoology. № 129. P. 25–34. https://doi.org/10.1016/j.zool.2018.05.008
Tomović L., Radojicić J., Dzukić G., Kalezić M.L., 2002. Sexual Dimorphism of the Sand Viper (Vipera ammodytes L.) from the Central Part of Balkan Peninsula // Russian Journal of Herpetology. V. 9. № 1. P. 69–76. https://doi.org/10.30906/1026-2296-2002-9-1-69-76
Webb T.J., Freckleton R.P., 2007. Only Half Right: Species with Female-Biased Sexual Size Dimorphism Consistently Break Rensch’s Rule // PLoS One. V. 2. № 9. P. e897. https://doi.org/10.1371/journal.pone.0000897
Webster M.S., 1992. Sexual Dimorphism, Mating System and Body Size in New World Blackbirds (Icterinae) // Evolution. V. 46. № 6. P. 1621–1641. https://doi.org/10.1111/j.1558-5646.1992.tb01158.x
Zelditch M.L., Swiderski D.L., Sheets H.D., 2012. Geometric Morphometrics for Biologists: A Primer. Academic Press. 488 p. https://doi.org/10.1016/C2010-0-66209-2
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал