Зоологический журнал, 2022, T. 101, № 10, стр. 1115-1119
Сравнительная оценка физических способностей окуня Perca fluviatilis (Perciformes, Percidae) и плотвы Rutilus rutilus (Cypriniformes, Cyprinidae)
Ю. А. Шустов a, *, В. В. Горбач a
a Петрозаводский государственный университет
185910 Петрозаводск, Россия
* E-mail: shustov@petrsu.ru
Поступила в редакцию 13.12.2021
После доработки 05.01.2022
Принята к публикации 08.01.2022
- EDN: QPHZVJ
- DOI: 10.31857/S0044513422100117
Аннотация
В эксперименте по оценке физических способностей рыб показано, что по тяговой силе окунь превосходит плотву почти в два раза. На ранних стадиях межвидовые различия выражены слабо, но с увеличением размерно-весовых показателей дифференциация существенно возрастает. Быстрый рост бросковой скорости окуня обеспечивает возможность питания более подвижными объектами. С возрастом пищевые рационы рыб в значительной мере дивергируют: плотва питается в основном малоподвижными животными и растительной пищей, а окунь почти полностью переходит на питание рыбами и донными беспозвоночными. Это может снижать конкурентную напряженность при совместном обитании видов.
Речной окунь (Perca fluviatilis (Linnaeus 1758)) и обыкновенная плотва (Rutilus rutilus (Linnaeus 1758)) широко распространены и многочисленны в пресных водоемах Европы и Азии. Оба вида традиционно относят к эврифагам, но плотва питается в основном малоподвижными животными и растительной пищей, а окунь предпочитает рыб и донных беспозвоночных. Специфика пищевых предпочтений в условиях совместного обитания способствует разделению экологических ниш, снижая конкурентную напряженность (Shustov, Lesonen, 2020). Успешность пищевых адаптаций обычно связывают со строением челюстного аппарата и пищеварительной системы, но дивергенции подвергаются и качества, напрямую не связанные с питанием, например, форма тела и гидродинамические характеристики (Алеев, 1963; Дгебуадзе, 2001). Обычно виды, потребляющие подвижные объекты, обладают бо́льшими физическими способностями. Для окуня и плотвы показана, в том числе и экспериментально, внутривидовая дифференциация экологических групп в пределах одного водоема (Столбунов, 2005; Stolbunov, Pavlov, 2006; Столбунов, Герасимов, 2008; Герасимов и др., 2015, 2015а), но насколько сильно различаются физические способности окуня и плотвы и каким образом наблюдаемая дивергенция связана с ростом рыб, неизвестно.
Цель настоящего исследования – оценить межвидовые различия физических способностей окуня и плотвы. Следуя общей логике, мы предположили, что (1) плотва, питающаяся менее подвижными организмами, в целом имеет более низкую бросковую скорость по сравнению с окунем и (2) межвидовая дифференциация по мере роста особей увеличивается, поскольку видовая специфичность в выборе объектов питания становится очевидной только у взрослых рыб.
МАТЕРИАЛЫ И МЕТОДЫ
Эксперимент проводили в полевых условиях на оз. Ангозере (Республика Карелия, Кондопожский р-н, 62.054° N, 34.051° E) летом 2020 г. Тяговую силу рыб измеряли в экспериментальной установке, состоящей из пластикового лотка размером 50 × 15 × 10 см, электродов (катода и анода), аккумуляторной батареи, регулятора для поддержания напряженности электрического поля 0.5 В/см, легкого сачка и рыболовной лески, соединяющей сачок с динамометром (Шустов и др., 1994; Чистяков и др., 2020). Окуней и плотву отлавливали удочкой и помещали в наполненный водой лоток между сачком и катодом головой к аноду. При пропускании электрического тока рыба устремлялась к аноду, толкая перед собой сачок с определенным усилием, максимальную величину которого (тяговую силу) фиксировали с помощью динамометра. Затем особь извлекали из лотка, измеряли длину и массу тела и выпускали в озеро. Повторяемость результатов оценивали по выборке окуней, полученной в тех же условиях летом 2015 г. Использовали установку с иным способом фиксации рыбы – посредством зажима, прикрепляемого заднему спинному плавнику (Шустов и др., 2018). Используемое в эксперименте напряжение электрического поля не вызывало у рыб состояния электронаркоза.
Сопряженность связи тяговой силы рыб (We) с их длиной (L) и массой тела (W) моделировали степенными зависимостями We = bLa и We = bW a. Коэффициент a в уравнениях является мерой скорости роста силы, равенство условий старта процесса в сравниваемых выборках обеспечивали назначением коэффициента b константой. Диапазоны варьирования показателей оценивали простым непараметрическим бутстрепом с числом испытаний B = 1000. Доверительные интервалы устанавливали методом процентилей. Показатели сравнивали с помощью рандомизационного теста (MCR – Monte Carlo Randomization) с тем же числом итераций B. Значимость отличий p при таком подходе представляет собой скорректированную долю нуль-модельных комбинаций (эмпирическая разность не больше рандомизированной, |dobs| ≤ |dran|) от общего числа испытаний B. Распределения частот сравнивали по формуле Колмогорова–Смирнова (критерий λ) с нуль-моделью λobs ≤ λran. Критической величиной для p принято стандартное значение α = 0.05 (Шитиков, Розенберг, 2013).
Данные обрабатывали в среде MS Excel и R 4.0.1 (R Core Team, 2020) с использованием базовых функций.
РЕЗУЛЬТАТЫ
Тяговую силу измерили у 105 рыб (табл. 1). Наблюдаемые различия основных параметров распределения размерно-весовых показателей не существенны (табл. 1). Сравнение выборок окуней указывает на хорошую воспроизводимость измерений – в 2015 и 2020 гг. они показали сходные физические способности, тяговая сила плотвы была значимо ниже. Линии трендов регрессионных моделей (рис. 1) иллюстрируют степенной рост тяговой силы у рыб с увеличением их размера. Рост массы тела близок к линейному. Сравнение скоростей a (табл. 2, MCR-тест: p <0.001) поддерживает предположение о межвидовой дифференциации физических способностей. У окуней по мере их роста физическая сила увеличивается быстрее, чем у плотвы.
Таблица 1.
Характеристики окуня и плотвы
| Показатели | Окунь | p* | Плотва, 2020 (n = 50) |
p** | |
|---|---|---|---|---|---|
| 2015 (n = 36) | 2020 (n = 55) | ||||
| Длина тела, см (L) | |||||
| lim | 9.0–19.5 | 9.0–16.0 | 0.249 | 10.5–16.0 | 0.150 |
| M | 12.1 (11.4–12.9) | 12.2 (11.7–12.7) | 0.814 | 12. 6 (12.2–13.0) | 0.326 |
| S | 2.4 (1.6–3.0) | 1.9 (1.6–2.1) | 0.780 | 1.4 (1.1–1.7) | 0.072 |
| Me | 11.6 (10.8–12.5) | 12.0 (11.0–13.0) | 0.600 | 12.5 (12.0–13.0) | 0.512 |
| Масса тела, г (W) | |||||
| lim | 8.0–43.0 | 9.0–39.0 | 0.099 | ||
| M | Нет данных | 19.2 (17.0–21.5) | – | 16.7 (15.1–18.7) | 0.389 |
| S | 8.7 (7.0–10.0) | 6.6 (4.7–8.1) | 0.077 | ||
| Me | 16.0 (13.5–23.0) | 15.5 (12.8–17.0) | 0.821 | ||
| Тяговая сила, г (We) | |||||
| lim | 10.0–120.0 | 10.0–100.0 | 0.609 | 5.0–50.0 | <0.001 |
| M | 32.4 (26.7–39.7) | 34.4 (28.9–40.0) | 0.641 | 18.2 (15.7–20.8) | 0.002 |
| S | 19.5 (10.2–28.6) | 20.4 (13.0–25.4) | 0.662 | 9.7 (7.5–12.5) | 0.086 |
| Me | 30.0 (20.0–32.5) | 30.0 (20.0–40.0) | 0.999 | 20.0 (12.5–20.0) | 0.042 |
Примечания. n – число рыб, lim – диапазон варьирования признака, M – средняя арифметическая, S – стандартное отклонение, Me – медиана, доверительные интервалы оценок получены бутстреп–методом, p* – значимость различий показателей у окуней в 2015 и 2020 гг. (MCR–тест), в строках lim указана значимость различий распределений (MCR–тест по критерию λ Колмогорова–Смирнова), p** – то же для окуня и плотвы в 2020 г. Жирным шрифтом выделены статистически достоверные различия между показателями.
Рис. 1.
Ординация особей и линии трендов моделей зависимости тяговой силы (We) от длины (L) и массы тела (W) рыбы. Параметры моделей даны в табл. 2.
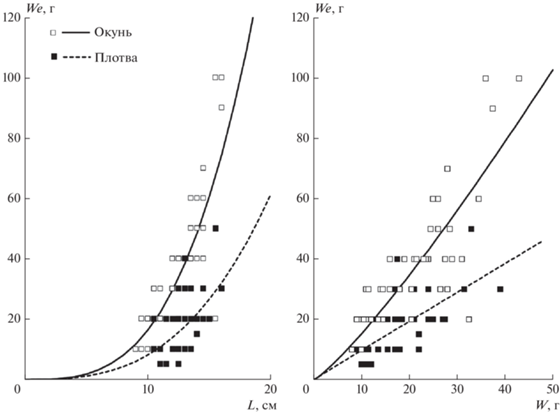
Таблица 2.
Параметры моделей зависимости тяговой силы от длины и массы тела рыбы
| Модель | a | t | d f | p | R 2 | lim a |
|---|---|---|---|---|---|---|
| We = 0.01La | ||||||
| Окунь, 2015 | 3.21 | 124.5 | 35 | <0.001 | 0.408 | 3.16–3.26 |
| 2020 | 3.22 | 208.3 | 54 | <0.001 | 0.711 | 3.19–3.25 |
| Плотва, 2020 | 2.91 | 105.8 | 49 | <0.001 | 0.350 | 2.86–2.97 |
| We = W a | ||||||
| Окунь, 2020 | 1.18 | 84.55 | 54 | <0.001 | 0.680 | 1.15–1.21 |
| Плотва, 2020 | 0.99 | 40.10 | 49 | <0.001 | 0.361 | 0.95–1.04 |
ОБСУЖДЕНИЕ
Плавательную способность рыб традиционно оценивают по времени сопротивления особей току воды (Green, 1964; Brett, 1967; Alsop, Wood, 1997; Wolter, Arlinghaus, 2003; Thorarensen, Farrell, 2006; Fu et al., 2013; Смирнов, Смирнова, 2020 и др.). Экспериментальные установки, основанные на этом принципе, в силу объективных причин используют для изучения плавательных характеристик молоди рыб (Stolbunov, Pavlov, 2006; Столбунов, Герасимов, 2008; Смирнова, 2010 и др.). В основу работы нашего прибора положен принцип влияния электрического поля на двигательную активность рыб (Протасов, 1972) и идея использования динамометра для фиксации максимальных усилий особи (Nachimoto, 1980). Напряжение электрического поля подобрано опытным путем для измерения бросковой скорости, которую рыба развивает в погоне за пищевым объектом либо в экстремальных ситуациях.
Метод многократно апробирован (Шустов, Тыркин, 2019), в том числе и для практических целей – оценки качества заводской молоди лососевых рыб, предназначенной для выпуска в водоемы и для производства товарной рыбы в садках, и позволяет оценивать тяговую силу у более крупных рыб с длиной тела до 20 см и более при увеличении размера лотка. Первоначальный способ фиксации рыбы с помощью зажима спинного плавника (Шустов и др., 1994), показавший хорошие результаты с лососевыми рыбами и окунем, оказался непригодным для более чувствительным к такой манипуляции видам, в том числе и плотве, поэтому в используемой модели прибора зажим был заменен на легкий сачок, который рыба, двигаясь к аноду, толкает головой (Чистяков и др., 2020).
Экспериментальные выборки окуней и плотвы однородны по размерно-весовым характеристикам, в том числе и по распределению частот. В ходе эксперимента все рыбы независимо от их размера активно совершали бросок в направлении анода. У окуня тяговая сила в среднем была почти в два раза больше, чем у плотвы, что дает преимущество в питании подвижными объектами. Физические качества, и прежде всего бросковая скорость, играют важнейшую роль в пищевой адаптации рыб. Так, ранее, изучая жизнестойкость дикой и заводской молоди атлантического лосося (Salmo salar (Linnaeus 1758)) на европейском севере России, мы установили, что заводские рыбы, которых выращивали в бассейнах без течения, значительно уступали по физической силе дикой молоди (Shustov, Shchurov, 1988) и вследствие этого были не в состоянии активно питаться дрифтом донных беспозвоночных сразу после выпуска на пороги и перекаты лососевых рек. Период адаптации заводских рыб обычно растягивался на несколько недель (Шустов и др., 1980).
Показанный степенной характер зависимости бросковой скорости от длины тела согласуется с результатами изучения плавательных способностей лососевых, карповых и других рыб длиной до 6 см (Wolter, Arlinghaus, 2003). Так же как и у этих рыб, в нашем эксперименте бросковая скорость молоди окуня и плотвы различается слабо, но с увеличением размерно-весовых показателей дифференциация существенно возрастает, подобно тому, как изменяется весь комплекс признаков и качеств в ходе онтогенеза (Kopf et al., 2014; Abramiuk, Afanasyev, 2017). Основной причиной межвидовой дивергенции, по-видимому, является усиление пищевой специализации. Молодь питается в основном планктоном, с возрастом в рационе плотвы начинает преобладать водная растительность, а у окуня – крупные, подвижные бентосные беспозвоночные и рыба, сходство содержимого желудков меняется от 88% в младших возрастных группах до 10% в старших (Shustov, Lesonen, 2020). Длина тела является более надежным признаком для оценки физических способностей рыб, чем масса тела, поскольку меньше зависит от случайных причин, например наполненности желудка у особи в момент эксперимента.
Список литературы
Алеев Ю.Г., 1963. Функциональные основы внешнего строения рыб. М.: Издательство АН СССР. 247 с.
Герасимов Ю.В., Иванова М.Н., Столбунов И.А., Павлов Д.Д., 2015. Окунь // Рыбы Рыбинского водохранилища: популяционная динамика и экология. Ред. Герасимов Ю.В. Ин-т биологии внутренних вод им. И.Д. Папанина РАН. Ярославль: Филигрань. С. 331–348.
Герасимов Ю.В., Столбунов И.А., Лёвин Б.А., Лёвина М.А., Комова Н.И., Касьянов Н.А., Изюмов Ю.Г., 2015а. Плотва // Рыбы Рыбинского водохранилища: популяционная динамика и экология. Ред. Герасимов Ю.В. Ин-т биологии внутренних вод им. И.Д. Папанина РАН. Ярославль: Филигрань. С. 263–294.
Дгебуадзе Ю.Ю., 2001. Экологические закономерности изменчивости роста рыб. М.: Наука. 276 с.
Протасов В.Р., 1972. Биоэлектрические поля в жизни рыб. М.: Центральный научно-исследовательский институт информации и технико-экономических исследований рыбного хозяйства. 228 с.
Смирнов А.К., Смирнова Е.К., 2020. Влияние температуры на двигательную активность и плавательную способность молоди плотвы Rutilus rutilus (Cyprinidae) // Вопросы ихтиологии. Т. 60. № 2. С. 219–228.
Смирнова E.C., 2010. Влияние условий выращивания на поведение молоди плотвы Rutilus rutilus (L.) (Cyprinidae) // Биология внутренних вод. № 3. С. 75–81.
Столбунов И.А., 2005. Морфологическая изменчивость молоди плотвы Rutilus rutilus (L.) в Рыбинского водохранилища // Биология внутренних вод. № 4. С. 67–71.
Столбунов И.А., Герасимов Ю.В., 2008. Морфологическая и поведенческая изменчивость молоди плотвы Rutilus rutilus (Cyprinidae, Cypriniformes) из разных биотопов Рыбинского водохранилища // Вопросы ихтиологии. Т. 48. № 2. С. 255–265.
Чистяков А.Б., Шустов Ю.А., Онищенко Н.А., 2020. Устройство для оценки физической силы рыбы // Патент № 196 960 от 23.03.2020.
Шитиков В.К., Розенберг Г.С., 2013. Рандомизация и бутстреп: статистический анализ в биологии и экологии с использованием R. Тольятти: Кассандра. 314 с.
Шустов Ю.А., Горбач В.В., Тыркин И.А., 2018. Сезонные особенности физических способностей речного окуня (Perca fluviatilis L.) // Труды Карельского научного центра РАН. № 6. С. 51–58.
Шустов Ю.А., Щуров И.Л., Смирнов Ю.А., 1980. О сроках адаптации заводской молоди семги Salmo salar L. к речным условиям // Вопросы ихтиологии. Т. 20. № 4. С. 758–761.
Шустов Ю.А., Щуров И.Л., Шемякин А.П., 1994. Способ определения жизнестойкости молоди лососевых рыб // Авторское свидетельство СССР № 1 264 881. Бюллетень № 6.
Шустов Ю.А., Тыркин И.А., 2019. Оценка физической силы рыб (итоги исследований, перспективы) // Труды Карельского научного центра РАН. Петрозаводск. № 12. С. 102–108.
Abramiuk I.I., Afanasyev S.A., 2017. Swimming performance of some freshwater fishes as index of transition to nekton mode of life // Hydrobiological Journal. V. 53. № 1. P. 37–44.
Alsop D.H., Wood C.M., 1997. The interactive effects of feeding and exercise on oxygen consumption, swimming performance and protein usage in juvenile rainbow trout (Oncorhynchus mykiss) // Journal of Experimental Biology. V. 200. P. 2337–2346.
Brett I.R., 1967. Swimming performance of sockeye salmon (Oncorhynchus nerka) in relation to fatigue time and temperature // Journal of the Fisheries Research Board Canada. V. 24. № 8. P. 1731–1741.
Green D.M.J., 1964. A comparison of stamina of brook trout from wild and domestic parents // Transactions of the American Fisheries Society. V. 93. № 1. P. 96–100.
Fu C., Cao Z.–D., Fu S.–J., 2013. The effects of caudal fin loss and regeneration on the swimming performance of three cyprinid fish species with different swimming capacities // Journal of Experimental Biology. V. 216. P. 3164–3174.
Kopf S.M., Humphries P., Watt R.J., 2014. Ontogeny of critical prolonged swimming performance for the six Australian freshwater fish species // Journal of Fish Biology. V. 84. № 6. P. 1820–1841.
Nashimoto K., 1980. The maximum swimming force of rainbow trout // Bulletin of the Japanese Society of Scientific Fisheries. V. 46. № 8. P. 949–954.
R Core Team, 2020. R: a language and environment for statistical computing. R version 4.0.1. (2020–06–06). Vienna: R Foundation for Statistical Computing. [Электронный ресурс]. Режим доступа: http://www.r–project.org/. Дата обновления: 14.05.2021.
Shustov Yu.A., Lesonen M.A., 2020. Food competition of roach and perch in the water bodies of the republic of Karelia // Hydrobiological Journal. V. 56. № 1. P. 17–26.
Shustov Yu.A., Shchurov I.L., 1988. Quantitative estimation of stamina of wild and hatchery – reared Atlantic salmon (Salmo salar L.) // Aquaculture. V. 71. № 1. P. 81–87.
Stolbunov I.A., Pavlov D.D., 2006. Behavioral differences of various ecological groups of roach Rutilus rutilus and perch Perca fluviatilis // Journal of Ichthyology. V. 46. Suppl. 2. P. 213–219.
Thorarensen H., Farrell A.P., 2006. Postprandial Intestinal Blood Flow, Metabolic Rates, and Exercise in Chinook Salmon (Oncorhynchus tshawytscha) // Physiological and Biochemical Zoology. V. 79. № 4. P. 688–694.
Wolter C., Arlinghaus R., 2003. Navigation impacts on freshwater fish assemblages, the ecological relevance of swimming performance // Reviews in Fish Biology and Fisheries. V. 13. № 1. P. 63–89.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


