Зоологический журнал, 2022, T. 101, № 10, стр. 1083-1095
Сообщества почвенных нематод типичных биоценозов республики Алтай
А. А. Сущук a, *, Е. М. Матвеева a, Д. С. Калинкина a, М. Г. Юркевич a
a Институт биологии – обособленное подразделение
Федерального государственного бюджетного учреждения науки Федерального исследовательского центра “Карельский научный центр Российской академии наук” (ИБ КарНЦ РАН)
185910 Петрозаводск, Россия
* E-mail: anna_sushchuk@mail.ru
Поступила в редакцию 20.10.2021
После доработки 17.02.2022
Принята к публикации 18.02.2022
- EDN: NFILMR
- DOI: 10.31857/S0044513422100129
Аннотация
Представлены первые сведения о почвенных нематодах хвойных лесных и степных биоценозов на территории Республики Алтай, позволившие установить связь различных характеристик сообществ нематод с особенностями растительности. Обнаружены нематоды 49 таксонов, принадлежащих к 31 семейству, 9 отрядам. Результаты исследования показали, что лиственничник имел высокое, а степные биоценозы – самое низкое таксономическое разнообразие нематод. Плотность популяций и биомасса почвенных нематод в лесных биоценозах имели сходные значения, значимо превышающие таковые в степных биоценозах. Выявлены различия эколого-трофической структуры сообществ нематод между биоценозами: в почве кедрача преобладали бактериотрофы и нематоды, ассоциированные с растениями, что в целом характерно для сосняков разных типов, в лиственничнике преобладали бактериотрофы, паразиты растений и микотрофы. Сообщества нематод степных почв заметно отличались от сообществ лесных биоценозов и имели специфические черты: неполночленную структуру с доминированием микотрофов и/или политрофов. Эколого-популяционные индексы (SI, EI), описывающие состояние трофических сетей на основе сообществ нематод, позволили оценить почвенные экосистемы исследованных лесных биоценозов как ненарушенные со сложными трофическими сетями и умеренным уровнем обогащения почв органикой. Степной биоценоз, образованный чием блестящим, напротив, характеризовался низкими значениями индексов SI и EI. Эти параметры указывают на упрощенную и нестабильную трофическую сеть и деградированную почвенную экосистему, испытывающую воздействие неблагоприятных факторов среды (климатических или антропогенных). По-видимому, полученный результат связан с экстремальными условиями степи Кош-Агачского района. Значения индекса преобладающего пути разложения органики в почве CI различались по типам биоценозов. В почве кедрача и лиственничника обнаружены низкие CI значения, свидетельствующие об активном участии бактерий в деструкции органики в почве. Такой тип деструкции не характерен для лесных биоценозов других природных зон (например, хвойных лесов Карелии), где главенствующее положение в разложении органики занимают почвенные грибы. В данном исследовании высокие CI значения наблюдались в степном биоценозе, что указывает на доминирование почвенных грибов в процессах деструкции органического вещества.
Нематоды – одна из наиболее многочисленных и разнообразных групп организмов, обитающих в почве. Они играют ключевую роль в почвенных экосистемах, участвуют в процессах разложения органического вещества и создании почвенного плодородия, тесно связаны с составом и структурой растительных сообществ. Изучение фауны и структуры сообществ почвенных нематод естественных биоценозов в Российской Федерации активно ведется лишь в некоторых регионах – на территории Республики Карелия (Груздева и др., 2006; Матвеева, Сущук, 2016; Сущук и др., 2017), Республики Коми (Кудрин, Лаптева, 2015; Кудрин и др., 2019), на Дальнем Востоке (Ерошенко, Волкова, 2004); отдельные данные имеются для Ростовской (Шматко, Ильина, 2017) и Томской (Калашникова, Карташев, 2018) областей, лугов Ярославской обл. и Северо-Запада России (Sushchuk et al., 2019). Однако ранее в ходе зоогеографических исследований фауна почвенных нематод различных природных зон европейской части СССР обследована довольно полно, в том числе изучена нематодофауна Центрально-Черноземного и Приокско-Террасного заповедников, заповедника “Мыс Мартьян” в Крыму и других территорий (Соловьева, 1986). В настоящее время сведения о фауне почвенных нематод на большей части территории РФ отсутствуют. Кроме того, на фоне усиливающейся антропогенной трансформации экосистем, приводящей к постоянному сокращению естественных мест обитания живых организмов, актуальными и востребованными являются исследования флоры и фауны ненарушенных биоценозов как потенциальных эталонных участков для мониторинга условий обитания организмов и выявления закономерностей их распространения.
В Западной Сибири для таких исследований была выбрана Республика Алтай, один из крупнейших индустриально-аграрных регионов России, характеризующийся сложными природно-географическими и климатическими условиями, разнообразием ландшафтов. Здесь и на сопредельных территориях более широко проводилось изучение паразитических нематод сельскохозяйственных и экзотических животных (Кравченко, Власова, 2011; Ефремова, Марченко, 2017; Пономарев, Лунева, 2018), а также древесных нематод, их распространение и степень патогенности для хвойных пород (Ремезов, 2005). Сведений по сообществам почвообитающих нематод биоценозов Республики Алтай нет.
Целью данной работы является изучение таксономического разнообразия, численности почвообитающих нематод, структуры их сообществ в биоценозах разных типов на территории Республики Алтай, а также выявление связи нематологических параметров с особенностями растительности.
МАТЕРИАЛЫ И МЕТОДЫ
Характеристика района исследования. Описание растительности
Отбор почвенных образцов проводился в четырех типичных биоценозах на территории двух районов (Онгудайский и Кош-Агачский) Республики Алтай в июле 2017 г. Описание растительности пробных площадок было проведено с использованием подхода Браун-Бланке (Raabe, Brandes, 1988).
Лесные биоценозы расположены в Онгудайском р-не центральной части Республики Алтай. Образцы почвы были отобраны на двух пробных площадках: кедрач и лиственничник. Кедрач находится в районе Семинского перевала (1754 м над ур. м.) (51°02′49.48″ N, 85°37′01.39″ E). Рельеф района горный, климат резко континентальный, среднее количество осадков 379 мм. Почвы горно-лесные (Ачимова, 2005). Исследуемая пробная площадка выбрана в пределах типичного однородного участка кедровой тайги, образованного сосной сибирской (кедр) (Pinus sibirica Du Tour). Подлесок отсутствует, в нижнем ярусе расположены куртины березы карликовой (Betula nana L.). Травяной ярус разрежен (общее проективное покрытие не более 60%), здесь представлена типичная растительность кедрачей: кошачья лапка (Antennaria sp.) (40%), шалфей (Salvia sp.) (40%), отдельные куртины фиалки трехцветной (Viola tricolor L.), курильского чая кустарникового (Dasiphora fruticosa L.), купальницы алтайской (Trollius altaicus Mey.), тысячелистника азиатского (Achillea asiatica Serg.). Слой хвойного опада 2–4 см.
Лиственничник расположен в районе перевала Чике-Таман (50°38′42.18″ N, 86°18′43.43″ E). Рельеф расчлененный, среднегорный, высота местности 1286 м над ур. м. Климат района резко континентальный, среднее количество отсадков 450 мм (Робертус и др., 2012). Почвы горно-лесные сильно каменистые. В древесном ярусе преобладает лиственница сибирская (Larix sibirica Ledeb.), в подлеске отмечены спирея дубравколистная (Spiraea chamaedryfolia L.), жимолость алтайская (Lonicera altaica Pall.), карагана карликовая (Caragana pygmaea L.). Травяной ярус хорошо выражен (общее проективное покрытие 40%), представлен разнотравьем с доминированием шалфея (60%), высока доля купальницы алтайской (20%) и первоцвета крупночашечного (Primula macrocalyx Bunge) (15%).
Степные биоценозы расположены в Кош-Агачском р-не Республики Алтай на границе степной и полупустынной зон, в межгорной котловине на высоте 1748 м над ур. м. (50°00′10.02″ N, 88°39′44.57″ E). Для района характерен суровый резко континентальный климат и экстремальный температурный режим. Количество осадков невелико (120–250 мм). Почвообразующими породами района являются пролювиально-алювиальные отложения, на которых сформировались криоаридные засоленные почвы. Эти почвы характеризуются небольшой мощностью профиля (40–60 см) и супесчаным и песчаным гранулометрическим составом верхнего горизонта, который слабо противостоит ветровой эрозии (Мударисова, 2016). Соле- и засухоустойчивая степная растительность чередуется с полупустынной растительностью. Ярко выражена мозаичность растительного покрова, зависящая от микрорельефа, степени засоления и увлажнения. Для отбора образцов почвы были выбраны две пробные площадки: первая – с доминированием в травяном покрове чия блестящего (Stipa splendens Trin.) (проективное покрытие 90%), почвы – солончак на галечнике; вторая – в месте произрастания караганы карликовой с малочисленными куртинами полыни (Artemisia sp.), кохии простертой (Bassia prostrata L.). Травяной ярус разрежен, общее проективное покрытие не превышает 40%. Почвы песчаные, каменистые.
Почвообитающие нематоды
Образцы почвы были отобраны случайным образом из каждого биоценоза в пределах типичного однородного участка растительности (2 × 2 м) с использованием почвенного бура (диаметр 20 мм) на глубину 0–15 см в девяти повторностях (для кедрача и лиственничника), в шести и трех повторностях – для степных биоценозов. Выделение нематод выполняли по модифицированному методу Бермана с экспозицией 48 ч из навески почвы массой 30 г, фиксатор ТАФ (триэтаноламин: формалин: вода в соотношении 2 : 7 : 91) (van Bezooijen, 2006). Идентификацию нематод осуществляли на врéменных глицериновых препаратах. Устанавливали систематическую принадлежность (до уровня рода) не менее чем 100 особей нематод из каждой пробы с помощью микроскопа при увеличении 400–600×. Таксономическая структура нематод приведена в соответствии с классификацией, предложенной De Ley, Blaxter (De Ley, Blaxter, 2004; Abebe et al., 2006).
Для анализа фауны нематод исследовались следующие параметры: таксономическое разнообразие (количество родов), индекс Шеннона H ', индекс доминирования Симпсона С (Одум, 1975), плотность популяций (численность) нематод (количество экз./100 г сырой почвы), биомасса почвенных нематод (мг/100 г почвы), эколого-трофическая структура сообществ. Общая биомасса нематод была рассчитана на основе данных о средней биомассе отдельных родов с использованием онлайн-ресурса NINJA: Nematode INdicator Joint Analysis (https://sieriebriennikov.shinyapps.io/ ninja/) (Sieriebriennikov et al., 2014). Эколого-трофическое группирование нематод было проведено на основе классификации Йейтса с соавторами (Yeates et al., 1993, 1993a), адаптированной на русский язык авторами статьи с выделением шести трофических групп: бактериотрофы (Б), микотрофы (М), политрофы (П), хищники (Х), нематоды, ассоциированные с растениями (Аср), и паразиты растений (Пр). Кроме того, при анализе разнообразия фауны учтена трофическая группа нематод-паразитов беспозвоночных (Пб) (Yeates et al., 1993), но группа была исключена из дальнейшего анализа сообществ почвенных нематод, так как данные виды не принимают участия в почвенных процессах.
Для характеристики сообществ нематод использовались эколого-популяционные индексы:
– индекс зрелости сообществ нематод ΣMI представляет собой количественную оценку состояния экосистемы на основе состава и соотношения таксонов нематод. Виды нематод имеют различные экологические преференции, связанные с их морфологией, биологией и экологией, которые выражаются в значениях, присвоенных каждому таксону по специальной с-р шкале Бонгерса. Колонизаторы с наименьшим значением (c-p = 1) устойчивы к неблагоприятным условиям существования. Персистеры c наибольшим значением (c-p = 5) чувствительны к факторам окружающей среды (Bongers, 1990);
– индексы, характеризующие почвенную трофическую сеть, введены в нематологическую науку Феррисом с соавторами (Ferris et al., 2001). При объединении трофической группы таксона (Yeates et al., 1993) и значения (от 1 до 5) по с-р шкале Бонгерса (Bongers, 1990) авторами концепции получены “функциональные группы” для выявления экологической специализации нематод внутри трофических групп. На основе функциональных групп рассчитываются эколого-популяционные индексы, характеризующие почвенную трофическую сеть и позволяющие оценить состояние местообитания нематод как организмов-педобионтов. Это индекс структурирования (Structure index, SI), индекс обогащения (Enrichment index, EI) почвенной трофической сети и индекс преобладающего пути разложения органического вещества в почве (Channel index, CI) (Ferris et al., 2001). Расчет экологических индексов и их интерпретация подробно рассмотрены в статье авторов (Матвеева, Сущук, 2016).
Статистическая обработка данных проведена с использованием U-критерия Манна–Уитни (Mann-Whitney, U-test) для малого числа повторностей. Различия между группами считали достоверными при р < 0.05. Числовые данные представлены в форме М ± SE (среднее значение ± ± стандартная ошибка среднего). Для выявления различий между локальными сообществами почвенных нематод проводили ординацию исследованных биоценозов методом главных компонент на основе относительного обилия функциональных групп нематод. Исходная матрица состояла из n объектов (биоценозы), охарактеризованным по m признакам (средние значения относительного обилия функциональных групп). Расчеты выполнены при помощи программы PAST 1.68. (Hammer et al., 2001). Для выполнения исследования почвенных нематод использовано научное оборудование Центра коллективного пользования Федерального исследовательского центра “Карельский научный центр Российской академии наук”.
РЕЗУЛЬТАТЫ
Таксономическое разнообразие нематод
Фауна почвенных нематод исследованных биоценозов на территории Республики Алтай представлена 49 таксонами нематод, относящимися к 31 семейству и 9 отрядам, шесть из них являются общими для всех исследованных участков. Разнообразие нематод минимально в месте произрастания караганы карликовой. И если исключить из сравнения данный биоценоз как характеризующийся экстремальными условиями обитания для живых организмов, то количество общих таксонов для лесов и биоценоза “степь-чий” возрастает до 10 (табл. 1). Главным образом, общие таксоны представлены бактериотрофами (4 таксона) и микотрофами (3 таксона), составляющими основу базовой фауны нематод любого биоценоза.
Таблица 1.
Среднее относительное обилие (%) таксонов почвенных нематод территории Республики Алтай
| Таксоны | Функциональная группа |
Биоценозы | |||
|---|---|---|---|---|---|
| К | Л | СТ-Ч | СТ-К | ||
| Отряд Enoplida Filipjev 1929 | |||||
| Семейство Alaimidae Micoletzky 1922 | |||||
| Alaimus De Man 1880 | Б4 | 0.55 | 1.05 | 0 | 0 |
| Paramphidelus Andrássy 1977 | Б4 | 0 | 0.23 | 0 | 0 |
| Отряд Triplonchida Cobb 1920 | |||||
| Семейство Diphtherophoridae Micoletzky 1922 | |||||
| Diphtherophora de Man 1880 | М3 | 0 | 2.51 | 0 | 0 |
| Семейство Trichodoridae Thorne 1935 | |||||
| Trichodoridae sp. | Пр4 | 0 | 0.76 | 0 | 0 |
| Семейство Prismatolaimidae Micoletzky 1922 | |||||
| Prismatolaimus de Man 1880 | Б3 | 0.37 | 0.47 | 0 | 0 |
| Семейство Tripylidae de Man 1876 | |||||
| Tripyla Bastian 1865 | Х3 | 0.14 | 0.93 | 0 | 0 |
| Отряд Dorylaimida Pearse 1942 | |||||
| Семейство Tylencholaimidae Filipjev 1934 | |||||
| Tylencholaimus de Man 1876 | М4 | 0 | 1.81 | 0 | 0 |
| Семейство Qudsianematidae Jairajpuri 1963 | |||||
| Discolaimus Cobb 1913 | Х5 | 0 | 0.70 | 0 | 0 |
| Eudorylaimus Andrássy 1959 | П4 | 12.68 | 4.67 | 12.35 | 41.67 |
| Семейство Nordiidae Jairajpuri & Siddiqi 1964 | |||||
| Longidorella Thorne 1939 | Пр4 | 0 | 0.23 | 0 | 0 |
| Семейство Aporcelaimidae Heyns 1965 | |||||
| Aporcelaimellus Heyns 1965 | П5 | 0 | 0.35 | 0 | 0 |
| Отряд Mononchida Jairajpuri 1969 | |||||
| Семейство Anatonchidae Jairajpuri 1969 | |||||
| Iotonchus Cobb 1916 | Х4 | 0 | 0.70 | 0 | 0 |
| Семейство Mononchidae Chitwood 1937 | |||||
| Clarkus Jairajpuri 1970 | Х4 | 0.14 | 0 | 0 | 0 |
| Семейство Mylonchulidae Jairajpuri 1969 | |||||
| Mylonchulus Cobb 1916 | Х4 | 0 | 0.23 | 0 | 0 |
| Отряд Desmodorida De Coninck 1965 | |||||
| Семейство Desmodoridae Filipjev 1922 | |||||
| Prodesmodora Micoletzky 1923 | Б2 | 0.55 | 0 | 0 | 0 |
| Отряд Monhysterida Filipjev 1929 | |||||
| Семейство Monhysteridae De Man 1876 | |||||
| Eumonhystera Andrássy 1981 | Б2 | 0.51 | 0 | 0 | 0 |
| Monhystera Bastian 1865 | Б2 | 0 | 0 | 0 | 2.78 |
| Отряд Araeolaimida De Coninck & Stekhoven 1933 | |||||
| Семейство Diplopeltidae Filipjev 1918 | |||||
| Cylindrolaimus De Man 1880 | Б3 | 0.37 | 0.64 | 0.31 | 0 |
| Отряд Plectida Malakhov 1982 | |||||
| Семейство Plectidae Örley 1880 | |||||
| Plectus Bastian 1865 | Б2 | 12.13 | 5.32 | 0 | 0 |
| Ceratoplectus Andrássy 1984 | Б2 | 0 | 0.41 | 0 | 0 |
| Anaplectus De Coninck & Stekhoven 1933 | Б2 | 0 | 3.39 | 0 | 0 |
| Wilsonema Cobb 1913 | Б2 | 1.29 | 4.38 | 0 | 0 |
| Семейство Metateratocephalidae Eroshenko 1973 | |||||
| Metateratocephalus Eroshenko 1973 | Б3 | 0.18 | 0.47 | 0 | 0 |
| Семейство Teratocephalidae Andrássy 1958 | |||||
| Teratocephalus de Man 1876 | Б3 | 2.54 | 0 | 0 | 0 |
| Отряд Rhabditida Chitwood 1933 | |||||
| Семейство Panagrolaimidae Thorne 1937 | |||||
| Panagrolaimus Fuchs 1930 | Б1 | 2.77 | 1.75 | 0.62 | 0 |
| Семейство Cephalobidae Filipjev 1931 | |||||
| Acrobeles Linstow 1877 | Б2 | 0 | 4.61 | 0.31 | 0 |
| Acrobeloides Cobb 1924 | Б2 | 11.95 | 5.26 | 2.78 | 13.89 |
| Cephalobus Bastian 1865 | Б2 | 0 | 1.23 | 0 | 0 |
| Cervidellus Thorne 1937 | Б2 | 0 | 28.62 | 0.31 | 5.56 |
| Chiloplacus Thorne 1937 | Б2 | 0 | 1.75 | 0.31 | 2.78 |
| Heterocephalobus Brzeski 1960 | Б2 | 0.88 | 0.12 | 4.32 | 2.78 |
| Семейство Rhabditidae Örley 1880 | |||||
| Rhabditis Dujardin 1845 | Б1 | 0.37 | 0.76 | 0 | 0 |
| Mesorhabditis Osche 1952 | Б1 | 0 | 1.87 | 0 | 0 |
| Семейство Steinernematidae Filipjev 1934 | |||||
| Steinernema Travassos 1927 | Пб- | 0.14 | 0 | 0 | 0 |
| Семейство Tylenchidae Örley 1880 | |||||
| Boleodorus Thorne 1941 | Аср2 | 0.18 | 0 | 0 | 0 |
| Filenchus Andrássy 1954 | Аср2 | 3.46 | 1.40 | 0 | 0 |
| Malenchus Andrássy 1968 | Аср2 | 3.78 | 0.12 | 0 | 0 |
| Aglenchus Andrássy 1954 | Аср2 | 9.36 | 0.41 | 0 | 0 |
| Lelenchus Andrássy 1954 | Аср2 | 19.23 | 2.69 | 0 | 0 |
| Tylenchidae sp. | Аср2 | 0.18 | 0 | 0 | 0 |
| Семейство Anguinidae Nicoll 1935 | |||||
| Ditylenchus Filipjev 1936 | М2 | 1.11 | 0.41 | 12.35 | 2.78 |
| Семейство Belonolaimidae Whitehead 1959 | |||||
| Tylenchorhynchus Cobb 1913 | Пр3 | 0 | 0 | 0.31 | 5.56 |
| Nagelus Thorne & Malek 1968 | Пр3 | 6.32 | 0.64 | 0 | 0 |
| Семейство Tylenchulidae Skarbilovich 1947 | |||||
| Paratylenchus Micoletzky 1922 | Пр2 | 0.37 | 5.49 | 1.85 | 0 |
| Семейство Pratylenchidae Thorne 1949 | |||||
| Pratylenchus Filipjev 1936 | Пр3 | 3.14 | 0 | 0 | 0 |
| Семейство Hoplolaimidae Filipjev 1934 | |||||
| Helicotylenchus Steiner 1945 | Пр3 | 0.37 | 7.24 | 0.31 | 0 |
| Семейство Criconematidae Taylor 1936 | |||||
| Mesocriconema Andrássy 1965 | Пр3 | 0 | 0.18 | 0 | 0 |
| Семейство Aphelenchoididae Skarbilovich 1947 | |||||
| Aphelenchoides Fischer 1894 | М2 | 4.38 | 5.49 | 63.58 | 11.11 |
| Семейство Aphelenchidae Fuchs 1937 | |||||
| Aphelenchus Bastian 1865 | М2 | 0.55 | 0.70 | 0.31 | 11.11 |
| Итого таксонов 49 | 30 | 39 | 14 | 10 | |
Примечания. К – кедрач, Л – лиственничник, СТ-Ч – степь с преобладанием чия блестящего, СТ-К – степь с доминированием караганы карликовой. Функциональная группа (Ferris et al., 2001) – это объединение трофической группы таксона (Yeates et al., 1993) и значения (от 1 до 5) по с-р шкале Бонгерса (Bongers, 1990). Трофические группы: Б – бактериотрофы; М – микотрофы; П – политрофы; Х – хищники; Аср – нематоды, ассоциированные с растениями; Пр – паразиты растений; Пб – паразиты беспозвоночных, личинки обитают в почве.
Анализ таксономического разнообразия нематод показал, что лиственничник выделяется наибольшим числом выявленных таксонов (39 родов) и высоким значением индекса Шеннона (H ' = 4.1). Наименьшие значения количества таксонов нематод отмечены для степных биоценозов (14 родов, H ' = 1.8 и 10 родов, H ' = 2.7) (табл. 1 и 2). Такое значительное сокращение разнообразия происходит в результате снижения числа специфичных видов, при этом в фауне остаются только нематоды, встречающиеся в любых типах биоценозов и почв. В биоценозах с высоким разнообразием нематодофауны специфичные роды представлены довольно хорошо: в кедраче 8 таксонов, в лиственничнике 14.
Таблица 2.
Параметры, характеризующие фауну почвенных нематод исследованных биоценозов на территории Республики Алтай
| Параметр | Кедрач, n = 9 |
Лиственничник, n = 9 | Степь-чий, n = 6 | Степь-карагана, n = 3 |
|---|---|---|---|---|
| Численность, экз./100 г почвы | 2168 ± 121b | 1712 ± 293b | 324 ± 38c | 36 ± 9a |
| Общее число родов нематод | 30 | 39 | 14 | 10 |
| Индекс Н ' | 3.74 ± 0.11b | 4.11 ± 0.10c | 1.83 ± 0.22a | 2.66 ± 0.16a |
| Индекс Симпсона, С | 0.10 ± 0.01a | 0.11 ± 0.01a | 0.44 ± 0.07b | 0.23 ± 0.04b |
| Биомасса, мг/100 г почвы | 1.67 ± 0.45b | 1.13 ± 0.22b | 0.19 ± 0.05c | 0.05 ± 0.02a |
Примечания. n – число исследованных биоценозов, Н ' – индекс Шеннона. Данные представлены в форме М ± SE (среднее значение ± стандартная ошибка среднего); использован U-критерий Манна–Уитни; значения с разными буквенными обозначениями в строках статистически различаются (р < 0.05). Здесь и в табл. 3, 4.
Согласно данным табл. 1, наибольшим таксономическим разнообразием характеризуются семейства Cephalobidae (6 родов), Tylenchidae (6 родов) и Plectidae (4 рода). Еще 5 семейств включают по 2 таксона, 23 семейства насчитывают по одному таксону. Таким образом, небогатые в таксономическом отношении семейства вносят значительный вклад в формирование общего таксономического состава фауны нематод региона. Из представленных в списке бóльшая часть таксонов нематод относится к группе бактериотрофов – 21 род, второе место занимают представители группы паразитов растений – 8 таксонов, причем разнообразие этой трофической группы претерпевает изменения в зависимости от типа исследованного биоценоза. Количество фитопаразитических видов в общем таксономическом списке минимально в степи (1 и 3 таксона) и далее возрастает в ряду “степь – кедрач – лиственничник”. Третье место по вкладу в общий таксономический список почвообитающих нематод биоценозов Алтая занимают представители трофической группы нематод, ассоциированных с растениями, т.е. связанных в своей трофике с растениями факультативно (6 таксонов); четвертое место делят микотрофы и хищные нематоды (по 5 таксонов в каждой группе). Политрофы представлены минимальным количеством (2 таксона). Также выявлен один род нематод (Steinernema) из группы паразитов беспозвоночных, личинки которых обитают в почве.
При рассмотрении относительного обилия отдельных родов почвенных нематод в исследованных биоценозах показано, что в сообществе нематод кедрача высокий уровень доминирования отмечен для нематод рода Lelenchus, ассоциированных с растениями, политрофов рода Eudorylaimus, бактериотрофов родов Plectus и Acrobeloides (табл. 1). В лиственничнике преобладали бактериотрофы рода Cervidellus и фитопаразиты рода Helicotylenchus. В биоценозе “степь-карагана карликовая” нематоды рода Eudorylaimus были наиболее обильными. Для сообщества нематод биоценоза “степь-чий” выявлено супердоминирование микотрофов рода Aphelenchoides, относительное обилие которого составило 63.6%. Отмеченное преобладание по численности таксона, относящегося к r-стратегам, подтверждается и высоким значением индекса доминирования Симпсона (табл. 2).
Плотность популяций и биомасса нематод
Плотность популяций почвенных нематод в кедраче и лиственничнике имела сходные значения (при р < 0.05 различия статистически незначимы), в степи – значимо снижалась (табл. 2). Расчет биомассы показал, что наиболее высокие значения характерны для кедрача; высокий показатель выявлен и для сообществ нематод лиственничника, тогда как для степи биомасса нематод очень низка.
Эколого-трофическая структура сообществ почвенных нематод
Эколого-трофическая структура сообществ почвообитающих нематод различалась между биоценозами: в почве кедрача преобладали бактериотрофы и нематоды, ассоциированные с растениями; в лиственничнике доминировали бактериотрофы, группы паразитов растений и микотрофов выступали в качестве субдоминантов. Сообщества нематод степи имели специфические черты и отличались от сообществ лесных биоценозов: здесь полностью доминировали микотрофы и/или политрофы, при этом структура сообществ была неполночленной (табл. 3).
Таблица 3.
Относительное обилие (%) эколого-трофических групп почвенных нематод исследованных биоценозов на территории Республики Алтай
| Параметр | Кедрач, n = 9 |
Лиственничник, n = 9 | Степь-чий, n = 6 |
Степь-карагана, n = 3 |
|---|---|---|---|---|
| Б | 34.60 ± 2.38b | 62.33 ± 3.45c | 8.96 ± 2.03a | 27.79 ± 2.83b |
| М | 6.04 ± 1.25a | 10.92 ± 1.96b | 76.24 ± 4.41c | 25.00 ± 4.64d |
| П | 12.68 ± 4.00ab | 5.02 ± 0.86a | 12.35 ± 2.54b | 41.67 ± 8.17c |
| Х | 0.28 ± 0.28a | 2.56 ± 0.99b | 0 | 0 |
| Аср | 36.19 ± 4.69b | 4.62 ± 1.19a | 0 | 0 |
| Пр | 10.20 ± 1.47b | 14.54 ± 2.02c | 2.47 ± 1.51a | 5.56 ± 2.47ab |
Анализ функциональных групп позволил выявить закономерности изменения состава таксонов с различными экологическими предпочтениями внутри отдельных эколого-трофических групп. Так, показано, что наибольшее таксономическое разнообразие характерно для бактериотрофов с с-р значением 2 (Б2) – от 5 до 10 таксонов и для группы нематод Аср2, обнаруженной только в лесных биоценозах – от 4 до 6 таксонов (табл. 1). Бактериотрофы с с-р значением 4 и хищные нематоды с с-р значениями 3, 4, по-видимому, из-за высокой требовательности к уровню влажности почвы также не выявлены в степных биоценозах. Разнообразие только нескольких функциональных групп было представлено равномерно – это микотрофы с с-р значением 2 (М2) и политрофы П4. Эти функциональные группы встречены во всех изученных биоценозах и представлены равным числом таксонов. Наибольшее количество функциональных групп (16) зафиксировано в лиственничнике. Также в качестве особенности данного биоценоза следует отметить присутствие в фауне нематод К-стратегов, выявленных среди различных трофических групп – фитопаразитов (Пр4), микотрофов (М3, М4), политрофов (П5), хищников (Х5). При этом наименьшее количество функциональных групп (4) обнаружено в степном биоценозе с караганой.
Принимая во внимание различия эколого-трофического группирования и функциональных групп сообществ нематод исследованных биоценозов, для определения специфичности сообществ применен метод главных компонент. Ординация выполнена на основе относительного обилия функциональных групп нематод. Показано, что первая главная компонента объясняет более 70% общей дисперсии и связана с вкладом бактериотрофов со значением 2 по c-p шкале (Б2) и группы нематод М2 в фауну (рис. 1). Значительно меньшая часть различий (около 16% – вдоль второй главной компоненты) обусловлена долей нематод Аср2 в сообществах, с одной стороны, и политрофов П4, с другой. При ординации биоценозов видно, что большинство проб характеризуется высоким обилием бактериотрофов Б2 с максимумом в лиственничнике, за исключением обособленного сообщества нематод “степь-чий”, где преобладают микотрофы М2. При этом биоценоз “степь-карагана” также характеризуется высоким вкладом нематод М2 в фауну, но его положение при ординации определяют более многочисленные нематоды-политрофы П4. Пробы из кедрача обособляются, главным образом, из-за высокого обилия нематод, ассоциированных с растениями Аср2.
Рис. 1.
Ординация сообществ почвенных нематод различных биоценозов на территории Республики Алтай на основе относительного обилия функциональных групп. Первая (ГК 1) и вторая (ГК 2) главные компоненты объясняют около 86% различий. На диаграмме (биплоте) обозначены только основные оси факторных нагрузок, вносящие наибольший вклад в разделение объектов (биоценозов).
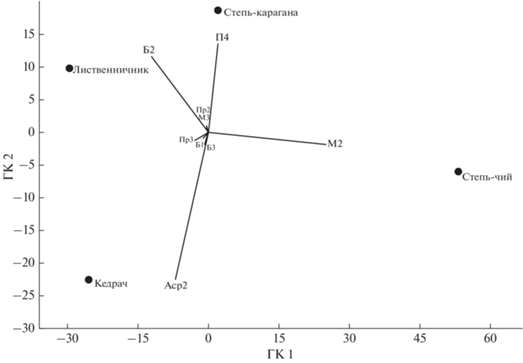
Степные биоценозы характеризуются суровыми и даже экстремальными условиями для существования организмов, что особенно ярко проявилось на комплексе нематологических параметров биоценоза “степь-карагана карликовая” (численность, биомасса и разнообразие нематод крайне низки). По этим причинам биоценоз был изъят из дальнейшего анализа нематодофауны из-за риска неправильной трактовки значений эколого-популяционных индексов сообществ почвенных нематод.
Эколого-популяционные индексы сообществ почвенных нематод
Расчет эколого-популяционных индексов показал, что сообщества нематод всех исследованных биоценозов характеризовались довольно низкими значениями индекса зрелости ΣMI (табл. 4). Индекс структурирования SI в кедраче и лиственничнике имел высокие значения (выше 50), свидетельствующие о зрелости сообществ почвенных нематод и ненарушенности почвенных экосистем лесов. А сообщество нематод степного биоценоза характеризовалось низким индексом SI. Значения индекса EI указывают на отсутствие привнесения в почву большого количества свежей (доступной) органики. Активное разложение органического вещества первичными деструкторами влечет за собой увеличение количества нематод-бактериотрофов с с-р значением 1, которое в данном случае не наблюдалось. Во всех исследованных биоценозах уровень обогащения почвы доступной органикой определен как умеренный. Индекс преобладающего пути разложения органики в почве различался по типам биоценозов: в кедраче и лиственничнике определены низкие значения CI, указывающие на активное участие бактерий в деструкции органики, и, соответственно, в нематодофауне отмечается высокая доля бактериотрофов; в степи значения индекса высоки, что свидетельствует о доминировании почвенных грибов в разложении органики.
Таблица 4.
Эколого-популяционные индексы сообществ почвенных нематод исследованных биоценозов на территории Республики Алтай
| Параметр | Кедрач, n = 9 |
Лиственничник, n = 9 | Степной биоценоз, n = 6 |
|---|---|---|---|
| ΣMI | 2.37 ± 0.13a | 2.31 ± 0.10a | 2.25 ± 0.08a |
| SI | 72.99 ± 8.09a | 50.61 ± 4.56a | 48.02 ± 5.54a |
| EI | 35.79 ± 5.26ab | 28.11 ± 3.54a | 48.30 ± 0.96b |
| CI | 32.51 ± 13.42a | 27.36 ± 12.81a | 96.86 ± 1.88a |
| Сопоставление SI и EI (по: Ferris et al., 2001) | Высокий SI, низкий EI (квадрат С фаунистического профиля) | Высокий SI, низкий EI (квадрат С фаунистического профиля) | Низкий SI, низкий EI (квадрат D фаунистического профиля) |
Примечания. n – число исследованных биоценозов; ΣMI – индекс зрелости сообществ нематод; SI и EI – индексы структурирования и обогащения почвенной трофической сети, соответственно; CI – индекс преобладающего пути разложения органического вещества в почве. Значения с разными буквенными обозначениями в строках статистически различаются (р < 0.05).
Сопоставление значений индексов SI и EI для каждого местообитания позволило распределить исследованные биоценозы в определенные квадраты фаунистического профиля (Ferris et al., 2001): квадрат C для лесных биоценозов и квадрат D для степного биоценоза (табл. 4). На основании этого почвенные экосистемы лесных биоценозов были оценены как ненарушенные со сложными трофическими сетями и умеренным уровнем обогащения почв органикой. Биоценоз “степь-чий”, напротив, характеризовался значениями индексов, свидетельствующими об упрощенной и нестабильной трофической сети и деградированной почвенной экосистеме. А значит экосистема испытывала воздействие неблагоприятных или даже экстремальных (климатических или антропогенных) факторов среды.
ОБСУЖДЕНИЕ
Исследование таксономического разнообразия нематод, численности их популяций и других характеристик сообществ позволило получить новые данные о фауне нематод лесных и степных биоценозов Республики Алтай.
Анализ численности почвенных нематод Алтая выявил наименьшую плотность популяций в почве степных биоценозов, что согласуется со сведениями литературы: для биома степей в глобальном масштабе также показана низкая плотность популяций нематод (van den Hoogen et al., 2019). Установлено высокое таксономическое разнообразие лесных биоценозов региона, которое сопоставимо с широколиственными лесами Центрального региона РФ (Калинкина и др., 2016; Сущук и др., 2017), луговыми биоценозами Северо-Запада (Матвеева, Сущук, 2016), целинными сухостепными биоценозами Ростовской обл. (Шматко и др., 2021). Низкое разнообразие нематодофауны исследованных степных биоценозов отражает неблагоприятные условия местообитания для педобионтов. Такая закономерность отмечена и для тундровых биоценозов Субарктики, которые также отличаются низким разнообразием почвенных нематод вследствие экстремальных условий существования организмов (Сущук и др., 2018).
При рассмотрении эколого-трофической структуры сообществ нематод участка кедровой тайги выявлено преобладание в почве нематод, ассоциированных с растениями, и бактериотрофов. Для сосняков, сформированных Pinus sylvestris L., наиболее типична высокая численность бактериотрофов, микотрофов и нематод из группы Аср (Матвеева, Сущук, 2016; Magnusson, 1983; Háněl, 2001; Sohlenius, Bostrom, 2001), однако в местах произрастания других видов сосен структура сообщества нематод может отличаться. Так, доминированию в структуре сообществ почвенных нематод политрофов и бактериотрофов благоприятствовала сосна горная (Pinus mugo Turra) (Mincheva et al., 2009) и сосна Тунберга (Pinus thunbergii Parl.) (Kitagami et al., 2017), политрофам и нематодам Аср – посадки сосны лучистой (Pinus radiata D. Don) (Yeates et al., 2000). Имеются результаты собственных исследований, проведенных в местах интродукции сосны кедровой на Северо-Западе России (Калинкина и др., 2016; Сущук и др., 2016), однако они не выявили особенностей сообществ нематод естественных хвойных лесов, образованных данным видом.
Сообщество почвенных нематод исследованного лиственничника характеризовалось доминированием бактериотрофов, паразитов растений и микотрофов в трофической структуре и в значительной степени отличалось от сообщества нематод кедрача. В частности, различия связаны со значительно более высоким обилием нематод Аср в кедраче. Согласно литературным данным сообщества почвенных нематод в местах произрастания лиственницы также имели особенности, отличающие их от сообществ нематод других видов хвойных деревьев, что было показано как на локальном уровне при изучении фитогенного поля дерева (Калинкина и др., 2018), так и в условиях посадок большой площади (Háněl, 2008). При сравнении фитогенного поля лиственницы и ели показано, что разнообразие и численность нематод Пр и Аср в подкроновом пространстве лиственницы выше, чем под елью. Высказана гипотеза о связи полученной закономерности с большей сквозистостью кроны лиственницы (по сравнению с елью), которая коррелирует с бóльшим проективным покрытием и разнообразием травянистых видов. Развитый травяной покров, в свою очередь, благоприятствует нематодам, трофически связанным с растениями (Калинкина и др., 2018). Сведения о численности нематод Аср в почвах под лиственницей различны: отмечалась как высокая численность нематод данной группы (Калинкина и др., 2018; Boag, 1974; Renco, Cerevkova, 2015), что в целом характерно для сообществ нематод хвойных лесов (Матвеева, Сущук, 2016), так и довольно низкая, что является нетипичным для ельников и сосняков (Háněl, 2008).
Известно, что хвойные леса обычно характеризуются высокими значениями индекса CI, свидетельствующими о значительной активности почвенных грибов в деструкции органики (Матвеева, Сущук, 2016). Органическое вещество в хвойных лесах в основном представлено накопленными в подстилке трудноразлагаемыми растительными остатками, для трансформации которых необходимы почвенные грибы (Звягинцев и др., 2005). При этом показано и высокое варьирование показателя CI в хвойных лесах (Ruess, 2003; Háněl, 2008). Полученные нами результаты для кедрача и лиственничника отличаются от литературных данных: индекс CI в данных биотопах имел низкие значения, указывающие на бактериальный путь разложения органики. Возможно, бóльшая роль бактериального разложения связана с лучшими показателями структуры почвы и ее плодородия и хорошо выраженным травяным ярусом. Травяной ярус образован разнотравьем как в кедраче, так и в лиственничнике. В подлеске последнего также отмечены спирея и жимолость, формирующие листовой опад. Ранее исследованные сосняки и ельники Республики Карелия характеризовались доминированием мхов, лишайников, карликовых кустарничков в травяно-кустарничковом ярусе и низким проективным покрытием высших растений, что и могло определить преобладание микодеструкции в почве, а значит и различия в полученных для Карелии и Алтая результатах.
Как указывалось выше, в исследованных степных биоценозах были выявлены низкие значения таксономического разнообразия и численности почвообитающих нематод, что может быть связано со сложными природно-географическими и климатическими условиями местности. В эколого-трофической структуре сообщества нематод степного биоценоза, согласно полученным данным, доминировали микотрофы и политрофы. По литературным источникам можно сделать вывод, что для степей более типична структура сообществ почвообитающих нематод с преобладанием паразитов растений и бактериотрофов (Шматко, Ильина, 2017; Smolik, Rogers, 1976; Wall-Freckman, Huang, 1998; Zhang et al., 2020). Однако было отмечено и доминирование политрофов и бактериотрофов в биотопе с типчаково-ковыльно-разнотравной растительностью (Шматко, Ильина, 2017). Микотрофы как трофическая группа-доминант не указывается в сведениях исследователей сообществ нематод степных ландшафтов разных стран, но в условиях полевых экспериментов показана устойчивость микотрофов к повышению температуры и снижению количества осадков как в пустынной степи (Zhang et al., 2020), так и в лугах субаридного региона (Bakonyi, Nagy, 2000). Также в лабораторном эксперименте выявлена наибольшая численность микотрофа рода Aphelenchoides в наиболее сухих пробах, несмотря на то что биомасса гриба возрастает пропорционально увеличению влажности (Sohlenius, 1985). Интересные результаты получены на основе прогностической модели, связывающей различные климатические параметры и метаболические отпечатки нематод (Bhusal et al., 2015). Так, согласно построенной модели, больший вклад микотрофов (и, соответственно, меньший – бактериотрофов) в процессы деструкции органики можно ожидать в открытых местообитаниях с луговой растительностью и в регионах с выраженной сезонностью климата. Известно, что организмы, участвующие в грибном пути разложения органики, более устойчивы и в большей степени способны адаптироваться к изменению климата, связанного с засухой (de Vries et al., 2012). При этом грибы имеют большое значение для процессов разложения органического вещества почвы в суровых условиях окружающей среды средиземноморских экосистем, для которых модели предсказывают более засушливые условия в будущем (Yuste et al., 2011). Резюмируя вышесказанное, выявленная структура сообществ нематод с доминированием микотрофов и высокие значения индекса CI, указывающие на грибной путь в разложении органики, могут рассматриваться как ожидаемые в условиях резко-континентального климата степи Кош-Агачского р-на, где годовая норма осадков не превышает 250 мм. Таким образом, нематологические параметры в комплексе закономерно свидетельствуют о складывающихся в степи неблагоприятных условиях для обитания педобионтов.
Фаунистический профиль, составленный на основе сопоставления значений индексов SI и EI, определил почвенную экосистему степного биоценоза как деградированную с упрощенной и нестабильной трофической сетью. Полученные для степи данные согласуются с концепцией Ферриса с соавторами (Ferris et al., 2001). Эти исследователи ввели термин “базальная трофическая сеть” для обозначения примитивной сети, представленной нематодами с широкой экологической пластичностью с c-p = 2, главным образом бактериотрофами и микотрофами. Простоту сети авторы связывают с фактором стресса, к которому относится и ограничение ресурсов, и экстремальные условия среды обитания.
ЗАКЛЮЧЕНИЕ
Исследование фауны и структуры сообществ почвенных нематод хвойных лесных и степных биоценозов Республики Алтай, территории, малоизученной с нематологической точки зрения, позволило получить новые данные о разнообразии и распространении нематод. Фауна почвенных нематод исследованных биоценозов разных типов на территории Республики Алтай представлена 49 таксонами нематод, относящимися к 31 семейству. Составленный таксономический список почвенных нематод позволил расширить представления о разнообразии почвообитающих нематод Западной Сибири. Полученные данные могут быть использованы для разработки основ мониторинга биоразнообразия и состояния окружающей среды в условиях глобальных климатических изменений и антропогенных воздействий.
Выполненное исследование позволило также установить связь ряда нематологических параметров с особенностями растительности. Показано, что лиственничник имеет высокое, а степные биоценозы – самое низкое таксономическое разнообразие нематод. Плотность популяций и биомасса почвенных нематод в исследованных лесных биоценозах имеют сходные значения, но значимо превышают таковые в степи. Кроме того, выявлены различия биоценозов по эколого-трофической структуре сообществ нематод. Полученные различия нематологических параметров являются результатом влияния комплекса условий, складывающихся в исследованных биоценозах: суровый климат и/или значительная средообразующая роль древесных видов. Эти условия сказываются на различных характеристиках среды обитания педобионтов, таких как растительный покров, обеспеченность водными ресурсами, поступление света, минеральных и органических веществ, а также структура почвы, уровень засоления и т.д.
Получены интересные результаты по индексу преобладающего пути разложения органики. В почве исследованных лесных биоценозов региона индекс CI имел низкие значения (активное участие бактерий в деструкции органики). Такой тип деструкции не характерен для большинства хвойных лесов, например, изученных в Республике Карелия.
Рассмотренные эколого-популяционные индексы позволили оценить почвенные экосистемы исследованных лесных биоценозов как ненарушенные со сложными трофическими сетями и умеренным уровнем обогащения почв органикой. Степной биоценоз, образованный чием блестящим, напротив, характеризовался низкими значениями индексов SI и EI. Эти параметры свидетельствуют об упрощенной и нестабильной трофической сети и деградированной почвенной экосистеме. А значит экосистема испытывала воздействие неблагоприятных факторов среды, связанных с экстремальными условиями степи Кош-Агачского района.
Список литературы
Ачимова А.А., 2005. Флора левобережья р. Катунь (Центральный Алтай). Автореф. дис. … канд. биол. наук. Новосибирск. 16 с.
Груздева Л.И., Матвеева Е.М., Коваленко Т.Е., 2006. Фауна почвенных нематод различных типов леса заповедника “Кивач” // Труды Карельского научного центра РАН. Вып. 10. С. 14–21.
Ерошенко А.С., Волкова Т.В., 2004. Эколого-фаунистический анализ корневых нематод хвойно-широколиственных лесов Уссурийского заповедника // Паразитические нематоды растений и насекомых. М.: Наука. С. 32–45.
Ефремова Е.А., Марченко В.А., 2017. Гельминты подотряда Strongylata овец и особенности их территориального распределения в Республике Алтай // Ветеринарный врач. № 4. С. 53–59.
Звягинцев Д.Г., Бабьева И.П., Зенова Г.М., 2005. Биология почв: Учебник. М.: Изд-во МГУ. 445 с.
Калашникова С.А., Карташев А.Г., 2018. Структура сообществ почвенных нематод в верхних горизонтах почвы ели и сосны // Вестник современных исследований. № 2.2 (17). С. 18–21.
Калинкина Д.С., Сущук А.А., Матвеева Е.М., 2016. Особенности сообществ почвенных нематод в условиях интродукции древесных растений // Экология. № 5. С. 360–367.
Калинкина Д.С., Сущук А.А., Криворот И.В., 2018. Особенности сообществ почвенных нематод в различных зонах фитогенного поля дерева // Труды Центра паразитологии. T. L. Биоразнообразие паразитов. М.: Товарищество научных изданий КМК. С. 95–97.
Кравченко И.А., Власова О.Е., 2011. Паразиты экзотических животных в Алтайском крае // Вестник ветеринарии. № 4 (59). С. 68–69.
Кудрин А.А., Лаптева Е.М., 2015. Разнообразие и плотность населения почвенных нематод в пойменных лесах долины среднего течения реки Печора // Вестник ИБ Коми НЦ УрО РАН. № 5 (193). С. 25–29.
Кудрин А.А., Конакова Т.Н., Таскаева А.А., 2019. Сообщества почвенных нематод различных тундровых фитоценозов, отличающихся степенью развития кустарникового яруса // Экология. № 6. С. 419–428.
Матвеева Е.М., Сущук А.А., 2016. Особенности сообществ почвенных нематод в различных типах естественных биоценозов: информативность параметров оценки // Известия РАН. Серия Биологическая. № 5. С. 551–560.
Мударисова М.Р., 2016. Экзогенные процессы рельефообразования в бассейне среднего течения реки Чуя. Выпускная бакалаврская работа. Томск. 48 с. URL: https://vital.lib.tsu.ru/vital/access/manager/Repository/vital:2530
Одум Ю., 1975. Основы экологии. Пер. с англ. М.: Мир. С. 186–187.
Пономарев Н.М., Лунева Н.А., 2018. Фауна нематод, паразитирующих у сельскохозяйственных животных Алтайского края // Вестник Алтайского государственного аграрного университета. № 1 (159). С. 134– 137.
Ремезов А.О., 2005. Древесные нематоды: распространение и оценка степени их патогенности для хвойных пород в Алтайском крае и Республике Алтай. Автореф. дис. … канд. биол. наук. Барнаул. 19 с.
Робертус Ю.В., Яшина Т.В., Байлагасов Л.В., Артемов И.А., Дьяков И.Б. и др., 2012. Особо охраняемые природные территории Республики Алтай. Современное состояние и перспективы развития. Красноярск: Всемирный фонд дикой природы (WWF) России. 118 с.
Соловьева Г.И., 1986. Экология почвенных нематод. Л.: Наука. 247 с.
Сущук А.А., Калинкина Д.С., Платонова Е.А., 2016. Сообщества почвенных нематод в условиях интродукции древесных растений на территории Ботанического сада Петрозаводского государственного университета // Hortus Botanicus. Т. 11. С. 184–197. URL: http://hb.karelia.ru/journal/article.php?id=3442
Сущук А.А., Матвеева Е.М., Калинкина Д.С., 2017. Почвенные нематоды лесных биоценозов особо охраняемых природных территорий Республики Карелия // Труды Карельского научного центра РАН. № 4. С. 49–61.
Сущук А.А., Матвеева Е.М., Калинкина Д.С., Криворот И.В., 2018. Сообщества почвенных нематод тундровых и таежных экосистем (на примере Северо-Запада России) // Проблемы почвенной зоологии: материалы XVIII Всерос. совещ. М.: Товарищество научных изданий КМК. С. 196–197.
Шматко В.Ю., Ильина Л.П., 2017. Особенности эколого-фаунистического комплекса почвенных нематод сухостепных ландшафтов долины Маныча // Аридные экосистемы. Т. 23. № 3 (72). С. 75–87.
Шматко В.Ю., Сушко К.С., Соколова Т.А., Ильина Л.П., 2021. Сезонная динамика структуры сообществ почвенных нематод каштановых почв долины Маныча при пастбищной нагрузке // Аридные экосистемы. Т. 27. № 1 (86). С. 106–118.
Abebe E., Andrássy I., Traunspurger W., 2006. Freshwater nematodes: ecology and taxonomy. Wallingford: CABI Publishing. 752 p.
Bakonyi G., Nagy P., 2000. Temperature- and moisture-induced changes in the structure of the nematode fauna of a semiarid grassland – patterns and mechanisms // Global Change Biology. V. 6. P. 696–707.
van Bezooijen J., 2006. Methods and techniques for nematology. Wageningen: Wageningen University Press. 112 p.
Bhusal D.R., Tsiafouli M.A., Sgardelis S.P., 2015. Temperature-based bioclimatic parameters can predict nematode metabolic footprints // Oecologia. V. 179. № 1. P. 187–199.
Boag B., 1974. Nematodes associated with forest and woodland trees in Scotland // Annals of applied biology. V. 77. P. 41–50.
Bongers T., 1990. The maturity index: an ecological measure of environmental disturbance based on nematode species composition // Oecologia. V. 83. P. 14–19.
De Ley P., Blaxter M., 2004. A new system for Nematoda: combining morphological characters with molecular trees, and translating clades into ranks and taxa // Nematology Monographs and Perspectives. V. 2. P. 633–653.
de Vries F.T., Liiri M.E., Bjørnlund L., Bowker M.A., Christensen S. et al., 2012. Land use alters the resistance and resilience of soil food webs to drought // Nature Climate Change. V. 2. P. 276–280.
Ferris H., Bongers T., de Goede R.G.M., 2001. A framework for soil food web diagnostics: extension of the nematode faunal analysis concept // Applied Soil Ecology. V. 18. P. 13–29.
Hammer Ø., Harper D.A.T., Ryan P.D., 2001. Past: paleontological statistics software package for education and data analysis // Palaeontologia Electronica. V. 4 (1). P. 1–9. http://palaeo-electronica.org/2001_1/past/issue1_01.htm
Háněl L., 2001. Succession of soil nematodes in pine forests on coal-mining sands near Cottbus, Germany // Applied Soil Ecology. V. 16. P. 23–34.
Háněl L., 2008. Nematode assemblages indicate soil restoration on colliery spoils afforested by planting different tree species and by natural succession // Applied Soil Ecology. V. 40. P. 86–99.
van den Hoogen J., Geisen S., Routh D., Ferris H., Traunspurger W. et al., 2019. Soil nematode abundance and functional group composition at a global scale // Nature. V. 572. P. 194–198.
Kitagami Y., Kanzaki N., Matsuda Y., 2017. Distribution and community structure of soil nematodes in coastal Japanese pine forests were shaped by harsh environmental conditions // Applied Soil Ecology. V. 119. P. 91–98.
Magnusson C., 1983. Abundance and trophic structure of pine forest nematodes in relation to soil layers and ground cover // Holarctic Ecology. V. 6. № 2. P. 175–182.
Mincheva Y., Lazarova S., Peneva V., 2009. Nematode assemblages from Mountain Pine (Pinus mugo Turra) communities in Pirin Mountain, Bulgaria // Helminthologia. V. 46. № 1. P. 49–58.
Raabe U., Brandes D., 1988. Flora und Vegetation der Dörfer im nordöstlichen Burgenland // Phytocoenologia. V. 16. № 2. P. 225–258.
Renco M., Cerevkova A., 2015. Long-term effects of a wildfire on the soil nematode communities in the spruce forest ecosystem of High Tatra National Park // International Journal of Wildland Fire. V. 24. P. 702–711.
Ruess L., 2003. Nematode soil faunal analysis of decomposition pathways in different ecosystems // Nematology. V. 5. № 2. P. 179–181.
Sieriebriennikov B., Ferris H., de Goede R.G.M., 2014. NINJA: An automated calculation system for nematode-based biological monitoring // European Journal of Soil Biology. V. 61. P. 90–93.
Smolik J.D., Rogers L.E., 1976. Effects of Cattle Grazing and Wildfire on Soil-Dwelling Nematodes of the Shrub-Steppe Ecosystem // Journal of range management. V. 29. № 4. P. 304–306.
Sohlenius B., 1985. Influence of Climatic Conditions on Nematode Coexistence: A Laboratory Experiment with a Coniferous Forest Soil // Oikos. V. 44. № 3. P. 430–438.
Sohlenius B., Bostrom S., 2001. Annual and long-term fluctuations of the nematode fauna in a Swedish Scots pine forest soil // Pedobiologia. V. 45. P. 408–429.
Sushchuk A.A., Matveeva E.M., Butorina N.N., Popova E.N., Popov I.O., Gagarin V.G., 2019. Comparative analysis of the soil nematode communities in meadows and agrocenoses: regional features // Russian Journal of Nematology. V. 27. № 2. P. 156–157.
Wall-Freckman D., Huang S.P., 1998. Response of the soil nematode community in a shortgrass steppe to long-term and short-term grazing // Applied Soil Ecology. V. 9. P. 39–44.
Yeates G.W., Bongers T., de Goede R.G.M., Freckman D.W., Georgieva S.S., 1993. Feeding habits in soil nematode families and genera: An outlain for soil ecologists // Journal of Nematology. V. 25. № 3. P. 315–331.
Yeates G.W., Wardle D.A., Watson R.N., 1993a. Relationships between nematodes, soil microbial biomass and weed-management strategies in maize and asparagus cropping systems // Soil Biology and Biochemistry. V. 25. № 7. P. 869–876.
Yeates G.W., Hawke M.F., Rijkse W.C., 2000. Changes in soil fauna and soil conditions under Pinus radiata agroforestry regimes during a 25-year tree rotation // Biology and Fertility of Soils. V. 31. P. 391–406.
Yuste J.C., Penuelas J., Estiarte M., Garcia-Mas J., Mattana S., et al., 2011. Drought-resistant fungi control soil organic matter decomposition and its response to temperature // Global Change Biology. V. 17. P. 1475–1486.
Zhang G., Sui X., Li Y., Jia M., Wang Zh., Han G., Wang L., 2020. The response of soil nematode fauna to climate drying and warming in Stipa breviflora desert steppe in Inner Mongolia, China // Journal of Soils and Sediments. V. 20. P. 2166–2180.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал


