Зоологический журнал, 2022, T. 101, № 11, стр. 1305-1316
Рукокрылые (Chiroptera) на озерно-речных системах севера Европейской части России
В. В. Белкин a, В. А. Илюха a, Е. А. Хижкин a, *, А. Н. Ляпунов b, А. О. Толстогузов a
a Институт биологии КарНЦ РАН
185910 Петрозаводск, Россия
b Центр дистанционного образования детей
610044 Киров, Россия
* E-mail: hizhkin84@mail.ru
Поступила в редакцию 14.02.2022
После доработки 14.04.2022
Принята к публикации 18.04.2022
- EDN: IOWGDQ
- DOI: 10.31857/S0044513422100038
Аннотация
В 2016–2020 гг. изучали видовой состав и распространение рукокрылых в Республике Карелия и Архангельской области, особенности использования летучими мышами водных объектов различных категорий. Апробирован метод точечного учета с использованием пассивного ультразвукового детектора на 90 озерах и 192 реках при проведении ночных автомобильных маршрутных учетов (5810 км). В подзоне средней тайги Карелии выполнены 14 учетов рукокрылых на берегах озер и рек с использованием паутинных сетей и ультразвукового детектора, а также 15 водных учетов с детектором на модельном водоеме с моторной лодки. На стоячих водоемах и водотоках зарегистрировано 234 случая идентификации летучих мышей, на модельном водоеме – 88 случаев, паутинными сетями отловлено 90 летучих мышей. На озерно-речных системах зарегистрирован весь перечень рукокрылых региона, определены самые северные точки их регистрации: M. nattereri и M. brandtii/mystacinus 64.120° N, M. daubentonii и M. dasycneme – 64.870° N, E. nilssonii – 66.275° N. В широтном направлении на озерно-речных системах Карелии отмечены ультразвуковые сигналы P. auritus и N. noctula до 66.275° N, а сигналы V. murinus – до 65.218° N, что значительно севернее видовых ареалов, показанных на картах МСОП (IUCN Red List). Относительное обилие рукокрылых на озерно-речных системах севера европейской части России определяется фактором “видовая принадлежность” (η = 89.7%, F = 8.73, p < 0.01). На всех категориях водных объектов в регионе и его частях прослеживается общая закономерность – преобладание в сообществах рукокрылых E. nilssonii. Встречаемость летучих мышей на озерно-речных системах Севера составляет 56.4% и определяется факторами “видовая принадлежность” (η = 47.0%, F = 15.57, p < 0.0001), географическое расположение частей региона (η = 22.9%, F = 52.54, p = 0.001), а также совместным влиянием этих факторов (η = 16.9%, F = 5.54, p < 0.05). Показана зависимость показателей встречаемости и относительного обилия рукокрылых (%) от ряда природных факторов, выявлены некоторые региональные и зональные особенности в системе “водные объекты–рукокрылые”.
Озерно-речные системы Европейского Севера России – важнейший элемент ландшафта, который используется для нагула и водопоя всеми видами рукокрылых региона. Стоячие водоемы и водотоки, наряду с прибрежными местообитаниями (водоохранные леса), имеют исключительную значимость как экологические русла расселения видов (Громцев и др., 2009). В отличие от более южных регионов России и западной Европы, север России обладает обширной гидрологической сетью и, как следствие, большей доступностью для рукокрылых.
На территории, расположенной в пределах Балтийского кристаллического щита (Республика Карелия, РК) и Русской равнины (Архангельская обл.), эта систематическая группа животных оказалась наименее изученной в фаунистическом и зоогеографическом отношении (Богдарина, Стрелков, 2003). Заполнению такого пробела способствуют широкие возможности использования акустических наблюдений в экологических исследованиях (Jones et al., 2013), в том числе и на северных пределах распространения видов (Белкин и др., 2018; Michaelsen, 2016; Tidenberg et al., 2019; Rydell et al., 2020). Они позволяют более оперативно фиксировать происходящие динамические процессы в видовом составе и распространении отдельных видов рукокрылых, выявлять некоторые общие и региональные особенности их экологии.
Цель работы – изучение пространственных закономерностей состояния сообществ летучих мышей на озерно-речных системах севера европейской части России. Нами были поставлены задачи: изучение с использованием статического ультразвукового детектора видового состава, распространения, встречаемости и относительного обилия рукокрылых на озерах и реках региона и его частей; изучение видовых особенностей использования рукокрылыми стоячих водоемов и водотоков; изучение влияния размерных характеристик водных объектов на показатели использования их летучими мышами. В работе проверена гипотеза о возможности и эффективности кратковременной акустической съемки летучих мышей на озерно-речных системах в процессе автомобильных маршрутных учетов для решения зоогеографических и экологических задач. Среди них – сохранение стабильности высоких показателей встречаемости и относительного обилия доминирующего вида – северного кожанка (Eptesicus nilssonii (Keyserling Blasius 1839)), а также увеличение этих показателей у водяной ночницы (Myotis daubentonii (Kuhl 1817)) и прудовой ночницы (Myotis dasycneme (Boie 1825)) в характерной для них среде обитания.
Отечественными исследователями рукокрылых подобные задачи не ставились и не решались. Как правило, работы сводились к изучению летучих мышей с использованием паутинных сетей или их комбинации с ультразвуковой регистрацией рукокрылых на отдельных водоемах и водотоках заповедников и национальных парков подзоны южной тайги, подтаежных и широколиственных лесов (Vlaschenko et al., 2016; Belkin et al., 2021). Большинство зарубежных исследований, так же как и в России, базировались на сборе материалов на отдельных водных объектах, на локальных территориях и посвящены одному или нескольким видам рукокрылых, чаще всего M. daubentonii (Salvarina, 2016). Результаты таких работ зачастую не позволяют использовать их для экстраполяции на другие водные объекты и более обширные территории.
Автомобильные маршрутные учеты с ультразвуковым детектором летучих мышей апробированы в западной Европе и в центральной России достаточно давно (Jones et al., 2013), но лишь в Словакии (Cel’uch et al., 2016) одновременно с маршрутным проведен учет летучих мышей на водных объектах, а в северной Финляндии (Siivonen, Wermundsen, 2008) – специальный учет рукокрылых на серии водоемов и водотоков. При этом результаты работ в Финляндии отражают регистрацию видов на 26 озерах и реках в широтном градиенте, а в Словакии – относительное обилие летучих мышей в целом на 1040 км маршрутов. В этом исследовании мы сконцентрировали внимание на интегрированном анализе результатов точечной регистрации рукокрылых на широкой выборке стоячих водоемов и водотоков. Такой подход, наряду с масштабом охваченных учетом территорий, можно считать новаторским как для российских, так и для зарубежных исследований летучих мышей.
МАТЕРИАЛЫ И МЕТОДЫ
Полевые работы проведены в различающихся по геологическому строению и рельефу Республике Карелия (Балтийский кристаллический щит) и Архангельской обл. (Русская равнина). На территории Карелии и Архангельской обл. зарегистрировано 61.1 и 59.4 тыс. озер, 23.6 и 71.8 тыс. рек соответственно. Озерность Карелии (суммарная площадь поверхности озер, % от общей площади республики) составляет 11.4%, Архангельской обл. – на порядок ниже (1.0%). В обеих частях региона преобладают малые озера площадью до 10 км2 (Карелия 99.8%, Архангельская обл. 93.0%). Густота речной сети на обеих территориях одинакова – 0.5–0.6 км/км2. В Карелии реки мелкие и порожистые, в Архангельской обл. – равномерного типа с плавным продольным профилем (Назарова и др., 2003; Громцев и др., 2019; Попов и др., 2020).
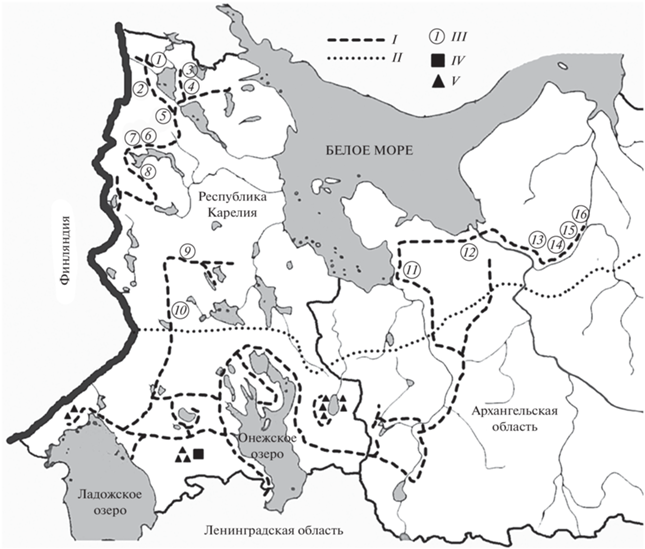
Протяженность ночных автомобильных маршрутов по учету рукокрылых в конце июля–в августе 2016–2019 гг. составила 5810 км (рис. 1). Маршруты проходили вдоль 90 стоячих водоемов (озера), среди которых 30 ламб (мелких озер диаметром от 100 до 300 м без видимого стока воды), и через 192 водотока (ручьи и реки с шириной русла от 3 до 120 м). В Карелии учет проведен на 77 стоячих водоемах и 134 водотоках, в Архангельской обл. – на 13 и 58 водных объектах, соответственно.
Рис. 1.
Распределение учетных маршрутов на севере европейской части России: I – учетные маршруты, II – граница подзон средней и северной тайги, III – самые северные точки регистрации (1–16) рукокрылых на озерно-речных системах, IV – модельный водоем оз. Каскеснаволокское, V – места отлова рукокрылых паутинными сетями.
Автомобильные учеты предусматривали остановки на всех мостах через пересекавшие маршрут водотоки и на берегу водоемов, находившихся в непосредственной близости (5–20 м). Продолжительность учета 5 мин (Cel’uch et al., 2016). При большой ширине русла водотока и для регистрации видов со слабым ультразвуковым сигналом учеты проводились на двух концах моста по 5 мин на каждый учет. Аналогичные по продолжительности точечные учеты рукокрылых на автомобильных маршрутах ранее апробировались на остановках вне водных объектов (Fisher-Phelps et al., 2017).
В подзоне средней тайги Карелии в 2018–2020 гг. с конца июля по середину августа проведено 14 учетов рукокрылых на 6 стоячих водоемах и 4 водотоках с использованием паутинных сетей. Эти учеты начинали за 1 час до захода солнца и заканчивали в 3 часа ночи. Отловлено 90 экз. летучих мышей. В 2016–2018 гг. с мая по октябрь выполнено 15 учетов рукокрылых на модельном водоеме с использованием ультразвукового детектора в сочетании с визуальными наблюдениями. Ночные учеты с моторной лодки, как и на автомобильных маршрутах, начинали через 45 мин после захода солнца. На озере продолжительность каждого учета составила 1.5–2 ч. На автомобильных маршрутах учеты заканчивали за 30 мин до восхода солнца. Учет на модельном водоеме проводили на удалении 20–30 м от изрезанной береговой линии длиной 12.6 км. Скорость движения около 10 км/ч – была обусловлена характером береговой линии, малой глубиной озера и изобилием зарослей макрофитов. Для определения видового состава и относительного обилия рукокрылых сопоставляли несколько показателей: видовую идентификацию, время регистрации летучих мышей и время прохождения береговых контрольных точек, время и расстояние между смежными регистрациями одного вида, характер полета и размеры рукокрылых. За три летних сезона на модельном водоеме зарегистрировано 88 случаев идентификации летучих мышей, что, вероятно, можно оценивать как минимальный показатель.
Для проверки объективности регистрации рыжей вечерницы (Nyctalus noctula (Schreber 1774)) и характеристик ее эхолокационных сигналов на севере европейской части России мы использовали наши учеты в конце июля 2020–2021 гг. в Ленинградской обл. (окрестности г. Старый Петергоф – 59.896° N, 29.839° E). Учет летучих мышей проводили на берегу небольшого пруда с использованием паутинных сетей и ультразвукового детектора. Отловлено 112 экз., среди которых 9 N. noctula.
На учетах применяли статический ультразвуковой детектор Song Meter SM2 Bat+ (США) с всенаправленным выносным микрофоном. Использовалась система прямой записи, которая с высокой скоростью дискретизации оцифровывает звук полного спектра на носитель. Диапазон записываемых сигналов 8–120 кГц. Определение видов осуществлялось в автоматическом режиме с помощью программного обеспечения Kaleidoscope Pro ver. 3.1.1., которое идентифицирует и удаляет шумовые файлы, выделяет файлы с минимальным количеством импульсов (менее двух), предоставляет для каждой серии импульсов ряд частотно-временных характеристик. Использовали классификатор для Финляндии, что при низком разнообразии летучих мышей в нашем регионе повышает точность идентификации видов, которая, по мнению ряда специалистов, пока еще недостаточно надежна и результаты которой следует принимать с осторожностью, особенно в регионах с высоким разнообразием летучих мышей (Russo, Voigt, 2016; Rydell et al., 2017). При обработке материалов учетов ночница Брандта (Myotis brandtii (Eversmann 1845)) и усатая ночница (Myotis mystacinus (Kuhl 1817)) объединены в условную группу M. brandtii/mystacinus.
При автоматической идентификации в каждом файле использовалось общее количество обнаруженных импульсов (N) и выдавались средние значения переменных. Применялись 12 параметров, которые апробированы достаточно давно (Russo, Jones, 2002; Redwell et al., 2009; Armitage, Ober, 2010): Fc – средняя характеристическая частота (кГц), “тело” вызова – это часть вызова, состоящая из наиболее плоского наклона, где характеристическая частота обычно представляет собой частоту в самой последней части тела вызова; Sc – средняя характеристическая крутизна (октав в секунду) – это крутизна тела вызова. Положительные значения соответствуют уменьшению частоты, а отрицательные значения – увеличению частоты; Dur – средняя продолжительность (мс) – это продолжительность вызова; Fmax – средняя максимальная частота (кГц) – максимальная обнаруженная частота вызова; Fmin – средняя минимальная частота (кГц) – минимальная обнаруженная частота вызова; Fmean – средневзвешенная частота (кГц) – взвешенная по времени частота вызова; TBC – среднее время между вызовами (мс) – если “N” выше единицы, это средний период от начала одного вызова до начала следующего; Fk – средняя частота колена (кГц) – частота в начале вызова; Tk – среднее время до колена (мс) – время от начала вызова до начала тела вызова; Sl – cредний начальный наклон (октавы в секунду) – начальный наклон вызова; Tc – среднее время характеристики (мс) – время от начала вызова до окончания тела вызова; Qual – среднее качество вызова (%) – показатель гладкости вызова, где меньшие значения указывают на более плавный вызов. Часть параметров представлена в табл. 1. Для точной идентификации видов наиболее важными были признаны частотные характеристики (Fmax, Fmin, Fk, Fc), а также Sc и Dur. Среди них Fc в среднем была самой важной переменной для всех поставленных задач классификации (Armitage, Ober, 2010). При этом отказ от наименее эффективных временны́х характеристик (Tk, Tc, TBC) может привести к неприемлемой потере точности идентификации.
Таблица 1.
Характеристика эхолокационных сигналов рукокрылых на севере европейской части России, M ± ± mean (min–max)
| Виды | Количество проанализированных импульсов | Dur | Fc | Fmax | Fmin | Fmean |
|---|---|---|---|---|---|---|
| M. nattereri | 253 | 2.45 ± 0.24 (2.17–2.94) |
49.45 ± 0.40 (42.14–56.32) |
74.76 ± 0.90 (64.85–98.42) |
35.68 ± 0.30 (31.85–37.70) |
51.96 ± 0.40 (46.39–58.22) |
| M. brandtii/ mystacinus | 782 | 2.67 ± 0.15 (2.24–3.30) |
46.70 ± 0.24 (40.47–52.43) |
71.92 ± 0.55 (54.48–86.04) |
36.78 ± 0.18 (32.00–41.28) |
51.17 ± 0.25 (44.32–58.75) |
| M. daubentonii | 1254 | 2.89 ± 0.13 (2.32–4.21) |
45.06 ± 0.22 (40.45–49.88) |
64.87 ± 0.50 (50.05–74.87) |
36.13 ± 0.17 (32.35–39.86) |
48.25 ± 0.23 (41.57–52.15) |
| M. dasycneme | 403 | 2.97 ± 0.21 (2.27–4.40) |
37.26 ± 0.35 (33.32–39.71) |
46.62 ± 0.80 (38.07–58.77) |
33.31 ± 0.27 (30.73–36.38) |
39.07 ± 0.36 (34.33–43.15) |
| P. auritus | 321 | 4.45 ± 0.30 (2.31–6.05) |
11.76 ± 0.50 (10.25–12.71) |
11.93 ± 1.14 (10.40–12.84) |
11.61 ± 0.38 (10.04–12.51) |
11.75 ± 0.51 (10.25–12.67) |
| N. noctula | 941 | 5.56 ± 0.21 (2.04–12.37) |
17.85 ± 0.34 (14.85–21.15) |
18.17 ± 0.78 (15.01–21.62) |
17.57 ± 0.26 (14.65–20.69) |
17.86 ± 0.35 (14.84–21.10) |
| E. nilssonii | 1288 | 5.54 ± 0.15 (3.48–12.36) |
29.72 ± 0.25 (27.87–31.15) |
35.11 ± 0.57 (30.82–42.42) |
29.06 ± 0.19 (27.27–30.56) |
31.01 ± 0.26 (29.39–33.35) |
| V. murinus | 312 | 5.06 ± 0.23 (3.14–7.72) |
25.93 ± 0.39 (23.08–27.89) |
27.32 ± 0.88 (23.40–32.96) |
25.41 ± 0.29 (22.65–27.21) |
26.18 ± 0.40 (23.05–28.98) |
Авторы не ставили своей задачей дать оценку эффективности работы и надежности использования оборудования и программного обеспечения. Результаты, полученные при автоматической обработке широкого перечня анализируемых показателей, приняты как данность, реально отражающая уровень идентификации при низком видовом составе фауны рукокрылых региона. Вместе с тем, следует отметить, что приведенные в табл. 1 характеристики не всегда соответствуют истинным показателям эхолокационных сигналов у рассматриваемых видов рукокрылых.
На каждой точке за единицу учета (один случай идентификации вида) принимали только одну серию импульсов (от 7 до нескольких десятков) каждого регистрируемого вида. Такая серия импульсов записывалась в один файл. Чаще всего определение было безальтернативным. Таким образом, общее количество случаев идентификации летучих мышей на водных объектах складывается из количества случаев идентификации отдельных видов, зарегистрированных на каждой точке учета. На водоемах Карелии зарегистрировано 89 случаев идентификации летучих мышей, Архангельской обл. – 13; на водотоках Карелии – 112, Архангельской обл. – 20 случаев идентификации рукокрылых.
Показатель относительного обилия вида (%) определяли как долю от общего количества случаев идентификации летучих мышей, встречаемость (%) – как долю водных объектов с регистрацией рукокрылых от общего количества обследованных объектов, а многовидовой нагул (%) – как долю случаев одновременной идентификации регистрации 2–4 видов на точке учета от общего количества водных объектов с регистрацией рукокрылых.
Полученный цифровой материал обрабатывали общепринятыми статистическими методами, используя пакеты программ MS Excel и Statgraphics Plus 5.0. Сравнение выборок проводили с применением параметрического (t-критерий Стьюдента) или непараметрических (U-критерий Вилкоксона-Манна–Уитни, χ2-критерий согласия Пирсона) критериев. Статистически значимыми считали различия при p < 0.05. Степень влияния различных факторов на изучаемые показатели оценивали с использованием многофакторного дисперсионного анализа (MANOVA).
РЕЗУЛЬТАТЫ
На озерно-речных системах севера европейской части России зарегистрирован весь перечень летучих мышей региона: ночница Наттерера (Myotis nattereri (Kuhl 1817)), M. brandtii/mystacinus, M. daubentonii, M. dasycneme, бурый ушан (Plecotus auritus (L. 1758)), N. noctula, E. nilssonii, двуцветный кожан (Vespertilio murinus (L. 1758)). В Карелии и на стоячих водоемах, и на водотоках зарегистрированы все девять видов рукокрылых, тогда как в Архангельской обл. в точечные учеты не попали M. nattereri и M. brandtii/mystacinus.
В широтном направлении регистрация ультразвуковых сигналов P. auritus и N. noctula на озерно-речных системах Карелии отмечена до 66.275° N, а V. murinus – до 65.218° N, что значительно севернее видовых ареалов, показанных на картах МСОП (IUCN Red List). Самые северные точки регистрации других видов также относятся к подзоне северной тайги: M. nattereri и M. brandtii/mystacinus – 64.120° N, M. daubentonii и M. dasycneme – 64.870° N, E. nilssonii – 66.275° N. В Архангельской обл. зарегистрированные виды, кроме E. nilssonii и V. murinus, отмечены значительно южнее – в подзоне средней тайги.
Относительное обилие рукокрылых на озерно-речных системах севера европейской части России определяется фактором “видовая принадлежность” (η = 89.7%, F = 8.73, p < 0.01). На всех категориях водных объектов в регионе и его частях (Республика Карелия и Архангельская обл.) прослеживается общая закономерность – преобладание в сообществах рукокрылых E. nilssonii (табл. 2).
Таблица 2.
Видовой состав, относительное обилие и встречаемость рукокрылых на стоячих водоемах (1) и водотоках (2) севера европейской части России
| Виды, показатели | Относительное обилие, % | Встречаемость, % | ||||
|---|---|---|---|---|---|---|
| 1 | 2 | в целом | 1 | 2 | в целом | |
| M. nattereri | 1.0 | 3.8* | 2.6 | 1.1 | 2.6* | 2.1 |
| M. brandtii/mystacinus | 2.0 | 3.0* | 2.6 | 2.2 | 2.1 | 2.1 |
| M. daubentonii | 8.8 | 9.1 | 9.0 | 10.0 | 6.3* | 7.5 |
| M. dasycneme | 6.9 | 3.8* | 5.1 | 7.8 | 2.6* | 4.3 |
| P. auritus | 14.7 | 5.3* | 9.4 | 16.7 | 3.7* | 7.8 |
| N. noctula | 19.6 | 16.7 | 17.9 | 22.2 | 11.5* | 14.9 |
| E. nilssonii | 33.3 | 53.0* | 44.4 | 37.8 | 36.5 | 36.9 |
| V. murinus | 13.7 | 5.3* | 9.0 | 15.6 | 3.7* | 7.5 |
| Среднее количество видов на один обследованный водный объект | 1.13 | 0.69* | 0.83 | |||
| Встречаемость рукокрылых, % | 68.9 | 50.5 | 56.4 | |||
Среднее количество видов, зарегистрированное на одном водном объекте севера европейской части России, составляет 0.83 и достоверно (р < < 0.01) выше на водоемах, чем на водотоках. В Карелии и Архангельской обл. различия этого показателя на водоемах не достоверны (1.16 и 1.00, соответственно), а на водотоках существенно различаются (0.84 и 0.35, p < 0.001).
На относительное обилие рукокрылых на стоячих водоемах Европейского севера России (табл. 3) оказывает влияние ряд факторов: географическое расположение частей региона (η = 38.1%, F = 75.4, p = 0.0001), видовая принадлежность (η = 27.4%, F = 9.28, p < 0.01), размер водоема (η = 11.5%, F = = 27.14, p < 0.01), а также совместное влияние двух факторов – расположение частей региона и размер водоема (η = 6.3%, F = 14.89, p < 0,01) и видовая принадлежность и расположение частей региона (η = 14.6%, F = 4.95, p < 0.05).
Таблица 3.
Относительное обилие рукокрылых на стоячих водоемах Карелии и Архангельской обл. по результатам ультразвуковой регистрации, %
| Виды, показатель | Республика Карелия | Архангельская область | ||||
|---|---|---|---|---|---|---|
| озера | ламбы | всего | озера | ламбы | всего | |
| M. nattereri | 1.6 | 0 | 1.1 | 0 | 0 | 0 |
| M. brandtii/mystacinus | 3.2 | 0 | 2.2 | 0 | 0 | 0 |
| M. daubentonii | 9.7 | 0 | 6.8 | 30.0 | 0 | 23.1 |
| M. dasycneme | 9.7 | 3.7 | 7.9 | 0 | 0 | 0 |
| P. auritus | 16.1 | 14.8 | 15.7 | 10.0 | 0 | 7.7 |
| N. noctula | 16.1 | 25.9 | 19.1 | 30.0 | 0 | 23.1 |
| E. nilssonii | 32.3 | 33.4 | 32.6 | 30.0 | 66.7 | 38.4 |
| V. murinus | 11.3 | 22.2 | 14.6 | 0 | 33.3 | 7.7 |
| Среднее количество видов на один обследованный водоем | 1.22 | 1.04 | 1.16 | 1.11 | 0.75 | 1.00 |
Эти же факторы, но в другой последовательности по силе влияния, отмечены для водотоков (табл. 4): видовая принадлежность (η = 41.9%, F = = 11.79, p = 0.0001), географическое расположение частей региона (η = 12.6%, F = 24.84, p < < 0.001), ширина водотока (η = 7.95%, F = 7.83, p < 0.01). Значимое совместное влияние двух факторов отмечено для ширины водотока и частей региона (η = 7.9%, F = 7.77, p < 0.01), а также для видовой принадлежности и частей региона (η = 13.2%, F = 3.72, p < 0.05).
Таблица 4.
Относительное обилие рукокрылых на водотоках разной ширины Карелии и Архангельской обл. по результатам ультразвуковой регистрации, %
| Виды, показатель | Республика Карелия | Архангельская обл. | ||||||
|---|---|---|---|---|---|---|---|---|
| <10 м | 11–50 м | >50 м | всего | <10 м | 11–50 м | >50 м | всего | |
| M. nattereri | 0 | 7.1 | 0 | 4.5 | 0 | 0 | 0 | 0 |
| M. brandtii/mystacinus | 6.7 | 2.9 | 0 | 3.6 | 0 | 0 | 0 | 0 |
| M. daubentonii | 10.0 | 11.4 | 8.3 | 10.7 | 0 | 0 | 0 | 0 |
| M. dasycneme | 0 | 5.7 | 0 | 3.6 | 0 | 0 | 20.0 | 5.0 |
| P. auritus | 3.3 | 5.7 | 8.3 | 5.3 | 0 | 16.7 | 0 | 5.0 |
| N. noctula | 23.3 | 17.2 | 8.3 | 17.9 | 11.1 | 0 | 20.0 | 10.0 |
| E. nilssonii | 50.0 | 45.7 | 66.8 | 49.1 | 88.9 | 83.3 | 40.0 | 75.0 |
| V. murinus | 6.7 | 4.3 | 8.3 | 5.3 | 0 | 0 | 20.0 | 5.0 |
| Среднее количество видов на один обследованный водоток | 0.48 | 1.21* | 0.92* | 0.84 | 0.26 | 0.35** | 0.83 | 0.35** |
Встречаемость летучих мышей на озерно-речных системах севера европейской части России составляет 56.4% и определяется факторами “видовая принадлежность” (η = 47.0%, F = 15.57, p < 0.0001), географическое расположение частей региона (η = 22.9%, F = 52.54, p = 0.001), а также совместным влиянием этих факторов (η = 16.9%, F = 5.54, p < 0.05). Карелия и Архангельская обл. различаются по этому показателю и на стоячих водоемах (p < 0.05), и на водотоках (p < 0.001).
Многовидовой нагул рукокрылых на озерно-речных системах определяется размером водоема (η = 23.1%, F = 6.29, p < 0.05) и шириной русла водотока (η = 32.0%, F = 4.05, p < 0.05). Для региона этот показатель составил 28.3% и в Карелии был значительно выше, чем в Архангельской обл. (31.8 и 11.1%, соответственно, p < 0.05).
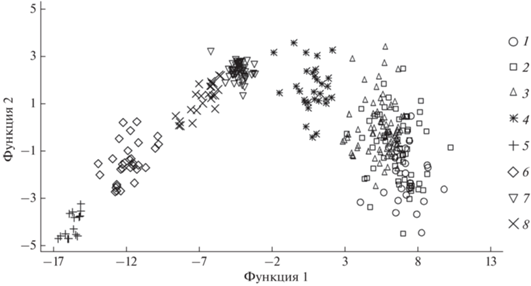
Результаты дискриминантного анализа показали, что на основе указанных в табл. 1 параметров можно однозначно идентифицировать P. auritus, N. noctula и E. nilssonii в 100% случаев, а M. dasycneme и V. murinus – в 96.7 и 96.0% случаев правильной классификации, соответственно (рис. 2). Для остальных трех видов существует значительная область перекрытия, однако при попарном анализе по характеристикам ультразвуковых сигналов правильность их определения составляет более 80%. При этом первая дискриминантная функция охватывает 93.89% общей дисперсии (лямбда Уилкса – 0.003, р < 0.001), а основной вклад в нее вносят Fmax и Fmean, в то время как вторая – только 5.27% (лямбда Уилкса – 0.17, р < 0.001), а основными предикторами являются Fmin и Fmean, но последний уже с отрицательным знаком.
ОБСУЖДЕНИЕ
В Европе и Северной Америке акустическая съемка является наиболее распространенным методом для оценки использования летучими мышами среды обитания (Salvarina, 2016). Огромный массив данных по региональным особенностям экологии рукокрылых на водных объектах можно свести к одному основному обобщению: эти биотопы играют важную роль в жизнедеятельности всех летучих мышей как места нагула, водопоя и как экологические русла расселения видов (Mysłajek et al., 2007; Siivonen, Wermundsen, 2008; Hagen, Sabo, 2011; Krüger et al., 2012; Burns et al., 2015; Ciechanowski, 2015; Bruckner, 2016; Ciechanowski et al., 2017; Todd, Waters, 2017), но лишь для M. daubentonii и M. dasycneme выступают как основные видоспецифичные местообитания.
Полученные нами характеристики эхолокационных сигналов летучих мышей, в том числе по низкочастотным сигналам P. auritus и N. noctula (табл. 1), укладываются в лимиты, приводимые для европейских видов (Дзенаевич, 1997; Anděra, Gausler, 2012; Jones et al., 2013; Dietz, Kiefer, 2016; Brabant et al., 2016; Limits …, 2022). Характеристики эхолокационных сигналов N. noctula, полученные нами в Ленинградской обл. при одновременном отлове и регистрации детектором летучих мышей, совпадают с полученными в Карелии и Архангельской обл.
Результаты наших учетов показывают, что видовой состав рукокрылых на озерно-речных системах аналогичен наблюдаемому на автомобильных маршрутах в лесных биотопах. Однако регистрация 88.8% M. daubentonii и 90.9% M. dasycneme на автомобильных маршрутах приурочена именно к водным объектам. В Финляндии и Великобритании для M. daubentonii получены сходные данные (Vaughan et al., 1997; Wermundsen, Siivonen, 2008). Известно (Bruckner, 2016), что высокое видовое разнообразие на водоемах может быть результатом краткосрочных посещений их рукокрылыми закрытых местообитаний.
Регистрация видов в широтном направлении наблюдается значительно дальше к северу, чем предполагалось до начала работ (рис. 1). Самые северные точки регистрации M. nattereri отмечены на р. Нурдас (точка № 9 на рис. 1) и на р. Бола (№ 10); ночниц условной группы M. brandtii/mystacinus – на безымянном озере (№ 9); M. daubentonii – на р. Сельвана (№ 8), р. Нурдас и на безымянном озере (№ 9), р. Бола (№ 10); M. dasycneme – на р. Кюреля (№ 8), р. Понноки (№ 9); P. auritus – на оз. Паанаярви, р. Оланга (№ 1), оз. Петроярви (№ 3); N. noctula – на оз. Паанаярви, р. Оланга (№ 1), р. Китис, р. Нурис (№ 2); E. nilssonii – на р. Оланга (№ 1), р. Мюгра (№ 4), р. Понча (№ 5), на Белом море (№ 11), р. Корода (№ 12), р. Юра (№ 13), р. Гбач, р. Чуса, р. Чуплега (№ 14), р. Карьела, р. Белая (№ 15); V. murinus – на р. Ухта (№ 6), на безымянной ламбе (№ 7), р. Нурдас (№ 9) и на безымянной ламбе (точка № 16 на рис. 1).
M. nattereri встречается в Финляндии выше 61° N (Siivonen, Wermundsen, 2008), в Швеции – до 63° N (Mitchell-Jones et al., 1999). В Архангельской обл. M. brandtii была отловлена А.Н. Ляпуновым в 2018 г. в паутинные сети на р. Северная Двина ниже г. Котлас (61.130° N, 46.599° E) и нами в 2019 – 2020 гг. в Карелии на оз. Водлозеро (62.413° N, 37.100° E), оз. Келкозеро (62.468° N, 36.684° E), оз. Каскеснаволокское (61.598° N, 33.366° E) и на ручьях Навдручей (62.138° N, 36.752° E) и Тервоярви (61.388° N, 30.031° E) (Белкин и др., 2020). M. mystacinus обнаружена А.П. Кутенковым на берегу р. Суна в Карелии (62.276° N, 33.980° E), что, наряду с нашими отловами (Belkin et al., 2021), является одной из самых северных точек встреч вида на севере европейской части России. Финские исследователи (Siivonen, Wermundsen, 2008) зарегистрировали M. brandtii/mystacinus на р. Оуланкайоки, впадающей в оз. Паанаярви (66.218° N, 29.200° E), а M. daubentonii – даже севернее Полярного круга. Визуально и одновременно с использованием детектора мы зарегистрировали M. daubentonii на оз. Каскеснаволокское, на р. Суоёки (62.231° N, 32.464° E) и р. Сельвана (64.818° N, 30.713° E), M. dasycneme – на оз. Каскеснаволокское, N. noctula – на двух безымянных озерах у д. Суднозеро (65.029° N, 30.393° E). В Финляндии N. noctula регистрируется до 64° N (Tidenberg et al., 2019). Исследования с использованием метода стабильных изотопов (Lehnert et al., 2014; Voigt et al., 2016) предсказывали происхождение части N. noctula значительно севернее, чем нынешний ареал этого вида в базе IUCN. Наши самые северные визуальные встречи и одновременная регистрация детектором E. nilssonii отмечены на р. Суоёки, ламбе у д. Суднозеро, на р. Понча (65.772° N, 31.057° E). В Мурманской обл. E. nilssonii встречен на р. Патсойоки на границе с Норвегией – 69.016° N, 29.077° E (Катаев, 2018). Экземпляр V. murinus был получен в Архангельской обл. с р. Емцá – 63° N (Богдарина, Стрелков, 2003). В Карелии вид был пойман нами в 2021 г. в количестве 2 экз.: на берегу оз. Каскеснаволокское и в здании на набережной Онежского озера в г. Петрозаводск (61.791° N, 34.379° E). Один экземпляр V. murinus в августе 2020 г. попал в орнитологические сети в окрестностях д. Гумбарицы (Нижне-Свирский заповедник) на границе Карелии и Ленинградской обл. (60.693° N, 32.940° E). В южной Финляндии, так же как в Норвегии, V. murinus отмечен до широты 63° N (Tidenberg et al., 2019).
Показатели относительного обилия и встречаемости рукокрылых на озерах и реках определяются биотопическими и поведенческими особенностями нагула отдельных видов летучих мышей (Ekman, Jong, 1996; Haupt, Schmidt, 2007; Mysłajek et al., 2007; Siivonen, Wermundsen, 2008; Wermundsen, Siivonen, 2008; Krüger et al., 2012; Ciechanowski, 2015; Ciechanowski et al., 2017), силой ультразвуковых сигналов и дальностью их регистрации (Skiba, 2003; Barataud, 2015), на севере – белыми ночами и продолжительностью темного времени суток в течение летнего периода (Frafjord, 2013), ночными температурами (Todd, Waters, 2017), а также наличием и близостью водных объектов к убежищам и колониям рукокрылых (Ciechanowski et al., 2017).
Высокая встречаемость рукокрылых на водоемах обеих частей региона (68.8 и 69.2%) и на водотоках Карелии (59.0%) говорят о благоприятных качественных характеристиках этих водных объектов для летучих мышей, что способствует относительной равномерности распределения рукокрылых (табл. 5). Низкая встречаемость летучих мышей на реках Архангельской обл. (31.0%), возможно, связана с обширными сельскохозяйственными полями, расположенными по берегам архангельских рек, особенно в подзоне средней тайги.
Таблица 5.
Встречаемость рукокрылых на озерно-речных системах севера европейской части России по результатам ультразвуковой регистрации, %
| Виды, показатель | Республика Карелия | Архангельская обл. | ||||
|---|---|---|---|---|---|---|
| стоячие водоемы | водотоки | всего | стоячие водоемы | водотоки | всего | |
| M. nattereri | 1.3 | 3.7* | 2.8 | 0** | 0** | 0** |
| M. brandtii/mystacinus | 2.6 | 3.0 | 2.8 | 0** | 0** | 0** |
| M. daubentonii | 7.8 | 9.0 | 8.5 | 23.1** | 0*, ** | 4.2** |
| M. dasycneme | 9.1 | 3.0* | 5.2 | 0** | 1.7*, ** | 1.4** |
| P. auritus | 18.2 | 4.5* | 9.5 | 7.7 | 1.7*, ** | 2.8** |
| N. noctula | 22.1 | 14.9 | 17.5 | 23.1 | 3.5*, ** | 7.0** |
| E. nilssonii | 37.7 | 41.0 | 39.8 | 38.5 | 25.9** | 28.2** |
| V. murinus | 16.9 | 4.5* | 9.0 | 7.7 | 1.7*, ** | 2.8** |
| Встречаемость рукокрылых, % | 68.8 | 59.0 | 62.6 | 69.2 | 31.0 | 38.0** |
При точечных учетах на водных объектах обследованного нами региона встречаемость и относительное обилие E. nilssonii характеризовались самыми высокими и стабильными показателями. У M. daubentonii и M. dasycneme, так же как в Словакии (Ceľuch et al., 2016), эти показатели не отличались от показателей других рукокрылых. Это обстоятельство позволяет говорить лишь о частичном (в отношении E. nilssonii) подтверждении выдвинутой нами гипотезы о возможном доминировании отдельных видов в таких учетах на севере европейской части России.
Более показательными методами, характеризующими реальное использование M. daubentonii и M. dasycneme водных объектов, выступают учеты паутинными сетями на берегах озер и рек и водные учеты с ультразвуковым детектором на модельном водоеме. Они показали, что при отловах доля M. daubentonii составила 34.4%, а при водных учетах – 40.9%. M. dasycneme в паутинные сети не поймана, но на модельном водоеме ее относительное обилие составило 25.0%. Наблюдаются достоверные различия между видами M. daubentonii и M. dasycneme (табл. 5) по встречаемости на разных типах водных объектов Карелии, Архангельской обл. и в целом по региону (критерий χ2, р < 0.05). Известно (Ciechanowski, 2015), что в северной Польше M. daubentonii относят к стенотопным видам, а встречаемость M. dasycneme в Бельгии максимальна над широкими реками, каналами и над городскими рвами, но не над большими прудами (Van de Sijpe et al., 2004). Относительное обилие E. nilssonii при отлове составило 25.6%, а при учете на модельном водоеме – 22.7%. В странах Западной Европы с низкой численностью вида его встречаемость на водоемах минимальна (Haupt et al., 2006; Bruckner, 2016).
Многовидовой нагул рукокрылых на стоячих водоемах Карелии значительно выше, чем в Архангельской обл. (41.5 и 22.2%, соответственно, p < 0.05). На водотоках наблюдается та же закономерность – 25.3 и 5.6%, соответственно (табл. 6). Одной из причин такого соотношения показателей многовидового нагула на водных объектах может быть более высокая относительная численность рукокрылых в РК (0.340 случаев идентификации на 1 км), чем в Архангельской обл. – 0.131 случаев идентификации на 1 км маршрута (Белкин и др., 2020). В южной Финляндии показатель многовидового нагула составил 18% на озерах и 19% на реках (Wermundsen, Siivonen, 2008).
Таблица 6.
Многовидовой нагул рукокрылых на озерно-речных системах севера европейской части России по результатам ультразвуковой регистрации, %
| Место учета | Стоячие водоемы | Водотоки | В целом озерно-речные системы | |||||
|---|---|---|---|---|---|---|---|---|
| озера | ламбы | всего | <10 м | 11–50 м | >50 м | всего | ||
| Подзона северной тайги РК | 35.3 | 35.7 | 35.5* | 33.3 | 27.6 | 25.0 | 28.9* | 31.6 |
| Подзона средней тайги РК | 58.8 | 20.0 | 50.0 | 16.7 | 23.5 | 20.0 | 20.6 | 32.1 |
| Республика Карелия в целом | 47.1 | 31.6 | 41.5** | 25.0 | 26.1 | 22.2 | 25.3 | 31.8** |
| Архангельская обл. в целом | 14.3 | 50.0 | 22.2 | 0 | 0 | 33.3 | 5.6 | 11.1 |
| В целом по региону | 41.5 | 33.3 | 38.7 | 18.2 | 23.1 | 25.0 | 21.7 | 28.3 |
Многовидовой нагул рукокрылых в подзоне северной тайги Карелии характеризуется схожими показателями на стоячих водоемах и водотоках различных категорий (25.0–35.7%). В подзоне средней тайги Карелии наблюдается преобладание многовидового нагула на озерах (58.8%), тогда как на всех других водных объектах он ниже и сопоставим по своей величине (16.7–23.5%). В целом многовидовой нагул на водотоках преобладает в подзоне северной тайги (28.9%) по сравнению со средней (20.6%, p < 0.05), а на стоячих водоемах – в подзоне средней тайги РК (50.0 и 35.5% соответственно, p < 0.05).
ЗАКЛЮЧЕНИЕ
Изобилие озерно-речных систем на севере европейской части России, особенно в Республике Карелия, обусловливает их высокую доступность и разнообразие условий жизнедеятельности рукокрылых. Использование метода точечных учетов на водных объектах при маршрутных автомобильных учетах можно рассматривать как один из вариантов мониторинга рукокрылых. Такой методический подход позволяет охватить исследованиями большѝе выборки водоемов и водотоков, что дает возможность получить общую характеристику населения летучих мышей обширных территорий. Выдвинутая нами гипотеза о стабильности высоких показателей встречаемости и относительного обилия некоторых видов на водных объектах региона подтвердилась лишь в отношении доминирующего вида – E. nilssonii. Густая сеть водных объектов способствует поддержанию относительной равномерности распределения рукокрылых и, наряду с полосой водоохранных лесов, выступает как экологические русла расселения летучих мышей в регионе.
Список литературы
Белкин В.В., Илюха В.А., Хижкин Е.А., Федоров Ф.В., Морозов А.В., Якимова А.Е., 2018. Видовой состав и распространение рукокрылых (Chiroptera, Vespertilionidae) в Карелии // Принципы экологии. № 3. С. 13–23.
Белкин В.В., Федоров Ф.В., Ляпунов А.Н., 2020. Летнее население летучих мышей ООПТ и смежных с ними территорий на Востоке Фенноскандии // Труды Карельского научного центра Российской академии наук. № 5. С. 17–28.
Богдарина С.В., Стрелков П.П., 2003. Распространение рукокрылых (Chiroptera) на севере европейской России // Plecotus et al. № 6. С. 7–28.
Громцев А.Н., Антипин В.К., Бахмет О.Н., Данилов П.И., Кузнецов О.Л. и др., 2009. Научное обоснование развития сети особо охраняемых природных территорий в Республике Карелия. Петрозаводск: Карельский научный центр РАН. 112 с.
Громцев А.Н., Кузнецов О.Л., Шкиперова Г.Т., 2019. Государственный доклад о состоянии окружающей среды Республики Карелия в 2018 году. Петрозаводск. 314 с.
Дзенаевич О.С., 1997. Адаптивные особенности акустической сигнализации и эхолокации бурого ушана (Plecotus auritus). Автореф. дис. … канд. биол. наук. 16 с.
Катаев Г.Д., 2018. Аннотированный список видов млекопитающих (зверей) // Позвоночные животные заповедника “Пасвик”. Петрозаводск. С. 193–207.
Назарова Л.Е., Сыстра Ю.Й., Лукашов А.Д., Демидов И.Н., Литвиненко А.В. и др., 2003. Разнообразие биоты Карелии: условия формирования, сообщества, виды. Петрозаводск: Карельский научный центр РАН. 259 с.
Попов И.Н., Шашин Э.В., Андриянов В.В., Перхурова О.В., Воронова Э.А. и др., 2020. Доклад “Состояние и охрана окружающей среды Архангельской области за 2019 год”. Архангельск. 482 с.
Anděra M., Gaisler J., 2012. Savci České republiky. Popis, rozšíření, ekologie, ochrana. Praha: Academia. 285 p.
Armitage D.W., Ober H.K., 2010. A comparison of supervised learning techniques in the classification of bat echolocation calls // Ecological Informatics. V. 5. P. 465–473.
Barataud M., 2015. Acoustic ecology of european bats: Species identification, study of their habitats and foraging behavior. Paris: Biotope & National Museum of Natural History. 352 p.
Belkin V.V., Fyodorov F.V., Ilyukha V.A., Yakimova A.E., 2021. Characteristics of the bat (Chiroptera) population in protected areas in the Northern and Middle taiga subzones of European Russia // Заповедная наука. Nature Conservation Research. V. 6. № S1. P. 17–31.
Brabant R., Laurent Y., Lafontaine R.-M., Vandendriessche B., Degraer S., 2016.First offshore observation of parti-coloured bat Vespertilio murinus in the Belgian part of the North Sea // Belgian Journal of Zoology. V. 146. P. 62.
Bruckner A., 2016. Recording at water bodies increases the efficiency of a survey of temperate bats with stationary, automated detectors // Mammalia. V. 80. P. 645–653.
Burns L.E., Segers J.L., Broders H.G., 2015. Bat activity and community composition in the northern boreal forest of South-central Labrador, Canada // Northeastern Naturalist. V. 22. № 1. P. 32–40.
Ceľuch M., Uhrin M., Bačkor P., Ševčík M., 2016. Monitoring netopierov pomocou autotransektov – prvé výsledky zo Slovenska // Vespertilio. V. 18. P. 41–54.
Ciechanowski M., 2015. Habitat preferences of bats in anthropogenically altered, mosaic landscapes of northern Poland // Eur. J. Wildl. Res. V. 61. P. 415–428.
Ciechanowski M., Zapart A., Kokurewicz T., Rusiński M., Lazarus M., 2017. Habitat selection of the pond bat Myotis dasycneme during pregnancy and lactation in Northern Poland // Journal of Mammalogy. V. 98. № 1. P. 232–245.
Dietz C., Kiefer A., 2016. Bats of Britain and Europe. UK: Bloomsbury Publishing. 400 p.
Ekman M., de Jong J., 1996. Local patterns of distribution and resource utilization of four bat species (Myotis brandti, Eptesicus nilssoni, Plecotus auritus and Pipistrellus pipistrellus) in patchy and continuous environments // Journal of Zoology. V. 238. P. 571–580.
Fisher-Phelps M., Schwilk D., Kingston T., 2017. Mobile acoustic transects detect more bat activity than stationary acoustic point counts in a semi-arid and agricultural landscape // Journal of Arid Environments. V. 136. P. 38–44.
Frafjord K., 2013. Influence of night length on home range size in the northern bat Eptesicus nilssonii // Mammalian Biology. V. 78. № 3. P. 205–211.
Hagen E., Sabo J., 2011. A landscape perspective on bat foraging ecology along rivers: Does channel confinement and insect availability influence the response of bats to aquatic resources in riverine landscapes? // Oecologia. V. 166. P. 751–760.
Haupt M., Menzler S., Schmidt S., 2006. Flexibility of habitat use in Eptesicus nilssonii: Does the species profit from anthropogenically altered habitats? // Journal of Mammalogy. V. 87. № 2. P. 351–361.
Haupt M., Schmidt S., 2007. Small scale activity patterns of Eptesicus nilssonii – an indication of habitat preference or interspecific processes // Acta Chiropterologica. V. 9. № 2. P. 503–516.
Jones K.E., Russ J.A., Bashta A.-T., Bilhari Z., Catto C.M. et al., 2013. Indicator bats program: a system for the global acoustic monitoring of bats // Biodiversity monitoring and conservation: bridging the gap between global commitment and local action. London: John Wiley-Blackwell. P. 213–247.
Krüger F., Harms I., Fichtner A., Wolz I., Sommer R., 2012. High Trophic similarity in the sympatric north European trawling bat species Myotis daubentonii and Myotis dasycneme // Acta Chiropterologica. V. 14. P. 347–356.
Lehnert L.S., Kramer-Schadt S., Schönborn S., Lindecke O., Niermann I., Voigt C.C., 2014. Wind farm facilities in Germany kill noctule bats from near and far // PLoS ONE. V. 9. № 8. e103106.
Limits of echolocation calls of european bats [Электронный ресурс]. Режим доступа: https://www.zoogdiervereniging.nl/sites/default/files/imce/nieuwesite/Zoogdiersoorten/Gewone%20dwergvleermuis/downloads/ geluidentable_EN_1_0.pdf. Дата обновления: 15.03.2022.
Michaelsen T.C., 2016. Summer temperature and precipitation govern bat diversity at northern latitudes in Norway // Mammalia. V. 80. № 1. P. 1–9.
Mitchell-Jones A.J., Amori G., Bogdanowicz W., Krystufek B., Reijnders P.J., Spitzenberger F., Stubbe M., Thissen J.B., Vohralik V., Zima J., 1999. The Atlas of European Mammals. London: T&A. D. Poyser. 484 p.
Mysłajek R., Nowak S., Henel K., 2007. Community structure and activity levels of bats above waters in the Łężczok Reserve, southern Poland // Vespertilio. V. 11. P. 103–107.
Redgwell R.D., Szewczak J.M., Jones G., Parsons S., 2009. Classification of echolocation calls from 14 species of bat by support vector machines and ensembles of neural networks // Algorithms. V. 2. P. 907–924.
Russo D., Jones G., 2002. Identification of twenty-two bat species (Mammalia: Chiroptera) from Italy by analysis of time-expanded recordings of echolocation calls // Journal of the Zoological Society of London. V. 258. P. 91–103.
Russo D., Voigt C.C., 2016. The use of automated identification of bat echolocation calls in acoustic monitoring: A cautionary note for a sound analysis // Ecological Indicators. V. 66. P. 598–602.
Rydell J., Elfström M., Eklöf J., Sánchez-Navarro S., 2020. Dramatic decline of northern bat Eptesicus nilssonii in Sweden over 30 years // R. Soc. open sci. V. 7. № 2. 191754 p.
Rydell J., Nyman S., Eklof J., Jones G., Russo D., 2017. Testing the performances of automated identification of bat echolocation calls: a request for prudence // Ecological Indicators. V. 78. P. 416–420.
Salvarina I., 2016. Bats and aquatic habitats: a review of habitat use and anthropogenic impacts // Mammal Review. V. 46. № 2. P. 131–143.
Siivonen Y., Wermundsen T., 2008. Distribution and foraging habitats of bats in northern Finland: Myotis daubentonii occurs north of the Arctic Circle // Vespertilio. V. 12. P. 41–48.
Skiba R., 2003. Europäische Fledermäuse: Kennzeichen, Echoortung und Detektoranwendung. Die neue Brehm-Bücherei. V. 648. 212 p.
Tidenberg E.-M., Liukko U.-M., Stjernberg T., 2019. Atlas of Finnish Bats // Annales Zoologici Fennici. V. 56. № 1–6. P. 207–250.
Todd V.L.G., Waters D.A., 2017. Small scale habitat preferences of Myotis daubentonii, Pipistrellus pipistrellus, and potential aerial prey in an upland river valley // Acta Chiropterologica. V. 19. № 2. P. 255–272.
Van de Sijpe M., Vandendriessche B., Voet P., Vandenberghe J., Duyck J., Naeyaert E., Manhaeve M., Martens E., 2004. Summer distribution of the pond bat Myotis dasycneme (Chiroptera, Vespertilionidae) in the west of Flanders (Belgium) with regard to water quality // Mammalia. V. 68. P. 377–386.
Vaughan N., Jones G., Harris S., 1997. Habitat use by bats (Chiroptera) assessed by means of a broad-band acoustic method // Journal of Applied Ecology. V. 34. № 3. P. 716–730.
Vlaschenko A., Kravchenko K., Prylutska A., Ivancheva E., Sitnikova E., Mishin A., 2016. Structure of summer bat assemblages in forests in European Russia // Turkish Journal of Zoology. V. 40. № 6. P. 876–893.
Voigt C.C., Lindecke O., Schönborn S., Kramer-Schadt S., Lehmann D., 2016. Habitat use of migratory bats killed during autumn at wind turbines // Ecol. Appl. V. 26. № 6. P. 771–783.
Wermundsen T., Siivonen Y., 2008. Foraging habitats of bats in southern Finland // Acta Theriologica. V. 53. P. 229–240.
Дополнительные материалы отсутствуют.
Инструменты
Зоологический журнал